Maladie à coronavirus 2019
La maladie à coronavirus 2019 , ou la, ou le[alpha 1], Covid-19 (acronyme de l'anglais coronavirus disease 2019), est une maladie infectieuse émergente de type zoonose virale causée par la souche de coronavirus SARS-CoV-2. Les symptômes les plus fréquents sont la fièvre, la toux, la fatigue et la gêne respiratoire. Dans les formes les plus graves, l'apparition d'un syndrome de détresse respiratoire aiguë peut entraîner la mort, notamment chez les personnes plus fragiles du fait de leur âge ou en cas de comorbidités. Une autre complication mortelle est une réponse exacerbée du système immunitaire inné (choc cytokinique).
Cet article concerne cette maladie virale chez l'humain. Pour la pandémie correspondante, voir Pandémie de Covid-19. Pour l'agent pathogène, voir SARS-CoV-2. Pour l'effet de cet agent chez les autres animaux, voir SARS-CoV-2 chez les animaux.
Wikipédia ne donne pas de conseils médicaux ou sanitaires. Cet article est susceptible de contenir des informations obsolètes ou inexactes. Seul un professionnel de santé est apte à vous fournir un avis médical, et seules les autorités sanitaires de votre pays sont compétentes pour donner des consignes de santé publique relatives à la pandémie de Covid-19 : France, Canada, Belgique, Maroc, Algérie, Suisse, Tunisie, Rép. dém. du Congo.
| Spécialité | Infectiologie, pneumologie, virologie, épidémiologie et médecine d'urgence |
|---|
| CIM-10 | U07.1 et U07.2 |
|---|---|
| DiseasesDB | 60833 |
| eMedicine | 2500114 |
| MeSH | D000086382 |
| Incubation min | 2 j |
| Incubation max | 14 j et 27 j |
| Symptômes | Fièvre, toux sèche, dyspnée |
| Maladie transmissible | Transmission aéroportée (d), contamination par les sécrétions respiratoires (d), transmission par contact (d), transmission directe (d), transmission par surface contaminée (d) et infection de l'oeil (d) |
| Causes | SARS-CoV-2 |
| Diagnostic | PCR sur prélèvement nasopharyngé ou bronchique et scanner des poumons |
| Différentiel | Infection virale à H5N1, H7N9, grippe et toutes infections pulmonaires bactériennes et virales y compris SRMO[1]/MERS, SRAS et tuberculose |
| Traitement | Traitement symptomatique, antiviral, oxygénothérapie normobare, immunothérapie, thérapie par immunoglobulines, immunosuppresseur et sérum immun |
| Médicaments | Soins de support. Aucun traitement à l'efficacité prouvée. |
| Mortalité |
Environ 0,5 % en moyenne Fortement liée à l'âge |
![]() Mise en garde médicale
Mise en garde médicale
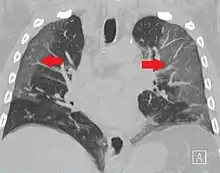
Une perte brutale de l'odorat (anosmie), associée ou non à une perte du goût (agueusie), est une manifestation relativement fréquente et parfois révélatrice de l'infection par le SARS-CoV-2.
Le taux de formes asymptomatiques est estimé à près de 20 % des personnes infectées. La transmission interhumaine se fait surtout par gouttelettes respiratoires et aérosolisation[2],[3], lorsqu'une personne respire dans un même lieu clos ou à proximité immédiate d'autres personnes. La transmission augmente en intérieur mal ventilé et lorsque la personne infectée tousse, éternue, parle ou chante. La transmission indirecte par surface contaminée, bien que possible, n'a pas été formellement démontrée[4]. La période d'incubation est en moyenne de 5 à 6 jours, avec des extrêmes pouvant aller de deux à quatorze jours.
Une proportion importante de personnes infectées, notamment d'enfants, ne présente que peu ou pas de symptômes mais peut néanmoins transmettre la maladie. De plus, il a été établi que, chez les personnes symptomatiques, la contagiosité peut précéder les symptômes de 2 à 3 jours et qu'elle serait maximale durant les premiers jours de la maladie.
La mortalité concerne principalement les personnes âgées, l'âge moyen des décès dus à la Covid-19 étant de 81 ans, les personnes présentant des comorbidités (diabète, obésité, etc.). Le taux de létalité, estimé à environ 0,5 % en moyenne, varie de 0,01 % pour les moins de 15 ans à 17,4 % pour les plus de 90 ans[5]. Le taux de décès varie aussi selon les pays [6].
Nom de la maladie
Dénomination par l'OMS
Le , l'OMS nomme officiellement la maladie dans plusieurs langues, dont la langue française, où le terme retenu est : « maladie à coronavirus 2019 (COVID-19) »[7]. La désignation COVID-19, donnée de façon identique à toutes les langues, est un mot valise formé par apocopation des termes du syntagme en langue anglaise (coronavirus disease 2019)[8],[alpha 2]. L'organisation, dans la version du texte en langue française, emploie majoritairement l'acronyme au féminin : « La COVID-19 est la maladie infectieuse causée par le dernier coronavirus qui a été découvert »[9].
Dénominations institutionnelles
L'acronyme Covid-19 est repris en France[10] et dans les régions francophones d'Europe avec la typographie Covid-19 et un genre masculin, y compris dans les communications gouvernementales françaises, belges[11] et suisses[12], malgré quelques exceptions. Dans les textes législatifs et réglementaires français instaurant l'état d'urgence sanitaire en mars 2020, le mot est utilisé au masculin, mêlant l'épidémie et le virus[13],[14].
Dans le décret français no 2020-545 du « prescrivant les mesures générales nécessaires pour faire face à l'épidémie de covid-19 dans le cadre de l'état d'urgence sanitaire », le mot est écrit en minuscule covid-19 avec un emploi au masculin[15] mais sert indifféremment à désigner la maladie et le virus, comme dans d'autres textes ultérieurs[16],[17]. On retrouve le même genre d'usage dans des textes officiels belges[18].
Début , le site de l'Académie française écrit sa préférence pour l'emploi du féminin pour Covid-19[19],[20], son noyau étant un équivalent du nom français féminin « maladie »[19],[alpha 3]. Dans ses échos à cet avis, la presse européenne doute de son impact[22],[23],[24] sur des usages bien ancrés[25], observant qu’il ne s’agit pas d’une position collégiale de l’Académie[26] mais qu’il s’agirait d'une décision d'Hélène Carrère d'Encausse seule[21], son secrétaire perpétuel, en raison de la difficulté à réunir les académiciens en période de confinement[21].
Usages
Un sondage réalisé en France par l'Ifop en montre que 56 % des Français emploient le mot « Covid » exclusivement au masculin, contre 19 % au féminin et 25 % aux deux genres, bien que, dans le même temps, une majorité de Français considère le genre féminin comme le genre correct[27],[28].
Dictionnaires
Le , le nom « covid » rentre dans le dictionnaire en ligne du Robert qui le considère masculin ou féminin[29],[30] en raison des usages différents en France et au Québec[31]. Dans la version 2022 du Petit Robert, le mot « Covid-19 » fait également son entrée au masculin ou féminin[32].
En 2021, le nom « COVID-19 » (avec la graphie « Covid-19 » comme variante) entre également dans l’édition 2022 du Petit Larousse qui le considère féminin ou masculin[33],[34].
Canada francophone
Au Canada, le nom est repris avec la typographie COVID-19. Si l'usage du masculin pour COVID-19 l'emporte dans un premier temps[35], l’Office québécois de la langue française se prononce rapidement pour un emploi au féminin[36],[37]. Début mars, le média national Radio-Canada recommande l'emploi du féminin sur son antenne[37]. Par la suite, le Bureau de la traduction du gouvernement canadien précise également le même genre[38]. Ces démarches aboutissent à un usage beaucoup plus fréquent du féminin au Canada que dans le reste de la francophonie[25]. Dans leurs allocutions, les premiers ministres Justin Trudeau[39], du Canada, et François Legault[40], du Québec, emploient le féminin.
Historique de la maladie
Bien que l'origine exacte du virus soit encore inconnue[41], la première éclosion a eu lieu à Wuhan en Chine en . Un mois plus tard, quelques dizaines de cas sont recensés, incluant plusieurs personnes qui, travaillant au marché de gros de fruits de mer de Huanan, sont hospitalisées à l'hôpital de Wuhan dans la région du Hubei, pour pneumopathie[42]. Des médias ont par la suite rapporté qu'un premier cas aurait été un patient de 55 ans tombé malade le en Chine[43].
Le , un kit diagnostic ciblant vingt-deux germes pathogènes respiratoires (dix-huit virus et quatre bactéries) donnant un résultat négatif, les médecins réalisent qu'ils sont en présence d'un nouvel agent pathogène respiratoire[44].
Le , l'Organisation mondiale de la santé (OMS) est officiellement informée par les autorités chinoises de la survenue de cas de cette pneumonie d'origine inconnue dans la ville de Wuhan. Au 3 janvier 2020, un total de 44 cas sont signalés[45].
Le , les autorités chinoises confirment qu'il s'agit bien d'un nouveau virus de la famille des coronavirus, baptisé temporairement « 2019-nCoV »[46] et isolent un nouveau type de coronavirus : le SARS-CoV-2 (deuxième coronavirus lié au syndrome respiratoire aigu sévère). Le coronavirus de Wuhan, désigné internationalement sous le terme « 2019 novel Coronavirus » abrégé 2019-nCov, parfois appelé « virus de la pneumonie du marché aux fruits de mer de Wuhan », est le coronavirus à l'origine de l’épidémie de « pneumonie de Wuhan », nom provisoire repris par l'Institut Pasteur. La Chine a annoncé la nommer provisoirement « pneumonie à nouveau coronavirus », lui donnant le sigle anglais officiel de NCP (pour novel coronavirus pneumonia)[47].
Le , l'OMS annonce que la maladie est transmissible entre humains[48]. Dans la semaine qui suit, elle indique que les modes de transmission de la maladie sont probablement les mêmes que pour d'autres coronavirus. La Commission nationale de la santé de Chine annonce que le nouveau virus a une période d’incubation pouvant aller jusqu’à deux semaines, et surtout que la contagion est possible durant la période d’incubation. De ce fait, s'il ne fait pas l'objet d'une politique de détection systématique et précoce, il est susceptible de se répandre avec une croissance exponentielle[49].
Le , l'OMS déclare que l'épidémie constitue une urgence de santé publique de portée internationale (USPPI)[50]. Certains évoquent la « maladie X », nom donné en 2018 par l'OMS à une maladie susceptible de causer un danger international[51],[52],[53]. Fin janvier il y a officiellement 6 patients atteints en France, 5 hospitalisés à Bichât, 1 à La Pitié et parmi eux un médecin libéral.
Le , l'OMS nomme officiellement la maladie : « maladie à coronavirus 2019 (Covid-19) »[7],[54]. Le virus est lui nommé : « coronavirus 2 du syndrome respiratoire aigu sévère (SARS-CoV-2) »[54].
Le , le directeur général de l'OMS qualifie la Covid-19 de pandémie, soulignant que c'est la première fois qu'une pandémie est causée par un coronavirus[55].
Agent causal
La maladie infectieuse Covid-19 est provoquée par le coronavirus SARS-CoV-2.
Pénétration dans l'organisme et physiopathologie
Les virus infectent généralement les cellules en y entrant via une endocytose médiée par un récepteur auquel chaque virus doit d'abord se lier. Le récepteur utilisé par le SARS-CoV-2 est une protéine de surface cellulaire : l'enzyme de conversion de l'angiotensine 2 (ACE2), la même que pour le SARS-CoV mais avec une affinité 10 à 20 fois plus importante que le SARS-CoV[56]. Le virus se lie avec le récepteur ACE2 par ses protéines présentes dans les épines (spicules) de sa couronne (protein spike)[56].
L'ACE2 est une enzyme de conversion des récepteurs cellulaires de l'angiotensine II[57]. Elle est présente sur les « cellules épithéliales alvéolaires AT2 » situées dans les alvéoles pulmonaires, mais aussi dans l'œsophage (dans les cellules épithéliales supérieures et stratifiées), dans les entérocytes absorbants de l'iléon et du côlon[57],[58] et dans le pancréas (de légères pancréatites sont d'ailleurs observées, via analyses d'amylase et de lipase et via l'imagerie médicale, chez les malades légèrement ou sévèrement atteints par la Covid-19[58]). Les « cellules à AT2 » sont connues pour être sujettes aux infections virales[59].
Le virus, en utilisant l'ACE2, empêche l'élimination naturelle de l'angiotensine II. Cette accumulation d'angiotensine II pourrait entraîner une stimulation des récepteurs AT1R présents sur les lymphocytes TCD8[60] entraînant une libération de cytokines pouvant, en l'absence de régulation, entraîner un choc cytokinétique.
L'implication du système rénine-angiotensine, régulant la pression artérielle dans la réponse immunitaire innée, a fait l'objet de nombreuses publications[60] (plus de 15). Ce système agit par l'intermédiaire du récepteur AT1R présent sur les lymphocytes T CD8+ (12 publications)[60].
Le virus pourrait s'introduire dans le liquide cérébrospinal des personnes contaminées[61].
Les lymphocytes cytotoxiques sont chargés de détruire les cellules dans lesquelles un virus commence à se répliquer : ce sont d'abord les cellules tueuses naturelles (éléments de l'immunité innée), et les lymphocytes T cytotoxiques qui viennent compléter le travail des précédentes et le poursuivre dans la durée. Ces cellules du système immunitaire permettent de bloquer en quelques heures ou quelques jours une infection virale en cours[62].
Une équipe médicale chinoise[63] constate qu'au début de la maladie, l'organisme des patients (panel de 68 malades, âge médian de 47 ans) n'arrive pas à produire les cellules NK et les lymphocytes T CD8+ nécessaires pour combattre le virus. Le nombre moyen de ces cellules a même chuté sous la moyenne normale[63]. Ceci a été révélé par le suivi des niveaux d'expression du récepteur NKG2A, « récepteur inhibiteur » déjà connu comme indicateur d'« épuisement » de ces types cellulaires lors d'autres infections virales chroniques[63]. Et, le jour de leur admission, la leucocytose et la lymphopénie des patients est proportionnelle à la gravité de la maladie[63] (atteignant surtout les LT CD8+). Autrement dit : la phase de progression du virus dans les cas sévères de Covid-19 correspondait à un « épuisement fonctionnel des lymphocytes cytotoxiques », avec un nombre total de cellules tueuses naturelles et de LT CD8+ qui s'effondrait quand le SARS-CoV-2 se développait, alors que l'expression de NKG2A augmentait[63]. Par contre, chez les convalescents, on voyait le nombre de cellules tueuses NK et de LT CD8+ se restaurer, pendant que l'expression de NKG2A diminuait[63]. Ceci laisse penser que dans les cas les plus graves, le SARS-CoV-2 peut bloquer précocement, efficacement (et durablement) notre immunité antivirale. Les auteurs de l'article estiment que le récepteur NKG2A pourrait être une cible thérapeutique à étudier[63].
Une caractéristique commune à de nombreux coronavirus est que « la gravité de la maladie augmente lors de la phase d'élimination du virus, suggérant que la réponse immunitaire de l'hôte est à la fois protectrice et pathogène. De plus, l'inhibition d'aspects spécifiques de la réponse immunitaire entraîne une maladie moins grave et moins de destruction des tissus, sans diminuer la cinétique de la clairance virale »[64].
Répartition dans l'organisme
Elle pourrait varier selon les souches virales ; par exemple chez un patient de Wuhan, « des populations de virus à séquence distincte ont été systématiquement détectées dans des échantillons de gorge et de poumon du même patient, prouvant une réplication indépendante » (réplication démontrée par des ARN réplicatifs viraux)[65].
La première synthèse basée sur 1 070 échantillons prélevés en hôpital en Chine en janvier-février 2020[66] a montré que l'ARN viral était fortement présent dans les lavages bronchoalvéolaires (14 cas sur 15 ; soit 93 %). Venaient ensuite les expectorations (72 cas sur 104 ; 72 %), les écouvillons nasaux (5 cas sur 8 ; 63 %), la biopsie par fibroscopie bronchique (6 cas sur 13 ; 46 %), le pharynx (126 cas sur 398 ; 32 %), les matières fécales (44 cas sur 153 ; 29 %) et enfin dans le sang (3 cas sur 307 ; 1 %).
Le virus infectieux n'a jamais été retrouvé dans l'urine. Mais il a été trouvé dans les selles, dont chez deux patients sans diarrhées[66].
En avril, on découvre[67], comme pour les virus du SRAS et du MERS, que le virus peut infecter le système nerveux central : un patient de 56 ans atteint de la Covid-19 à l'hôpital Ditan de Pékin présente des troubles neurologiques (contractions de muscles du visage après quelques jours de traitement), des coronavirus sont retrouvés dans son liquide cérébrospinal et il développe une encéphalite[68].
Le virus semble aussi affecter le foie et les reins (la métabolisation des médicaments administrés peut de ce fait être modifiée)[69].
Les sécrétions vaginales et la voie vaginale ne semblent pas être une voie d'infection[70].
Fin avril 2020, le virus a été détecté dans les cellules épithéliales alvéolaires de type II, les monocytes, les cellules épithéliales du tube digestif, les cellules tubulaires rénales distales, les cellules des glandes sudoripares cutanées, les éosinophiles parathyroïdes et hypophysaires, les cellules du cortex surrénalien, les cellules pariétales gastriques, les cellules pancréatiques, les cellules acineuses et les cellules de la glande séreuse trachéale. Différent du SARS-CoV-1, le SARS-CoV-2 a été principalement détecté dans les cellules épithéliales alvéolaires de type II et les macrophages pulmonaires, et en partie dans les ganglions lymphatiques hilaires, la rate et les testicules[71].
Fin octobre 2020, une prépublication américaine, encore à confirmer par les pairs, a recherché parmi les cellules épithéliales, mésenchymateuses et immunitaires de la bouche, quelles sont celles qui expriment le plus l’ACE2 (récepteur du virus) ; ce sont les glandes salivaires, la langue et les amygdales[72]. Les autopsies ont confirmé cette spécificité, qui pourrait expliquer que la Covid-19 induit non seulement une perte de l’odorat, mais aussi du goût et une sécheresse persistante de la bouche chez certains patients[72]. Un essai clinique a aussi conclu que les cellules épithéliales de la bouche peuvent effectivement être infectées par le SARS-CoV-2. Le taux de virus dans la salive des patients était positivement corrélé aux changements de goût et d’odeur ressentis. La dynamique d'excrétion virale était distincte pour les zones buccale et nasale et les patients en guérison ont présenté des anticorps salivaires contre les protéines du SARS-CoV-2[72]. Le SARS-CoV-2 installé dans les glandes salivaires pourrait contribuer à une prolongation ou évolution de la maladie, quand la salive infectée est avalée (induisant un risque d’infection intestinale) ou aspirée vers les poumons (avec alors un risque de pneumonie) ou expulsés lors des crachats, éternuements, postillons, d’une manière « peut-être sous-estimée » et parfois asymptomatique[72]. Ceci confirme, s'il en était besoin, l’enjeu du port du masque facial correctement ajusté et de la distanciation physique[72].
Comparaison de dangerosité avec d'autres virus
Le taux de reproduction de base (R0) est le nombre moyen d'individus qu'une personne infectieuse peut infecter, tant qu'elle est contagieuse.
Le temps de génération est le délai qui sépare l'apparition des signes cliniques d'une personne infectée et l'apparition des signes cliniques des ou de la personne qu'elle a infectée.
| Virus | Maladie | Transmission respiratoire | Taux de reproduction de base | Taux de létalité pour 1000 habitants | Temps de génération (jours) | Contagiosité avant l'apparition des symptômes |
|---|---|---|---|---|---|---|
| SARS-CoV-2 | Covid-19 | Supérieur à 2[73] | entre 11,5 et 2,3 suivant les pays[74] | > 3 | ||
| Alphainfluenzavirus Betainfluenzavirus Gammainfluenzavirus |
grippe | 1,4 | 1 | |||
| SARS-CoV(-1) | SRAS | Supérieur à 2 | 94 | Non (trois jours après la toux, probablement car contrairement au cas de la Covid-19, le SARS-CoV-1 ne se reproduisait que dans la partie basse du poumon, alors que le SARS-CoV-2 se reproduit aussi dans la partie supérieure des voies respiratoires[78]). | ||
| MERS-CoV | SRMO / MERS | Inférieur à 1 | 344 | |||
| Morbillivirus (measles virus) | rougeole | 12 | 1 | Non mais signes très légers |
Transmission
La première étude (portant sur les 425 premiers cas) dans The New England Journal of Medicine, montre que la transmission inter-humaine date au moins de la mi-[79].
Pour éviter la contagion, une distance supérieure à un mètre semble généralement suffisante. Par précaution 2 mètres, voire plus, sont parfois proposés ou imposés[80]. Une étude publiée le dans le JAMA montre qu'en cas de toux ou d'éternuement, la diffusion du virus est possible lors de l’expiration jusqu'à une distance pouvant atteindre 8 mètres[81], très loin des deux mètres recommandés par le CDC[82]. En présence d'aérosols et non de gouttelettes, un masque FFP2 est efficace.
L’existence de patients totalement asymptomatiques, en grand nombre (20 % des individus infectés[83] et contagieux), semble se confirmer et modifie les recommandations initiales de l'OMS de ne pas porter de masque[84].
Contagiosité
La contagiosité du SARS-CoV-2 serait notamment due à sa capacité à être clivé par la furine (protéine présente dans de nombreux tissus), ce qui n'était pas le cas des deux autres coronavirus hautement pathogènes pour l'humain[85],[86].
Établir la contagiosité
Mesurer la contagiosité du virus n'est pas simple. Le test-diagnostic RT-PCR n'indique que la présence d'ARN viral (en fait d'un fragment qui diffère selon les tests), il ne peut pas différencier l'ARN de virus activement infectieux et celui de restes de virus inactivés par le système immunitaire. Il ne mesure donc pas le degré de contagiosité du patient[87]. La réplication active du virus peut cependant être démontrée par l'analyse d'intermédiaires réplicatifs sous-génomiques viraux, mais ce n'est pas une pratique de routine en laboratoire[88].
Un bon moyen d'établir le pouvoir infectieux et la contagiosité est la culture virale (in vitro), mais elle n'est pas utilisable en pratique, car elle est longue, non représentative de la vitesse de reproduction du virus in vivo, et de faible sensitivité (beaucoup d'échec de culture)[89]. Pour la grippe, il existe une corrélation entre la quantité de copies retrouvée par RT-PCR et la quantité de virus retrouvée par culture virale[90]. Il n’existe aucune donnée pour le SARS-CoV-2.
Le , le South China Morning Post cite une étude post-mortem de l’université de Hong-Kong sur la multiplication du SARS-CoV-2 (par rapport au SARS-Cov, responsable du SARS) dans le tissu pulmonaire. Le SARS-CoV-2 se multiplie de 5 à 10 fois plus que le SARS-Cov dans la même unité de temps, aboutissant à une production de virus 3 fois supérieure au SARS-Cov. Cette multiplication importante s'accompagne d'une réponse immunitaire plus faible de l'organisme[91].
Durée de la période d'excrétion virale
C'est le temps durant lequel un malade est potentiellement contagieux. Elle commence dans les heures qui suivent la contamination, donc avant toute manifestation perceptible de la maladie.
En général :
- lors de l'incubation : avant les premiers symptômes, avant que le système immunitaire ne soit déjà bien activé, le futur malade est déjà contagieux[92]. Mi-avril 2020, dans Nature, une étude a confirmé qu'il est particulièrement contagieux en fin d'incubation (c'est peut-être le moment où il le sera le plus). La contagiosité commence 2,3 jours avant les premiers symptômes, et elle culminerait à 0,7 jour avant l'apparition de ces symptômes[92] ; une autre étude a trouvé que l'excrétion pharyngée était très élevée la première semaine de symptômes (pic à 7,11 × 108 copies d'ARN par prélèvement de gorge au jour 4)[65] ;
- pendant la phase clinique (symptomatique) : le malade est contagieux ; après l'apparition des signes cliniques, la moyenne de la durée de contagiosité serait de 20 jours pour les personnes de moins de 65 ans et de 22 jours pour les personnes de plus de 65 ans[93] ;
- durant la convalescence : certains malades excrètent encore le virus après disparition des symptômes. De l'ARN viral est retrouvé dans les expectorations et les selles après disparition totale des symptômes[65].
À la mi-mars 2020, peu de données concernent les porteurs asymptomatiques et/ou non hospitalisés, mais chez les patients hospitalisés, la durée médiane d'excrétion virale était de 20 jours environ chez les survivants. Et le SARS-CoV-2 était détectable jusqu'à la mort chez tous les non-survivants[94]. Il est probable que ces patients sont ceux qui excrètent le plus de virus, et le plus longtemps. La durée la plus longue d'excrétion virale observée parmi près de 200 cas étudiés a été (parmi les survivants) de 37 jours[94].
Cette excrétion, plus précoce et plus longue qu'attendue, est à prendre en compte dans les modélisations épidémiologiques. Elle confirme la nécessité d'isoler les patients infectés et de rechercher des antiviraux plus efficaces[94]. La contagiosité ne disparaît pas nécessairement quand l’excrétion du virus disparaît de la gorge, notamment chez l'enfant qui peut encore excréter le virus via l'intestin jusqu'à 8 à 20 jours après que le virus n'est plus présent dans la gorge[95].
Chez les enfants
L'enfant ne présente souvent que des symptômes bénins (ou aucun symptôme) mais tout en excrétant le virus et pouvant alors être contagieux. De plus, l'excrétion virale dans les selles persiste même après la disparition du virus dans les excrétions nasales ou dans les écouvillonages de la gorge, avec des écarts constatés de 8 à 20 jours. Ce fait évoque des mécanismes différents de ceux constatés chez l'adulte[96],[97].
Taux de contagion
Selon de premiers travaux de recherche, le taux de reproduction de base (noté R0) qui est un indice de contagiosité se situerait entre 2,2 et 3,5[79],[98]. Il est de 2,2 (intervalle de confiance 95 %, de 1,4 à 3,9) sur les 425 premiers cas confirmés[79].
Une revue de la littérature publiée entre le et le indique une médiane du taux de reproduction de base à 2,79[99].
En avril 2020, le taux de contagiosité est réévalué fortement à la hausse, entre 3,8 et 8,9, avec une médiane à 5,7[100],[101].
Taux d’attaque secondaire
Ce taux décrit le nombre de foyers secondaires apparaissant à partir d'un foyer primaire. Il indique la facilité d'une infection à se propager dans un lieu clos (foyer...). Une publication du dans le Lancet, estime ce taux d'attaque secondaire à 35 %[102].
Survie du virus hors de l'organisme
Elle a dans un premier temps été estimée comprise entre trois heures (en milieu sec) et trois jours (en milieu humide), mais, comme pour la plupart des virus, elle varie beaucoup selon les conditions de température, d'humidité, de lumière (les UV solaires le détruisent), et selon le type de surface sur laquelle le virus, ou le résidu sec de gouttelettes en contenant, se sont déposés.
En , on estimait que le pouvoir infectieux du virus disparaissait en quelques heures[103]. On notait cependant que le virus de la Covid-19 se montrait bien plus contagieux que celui du SRAS et encore bien plus que celui du MERS, surtout pour le personnel soignant, surexposé, et ce malgré les masques chirurgicaux utilisés.
Une étude américaine parue le dans le NEJM[104] a mesuré le temps de « survie » des virus SARS-Cov-1 et SARS-CoV-2 dans différentes conditions :
- En aérosol (en suspension sèche, dans l'air — c'est-à-dire hors de gouttelettes).
- Sur quatre types de surfaces[105].
Les résultats peuvent être résumés ainsi :
| Virus | En suspension dans l'air | Sur une surface de cuivre | Sur une surface de carton | Sur une surface d'inox | Sur une surface de polypropylène |
|---|---|---|---|---|---|
| SARS-Cov-1 | Encore très présent après 3 heures. | Les virus infectieux ont disparu en 8 heures. | Les virus infectieux ont disparu en 8 heures. | Encore détectable à faible concentration après 48 heures. | Encore détectable à faible concentration après 72 heures. |
| SARS-CoV-2 | Encore très présent après 3 heures. | Les virus infectieux ont disparu en 4 heures. | Les virus infectieux ont disparu en 24 heures. | Encore détectable à faible concentration après 72 heures. | Encore détectable à faible concentration après 72 heures. |
Important : trois heures est la durée maximale testée ci-dessus pour les aérosols (virus en suspension dans l'air) ;
trois heures après l'aérosolisation, le taux de SARS-CoV-2 viables était encore très significatif (le titre infectieux n'était passé que de 103,5 à 102,7 TCID50/mL). Il en allait de même pour le SARS-CoV-1 qui en 3 heures passait de 104,3 à 103,5 TCID50/mL.
Remarque : cette étude visait à « prévenir le milieu hospitalier et les chercheurs qui manipulent le virus en laboratoire — qui sont en contact étroit avec les agents infectieux — sur différentes surfaces, pour minimiser les risques de contamination et d'infections nosocomiales »[106]. Les quantités de virus (charge virale) utilisées pour ces tests en laboratoire étaient très élevées, non représentatives de contaminations accidentelles en milieu ordinaire. L'étude américaine précisait d'ailleurs que le virus résiste moins de 5 minutes en dessous de 10 000 particules (contre 100 millions de copies pour test)[106].
- Toutefois, en cas de toux ou d'éternuement, les gouttelettes exhalées se diffusent dans l'air sous la forme d'un nuage chaud et humide dont la cinétique retarde l'évaporation de ces gouttelettes ; l'aérosol (résidu sec après leur évaporation) pourrait rester dans l'atmosphère ambiante pendant plusieurs heures, et dans des conditions propices se diffuser via les systèmes de ventilation, ce qui serait alors une source potentielle d'infections nosocomiales[81].
- Le 7 juillet 2020, après que plus de 200 scientifiques ont consigné une lettre ouverte dans la revue Oxford Clinical Infectious Diseases, exhortant l’OMS et la communauté médicale à « reconnaître le potentiel de transmission aérienne de la Covid-19 » (l'OMS a alors reconnu qu'une transmission aérienne n'est pas à exclure), Joshua Santarpia et son équipe (à l'université du Nebraska) ont confirmé que des particules virales expirées sous forme d'aérosols (dans leur étude, captées à 30 centimètres au-dessus des pieds de cinq malades alités dans leur chambre d'hôpital, dans des microgouttelettes de moins de 1 à cinq microns de diamètre, issues de l'expiration des malades) semblent bien capables de se répliquer chez un autre individu et de provoquer une infection. Pour 3 de 18 échantillons de gouttelettes d'un micron le virus a pu se reproduire in vitro. Selon la professeure Linsey Marr (experte en contamination virale aéroportée), qui évoque à ce sujet « des preuves solides », « il y a du virus infectieux dans l'air[107] ». On ignore encore la concentration à inhaler pour être infecté[107].
Saisonnalité
Une étude chinoise sur la température et le taux d'humidité dans la transmission du virus conclut que celle-ci semble peu influencée par ces paramètres[108].
Le chef du service de virologie du CHU de Caen, le Dr Astrid Vabret, rappelle que l'épidémie de SRAS s'est produite de à , puis de à . De l'automne au printemps, voire à l'été, donc. Et « on ne sait pas quel a été le rôle de la saisonnalité sur le SRAS ». Certes, « les virus sont tués par les hautes températures, mais on parle là de plus de 56 °C », insiste la virologue. « Si l'organisme d'un humain atteint cette température-là, s'il ne peut pas se refroidir, lui aussi meurt. C'est déjà compliqué de survivre à 43 °C »[109].
Le directeur de l'Institut de santé globale au sein de la faculté de médecine de l'université de Genève, Antoine Flahault, estime que, « sous les latitudes tempérées, les virus respiratoires, comme ceux de la grippe ou les coronavirus, sont sensibles aux saisons et l'hiver est leur saison de prédilection »[109].
Lieux de transmission du virus
Les entreprises sont les lieux où l'on a le plus de chances de se faire contaminer (une contamination sur quatre). Viennent ensuite le milieu scolaire, universités en tête, et les établissements de santé[110].
Selon une étude américaine basée sur de la modélisation, et réalisée en mars 2020, les lieux clos et mal aérées, qui accueillent beaucoup de monde, ont un taux de contamination plus fort qu'ailleurs. Cette étude pointe ainsi les restaurants, les salles de sports, les cafés et les hôtels comme étant des hauts lieux de contamination, sachant toutefois qu'à l'époque, aucun protocole sanitaire n'était respecté, et aucun masque n'était porté dans ces lieux. Pour des raisons pratiques, les entreprises n'ont pas été incluses dans cette étude[111].
En France, un collectif de six médecins estime que l'on se contamine surtout lors de rassemblements privés, et appelle donc la population à limiter ces rassemblements[112].
Selon « Santé Publique France », la majorité des clusters de contamination en France viennent des milieux universitaires, des EPHAD, et des entreprises[113].
En Espagne, les discothèques sont considérées comme des lieux propices à la transmission, en raison d'une moindre aération, du non port du masque durant la consommation des boissons, du non-respect des distances physiques, et du parler fort nécessaire pour couvrir une sonorisation bruyante[114].
Ces discothèques ne génèrent pas de nombreux foyers de contagion, mais les foyers de contagion générés par les discothèques touchent une plus grande population[115].
Environnement de transmission
L'environnement peut jouer un rôle dans la transmissibilité du virus et ou de la maladie :
- la transmission de Covid-19 est commune dans les lieux fermés.
- malgré l'existence de deux clusters attribués à des mécanismes de ventilation/climatisation, il n'y a pas de preuve d'infection humaine par SARS-CoV-2 via la distribution d'aérosols infectieux avec des ventilations HVAC (anglais : Heating ventilation air-conditioning) système contrôlant la température de chauffage, la ventilation et l'air conditionné) : le risque est considéré/supposé très faible par l'ECDC (Centre européen de prévention et de contrôle des maladies).
- les systèmes HVAC bien entretenus peuvent filtrer sûrement des grosses gouttelettes contenant du SARS-CoV-2, mais des aérosols Covid-19 peuvent se propager à travers des HVAC de bâtiments ou de véhicules lorsque l'air circule en circuit fermé.
- les flux d'air de ventilation/climatisation peuvent faciliter l’épandage des gouttelettes sur de plus longues distances dans des espaces fermés.
- les HVAC peuvent jouer un rôle complémentaire pour réduire la transmission intérieure en changeant l'air intérieur par de l'air extérieur[116].
Transmission interhumaine
Au , les modalités précises de transmission sont encore mal cernées. Certaines personnes infectées n'ont pas transmis le virus, tandis que d'autres l'ont transmis à plusieurs personnes[117].
Plusieurs voies de transmission semblent coexister :
- la voie respiratoire directe : c'est la plus commune. Une étude publiée le 26 mars dans le JAMA montre que la diffusion du virus est possible lors de l’expiration jusqu'à une distance pouvant atteindre 8 mètres en cas de toux ou d'éternuement[81], très loin des deux mètres recommandés par le CDC[82] ;
- la parole est suffisante pour émettre un nombre important de gouttelettes de salive. Une personne prononçant trois fois la phrase « Stay healthy » pendant vingt-cinq secondes, émet environ 350 gouttelettes avec une courte pause entre les phrases, au cours de la première phrase et 230 à la troisième. Ce résultat a été obtenu par étude utilisant une lumière laser verte[118], le virus stagne alors dans l'air d'un espace confiné pendant environ dix à douze minutes[119],[120] ou, selon une autre étude, entre 8 et 14 minutes[121] ; en extérieur, la propagation des gouttelettes après un éternuement sans masque dépend beaucoup de la vitesse et de la direction du vent[121] ;
- par contact avec une surface ou un objet infecté : les doigts qui se sont contaminés sur une surface, s'ils sont ensuite portés à la bouche, près des narines ou sur l'œil, peuvent être vecteurs du virus. Les virus du SRAS et du MERS pouvaient rester infectieux sur des surfaces lisses et certains objets (dits fomites)[122] : ceci est aussi démontré depuis février 2020 pour le SARS-CoV-2[123]. Mi-mars, on estime qu'à l'intérieur d'une pièce, un coronavirus reste infectieux 9 jours sur des substrats lisses non poreux[124], sauf sur le cuivre ou les métaux à base de cuivre (laiton, bronze) qui sont naturellement biocides. La demi-vie du virus (temps nécessaire pour que la moitié des virus soient inactivés) est d'environ treize heures sur de l'inox et seize heures sur du polypropylène[125] ;
En juillet 2020, dans un commentaire[126] envoyé au Lancet, l'américain Emanuel Goldman (Microbiologiste et biochimiste en génétique moléculaire à la New Jersey Medical School - de l'université Rutgers) considère que ce risque existe surtout à court terme (pour quelques heures) et quand une personne a directement éternué ou toussé sur un objet, mais que le risque a pu être surestimé par le titre élevé de virus caractérisant les inoculums faites pour évaluer la durée d'infectiosité du virus sur divers types de surface (ex : 105 à 107 particules virales infectieuses par ml dans les aérosols, 104 particules virales infectieuses sur les surfaces)[125] ; selon Emanuel Goldman : en situations réelles, le nombre de virus contaminant les fomites est bien moindre (par exemple sur le latex des gants[127] ou sur d'autres surfaces[128]) ; remarque : il n'évoque pas les fomites contaminés par d'autres fluides corporels que les gouttelettes expectorées (vomi, excréments de malades notamment). - par aérosolisation d'un inoculum viral: une transmission par aérosols a été pétitionnée par des scientifiques[2],[129], puis acceptée par l'OMS[130] et confirmée[125] (le virus pouvant alors rester infectieux deux à trois heures dans l'air, sans doute plus si l'hygrométrie est très élevée) ;
- par des particules ou gouttelettes fécales ; la Covid-19 induit souvent des diarrhées, et une modélisation récente a montré qu'activer la chasse d'eau (lors d'un rinçage « à entrée unique », et pire encore lors d'un « rinçage annulaire »), entraîne un « transport ascendant et massif de particules virales aérosolisées » (avec 40 à 60% de ces particules s'élevant au-dessus du niveau du siège des toilettes). Une vitesse ascendante atteignant 5 m/s dans la cuvette permet une propagation du virus à grande échelle dans l'air intérieur de la pièce, avec « 0 à 60% du nombre total de particules pouvant s'élever (...) à 106,5 cm au dessus du sol »[131]. Le risque est atténué si le couvercle du W-C est rabattu au moment de la chasse d'eau. Le risque est fortement diminué si le contenu des toilettes est désinfecté et si on y ajoute un surfactant de type ammonium quaternaire (mais le temps de contact doit être d'au moins quinze minutes)[131]. Les personnes se lavant mal les mains après être passées aux toilettes sont donc potentiellement vectrices du virus, ce qui a d'abord été suggéré en février par deux laboratoires d'État chinois[132] puis confirmé dans JAMA le 12 mars 2020[133], et qui est cohérent avec le fait que le récepteur de surface utilisé par le virus pour pénétrer dans une cellule est aussi présent dans les entérocytes de l'iléon et dans les colonocytes du tube digestif[57],[134],[135] ;
- par le réseau des eaux usées (en cas d'assèchement de siphons et/ou de fuites…) : lors de la pandémie de SRAS de 2002-2003, une flambée majeure de SARS-CoV a concerné 321 personnes infectées dans un même immeuble de grande hauteur, au même moment, à Hong Kong. La conduite d'eau usée qui descendait à l'extérieur à proximité d'une rangée verticale de climatiseurs et de fenêtres a été jugée responsable de cette brutale contagion[136] ;
- par les systèmes de climatisation[137].
Une étude de suggère que le port régulier de lunettes réduit le risque de contamination[138], confirmant ainsi que les yeux sont un point d'entrée possible pour le virus.
Transmission humain-animal
En mars 2020, un cas de transmission de l'humain vers l'animal semble documenté à Hong Kong[139]. Il s'agit d'un spitz nain testé faiblement positif après que son propriétaire a développé la Covid-19. Selon le ministère de l'Agriculture, des Pêches et de la Conservation de Hong Kong, les experts pensaient unanimement que ce chien avait « un faible niveau d'infection et qu'il s'agirait probablement d'un cas de transmission d'humain à animal ». Des experts médicaux, notamment de l'OMS, enquêtent pour déterminer si le chien a été directement infecté ou s'il s'agit d'une contamination acquise via un objet porteur du virus. Pour l'OMS, il n'y avait pas encore de preuve que des animaux, comme les chiens ou les chats, puissent être infectés par ce coronavirus. Les autorités locales recommandent cependant de ne plus embrasser les animaux de compagnie. Le chien est mort 7 jours après avoir été testé et le propriétaire a refusé l'autopsie[140].
Un deuxième cas de transmission de l'humain vers l'animal a été recensé en Belgique ; il s'agit d'un chat qui a été contaminé par son maître testé positif à la Covid-19.
En avril 2020, une étude d'une équipe de scientifiques de l'Institut de recherche vétérinaire de Harbin, foyer de la seconde vague de Covid-19 en Chine, montre que le chat peut être infecté par le virus mais sans présenter de symptôme ; son rôle semble néanmoins très minime dans la propagation du virus[141], mais les scientifiques chinois ont toutefois constaté que la transmission entre chats pouvait être possible par crachats et que les chatons étaient plus gravement atteints que les adultes, avec « des lésions massives dans la muqueuse nasale et trachéale, ainsi que les poumons »[142]. Par contre, le furet serait plus sensible au virus, puisque certains d'entre eux auraient perdu l’appétit et eu de la fièvre[142]. Les autres animaux étudiés, dont le chien, le porc, le poulet ou le canard, ne semblent pas être atteints par le virus[141],[142].
Selon une étude pré-publiée sur BioRxiv l'inoculation expérimentale sur la conjonctive de l'œil du singe Macaque s'est montrée infectieuse[143].
En novembre 2020, un variant dit « Cluster 5 » du SARS-CoV-2 est identifié chez des visons d'élevage. « A ce jour, six pays, à savoir le Danemark, les Pays-Bas, l'Espagne, la Suède, l'Italie et les États-Unis ont rapporté des cas de SARS-CoV-2 chez des élevages de visons auprès de l'Organisation mondiale de la santé animale » déclare l'OMS[144]. La France rapporte à son tour un cas le 22 novembre dans un élevage d'Eure-et-Loire et ordonne l'abattage immédiat des mille bêtes de l'exploitation[145].
En janvier 2021, il a été relevé que les espèces suivantes étaient susceptibles d'être infectées par le SARS-CoV-2 : les chauves-souris, les chats, les chiens, les lions et les tigres (du zoo de New-York), les visons d'élevage, les furets sauvages, les hamsters, les macaques[146].
Transmission en phase d'incubation
Elle est prouvée par des tests faits systématiquement chez des sujets ayant eu un contact avec un cas « index »[76]. Ont été ainsi mis en évidence :
- la présence du SARS-CoV-2 dans des frottis nasopharyngés au moyen de la technique de PCR quantitative par transcriptase inverse (qRT-PCR) ;
une étude de la charge virale des écouvillons nasaux et de la gorge obtenus auprès des 17 patients symptomatiques en fonction du jour d'apparition de tout symptôme est publiée le [147] ; - une charge virale élevée (environ 100 000 000 de copies (du virus) par millilitre de crachat).
Transmission durant la maladie
- Des charges virales plus élevées sont détectées peu après l'apparition des symptômes, avec des valeurs plus fortes dans le nez que dans la gorge. Le schéma d'excrétion virale par les malades symptomatiques semble plus proche de celui des sujets grippés[148] que de celui observé chez les patients infectés par le SARS-CoV-2[149].
Transmission par des sujets asymptomatiques
En novembre 2020, les preuves suggèrent qu'environ une personne infectée sur cinq ne présentera aucun symptôme et qu'elle transmettra le virus à beaucoup moins de personnes qu'une personne présentant des symptômes. Une méta-analyse publiée en octobre 2020 a calculé un taux d'infections asymptomatiques à 17 %. Cette analyse révèle également que les personnes asymptomatiques étaient 42 % moins susceptibles de transmettre le virus que les personnes symptomatiques (le risque qu'une personne asymptomatique transmette le virus à d'autres personnes chez elle serait, lui, d'environ un quart du risque de transmission par une personne symptomatique)[83].
Un programme de dépistage de masse de plus de 10 millions d'habitants de Wuhan, en Chine, réalisé après la maîtrise du SRAS-CoV-2, a identifié 300 cas asymptomatiques de covid-19, dont aucun n'était infectieux. Les chercheurs n'ont trouvé aucun « virus viable » dans les cultures d'échantillons asymptomatiques. Ils ont néanmoins déclaré que leurs découvertes ne montraient pas que le virus ne pouvait pas être transmis par des porteurs asymptomatiques, et n’ont pas suggéré que leurs résultats étaient généralisables[150].
_infections_among_travellers_from_Wuhan%252C_China%252C_20%E2%80%9328_January_2020_-_2000062-f3.gif)
bleu : SARS-CoV-2 ; rose : SARS-CoV ; vert : MERS-CoV ; médiane : point noir ; intervalle interquartile : encadré ; la longueur des « moustaches » valant 1,5 fois l’écart interquartile.
D'après les 1res données disponibles pour le SARS-CoV-2 (à confirmer donc...)
Incubation
La période d'incubation de la Covid-19 serait d'environ cinq jours, le plus souvent comprise entre trois et sept jours. Exceptionnellement, pour un peu plus de 1 % des cas, le temps d'incubation dépasse quatorze jours[151] et très exceptionnellement pourrait durer jusqu'à 24 jours[152].
Quatorze jours est donc considéré comme un bon délai de sécurité pour savoir si une personne est symptomatiquement infectée, et pour éviter qu'elle ne contamine d'autres gens hors de sa zone de confinement.
Historiquement, fin janvier, l'OMS, en se basant notamment sur les observations anciennes faites sur le MERS[153], a estimé la durée d'incubation à en moyenne cinq jours (entre deux et dix jours)[154]. On savait aussi déjà qu'« on peut être contagieux avant que les signes cliniques soient là », voire sans symptômes, comme avec la grippe ; et « que les cas secondaires sont de plus en plus fréquents »[155].
Le , une étude chinoise supervisée par Zhong Nanshan (médecin ayant découvert le SRAS en 2003)[152], menée sur près de 1 100 patients conclut à une incubation de 0 à 24 jours, avec une durée médiane de trois jours[156],[157].
Le 10 mars, une étude internationale[158] estime la durée médiane d'incubation à 5,1 jours (5,5 jours en moyenne), et que 97,5 % des personnes seront malades 11,5 jours après le contact infectieux. Même si dans 101 cas sur 10 000 (99e percentile), les 14 jours sont dépassés, les auteurs principaux, le docteur Lauer et Ms. Grantz, jugent qu'il n'y a pas lieu de remettre en cause la durée de 14 jours de quarantaine[151].
Symptômes et manifestations cliniques
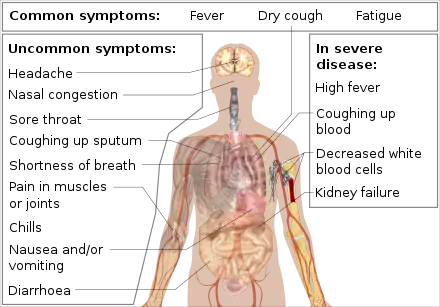
Une étude française publiée le décrit trois types de malades[159] :
- patients présentant peu de signes cliniques mais avec une charge virale nasale élevée et étant très contagieux ;
- patients ayant des symptômes légers au départ mais subissant une aggravation vers le dixième jour avec apparition d'un syndrome respiratoire aigu sévère malgré une charge virale qui diminue ; la réaction immunitaire au niveau pulmonaire ne serait plus régulée ;
- patients avec une aggravation rapide vers un syndrome respiratoire aigu avec persistance d'une charge virale élevée dans le nez et dans la gorge et apparition d'une virémie sanguine à SARS-CoV-2 provoquant une défaillance multiviscérale conduisant au décès. Ce troisième type de malade concerne surtout les personnes âgées.
Dans certains cas, la maladie peut durer de 30 à 60 jours[160].
Formes cliniques (la plus fréquente étant respiratoire)
L’installation des symptômes se fait progressivement sur plusieurs jours, contrairement à la grippe qui débute brutalement[161].
Signes cliniques
En , les signes cliniques sont, selon le British Medical Journal[162], en fonction de leur fréquence :
- signes cliniques principaux :
- la fièvre (sauf chez l'enfant) chez 77 % à 98 % des patients, qui peut parfois apparaître après la toux ;
- la toux, le plus souvent sèche, chez 57 % à 82 % des patients ;
- une anosmie (perte totale de l'odorat) chez 70 % à 86 % des patients (d'autres études ont obtenu des taux différents[163],[164],[165]) ;
- une agueusie (perte du goût) chez 54 % à 88 % des patients (d'autres études ont obtenu des taux différents[166],[167]) ;
- la dyspnée (gêne respiratoire) chez 18 % à 57 % des patients ;
- signes secondaires :
- la fatigue chez 29 % à 69 % des patients,
- une perte d'appétit chez 40 % des patients ;
- des crachats chez 26 % à 33 % des patients,
- les douleurs musculaires chez 11 % à 44 % des patients,
- des maux de gorge chez 5 % à 17 % des patients.
D'autres signes cliniques ont été peu à peu rapportés :
- des symptômes dermatologiques dans 20 % des cas[168] (exanthème, ou, plus rarement tâches noires sur la peau, noircissement de la peau[169] ou pseudo-engelures)[170],[171].. Selon le Massachusetts General Hospital, le syndrome dit « orteil covid » pourrait persister à long terme chez certains patients[172], bien que le lien entre ce syndrome et la covid-19 ne soit pas formellement établi[173].
- des symptômes oculaires. Lors des pandémies de SRAS de 2002-2003 puis de MERS (2012), quelques études avaient détecté le virus dans les larmes de patients[174],[175], et une autre non (dans le cas du SRAS)[176], mais des signes et symptômes oculaires ont été rétrospectivement retrouvés[177]. Ainsi, une première étude (février 2020) notait une « congestion conjonctivale » chez certains malades[178]. Une autre étude parmi 38 patients chinois hospitalisés pour Covid-19 dans le Hubei du 9 au , 28 (soit 73,7 %) ont été testés positifs et 12 (soit 31,6 % ; environ un tiers) ont manifesté des troubles oculaires associés à une conjonctivite (dont hyperémie conjonctivale, chémosis, épiphora ou sécrétions anormalement abondantes)[177]. Ces troubles sont plus marqués chez ceux qui ont été les plus gravement malades[177]. La RT-PCR était positive SARS-CoV-2 pour 28 écouvillons nasopharyngés et également pour des écouvillons conjonctivaux chez deux d'entre eux (soit 5,2 %)[177]. Une conjonctivite (éventuellement avec kératoconjonctivite) peut être le premier symptôme de la maladie[179]. Les anomalies sanguines étaient les plus marquées chez les patients ayant ces troubles oculaires[177]. Ces troubles ont une valeur diagnostique[177] ; les connaître peut contribuer à prévenir la transmission de la maladie[177]. L'œil est une cible possible du virus car l'ACE2 (cible du SRAS-CoV-2)[180] est présente dans la rétine humaine[181], la choroïde de l'épithélium pigmentaire rétinien vascularisé[182] et la cornée ainsi que sur l'épithélium conjonctival[183]. Bien que le virus soit peu présent dans les larmes « il est possible de le transmettre par les yeux »[177]. En avril, des informations et préconisations pour les ophtalmologistes ont été publiées[184]. La tomographie par cohérence optique (ou PTOM) permet l'observation non invasive de la rétine ; elle avait déjà montré des changements rétiniens discrets (infracliniques) en cas de diabète, maladie de Parkinson et maladie d'Alzheimer, et pour beaucoup d'infections virales[185]. En 2020, elle a montré que le SARS-CoV-2 induit aussi de discrets changements rétiniens (dans un panel de patients hospitalisés, mais n'ayant pas nécessité de soins intensifs et dont les paramètres sanguins étaient normaux au moment de l'évaluation ophtalmologique)[186]. Tous ces patients présentaient des lésions hyper-réfléchissantes au niveau des cellules ganglionnaires et des couches plexiformes internes de la rétine, plus visibles au niveau du faisceau papillomaculaire. Ni leur acuité visuelle ni leurs réflexes pupillaires étaient dégradés, et aucun signe d'inflammation intraoculaire étaient visibles[186] ; l'angiographie OCT et de l'analyse des cellules ganglionnaires semblaient normales chez tous ces patients, mais quatre d'entre eux présentaient de subtiles taches cotonneuses et des microhémorragies le long de l'arc rétinien (visible lors de l'examen du fond d'œil, à la photographie couleur du fond d'œil, et à l'imagerie sans rouge)[186]. « Les implications oculaires doivent également être prises en compte pour le traitement. Car un traitement potentiel est la chloroquine et ses dérivés, y compris l'hydroxychloroquine. Or l'hydroxychloroquine peut induire une toxicité rétinienne »[179].
Les critères de gravité sont les suivants :
- Une fréquence respiratoire supérieure à 30 par minute ;
- Une saturation en oxygène au repos inférieure à 93 % (SaO2) ;
- Un rapport pression en oxygène sur concentration en oxygène inférieur à 300 mm de mercure (PaO2/FiO2).
Dégâts pulmonaires
Les études en microscopie électronique et sur coupes histologiques de tissus pulmonaires (faites après autopsies) ont montré que les virions sont dans le poumon essentiellement localisés dans les pneumocytes[187].
Comme dans le cas du SARS, puis du MERS, la Covid se traduit dans l'arbre respiratoire par des lésions alvéolaires diffuses, caractérisées par des phases exsudatives et prolifératives de ces lésions, avec une congestion des vaisseaux capillaires et une nécrose systématique des pneumocytes, et très souvent une atteinte des membranes hyalines, un œdème interstitiel et intra-alvéolaire.
Les autopsies ont aussi révélé de fréquents événements thromboemboliques (« parfois cliniquement insoupçonnés au décès »)[188] . Outre une hyperplasie pneumocytaire de type 2, on a souvent observé une métaplasie squameuse avec atypie et micro-thrombus plaquettaire-fibrine[187],[189],[190],[191],[192].
L'infiltrat inflammatoire est toujours majoritairement composé de macrophages, souvent présents dans la lumière alvéolaire, souvent accompagnés de lymphocytes dans l'interstitium[187]. Des membranes hyalines se forment fréquemment, et une hyperplasie atypique des pneumocytes est également fréquemment constatée post-mortem. Le thrombus plaquettaire-fibrine des petits vaisseaux artériels peut être relié à une coagulopathie apparemment fréquente chez les malades de Covid-19 et qui selon Carsana & al (2020) devrait être l'une des principales cibles du traitement[187].
Formes extra-respiratoires
Quatre mois après l’apparition de la maladie, celle-ci fait l'objet de plusieurs nouvelles descriptions.
Manifestations gastro-intestinales
Dès décembre 2019, des symptômes gastroentériques sont épisodiquement signalés chez les malades[193],[194], suivis de preuves éparses d'atteintes entériques[195],[196],[197],[198],[199],[200],[201].
Ces études laissaient penser que les symptômes gastro-intestinaux ne survenaient qu'au cours de la maladie, mais une autre étude[194] a signalé que des patients atteints de Covid-19 avaient déjà des diarrhées 1–2 jours avant apparition d'une fièvre et/ou de dyspnée.
Début avril 2020, une analyse virologique détaillée de 9 malades conclut que dans ces 9 cas, des virus infectieux était abondants dans la gorge et les poumons, mais pas dans les échantillons de sang, d'urine ou de selles (malgré une forte concentration en ARN viral dans les selles)[65].
Mi-avril 2020, la fréquence d'atteintes gastroentériques est rétrospectivement confirmée par une étude multicentrique[202], menée en Chine dans la province du Hubei, où les cas de 232 patients testés positifs au SARS-CoV-2 entre le et le ont été étudiés[203]. Ces malades se répartissaient en 129 hommes et 101 femmes ; ils étaient âgés de 7 à 90 ans (âge médian : 47,5 ans)[203]. Des diarrhées ont été signalées chez 49 (21 %) patients, plutôt chez les plus âgés, et chez les plus susceptibles d'avoir des comorbidités et plus souvent touchés par une pneumonie grave (par rapport à la moyenne des malades)[203].
Singulièrement, plus l'épidémie avançait dans le temps, plus la part des malades souffrant de diarrhée augmentait ; ainsi 43 % des patients accueillis entre le et le présentaient des diarrhées contre 19 % des malades accueillis dans le mois précédent (entre le et le )[203]. Les auteurs n'ont pas trouvé de corrélation entre le risque de diarrhée et la supplémentation en oxygène. Mais chez les patients souffrant de diarrhée, la part de ceux ayant nécessité des soins intensifs et une assistance respiratoire a été significativement plus élevée[203]. Les résultats aux tests de laboratoire, de même que la part des patients ayant reçu un traitement antibiotique et/ou antiviral, étaient globalement identiques chez les patients avec ou sans diarrhée[203]. Dans quelques cas (4 % des 230 malades du panel), des problèmes hémorragiques ont été signalés (selles sanglantes) et 1 % des cas ont manifesté des douleurs abdominales, mais en aucun cas (dans ce panel) les symptômes gastroentériques n'étaient seuls. Les auteurs notent que parmi les malades du SRAS en 2003, on avait déjà noté que les patients diarrhéiques avaient été plus nombreux à nécessiter des soins intensifs et une ventilation (par rapport aux non-diarrhéiques)[204].
Expliquer ces diarrhées et ces corrélations, et pourquoi le nombre de maladies diarrhéiques augmente entre janvier et mars (passage de 2 à 3 % avec diarrhée à 21 %)[193],[205] pourrait selon Yunle Wan et al. (en ) « aider à identifier de nouvelles stratégies d'intervention pour réduire ou prévenir les conséquences graves de COVID-19 »[203]. Le taux apparent d'atteintes gastroentériques signalées intrigue car ayant plus que doublé en un mois [203]. Il pourrait en partie s'expliquer par une sous-estimation de ces symptômes par les cliniciens en début d'épidémie, et/ou refléter des différences géographiques entre les populations humaines ou virales étudiées (car les premières études portent sur des malades de Wuhan et le panel a ensuite été élargi à quatre autres villes de la province)[203]. Le manque de données sur le nombre de cas asymptomatiques a pu faire surestimer la part des patients présentant des troubles gastro-intestinaux. Et par ailleurs, le lopinavir et le ritonavir ici utilisés comme antiviraux contre le SARS-CoV-2 ont comme effet secondaire fréquent des diarrhées, il aurait pu être source de quelques biais, mais l'étude n'a rétrospectivement pas constaté chez les malades de corrélation entre diarrhée et utilisation d'antiviraux ou d'antibiotiques[203]. Il est donc possible que le virus ait muté en modifiant son tropisme, en l'élargissant aux intestins, ce qui invite à des travaux approfondis. Le virus étant présent dans les diarrhées, ces excrétas devraient faire l'objet d'une gestion adaptée (déchet à risque infectieux).
Une hypothèse, testée par deux études à partir d'avril 2020, est qu'une faible diversité du microbiote intestinal facilite l'infection[206],[207].
Manifestations neurologiques
On sait que le virus du SRAS ou celui du MERS peuvent infecter les cerveaux des souris[208], notamment le thalamus et le tronc cérébral. Il en va de même pour l'Homme [209], et les cellules gliales du cerveau ont bien des récepteurs ACE2 (utilisés par le virus pour pénétrer les cellules qu'il infecte, respiratoires notamment)[210].
Une seconde porte d'entrée dans le système nerveux central (SNC) peut être la circulation périphérique via le franchissement des barrières qui séparent la circulation du cerveau et la circulation générale.
Une troisième voie possible est sa dispersion des poumons dans le nerf vague, via les récepteurs d'étirement pulmonaire, atteignant éventuellement le tronc cérébral[209] (d'autres coronavirus peuvent infecter le cerveau via une voie synaptique vers le centre respiratoire situé dans la moelle allongée, par le biais de mécanorécepteurs comme les récepteurs pulmonaires extensibles et les chimiorécepteurs (principalement les chimiorécepteurs centraux) dans les poumons)[211].
Dans tous les cas, un dysfonctionnement du centre respiratoire pourrait aggraver le syndrome de détresse respiratoire aigüe observé chez beaucoup de patients Covid-19 [209].
Les manifestations neurologiques signalées chez des patients Covid-19 concernent :
- le système nerveux central (maux de tête, vertiges, troubles de la conscience, ataxie, maladie cérébrovasculaire aiguë et épilepsie) et/ou
- le système nerveux périphérique (anosmie, agueusie, névrite optique)[212],[213]. Une encéphalite aigüe par pénétration directe du virus dans le cerveau est rapportée le 1er avril 2020[214].
Depuis avril 2020[215], quelques encéphalopathies et/ou méningites ont été observées chez certains patients (et confirmée par imagerie), avec certains rapports de détection du virus par ponction lombaire. La présence de bandes oligoclonales semble être un point commun à tous ces patients[216].
Une étude australienne invite les autorités de santé à exercer une vigilance sur les manifestations neurologiques consécutives à la Covid-19, notamment en recherchant la présence de neurofilaments dans les prélèvements sanguins[217],[218].
Le , une étude parue dans le Journal of Experimental Medicine démontre la capacité du SARS-CoV-2 à infecter les neurones, avec des effets divers : maux de tête, perte d'odorat, perte de conscience ou accident vasculaire cérébral[219].
Manifestations cardiovasculaires
Les complications cardiovasculaires aiguës sont une partie du tableau clinique de la Covid-19, comme l'a montré une vaste étude basée sur 86 742 patients atteints de Covid-19 en Suède entre le 1er février et le 14 septembre 2020 (patients comparés à 348 481 sujets-témoins)[220]. L'étude a montré un triplement du risque d'infarctus aigu du myocarde (et d'accident vasculaire cérébral ischémique) lors les 15 jours suivant le diagnostic de Covid-19, si l'on comptabilise les cas survenus à partir du sur suivant le diagnostic, et ceci « même après ajustement pour les facteurs de risque » ; le risque diminue (0,60 fois plus) les 3e et 4e semaines après le diagnostic. Par contre si l'on prend en compte le jour même de l'exposition, l'incidence de l'infarctus est encore plus importante (risque 8,44 fois plus élevé lors de la 1re semaine, 2,56 fois plus la 2e semaine, et 0,62 fois plus les 3e et 4e semaines)[220]. En incluant le jour d'exposition, l'incidence de l'AVC ischémique est multipliée par 6,18 au cours de la 1re semaine, par 2,85 lors de la 2e semaine et par 2,14 les semaines 3 et 4[220].
Remarques : 1) l'étude avait exclu les personnes ayant déjà subi un infarctus du myocarde et/ou un AVC car le risque d'une récidive est accru après un premier incident de ce type. 2) Ces chiffres valent pour 2020, le risque peut avoir diminué depuis le début de la pandémie, suite à l'amélioration des traitements, et il peut ensuite encore diminuer avec la généralisation de la vaccination[220].
Formes critiques
Les principales complications sont une détresse respiratoire aiguë dans 30 % des cas, une myocardite dans 10 % des cas et une surinfection bactérienne dans 10 % des cas[221] ou une libération importante de cytokine responsable d'une lymphohistiocytose hémophagocytaire secondaire qui est une forme particulière de choc cytokinique.
Ces complications peuvent entraîner la mort spécialement, mais pas exclusivement, chez les personnes rendues fragiles par l'âge ou par des comorbidités.
Dysfonctionnement de la coagulation
Le risque thrombo-embolique est une complication des formes critiques. Ces dernières s'accompagnent d'un état d'hypercoagulabilité, et on observe une corrélation entre le taux de D-dimère et le risque de mortalité[222]. L'embolie massive est une cause majeure de mortalité[223], surtout chez les sujets jeunes et chez les patients sévèrement atteints[224]. Un temps de prothrombine prolongé et des niveaux élevés de protéine C-réactive à l'admission à l'hôpital sont associés au déroulement sévère du COVID-19 et au transfert en unité de soins intensifs (USI)[225],[226].
Mi-avril, une étude sur 183 patients de Wuhan estimait qu'environ 71 % des morts de Covid-19 ont présenté une thrombose et une hémostase (ISTH (en))[Quoi ?] répondant aux critères de diagnostic d'une coagulation intravasculaire disséminée (CID)[227].
On avait déjà montré (2013) que le virus du SRAS, via une voie anormale d'urokinase, pouvait induire une lésion du poumon par le SARS-CoV, ce qui évoquait une interaction complexe entre les nouveaux coronavirus, la coagulation et les systèmes fibrinolytiques[228].
En avril 2020, la Chine a publié un consensus d'experts sur les troubles de la coagulation liés à la Covid-19 sévère, sur les tests de coagulation, le traitement anticoagulant, un traitement de remplacement et sur un traitement de soutien et la prévention, avec 18 recommandations cliniques[67]. L'effet inflammatoire multi-organes endommage aussi le système microvasculaire, ce qui suractive le système de coagulation, avec comme manifestation une vascularite généralisée des petits vaisseaux et une microthrombose largement répartie[229],[230],[231].
Rhabdomyolyse
La rhabdomyolyse est une complication sous-estimée car se manifestant principalement par des douleurs musculaires mais qui persiste et se focalise. Le diagnostic de cette complication est facile car elle se fait par le dosage de la créatine-kinase et de la myoglobine. Mais ces examens ne font pas partie des examens biologiques de routine[232].
Cause des décès plus cardiovasculaire que pulmonaire
Plusieurs articles avaient signalé en Chine et à Singapour un aspect cardiovasculaire chez des patients, mais sans les étudier systématiquement[233],[234].
Le 25 mars 2020, un article scientifique confirme que de nombreux patients sévèrement touchés avaient une maladie cardiovasculaire sous-jacente et/ou des facteurs de risque cardiovasculaires et cérébrovasculaires. Une lésion cardiaque aiguë (notamment démontrée par des taux élevés de troponine) est fréquente dans les cas graves et très associée à la mortalité. Les auteurs estiment que la Covid-19 induit plus souvent qu'on ne le pensait initialement une inflammation vasculaire, une myocardite et des arythmies cardiaques, ce qui invite à mieux étudier les facteurs de risque, cardiovasculaires[235].
Le 10 avril 2020, Sandro Giannini, professeur de médecine à l'université de Bologne estime que les décès dus à la Covid-19 qu'il a observés ont une cause cardiovasculaire plutôt que respiratoire. La Covid-19 induit un affolement du système immunitaire où l'inflammation induit aussi une embolie pulmonaire (caillots sanguins). Ceci expliquerait l'efficacité des anti-inflammatoires et l'inefficacité de la ventilation assistée[236],[237]. Le Dr Cameron Kyle-Sidell (médecin urgentiste du centre médical Maïmonide de New York) pense de même : les poumons des patients sont sains et remplis d'air, mais le niveau d'oxygène sanguin est insuffisant. 50 % des patients soignés par Luciano Gattinoni (professeur au service d’anesthésie-réanimation de l’université de Göttingen en Allemagne, et expert renommé en ventilation mécanique) étaient dans ce cas[238],[239].
Pronostic et létalité
Avertissements :
- Deux indicateurs sont à ne pas confondre :
- taux de létalité = ratio du nombre de décès sur nombre de personnes malades (ce qui est différent du nombre de personnes testées positives sauf si on teste l’ensemble des personnes concernées),
- taux de mortalité = ratio du nombre de décès sur l’ensemble d’une population concernée ;
- Ces taux sont incertains, car mesurer le nombre total de malades et de morts par le virus est à ce jour impossible, faute de moyens de test suffisants. Le nombre de guérisons et de décès, et donc le vrai taux de létalité, ne seront connus de façon définitive qu'après la fin de l'épidémie[240],[241],[242],[243]. Si les cas pas et peu symptomatiques sont moins détectés, cela biaise les taux vers le haut. Si les morts sont attribués à la Covid-19 sur des critères restrictifs en ne comptant par exemple que les morts constatés à l'hôpital, cela biaise les taux vers le bas.
Taux de létalité de l'épidémie de coronavirus de 2019-2020
- Au , le taux de létalité provisoire (nombre de morts rapporté au nombre de cas positifs) calculé par l'OMS d'après les chiffres fournis par les différents pays, était de 3 % environ (80 décès sur 2 800 infections)[244]. Cette valeur provisoire est bien plus faible que celles des épidémies de SRAS en 2002-2003 (9,6 %) et de MERS en 2009 (34,4 %)[245] mais néanmoins beaucoup plus élevée que la plupart des virus grippaux touchant les humains.
- Au 11 février 2020, le taux de létalité recalculé par le CDC chinois (« Chinese Center for Disease Control and Prevention » ) sur près de 45 000 cas confirmés, était de 2,3 %[246], restant bien plus élevé que celui des grippes saisonnières typiques ; il est supérieur à celui de la pandémie grippale de 1957 (0,6 %) qui fit entre 1 et 4 millions de morts, et même à celui de la pandémie de grippe espagnole (1918) (2 %)[247],[248].
- Au 28 février 2020, sur la base du nombre de pneumonies hospitalisées confirmées, une étude chinoise portant sur les 421 premiers cas donne un taux de létalité d'environ 2 %, suggérant des conséquences proches de celles d'une épidémie de grippe saisonnière sévère, ou d'une grippe pandémique modérée (comme celles de 1957 et 1968), plutôt que de celles d'une épidémie type SRAS ou MERS[249].
- Ces taux de létalité sont souvent calculés sur le nombre de cas déclarés et ne tiennent pas compte des cas asymptomatiques ou peu symptomatiques qui sont pourtant la majorité des cas[250].
- Le 22 mars 2020, un étude française se basant sur un couplage entre une approche statistique et un modèle épidémiologique calcule un taux de létalité de 0,8 % en France (0,5 % si l'on ne tient compte que des données hospitalières)[251].
- Une étude du 30 mars parue dans le Lancet permet d'affiner la létalité de cette maladie : le taux de létalité en Chine serait de 1,38 % chez les moins de 60 ans, de 6,4 % chez les plus de 60 ans et jusqu'à 13,4 % après 80 ans[252].
- Le , une étude allemande menée dans la commune de Gangelt a consisté notamment à détecter les personnes immunisées en recherchant chez un échantillon représentatif de la population des anticorps anti-SARS-CoV-2. Les résultats montrent que 14 % de la population a été infectée par le virus. Dans cette commune le taux de létalité de la maladie a été déterminé à 0,37 % lors de l’étude (à comparer au taux de létalité de près de 2 % pour la totalité du pays pour la même période). Le taux de mortalité était de 0,06 % calculé sur la population de Gangelt[253].
- Le une modélisation de l'Institut Pasteur indique notamment que le « taux de létalité chez les personnes infectées est de l’ordre 0,5 % (13 % chez les hommes de plus de 80 ans) » sur la base des données hospitalières, confirmant ainsi la valeur obtenue le 22 mars[251] et indiquant une stabilité de ce taux dans le temps. D'après cette étude, au « près de 6 % des Français devraient avoir été infectés par le SARS-CoV-2 »[254].
- Le 23 avril, une étude sérologique à grande échelle conduite à New York donne un taux de létalité de 0,6 %[255].
- Le 20 mai 2020, le Centers for Disease Control and Prevention publie un taux de létalité de 0,4 % des patients symptomatiques, et 35 % d'infections asymptomatiques[256].
- Selon une étude de l'Imperial College London, le taux de létalité serait d'environ 1 % avec des variations entre pays, liées à l'âge de leur population (le taux de létalité variant de 0,01 % pour les moins de 15 ans à 17,4 % pour les plus de 90 ans)[74],[5].
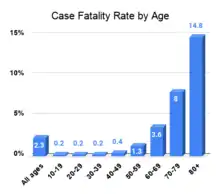
Taux de létalité par âges
En décembre 2020, la maladie tue principalement les personnes âgées, 78 % des victimes de la Covid-19 en France ayant 75 ans et plus. Ce taux monte à 92 % pour les personnes de 65 ans et plus[257]. L'âge moyen des décès liés à la Covid-19 est de 81 ans, et l'âge médian de 84 ans. Les moins de 50 ans ne représentent que 1,9 % des décès liés à la maladie[258].
| Âge | (en % de cas) |
|---|---|
| 75 ans ou plus | 78 % |
| 65 - 74 ans | 14 % |
| 45 - 64 ans | 7 % |
| Moins de 45 ans | 1 % |
65 % des personnes décédées avaient des comorbidités, c'est-à-dire qu'ils avaient, en plus de la Covid-19, une autre maladie susceptible d'avoir causé leur mort.
Taux de létalité en fonction des pathologies existantes
Source : Centre chinois pour le contrôle et la prévention des maladies. Données au 11 février[259].
| HTA | Diabète | Maladies cardiovasculaires | Maladies respiratoires | Cancer |
|---|---|---|---|---|
| 6 % | 7,3 % | 10,5 % | 6,3 % | 5,6 % |
L'hypertension artérielle (HTA) semble être le facteur de risque le plus important dans une étude du 24 mars[260]. Les coronavirus SARS et SARS-CoV-2 utilise le récepteur ACE2 pour pénétrer dans l'épithélium respiratoire. Plusieurs hypothèses sont avancées notamment la perturbation du fonctionnement des ACE2 par un traitement antagoniste des récepteurs de l'angiotensine II ou les enzymes impliquées dans le fonctionnement de ces récepteurs[261]. Un autre mécanisme évoqué est la surexpression des ACE2 chez les patients atteints d'hypertension ou de diabète[262]. Le Dr Karol Watson, éditeur associé du NEJM Journal Watch Cardiology indique qu'il n'y a aucune donnée actuelle qui laisse penser à un risque supplémentaire chez les patients prenant un antagoniste des récepteurs de l'angiotensine II ou un inhibiteur de l'enzyme de conversion[263],[264]. Au contraire, une étude rétrospective sur 511 patients montre que la prise d'antagoniste des récepteurs de l'angiotensine II pour HTA s’accompagne d'une mortalité diminuée par rapport aux hypertendus ne prenant pas ce traitement. L'effet est net après 65 ans. Ce caractère protecteur du traitement anti-HTA est spécifique des antagonistes des récepteurs de l'angiotensine II. Il n'est pas retrouvé dans les autres catégories d'anti-hypertenseurs (bêta-bloquant, inhibiteur calcique)[265].
Ce même mécanisme pourrait être à l'origine de l'effet délétère de l'ibuprofène sur la maladie.
Selon le sexe
Le nombre de malades est égal entre les sexes, mais parmi les personnes sévèrement touchées, les hommes survivent moins à la maladie. Ainsi :
- la seconde semaine d’avril 2020 selon l'OMS[266], 50 % des cas de Covid-19 déclarés sur le continent européen était des hommes, mais les hommes comptaient pour 60 % des décès (alors qu'il y a moins d'hommes âgés que de femmes âgées)[267] ; les hommes sont aussi beaucoup plus nombreux que les femmes à être envoyés en soins intensifs, mais avec des différences importantes selon l'âge[266] ;
- l'ONG Global Health 5050, qui travaille sur les inégalités de santé entre hommes et femmes, a montré que là où des données sont disponibles, les décès sont toujours plus nombreux chez les hommes que chez les femmes (que les hommes soient plus souvent infectés ou pas) ; en France au 2020, 47 % des cas et 58 % des décès étaient des hommes[268] ;
- du 16 mars au 16 avril, en un mois 2 806 cas graves de Covid-19 ont été enregistrés par Santé publique France (par 144 services de réanimation du réseau sentinelle) ; parmi les malades envoyés en réanimation (âgés en moyenne de 61 ans), 73 % étaient des hommes. Et les hommes restent aussi très sur-représentés parmi les morts[269]. En outre, quand les femmes mettent quatre jours pour éliminer le virus, les hommes en mettent six (temps de 50 % plus long) ;
- en Lombardie, 82 % des 1 591 patients envoyés en unités de soins intensifs (du au ) étaient des hommes (âge moyen : 63 ans)[267].
Causes de surmortalité masculine
Cette surmortalité masculine est particulièrement marquée chez les 40-70 ans (d'après les statistiques OMS)[266]. Elle pourrait s'expliquer par :
- une consommation en moyenne plus élevée d'alcool et de tabac chez les hommes[269] ;
- de nombreux gènes régulant l'immunité se trouvent sur le chromosome X (et les hommes n'en possèdent qu'un seul)[270] ;
- des origines hormonales :
- deux hormones féminines, les œstrogènes et la progestérone, sont connues pour stimuler l'immunité innée et acquise ;
- le poumon du nourrisson garçon est plus immature à la naissance que celui de la fille, faisant que le nourrisson garçon est, en moyenne, plus vulnérable au syndrome de détresse respiratoire aiguë[271] ; il répond en outre également moins bien à la « corticothérapie prénatale » prescrite contre la détresse respiratoire[272] ;
- le récepteur des androgènes (RA) inhibe la production de surfactant pulmonaire[273] ; or il est peu exprimé chez les femmes (toute leur vie), et il l'est également peu chez l'enfant (jusqu'à l'adolescence), ce qui pourrait expliquer que les enfants et les femmes soient moins gravement touchés par les manifestations respiratoires aiguës de la Covid-19 (détresse respiratoire notamment)[274] ;
- le SARS-CoV-2 (comme les autres coronavirus humains) cible principalement les pneumocytes de type II dans le poumon humain[275]. On sait que le processus d'entrée du virus SARS-CoV-2 dans la cellule doit être amorcé par le lien entre la protéine de pointe de la surface virale et l'enzyme de conversion de l'angiotensine 2 (ACE2), que l'on sait influencée par des hormones sexuelles[276]). De plus, la protéase transmembranaire à sérine 2 (TMPRSS2) de l'hôte joue aussi un rôle[277],[278]. Or, dans les pneumocytes de type II, l'expression de la TMPRSS2 s'accompagne d'une augmentation de l'expression du récepteur des androgènes (RA)[279]. Ceci lie donc l'expression du RA[280] au SARS-CoV-2. Début avril 2020, des chercheurs ont proposé[274] qu'une étude épidémiologique s'intéresse aux personnes prédisposées (ethniquement, génétiquement ou pathologiquement) à une surexpression ou à une sous-expression du récepteur des androgènes (ex : hommes souffrant d'alopécie androgénétique, d'hypertrophie bénigne de la prostate ; femmes souffrant du syndrome des ovaires polykystiques. Car, si ce récepteur est en cause, on dispose de plusieurs classes de médicaments le ciblant (les antagonistes de la RA, les inhibiteurs de la synthèse des androgènes et les antigonadotrophines)[274].
Mortalité
En juillet 2021, l'ECDC indique que la maladie a tué 3 986 982 personnes dans le monde, dont 740 809 dans l'union européenne et l'espace économique européen, 605 526 aux États-Unis, 524 417 au Brésil, 402 728 en Inde, 233 689 au Mexique, 193 389 au Pérou, 137 925 en Russie et 128 231 au Royaume-Uni entre le et la semaine 26 de l'année 2021[281].
Causes
- La détresse respiratoire aiguë (SDRA) est la cause physiologique principale de la mortalité de la Covid-19[282]. D'apparition particulièrement brutale et sévère, la mortalité induite par le SDRA se situe entre 30 et 50 % selon le site European Lung[283]. Le pronostic du SDRA dépend de l'état de santé initial du patient[284]. Il peut entraîner des séquelles à long terme dans la plupart des cas[284].
- Selon F. Zhou et ses collègues (mars 2020) environ la moitié des morts de la Covid-19 résultent de coinfections ou surinfections (dites sur infections secondaires)[285], le plus souvent bactériennes, mais dès février 2020 Chen et ses collègues avaient noté que la coinfection est parfois à la fois bactérienne et fongique[286].
- Une réaction immunitaire trop importante connue responsable d'une lymphohistiocytose hémophagocytaire secondaire, une forme particulière de choc cytokinique, est aussi un facteur majeur de mortalité[287].
Facteurs de risque
Connaître les facteurs favorisant ou non l'infection, le développement des symptômes et le diagnostic aide les cliniciens à mieux identifier, et précocement trier les patients à risque[94]. Selon une mise à jour (9 mars 2020) rétrospective des facteurs de risques chez 191 patients[288] (dont 137 ont guéri et 54 sont morts à l'hôpital)[94], les facteurs de risques de mortalité sont :
| Facteur de risque | Précisions |
|---|---|
| Comorbidité | Une comorbidité est présente dans 48 % des cas. Il s’agit d’hypertension le plus souvent (30 % des comorbidités), devant le diabète (19 %) et les maladies coronariennes (8 %)[94]. |
| Âge avancé | Les plus de 65 ans risquent plus de développer une forme grave de la maladie, et risquent plus d'en mourir[94]. |
| Score SOFA élevé | Le score SOFA (Sequential Organ Failure Assessment) décrit un risque élevé de défaillances d'organes, s'il est élevé, il est associé à un mauvais pronostic[94]. |
| Taux de D-dimère élevé | Un taux de D-dimère supérieur à 1 μg/L au moment de l’admission dégrade également le pronostic[94]. |
| Cancer et chimiothérapie | Dès février 2020, le cancer est considéré par l’OMS comme facteur de risque aggravant de prévalence et de létalité en cas de Covid-19 [289], mais une étude anglaise (août 2020)[290] a cherché à différencier le risque (chez l’adulte) selon le sous-types de tumeur primaire, l'âge et le sexe à partir de données disponibles pour le Royaume-Uni pour la période 18 mars - 8 mai 2020 : 30,6% des 1044 patients de la cohorte UKCCMP sont morts, dont 92,5% avec la Covid-19 comme cause de décès enregistrée. Le taux de létalité toutes causes chez les cancéreux infectés par le SRAS-CoV-2 était significativement associé chez les 80 ans et plus[290]. - Les porteurs de tumeurs hématologiques malignes (leucémie, lymphome et myélome) avaient une Covid-19 plus sévère et plus souvent mortelle que chez ceux ayant des tumeurs d’organes solides. - Après correction selon l'âge et le sexe, être atteint d’une hémopathie maligne et avoir récemment subi une chimiothérapie augmentait le risque de décès en cas de Covid-19 [290]. |
Personnes à risque
En France, le ministère des Solidarités et de la Santé informe, le , que, dans le cadre de la procédure d’arrêt de travail simplifiée, sont considérés comme « à risque » au regard de la Covid-19 et susceptibles de développer une forme grave d’infection, les cas suivants[291] :
« Les personnes âgées de 70 ans et plus (même si les patients entre 50 ans et 70 ans doivent être surveillés de façon plus rapprochée) ;
Les patients présentant une insuffisance rénale chronique dialysée, insuffisance cardiaque stade NYHA III ou IV ;
Les malades atteints de cirrhose au stade B au moins ;
Les patients aux antécédents (ATCD) cardiovasculaires : hypertension artérielle, ATCD d’accident vasculaire cérébral ou de coronaropathie, chirurgie cardiaque ;
Les diabétiques insulinodépendants ou présentant des complications secondaires à leur pathologie (micro ou macro angiopathie) ;
Les insuffisants respiratoires chroniques sous oxygénothérapie ou asthme ou mucoviscidose ou toute pathologie chronique respiratoire susceptible de décompenser lors d’une infection virale ;
Les personnes avec une immunodépression :
- médicamenteuses : chimiothérapie anti cancéreuse, immunosuppresseur, biothérapie et/ou une corticothérapie à dose immunosuppressive ;
- infection à VIH non contrôlé avec des CD4 < 200 par minute ;
- consécutive à une greffe d’organe solide ou de cellules souche hématopoïétiques ;
- atteint d’hémopathie maligne en cours de traitement ;
- présentant un cancer métastasé ;
- Les femmes enceintes ;
Les personnes présentant une obésité morbide (indice de masse corporelle > 40 kg m−2) : par analogie avec la grippe A(H1N1). »
Obésité
Les personnes avec un IMC supérieur à 30 sont plus à risque d'avoir une forme grave de la maladie et celles avec un IMC supérieur à 40 sont plus à risque d'en décéder[292].
Perception du risque chez les femmes enceintes
Une étude réalisée en Chine montre que les femmes enceintes ou venant juste d'accoucher ont une perception juste des risques liés au coronavirus: la contamination est inférieure à celle de la grippe mais les complications peuvent être supérieures aux autres évènements malencontreux que peuvent rencontrer une femme enceinte, elles sont vigilantes sur les possibles contaminations de leurs proches. Elles sont mieux renseignées sur les risques que l'ensemble de la population éduquée[293] .
Effets « paradoxaux » du tabac
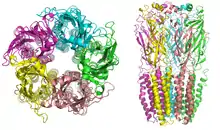
De premières études estimaient un risque plus élevé de 50 % chez les fumeurs de développer une forme grave (notamment en raison des effets nocifs du tabac sur les poumons et/ou le système cardiovasculaire)[295]. Mais alors que le fumeur double son risque de déclarer une grippe, qu'il n'est pas protégé pour le SRAS et alors qu'il semblait nettement plus vulnérable au MERS[296], des faisceaux d'indices statistiques plaident pour une moindre vulnérabilité à la Covid-19 :
- En Chine 6 % des 191 malades hospitalisé à Wuhan étaient fumeurs. 30 % des chinois adultes sont réputés fumeurs, mais seuls 12,6 % de 1 099 malades étudiés étaient fumeurs[297] ;
- Aux États-Unis où 13,4 % de la population fume, seuls 1 % de 7 162 patients U.S. étaient signalés comme fumeurs[298] ;
- En France dans l'étude du cluster du lycée de Crépy-en-Valois, 7,2 % des fumeurs présentaient des anticorps contre le virus, contre 28 % des non-fumeurs, ce qui laisse penser que le risque d'être infecté était ici de 75 % moindre pour les fumeurs (à moins qu'ils ne soient faiblement infectés et qu'ils n'aient pas produit d'anticorps). Par ailleurs, la Pitié-Salpétrière a noté que pour 350 malades hospitalisés et 130 patients plus légers accueillis en ambulatoire, tous testés positifs à la Covid-19, les non-fumeurs étaient largement sur-représentés. Selon Zahir Amoura, dans ce dernier cas, « on a trouvé seulement 5 % de fumeurs chez ces patients, ce qui est très bas. En gros, chez les patients Covid-19 , les fumeurs ne sont représentés qu'à 20% dans une population générale de même sexe et de même âge »[299].
On a pensé au début de la pandémie que la nicotine pouvait protéger de la Covid-19[300].
- Une hypothèse d'explication est que la nicotine interagirait avec le système rénine-angiotensine (SRA) chez les fumeurs, comme l'avait déjà montré en 2018 Joshua M. Robert et ses collègues[301] ; la nicotine bloquerait peut-être l'accès à l'ACE2 (récepteur SARS-CoV-2) pour le virus.
Les experts restent prudents, estimant que ces résultats doivent être reproduits, compris et « être soigneusement examinés à la lumière du risque accru de forme grave de COVID-19 chez les fumeurs une fois infectés »[302] et des conséquences néfastes à long terme du tabagisme[303], qui par ailleurs tue des millions de personnes dans le monde[304] ; - seconde hypothèse (pré-publiée le 21 avril 2020) : le récepteur nicotinique de l'acétylcholine (nAChR) pourrait avoir une fonction essentielle lors de l'infection Covid-19 ; fonction qui serait inhibée par la nicotine ; le SARS-CoV-2 pourrait aussi être un bloqueur du récepteur nAChR (tout comme l'ivermectine[305] qui fait aussi partie des molécules testées)[294] ;
- autre hypothèse (non exclusive des précédentes) : la nicotine pourrait atténuer la réponse immunitaire très anormalement excessive dans les cas les plus sévères[299].
Plusieurs des études citées ci-dessus présentent de possibles biais. Par exemple, le personnel soignant et enseignant (moins susceptibles de fumer) y est sur-représenté. Ou (dans l'étude de la Pitié-Salpétrière) les patients viennent d'Île-de-France, une région où l'on compte moins de fumeurs qu'ailleurs en France. Mais au moins deux de ces études laissent fortement penser que les fumeurs sont mieux protégés du virus[294].
Une pré-étude (du 8 mai 2020) rappelle que d'après les bases de données disponibles, les tissus pulmonaires et rénaux des fumeurs (tout comme ceux des patients souffrant d'hypertension artérielle pulmonaire, d'insuffisance rénale chronique et de néphropathie diabétique) expriment plus que la normale la protéine ACE2 (consensuellement considérée comme principale voie d'entrée pour le virus dans les cellules qu'il infecte)[306].
Des études utilisant des patchs nicotiniques (ou contenant d'autres « agents nicotiniques ») sont prévues ; ces patchs seront testés sur du personnel soignant, et en essai thérapeutique sur des patients hospitalisés (dont en réanimation). Ils doivent permettre de confirmer ou infirmer que le produit actif est bien dans ce cas la nicotine (sachant que la chimie de la fumée de tabac est particulièrement complexe)[294].
Finalement, en mai 2021 la principale étude concluant à un « effet protecteur du tabac » est rétractée par la revue The European Respiratory Journal, à la suite de la mise en évidence de nombreux biais (notamment par une contre-étude publiée dans le British Medical Journal), et surtout à la révélation que les deux principaux auteurs de l'article avaient « oublié » de déclarer qu'ils travaillaient pour le lobby du tabac[307],[308]. Le consensus scientifique penche donc très clairement pour un rôle aggravateur du tabagisme sur la COVID-19[308].
Le paradoxe avec l'asthme et la maladie pulmonaire obstructive chronique
On a d'abord craint que l'asthme et la maladie pulmonaire obstructive chronique (MPOC), et d'autres maladies respiratoires chroniques, prédisposeraient à l'infection par le SARS-CoV-2 et/ou à développer les formes les plus sévères de Covid-19. Contre toute attente et au contraire, lors des trois premiers mois de pandémie, ces deux maladies ont été sous-représentées dans les comorbidités signalées. Une même tendance, non expliquée, avait concerné le SRAS.
Il y a plusieurs hypothèses expliquant pourquoi elles sont sous-représentées[309] :
- Ces deux maladies pourraient avoir été méconnues chez les premiers patients chinois atteints de Covid-19. C'est peu probable car en Italie au , par exemple, pour 355 patients morts de la Covid-19 (à 79,5 ans en moyenne), l’un était diabétique et un diabète a été signalé chez 20,3 % des patients ayant survécu, alors qu'aucune BPCO ne figurait parmi les comorbidités[310]. De même aux États-Unis (au ), pour 7 162 parmi 74 439 cas signalés documentés, les maladies respiratoires chroniques et le diabète étaient respectivement signalés chez 8,5 % et 10,2 % de ces cas (à comparer aux taux mondiaux de 11,3 % pour les maladies respiratoires chroniques et de 10,2 % pour le diabète)[311].
- avoir une maladie respiratoire chronique protégerait contre la Covid-19, peut-être en calmant la réponse immunitaire ; si c’est le cas, ce n'est pas encore expliqué, et cette protection ne vaudrait pas pour les patients néanmoins entrés en phase aiguë de la maladie, car parmi ces derniers, avoir une BPCO comme comorbidité est associé à un risque accru de mourir, comme cela était attendu[312].
- les médicaments pris pour ces deux maladies diminueraient le risque d’infection, et/ou d'émergence des symptômes permettant le diagnostic. Cependant seuls 50 % des MPOC sont en Chine traités par les traitements standard européens et nord-américains[313] alors que près de 75 % des asthmatiques chinois inhalent des corticostéroïdes[314]. In vitro, des corticostéroïdes non seulement suppriment la réplication des coronavirus, mais atténuent ou bloquent la production de cytokines (impliquées dans la « tempête de cytokines » qui tue de nombreux patients sévèrement atteints)[315],[316]. Par un mécanisme encore incompris, des corticostéroïdes inhalés semblent, chez ces patients, pouvoir empêcher ou freiner le développement d'une infection symptomatique ou diminuer la sévérité de la Covid-19. L’exemple suivant n'a pas valeur de preuve statistique (peu de cas, pas de groupe témoin), mais il est cité par la littérature médicale : l'état de trois malades de Covid-19 (nécessitant de l'oxygène, mais pas d'assistance ventilatoire) s'est amélioré après inhalation de ciclésonide[317].
Depuis le début de la pandémie, les experts et l’OMS recommandent aux victimes de MPOC et d'asthme de ne pas changer leur traitement[309]. Une revue systématique faite après la pandémie de SRAS avait conclu que les corticostéroïdes systémiques ne présentaient aucun avantage et parfois un préjudice[318].
Début avril 2020, les chercheurs ayant fait ce constat invitent à documenter avec précision les comorbidités, et les traitements antérieurs des malades de Covid-19, pour préciser les facteurs favorisant ou non l'infection, le développement des symptômes et le diagnostic, et pour définir les avantages/inconvénients du traitement de l'asthme et de la MPOC lors de la pandémie de Covid-19[309].
Effets des antihypertenseurs
Parmi les plus utilisés au monde, surtout chez des gens âgés, ces médicaments peuvent exacerber le risque de septicémie et d'hypotension (en modifiant l'homéostasie et notamment le système nerveux sympathique, l'équilibre sodique et/ou le système rénine-angiotensine-aldostérone (RAS) qui est impliqué dans la Covid-19[319]). Malgré une préoccupation théorique concernant une expression accrue de l'ACE2 par blocage du système Rénine-Angiotensine-Aldostérone (RAS), début mai 2020, on n'a pas démontré que les antihypertenseurs soient nuisibles lors d'une infection à Covid-19 (sur le modèle animal, ils semblent même bénéfiques)[319]. Sur ces bases, le 7 mai 2020, un groupe de spécialité de l'hypertension (Sungha Park & al.) a recommandé de maintenir le blocage RAS chez les hypertendus lors de la pandémie de Covid-19[319].
Facteur génétique
Analysant les facteurs génétiques de comorbidité qui augmentent le risque de contracter une forme sévère de la maladie, une étude d'association génétique a identifié un cluster de gènes sur le chromosome 3 comme un locus de risque d'insuffisance respiratoire après infection par le coronavirus du SRAS-CoV-2. Une étude distincte comprenant 3 199 patients hospitalisés atteints de la maladie à coronavirus 2019 (COVID-19) et des individus témoins a montré que ce cluster est le principal facteur de risque génétique pour les symptômes graves après une infection et une hospitalisation par le SRAS-CoV-2[320],[321].
Ce variant génétique est un héritage de gènes de l'Homme de Néandertal. L'étude estime que ce mélange de gènes humains et néandertaliens modernes s'est produit il y a environ entre 50 000 et 60 000 ans en Europe du Sud. Les personnes qui portent ces variantes de Néandertal auraient jusqu'à trois fois plus de risque de nécessiter une ventilation mécanique que celles qui ne les possèdent pas[322]. Les chercheurs ont également constaté qu'il existe des différences majeures dans la fréquence de ces variantes dans différentes parties du monde. En Asie du Sud, environ 50 % de la population est porteuse de cette variante et elle concerne environ 16 % des personnes en Europe. En Asie de l'Est, elle est presque absente[322],[320]. Lors de la publication de l'étude , les chercheurs ignoraient pourquoi cette région génique de Néandertal est associée à un risque accru de devenir gravement malade[322]. Une autre étude publiée sous forme de pré-impression en décembre 2020, met en lumière une enzyme appelée dipeptidyl peptidase-4 (DPP4)[323].
Diagnostic et tests
La méthode standard de diagnostic consiste à effectuer une réaction en chaîne par polymérase à transcription inverse (rRT-PCR) à partir d'un écouvillon nasopharyngé[324],[325]. Au début de l’épidémie, des critères avaient été définis[Par qui ?] pour réaliser les tests diagnostiques. Au 6 mars 2020, devant la diffusion mondiale du virus et l’apparition de plusieurs foyers importants, ces critères sont devenus de plus en plus obsolètes. Le fait de revenir d'un séjour dans une région infectée est suffisant pour justifier une recherche par RT-PCR[326] et/ou la réalisation d'un CT scan des poumons si un patient présente les signes décrits ci-dessus.
Les CDC définissent un « contact étroit » comme le fait d'être à moins de deux mètres d'un malade suspecté ou confirmé ou dans une pièce ou une zone de soins pendant une période prolongée sans équipement de protection individuelle ou exposé directement aux sécrétions d'une personne infectée par le SARS-CoV-2.
En complément du test PCR, un oxymètre peut également être utilisé pour détecter une contamination au COVID-19 ou pour surveiller une personne contaminée afin d'être alerté en cas de détresse respiratoire.
RT-PCR
Le test-diagnostic le plus utilisé est la mise en évidence du génome du virus par la technologie RT-PCR (amplification génique après transcription inverse) sur des frottis nasopharyngés[221]. Cependant, ce diagnostic n'est pas à la portée de tous les systèmes de santé. De plus, des faux négatifs sont possibles en RT-PCR[327], ce pourquoi l'imagerie médicale reste essentielle pour le bon diagnostic des patients[328].
La spécificité de ce test est de 100 % mais on ignore sa sensibilité[329] cependant tout dépend de la charge virale du prélèvement laquelle est variable selon le moment (primo-infection) selon l’état immunitaire du sujet (risque élevé chez les sujets immunodéprimés). L'existence de faux négatifs est connue[330]. La RT-PCR a été largement déployée en virologie diagnostique et a donné peu de résultats faussement positifs[331]. Les valeurs prédictives positive et négative ne sont pas actuellement connues avec précision, car, pour les calculer il faut avoir le chiffre exact de l'incidence et de la prévalence de la maladie. Le , le ministère français des Solidarités et de la Santé annonce qu'un test diagnostic développé par le centre national de référence des virus respiratoires, à savoir l'Institut Pasteur, est disponible en France[332].
La sensibilité du test dépend aussi de son lieu et mode de prélèvement. Ainsi la sensibilité de la RT-PCR est meilleure pour les prélèvements faits dans le nez que dans la bouche[93]. Pour échantillonner l'ARN du SARS-CoV-2, on a d'abord recommandé d'analyser le mucus de fond de gorge par écouvillonnage. Les gouttelettes d'expectorations ont été jugées ensuite plus représentatives de la charge virale[333]. En cas de RT-PCR négative au niveau nasopharyngés chez un patient suspect de maladie à coronavirus 2019, il est préférable d'effectuer des prélèvements par lavage bronchoalvéolaire (lavage bronchique au cours d'une fibroscopie pulmonaire)[334], mais cette méthode (recommandée pour toute maladie respiratoire à risque) est impossible à appliquer en contexte épidémique.
La RT-PCR nécessite du temps, or le nombre d'appareils et leur capacité sont limités. Des diagnostics rapides sont donc proposés, par exemple en s'appuyant sur l'âge, le sexe, la température, les images radiologiques et le rapport neutrophile sur lymphocyte[335].
Une étude rétrospective chinoise, publiée le dans le Journal of Clinical Virology, portant sur 301 malades hospitalisés présentant des formes moyennes ou sévères (mais dont aucune n'a nécessité un transfert en U.S.I.), 1 113 RT-PCT ont été effectuées chez ces patients sur des prélèvements nasaux ou laryngés (nez et bouche). Cette étude permet d'établir la dynamique de la RT-PCR[93] :
| 0−7 jours | 8−14 jours | 15−21 jours | 22−28 jours | Plus de 28 jours |
|---|---|---|---|---|
| 97,9 % | 68,8 % | 36,3 % | 30 % | 26,3 % |
Une méta-analyse publiée le dans le Annals of Internal Medicine évoque aussi des faux négatifs évoluant de 38 % à J5 (jour moyen de début des symptômes) à 20 % à J8 pour remonter à 21 % à J9 puis 66 % à J21[336],[337].
Charge virale
Il existe une certaine confusion sur la notion de charge virale pour la maladie à coronavirus 2019 comme le rappelle Alexandre Bleibtreu, infectiologue à l'hôpital de la Pitié-Salpêtrière à Paris[338]. La charge virale est la quantité de virus dans une unité de volume. Le test RT-PCR dose la quantité de génome virale c'est-à-dire après destruction de l’enveloppe et de la membrane du virus.
La persistance d'une excrétion virale par l'épithélium nasal est aussi un facteur de risque. Toutes les personnes dans une étude comprenant 171 personnes admises en USI avec 53 décès ont gardé une charge virale jusqu'à la fin[222]. Une lettre adressée à l’éditeur de la revue Lancet rappelle que la charge virale dans le cas du SARS restait positive jusqu'à 1 mois après la guérison alors que la culture virale se négativait plus rapidement relativisant la charge virale dans la contagiosité[339].
La présence d'une charge virale sanguine (assez fréquente lors de maladies à coronavirus) semblerait être un facteur de gravité[340]. Elle invite aussi à une bonne gestion des dons de sang faits pour les transfusions[341].
Réponse sérologique
Une première étude s'intéresse à la présence des anticorps IgG et IgM. La recherche des IgG et IgM est beaucoup plus simple et rapide que le RT-PCR. Elle permettrait de rattraper les faux positifs (par pollution d'ARN dans le laboratoire) et les faux négatifs (mauvais prélèvement) mais le faible nombre de cas ne permet pas de conclure définitivement[342].
Une autre étude sur 173 patients porte sur la réaction sérologique à l'infection à SARS-CoV-2 : le taux de séroconversion (passage de l'absence d'anticorps spécifique à la présence d'anticorps spécifiques) pour les anticorps IgG et IgM étaient de 93,1 % (161/173) 82,7 % (143/173) avaient des IgM sans IgG et 64,7 % (112/173) des IgG sans IgM ; La séroconversion est apparue séquentiellement pour anticorps IgG et IgM, IgM puis IgG, avec un temps médian respectivement de onze, douze et quatorze jours. Moins de 40 % de patients avaient des anticorps les sept premiers jours de la maladie puis ce pourcentage a rapidement augmenté à 100,0 %, 94,3 % et 79,8 % pour IgG et IgM, IgM et IgG respectivement quinze jours après le début de la maladie. En revanche, le taux positif du RT-PCR est passé de 66,7 % (58/87) dans les échantillons prélevés avant le 7e jour à 45,5 % (25/55) entre J15 et J39. La combinaison de la détection d’ARN et d’anticorps a amélioré la sensibilité du diagnostic (p < 0,001), même en phase précoce (première semaine)[343].
Une autre étude a conclu que chez la moitié des patients, la séroconversion se produit après une semaine (parfois au 14e jour), et elle n'est pas suivie d'une baisse rapide de la charge virale[65].
Une étude remarque que les IgG apparaissent un ou deux jours seulement après les IgM, soit de façon beaucoup plus rapide qu’habituellement[343].
Un titre anticorps IgG et IgM élevé serait indépendamment associé à une gravité de la maladie[343].
Indications dans la recherche des anticorps
Début mai, la HAS rappelle que les tests sérologiques ne permettent pas de statuer sur une potentielle immunité protectrice ni a fortiori sur sa durée. Et ils n’apportent pas d’information sur la contagiosité. Outre leur intérêt épidémiologique, elle précise les indications dans le diagnostic de la maladie[344] :
- En diagnostic initial pour les patients symptomatiques graves hospitalisés, dont la RT-PCR est négative mais chez qui les symptômes cliniques ou le scanner sont évocateurs d’une Covid-19.
- En diagnostic de rattrapage de patients symptomatiques graves hospitalisés mais qui n’ont pas eu un test RT-PCR dans les sept premiers jours.
- En diagnostic initial de patients symptomatiques sans signes de gravité suivis en ambulatoire dont le test RT-PCR est négatif mais dont le tableau clinique est évocateur.
- En diagnostic de rattrapage de patients symptomatiques sans signes de gravité suivis en ambulatoire mais chez qui un test RT-PCR n’a pu être réalisé avant 7 jours.
- En diagnostic différé des patients symptomatiques sans signes de gravité diagnostiqués cliniquement mais n’ayant pas fait l’objet d’une RT-PCR et ce depuis la mise en place de la phase 2 (à partir du ).
- En détection d’anticorps chez les professionnels soignants non symptomatiques, en complément du dépistage et de la détection de personne-contact par RT-PCR selon les recommandations en vigueur, si la RT-PCR est négative.
- En détection d’anticorps chez du personnel d’hébergement collectif (établissements sociaux et médico-sociaux, prisons, casernes, résidences universitaires, internats…) non symptomatiques en complément du dépistage et de la détection de personne-contact par RT-PCR selon les recommandations en vigueur, si la RT-PCR est négative.
Culture virale
Ce virus peut se cultiver par culture virale (faite le à l'Institut Pasteur de Paris[345] ; par contre, c'est une équipe australienne qui isole le virus par culture pour la première fois), mais celle-ci n'est pas utilisée en pratique clinique[89].
Auto-Test de recherche de protéine virale
Un premier essai d'un test à faire chez soi a été publié dans la revue Journal of Clinical Virology le . Ce test, bien qu'ayant une sensibilité de 100 % et une spécificité de 97 %, se montre pas assez spécifique lors de l'essai, puisque sa valeur prédictive positive n'est que de 55 % (donc, si ce test est positif, le virus détecté sera le SARS-CoV-2 une fois sur deux et une fois sur deux un autre virus), mais sa valeur prédictive négative est de 100 % : s'il est négatif, vous êtes sûr de ne pas avoir le virus[346].
Examens courants
Les signes biologiques les plus importants car semblant en rapport avec la gravité de la maladie sont[178] :
- lymphopénie (inférieure à 1 500 lymphocytes par ml) est retrouvée dans 83 % des cas ; une lymphopénie est très souvent présente chez des patients en état critique. La lymphopénie est une caractéristique importante des patients gravement malades infectés par le SARS-CoV[347], car une invasion ciblée des lymphocytes par des particules virales du SARS-CoV endommage la composante cytoplasmique du lymphocyte et provoque sa destruction. La lymphopénie était également courante chez les patients gravement malades infectés par le MERS-CoV, qui est le résultat de l'apoptose des lymphocytes[348]. Il semblerait que la gravité de la lymphopénie reflète la gravité de l'infection par le SARS-CoV-2[349] ;
- thrombopénie (inférieure à 150 000 plaquettes par ml) existe dans 36 % des cas ;
- leucopénie (inférieure à 1 500 leucocytes par ml) retrouvée dans 33 % des cas ;
- dans la mesure où 50 % des décès résultent d'une surinfection opportuniste ou provenant de bactérioses ou de mycoses sous-jacentes, une recherche de bactéries ou micro-champignons infectieux est à faire, idéalement par les moyens de la métagénomique ou la recherche de génomes entiers[350],[351] (qui sont encore peu disponibles, notamment dans les pays pauvres).
Les autres anomalies évaluent le retentissement de l'infection virale sur les différents organes (cœur, rein, foie) : on peut retrouver une cytolyse hépatique modérée (transaminase légèrement augmentée) ; le taux de procalcitonine est normal ; les lactates déshydrogénases et la créatine kinase peuvent être augmentées[221].
Une aggravation de la maladie se traduit par l'aggravation de la lymphopénie avec aggravation de la leucocytose.
Marqueurs biologiques pronostiques
Les taux de 13 cytokines sont significativement corrélés avec le risque de développer une forme grave nécessitant une prise en charge en unité de soins intensifs. Un bon marqueur pronostique est constitué de deux d'entre elles[352] :
- la CXCL13 ;
- le facteur de croissance des hépatocytes (HGF).
Interleukine
Des indicateurs d'inflammation ont été recherchés chez des patients légers, graves et critiques, pour discriminer rapidement ceux dont la pneumopathie pourrait évoluer vers une forme sévère ou mortelle[353]. Les critères associés à la gravité de la maladie étaient l'âge, le récepteur de l'interleukine 2, de l'interleukine 6 (IL-6), de l'interleukine 8, de l'interleukine 10, le facteur de nécrose tumorale α, la protéine C réactive (CRP), la ferritine, la procalcitonine, la numération des globules blancs, la numération des lymphocytes, la numération des neutrophiles et la numération des éosinophiles[353], avec en conclusion un risque maximal pour les plus de 67 ans, avec un taux d'interleukine 2 supérieure à 793,5 U/mL, de CRP supérieure à 30,7 ng/mL, de ferroprotéine supérieure à 2 252 μg/L, une leucocytose supérieure à 95 × 108 L-1 ou un nombre de neutrophiles dépassant 7 305 × 106 L-1.
Un niveau élevé d'IL-6 à l'admission serait associé à une manifestation clinique sévère. La diminution de l'IL-6 semble indiquer l'efficacité du traitement, tandis que son augmentation indique une progression de la maladie. L'évolution du niveau d'IL-6 est donc un marqueur utile pour la surveillance de la maladie chez les patients atteints de Covid-19 sévère[354].
Une étude montre une présence de l'ARN viral dans le sang et que la charge virale est directement corrélée avec le taux sanguin d'interleukine 6, ce qui fait de cette molécule un marqueur pronostique important[340]. Cette augmentation associée à un taux de fer sanguin élevée doit faire rechercher une lymphohistiocytose hémophagocytaire secondaire[287].
Le taux de CRP semble être en rapport avec une réaction inflammatoire inappropriée du foie[355].
Lymphocyte
Une étude[356] semble montrer que le taux de lymphocytes est un moyen efficace et un indicateur fiable pour la classification et le pronostic de la maladie : durant le passage d'une forme bénigne vers une forme grave, le taux de lymphocyte sanguin diminue et reste bas. Au moment où l'état du malade s’améliore, le taux de lymphocyte sanguin remonte vers des taux normaux. Les patients ayant moins de 5 % de lymphocytes par rapport aux normes, avaient souvent un mauvais pronostic. Une autre étude confirme l'existence d'une corrélation élevée entre le taux des lymphocytes sanguins et la progression de la maladie. Pour les auteurs de cette étude, le lymphocyte est la cellule clé de la pathologie du SARS-CoV-2.
D-dimère
L'augmentation des D-dimères est un signe de gravité ainsi que l'augmentation de la créatinémie[357]. Ce marqueur est aussi retrouvé dans cette publication qui a été étudié les facteurs de risque chez les patients décédés de Covid-19 pour un taux supérieur à 1 microgramme par ml[222].
Imagerie médicale
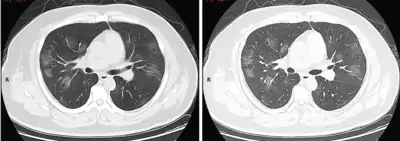 Stade 2 (progressif)
Stade 2 (progressif)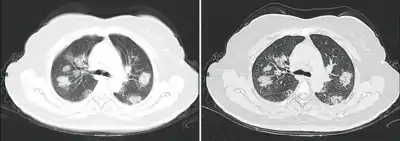 Stade 3 (du pic)
Stade 3 (du pic)
Comme le fait remarquer le professeur Christine Jenkins, responsable de la Fondation australienne des maladies pulmonaires et expert en pneumologie, la particularité des pneumopathies virales est leur propension à atteindre tout le poumon alors que les pneumopathies bactériennes sont souvent localisées à un lobe pulmonaire. La Covid-19 atteint très rapidement ensemble des deux poumons[358].
Une équipe chinoise décrit en l’évolution de la pneumopathie chez des patients peu sévères en la divisant en quatre stades selon l’aspect au scanner[359] :
- stade 1, dit précoce (jusqu'aux quatre premiers jours) : les opacités en verre dépoli c’est-à-dire des changements de densité des tissus en forme de halo, courants dans les affections virales.sont la principale anomalie pulmonaire, sont sous-pleurales et touchent les lobes inférieurs des poumons ;
- stade 2, dit progressif (cinq à huit jours) : les opacités en verre dépoli deviennent bilatérales et multilobaires, des plages de condensation et de crazy paving apparaissent ;
- stade 3, dit du pic (dix à treize jours) ; les anomalies s’intensifient, notamment la condensation alvéolaire ;
- stade 4, dit de résorption (après quatorze jours) : régression des anomalies, résorption de la condensation, disparition complète du crazy paving et persistance de verre dépoli.
Les mêmes auteurs concluent que les patients présentant une pneumonie modérée (sans détresse respiratoire sévère), les anomalies pulmonaires au scanner thoracique sont maximales environ dix jours après l'apparition initiale des symptômes, et régresse à partir de quatorze jours[359].
Généralement, plus la maladie avance, plus les opacités linéaires, un motif de pavage fou » et/ou un signe de « halo inversé sont présents sur l’image[360].
Chez les sujets asymptomatiques ou encore symptomatiques (c'est-à-dire à un stade infraclinique) le scanner (tomodensitométrie ou TDM) montre néanmoins des changements précoces dans les poumons[361] (opacités en verre dépoli unilatérales)[362]. Le scanner peut donc contribuer au diagnostic de la Covid-19, associé à un test RT-PCR concordant, voire en cas de faux-négatif de ce test[363].
Le 23 avril l'équipe du Pr Delabrousse du Centre hospitalier régional universitaire de Besançon publie un article dans la revue internationale RADIOLOGY qui fait figure d'avancée majeure dans la prise en charge des patients atteints de Covid-19. Cette étude établit que 23 % des patients atteints présentent une embolie pulmonaire détectée par angioscanner (qui utilise une injection de produit de contraste). « Le diagnostic d'embolie pulmonaire chez les patients COVID-19 est impératif et impose la réalisation d'un angioscanner pulmonaire au lieu du scanner thoracique sans injection actuellement recommandé »[364]. Cette nouvelle recommandation est aussitôt suivie par le CHU de Strasbourg[365].
Prise en charge et diagnostic par télémédecine
La télémédecine a montré son intérêt dans plusieurs situations de crises sanitaires[366]. Elle pourrait permettre de trier les cas nécessitant une hospitalisation et pour les autres une surveillance à domicile. Le recueil des données associées avec un programme d'intelligence artificielle permet de trier et d'évaluer le risque. En cas d'hospitalisation, l'équipe médicale peut isoler et prendre en charge le patient de façon plus rapide, protégeant aussi les autres patients attendant dans le service des urgences[367].
Diagnostic par intelligence artificielle
Une étude scientifique semble montrer l'intérêt d'utiliser des logiciels d'IA, qui en analysant les anomalies pulmonaires visibles au scanner initial permettent de prédire avec de bonnes performance la durée d'hospitalisation des patients[368].
Des chercheurs de l'EPFL ont développé une application web, CoughVid, ayant pour objectif de diagnostiquer la Covid-19 en analysant le son produit par la toux[369].
Outil de diagnostic en ligne
L'Institut Pasteur met en ligne un outil de diagnostic tout public qui comprend 22 questions[370].
Dépistage par les composés organiques volatils
Les composés organiques volatils excrétés par l'organisme, notamment exhalés par la respiration, pourraient devenir un moyen de diagnostic de la Covid-19.
Une start-up de Singapour propose de détecter la Covid-19, entre autres maladies, en faisant souffler le patient dans un appareil[371].
L’École nationale vétérinaire d’Alfort, quant à elle, travaille au dépistage canin de la Covid-19[372]. C'est alors le flair de l'animal qui détecterait des signaux olfactifs marqueurs du coronavirus.
Diagnostic différentiel
L'utilisation d'un kit permettant de détecter plusieurs agents pathogènes responsables des maladies respiratoires a révélé un taux élevé d'infections par le virus de la grippe, représentant 28,5 % de tous les cas suspects d'infection par le SARS-CoV-2[373].
| Clinique | Examens |
|---|---|
| Syndrome respiratoire du Moyen-Orient (MERS) | |
|
|
| Syndrome respiratoire aigu sévère (SRAS) | |
|
|
| Grippe | |
|
|
| Pneumonie communautaire | |
|
|
| Rhume | |
|
|
| Grippe aviaire à H7N9 | |
|
|
| Grippe aviaire à H5N1 | |
|
|
| Autres infections pulmonaires virales ou bactériennes | |
|
|
| Tuberculose pulmonaire | |
|
|
Classification de la maladie
La classification de la gravité de la Covid-19 est très importante. Lors du déclenchement d'une épidémie les ressources médicales sont relativement rares. Une classification en optimise l’utilisation permettant de limiter le sur-traitement ou le sous-traitement. Le guide du Centre national de contrôle des maladies chinois classe la maladie principalement sur des critères radiologiques[356] en quatre types. Une étude suggère d'utiliser le taux de lymphocytes pour classer la maladie[356].
Chiens renifleurs
Dès le début de la pandémie, les chiens « renifleurs » sont rapidement envisagés pour dépister les patients atteints de Covid-19. Le professeur Dominique Grandjean de l'École nationale vétérinaire d’Alfort est à l’initiative du projet EnvA Equipe Nosaïs après avoir constaté « que la signature olfactive du virus est forte et très spécifique ». Aussi, une étude est lancée dans le cadre de Salicov AP-PH et les résultats donnés le 19 mai 2021 sont très positifs : l'analyse olfactive est rapide, non invasive, ne « nécessite qu’une fraction de seconde par prélèvement avec un résultat instantané » et ne coûte « que quelques millions d’euros pour le déploiement des chiens », « par rapport aux milliards engendrés par les tests de RT-PCR ». Aussi, le professeur assure se battre « avec l’OMS pour que cette technique soit développée à bas coût dans des pays comme Madagascar, le Mali, le Rwanda, ou au Congo, par exemple… » et envisage « de créer une plateforme de formateurs à Dubaï qui inviterait des personnes de pays plus pauvres à se former »[375].
Anatomopathologie, autopsies
Peu de données issues d'un examen microscopique sont disponibles sur la Covid-19[376],[377]. Les principales constations anatomopathologiques à l'autopsie sont :
- macroscopie : épanchement pleural, péricardite, pneumopathie et œdème pulmonaire ;
- quatre niveaux de sévérité de pneumonie virale peuvent être observés :
- pneumonie légère : exsudat de plasma ou de fibrine dans les alvéoles pulmonaires,
- pneumonie modérée : œdème pulmonaire modérée, hyperplasie des pneumocytes, présence de grands pneumocytes atypiques, inflammation interstitielle avec infiltrat lymphocytaire des septas interalvéolaires, formation de cellules géantes multinucléées (pneumonie à cellules géantes),
- pneumonie sévère : dommage alvéolaire diffus (Diffuse alveolar damage, DAD) avec membranes hyalines pulmonaires (membranes de fibrine, exsudat fibrineux), qui est à l'origine du syndrome de détresse respiratoire aiguë (SDRA) et de l'hypoxémie observée dans 5 à 10 % des cas de cette maladie,
- pneumonie d'organisation : forme de cicatrisation pulmonaire après le stade inflammatoire, et fibrose pulmonaire ;
- coagulation intravasculaire disséminée (CIVD) ;
- plasmocytose au lavage bronchoalvéolaire[378] ;
- foie : stéatose microvésiculaire.
La médecine légale ou toute pratique d'autopsie nécessite des précautions particulières en période de risque pandémique. Le Collège royal des pathologistes a publié des recommandations sur la pratique de l'autopsie sur des corps pouvant être infectés à la Covid-19[379].
Traitement
En septembre 2021, il n'existe pas de traitement efficace ou de cure spécifique contre le SARS-CoV-2, reconnu par l'OMS. « Les soins de soutien les plus efficaces sont l’oxygénothérapie pour les patients dans un état grave et ceux qui risquent de développer une forme grave de la maladie, ainsi qu’une assistance respiratoire plus poussée, comme la ventilation pour les patients dans un état critique. La dexaméthasone est un corticostéroïde qui peut contribuer à réduire la durée de placement sous respirateur et à sauver des patients dans un état grave ou critique »[380].
Vaccination
Les objectifs de la vaccination contre le SARS-CoV-2 sont divers : protéger chaque individu de la maladie, protéger les personnes particulièrement à risque, stopper une vague pandémique, maintenir la liberté individuelle, protéger l'économie, protéger les moins menacés des effets secondaires de la vaccination, justice mondiale . Ces objectifs en partie divergents impliquent différentes stratégies possibles concernant la distribution[381] et la priorisation des vaccins[382], l'intervalle entre la première et la deuxième vaccination[383], le nombre de vaccinations de rappel [384]et la sélection de la dose[385].
Vaccin
Le vaccin contre la maladie à coronavirus 2019 (Covid-19) fait l'objet de recherches dès le début de la pandémie de maladie à coronavirus 2019, dans plusieurs pays. Ainsi, le cofondateur de BioNTech a expliqué en , que son vaccin a été conçu en quelques heures dès [386],[387].
Différentes approches sont explorées pour forcer l'organisme à développer une réponse immunitaire permettant d'éliminer le virus SARS-CoV-2 : l'utilisation de formes atténuées ou inactivées du coronavirus, de virus anodins modifiés génétiquement pour exprimer une protéine du coronavirus, de protéines du coronavirus, ou d'acides nucléiques insérés dans des cellules humaines pour y produire des protéines virales[388],[389].
En , selon l'Organisation mondiale de la santé (OMS), il y aurait soixante vaccins contre le coronavirus SARS-CoV-2 autorisés ou en phase d'étude clinique, ainsi que 172 vaccins potentiels à l'étude[390].
La Russie, la Chine et Cuba sont les premières à injecter à grande échelle un vaccin et à le commercialiser. Le vaccin russe Spoutnik V est le premier au monde à être homologué, son nom faisant référence au premier satellite envoyé dans l'espace. La Chine aurait déjà vacciné 350 000 personnes début [391].
Le , Pfizer, qui mène la course dans l'industrie occidentale, annonce que le candidat vaccin contre la Covid-19 qu'il prépare en partenariat avec BioNTech (le Tozinaméran) est efficace à 90 %[392]. Cette nouvelle provoque un envol des bourses mondiales. Le , Moderna annonce à son tour que son vaccin est efficace à 94,5 %[393]. Le , le vaccin Pfizer-BioNTech est approuvé par le MHRA (en) pour le Royaume-Uni[394], et la vaccination y débute le [395]. Le , ce vaccin est autorisé aux États-Unis par la Food and Drug Administration[386] et la campagne de vaccination commence à New York le [396]. Les homologations de ce 1er vaccin ont lieu en au Royaume-Uni, aux États-Unis, au Canada, en Israël, en Arabie saoudite, aux Émirats arabes unis et en Union européenne[397],[398],[399].
Le 27 décembre 2020, Mauricette M. âgée de 78 ans, devient la première femme française vaccinée[400].
Vaccination et variants
La vaccination doit toucher un public suffisamment large pour que l'immunité collective soit atteinte. Dans le cas contraire, le virus continue à circuler et à muter dans la population non vaccinée ce qui peut aboutir à l'apparition de variants de nature à compromettre l'efficacité des vaccins. Une étude montre que ce risque est maximal avec une couverture vaccinale de l'ordre de 60 % (situation de beaucoup de pays développés à l'été 2021)[401],[402].
Typologie des malades
Facteurs de prédisposition
L'un des aspects marquants de la Covid-19 porte sur les grandes différences d'intensité d'expression clinique de la maladie ; allant de l'asymptomatisme complet à des formes rapidement mortelles, note le généticien Kári Stefánsson[403], selon qui des prédispositions génétiques pourraient expliquer certaines de ces différences.
Prédispositions génétiques
En juillet 2020, dans le cadre de la « COVID-19 Host Genetics Initiative » (consortium international de chercheurs partageant des données utiles pour l'étude des liens entre génome humain et COVID-19), les données génomiques acquises chez 4 000 patients (tombés malades en Italie et en Espagne) ont mis en évidence de premiers liens génétiques solides entre la sévérité de la Covid-19 et certaines caractéristiques du génome des malades. Le risque d'insuffisance respiratoire était nettement accru chez les porteurs de deux variantes génétiques[404] :
- l'une est située à proximité de plusieurs gènes, dont l'un codant une protéine interagissant avec le récepteur utilisé par le virus pour pénétrer dans les cellules humaines, et deux autres codant des molécules liées à la réponse immunitaire[404] ;
- l'autre est située dans la région du génome déterminant le type sanguin ABO[404]. Remarque : précédemment une typologie par groupe sanguin avait été soupçonnée[405] par un preprint (du 16 mars 2020) en Chine à partir de différents hôpitaux (Wuhan, Shenzhen), qui semblait montrer que les personnes de groupe sanguin A présentent un risque plus élevé que les autres groupes, tandis que les personnes de groupe O présentent un risque moins élevé que les autres groupes. Dans cette étude la répartition des patients de groupe B et AB atteints de la Covid-19 est la même que dans un échantillon sain de population, étude qui avait été mise en relation avec une autre sur le SARS-CoV de 2001-2002[406] par France Inter[407], évoquant une corrélation in vitro pour un virus cousin du SARS-CoV-2.
Ces deux variantes ne joueraient cependant qu'un rôle modeste dans le caractère fatal ou non de la maladie (des immunologistes, tels Jean-Laurent Casanova à l'université Rockefeller de New York, recherchent d'autres mutations jouant un rôle plus significatif[404].
Des études de septembre 2020 et août 2021 indiquent que « 20 à 25% des formes sévères de Covid-19 » s’expliquent par des anomalies génétiques et immunologiques[408] :
- environ 4 % des formes graves seraient dues à un « défaut de production ou d'action des interférons de type I » causé par des anomalies génétiques (mutations concernant 8 gènes[409] dont le gène TLR7 situé sur le chromosome X[410]) ; un dosage sérique des IFN de type I permettrait de détecter certains sujets à risque ;
- 15 à 20 % des formes graves seraient dues à des auto-anticorps ciblant les interférons de type I du patient (cf. ci-dessous).
Composante auto-immune (dans certaines formes graves et/ou longues)
15 à 20 % des formes graves seraient dues à une composante auto-immune conduisant à une production importante d'anticorps dirigés contre les interférons de type I du patient (contre 0,33 % dans la population générale). Les patients à risque pourraient bénéficier d'une plasmaphérèse ou de traitements de nature à réduire la production de ces auto-anticorps par les lymphocytes B[411],[412].
Ceci semble confirmé par une étude[413] prépubliée le 11 décembre 2020, avant relecture par des pairs, par des chercheurs de l'Université de Yale (Ring, et l’immunobiologiste Akiko Iwasaki, qui étudie la réponse immunitaire contre le SARS-CoV-2, déjà auteur de plusieurs découvertes sur le virus) : le système immunitaire de certains patients infectés par le SARS-CoV-2 se retourne contre eux, causant alors une maladie grave et de longue durée, « post-Covid-19 »[413] ; plus de 5 % des hospitalisés testés par cette étude produisaient des auto-anticorps affaiblissant le rôle des interférons. Des dizaines de types d’autoanticorps aberrants ont été trouvés chez ces malades, expliquant des symptômes persistants alors même qu’on ne trouve plus de traces du virus dans leur organisme[413]. Ces anticorps ciblent divers tissus et organes (cerveau, vaisseaux sanguins, foie, tissu conjonctif, tube digestif) du patient supposé guéri, mais aussi — parfois — le système immunitaire du malade (ex : anticorps s’attaquant à certains globules blancs importants : lymphocyte B et/ou T (Cellule tueuse naturelle) chargés de nous protéger contre le virus et d'autres infections). Les malades de la Covid-19 présentaient « des augmentations spectaculaires de la réactivité des auto-anticorps » (par rapport à 30 travailleurs hospitaliers en bonne santé n’ayant pas été infectés par le virus)[413].
- Plus ces « auto-anticorps » sont nombreux dans le sang, plus la maladie auto-immune est grave (les patients Covid-19 présentaient plus d'autoanticorps que des patients victimes de lupus, autre maladie auto-immune causée par de type d’anticorps) ;
- Certains de ces malades avaient probablement des autocanticorps avant cette infection, mais d'autres autoanticorps sont apparus, au fur et à mesure que la maladie progressait.
« La somme agrégée de ces réponses multiples peut expliquer une partie importante de la variation clinique chez les patients ». 10 % des 18 à 49 ans touchés pourraient développer une post-Covid longue (et un sur cinq chez les plus de 70 ans). Chez la souris, certains de ces auto-anticorps augmentent la sensibilité à l'infection et le risque de mourir.
Des autoanticorps de ce type ont déjà été soupçonnés de causer des « symptômes à long terme » après des viroses de type Ebola ou Chikungunya, certains cas de maladie de Lyme (alors que le pathogène n’est plus détectable). De même chez des patients cancéreux ayant subi une immunothérapie. Des traitements immunosuppresseurs existent (par ex utilisés contre certaines maladies rhumatologiques) mais ils rendent vulnérables à d’autres infections[414],[415].
Ratio homme/femme (caractère sexo-dépendant)
En 2020, au sein de la population générale, "exactement la moitié" des personnes confirmées infectées par le SARS-CoV-2 sont des hommes[416]. Mais de nombreuses études ont montré que l'homme est souvent plus gravement touché[417],[418],[419],[420],[421]. Selon les données disponibles en décembre 2020, l'homme a statistiquement près de trois fois plus (2,84 fois exactement) de risques qu'une femme d'être admis en soins intensifs ; avec également un risque significativement plus élevé de mourir de la maladie (+ 39%)[416]. Cette différence a été confirmée par une méta-analyse britannique publiée en décembre 2020 ayant porté sur 3 111 714 cas signalés entre le 1er janvier et le 1er juin 2020 dans 46 pays et 44 États des États-Unis[416].
On sait que le système immunitaire (inné et adaptatif) diffère légèrement selon le sexe :
- Le système immunitaire adaptatif féminin produit plus de lymphocytes T CD4+[422],[423],[424],[425],[426] ;
- les lymphocytes T CD8+ des femmes sont plus cytotoxiques, et donc plus efficaces[427] ;
- les femmes produisent plus d'immunoglobulines de lymphocytes B que les hommes[422],[428].
- en réponse à la vaccination trivalente inactivée contre la grippe saisonnière (TIV pour Trivalent Inactivated flu Vaccine), les femmes présentent aussi des titres d'anticorps plus hauts (avec en revanche un inconvénient : les effets secondaires de type réactions locales et systémiques sont souvent plus exacerbés)[429], ainsi qu'à la plupart des autres vaccins « pathogènes »[430]. Les femmes produisent en moyenne des titres d'anticorps protecteurs équivalents à ceux des hommes pour une dose de vaccin TIV deux fois moindre (ce que la différence de poids ne peut expliquer)[431], les taux sériques de testostérone étant inversement corrélés aux titres d'anticorps anti-TIV[432].
- Les femmes produisent naturellement plus d'interféron de type 1[433],[434],[435],[436],[437],[438],[439], ce qui limite chez elles le risque d'orage cytokinique qui semble expliquer de nombreuses formes graves de Covid-19[416].
- Les femmes pourraient être protégées par certaines hormones sexuelles féminines (œstrogènes (progestérone, et l'alloprégnanolone, un sous-produit de la progestérone), qui auraient un effet favorable sur la production d'anticorps, et contribuent à inhiber le récepteur ACE2, point d’entrée du coronavirus pour infecter les cellules[440],[441].
- L'oestradiol tendrait à protéger des formes graves de la maladie, en stimulant la réponse des lymphocytes T et en augmentant la production d'anticorps... alors que la testostérone inhiberait la réponse immunitaire masculine[416].
- Les cellules B des femmes produisent aussi plus d'IgG spécifiques de l'antigène en réponse au TIV[442], suggérant que la femme a une meilleure immunité humorale que l'homme.
Perturbateurs endocriniens
L'exposition aux perturbateurs endocriniens pourraient favoriser l'apparition de formes graves[443].
Patients carencés en vitamine D
Selon une étude espagnole, 8 patients sur 10 hospitalisés pour cause de Covid-19 étaient carencés en vitamine D[444],[445], mais on manque d'études randomisées pour attester une éventuelle causalité.
Patients vaccinés contre les oreillons
Le vaccin contre les oreillons pourrait réduire le risque de formes graves de la maladie[446]. Jeffrey E. Gold constate « une corrélation inverse entre les niveaux d'anticorps IgG des oreillons et la gravité de la Covid-19 chez les personnes de moins de 42 ans vaccinées avec le ROR »[447]. Ce fait expliquerait pourquoi les jeunes enfants vaccinés sont moins touchés par la maladie. Les auteurs préconisent de revacciner les personnes de plus 40 ans.
Covid-19 et grossesse
La grossesse n'induit pas de risque supplémentaire d'attraper la maladie. En revanche, elle peut augmenter le risque d'aggravation, notamment lors du troisième trimestre, ce risque étant comparable à celui d'une femme plus âgée de 15 ans[448]. Cette aggravation peut s'expliquer par la baisse de l'immunité et une sollicitation plus forte du système cardiovasculaire. Par ailleurs, en fin de grossesse l'utérus exerce une pression sur les poumons, ce qui ne facilite pas la ventilation. Certaines femmes placées en coma artificiel et proches du terme ont dû être césarisée[449].
Historique des connaissances
Le SRAS pendant la grossesse était associé à une incidence élevée de complications maternelles et fœtales telles que fausse couche spontanée, accouchement prématuré, retard de croissance intra-utérine, insuffisance rénale et coagulation intravasculaire disséminée[450],[451]. L'admission en unité de soins intensifs (USI) et la ventilation mécanique assistée peuvent aussi interférer avec le déroulement de la grossesse.
Une infection périnatale par le SARS-CoV-2 peut être acquise auprès de l'entourage, des soignants (éventuellement de manière nosocomiale) ou via la mère (transmission verticale in utero ou postnatale)[452].
La transmission verticale in utero du virus est décrite mais survient très rarement[453]. Le taux d'infection néonatale est de moins de 2%[454].
Une étude publiée le dans The Lancet sur neuf femmes enceintes présentant une pneumonie Covid-19 contractée au dernier trimestre de la grossesse est plutôt rassurante. Le tableau clinique de la pneumonie Covid-19 était identique chez les personnes non enceintes. Six patientes ont reçu des antiviraux. Elles ont toutes accouché par césarienne d'indication obstétricale (prééclampsie, utérus cicatriciel, etc.)[455].
Une nouvelle étude du confirme cette impression sur 16 femmes enceintes confirmées et 18 cas suspects tout en soulignant qu'elles ont des signes radiologiques type de la maladie, les manifestations cliniques sont moins importantes que chez les femmes non enceintes[456].
Transmission du virus par allaitement maternel
Après environ un an de pandémie, en décembre 2020 aucune transmission mère-enfant certaine du virus par le lait maternel n'a pu être démontrée[457] (et pour le SARS, un seul cas de PCR positif avait été rapporté dans le lait maternel, mais dans du colostrum, avant l'accouchement[458].
Quelques échantillons de lait maternel ont été positifs au test recherchant l'ARN du SRAS-CoV-2, mais aucun virus infectieux n'a pu y être trouvé[459],[460],[461],[462],[463].
En septembre 2020, The Journal of Perinatology publie un article montrant qu'une majorité d'échantillons de lait collectés lors de la pandémie chez des mères (non infectieuses au moment du prélèvement) contenaient des niveaux élevés d'IgA et de certaines IgG et IgM dans le lait ; ces anticorps réagissant aux sous-unités S1 et S2 de la protéine de pointe du virus SARS-CoV-2 [464].
En novembre 2020, une autre étude confirme que le lait de femmes rétablies du COVID-19 peut contenir des anticorps ciblant la protéine de pointe du virus. Ces anticorps (immunoglobuline G, immunoglobuline M, mais surtout IgA et d'IgG) sont transmis au bébé via l'allaitement et sous une forme favorisant l'immunité des muqueuses[465] ; allaiter durant la pandémie est donc a priori sans danger, et serait même encore plus protecteur pour le nourrisson[463].
Remarques :
- Ces études ont toutes porté sur un petit nombre d'échantillons, mais elles semblent concorder. Fin 2020, elles demandent encore à être confirmées par des recherches élargies, dont, au fur et à mesure des mutations du virus, par des recherches d'anticorps ou de virus dans les banques de lait[463].
- Rebecca Powell (coauteur de l'étude, immunologiste à l'École de médecine Icahn du mont Sinaï) a proposé d'utiliser le lait maternel comme source d'anticorps thérapeutique (alors qu'on utilise aujourd'hui du sérum de convalescents), ajoutant que d'autres antiviraux pourraient être extraits de laits maternels, à condition de dépasser un tabou concernant d'autres utilisations de cette sécrétion que l'allaitement[463].
Perception du risque chez les femmes enceintes
Une étude réalisée en Chine montre que les femmes enceintes ou venant juste d'accoucher ont une perception juste des risques liés au coronavirus Covid-19: la contamination est inférieure à celle de la grippe ou du virus H1N1 mais les complications peuvent être supérieures aux autres évènements malencontreux que peuvent rencontrer une femme enceinte, elles sont vigilantes sur les possibles contaminations de leurs proches. Elles sont mieux renseignées sur les risques que l'ensemble de la population éduquée[293] .
Nouveau-né
Dans une étude chinoise du 12 février 2020 publiée dans The Lancet et réalisée sur 9 femmes enceintes contaminées, tous les enfants nés étaient en bonne santé. Le sang fœtal, le liquide amniotique, des prélèvements au niveau de la gorge du nouveau-né et du lait maternel ont été effectués sur six des neuf patientes. Tous les résultats d'analyse étaient négatifs pour le SARS-CoV-2. Deux cas n'ont pu être prélevés car la césarienne a été effectuée la nuit. Le dernier cas n'a pas été prélevé car le résultat (positif) du test maternel SARS-CoV-2 n'est parvenu qu'après la césarienne. Selon les chercheurs, le cas positif du serait dû à une contamination maternelle post-naissance[455].
Une autre étude chinoise, publiée en février 2020 dans la revue Translational Pediatrics, est moins rassurante et concerne dix nouveau-nés de Wuhan, issus de neuf mères infectées ayant présenté des symptômes avant l'accouchement dans quatre cas, le jour même dans deux cas et après l'accouchement dans trois cas[452]. Huit bébés étaient des garçons et deux des filles ; quatre sont nés à terme et six prématurément ; deux étaient petits pour leur l'âge gestationnel (SGA) et un était macrosome ; six avaient un score PCIS (Pediatric Critical Illness Score) inférieur à 90. Six ont présenté un essoufflement comme premier symptôme, mais deux ont d’abord eu de la fièvre. Deux ont présenté une thrombocytopénie avec fonction hépatique anormale ; un avait une fréquence cardiaque rapide, un vomissait et un a fait un pneumothorax ; cinq nouveau-nés ont guéri, un est mort et quatre sont restés hospitalisés dans un état stable[452]. Cette étude ne donne aucune explication sur le décès du nouveau-né. Seuls des prélèvements nasaux ont été faits. Ils étaient tous négatifs.
Dans l'étude du citée plus haut[456], il n' y a pas de différences significatives chez les nouveau-nés des cas confirmés ou suspects par rapport à un groupe témoin de 121 cas notamment pour ce qui concerne le score d'Apgar à la naissance.
Une autre étude chinoise datant du , et effectuée sur 33 nouveau-nés, confirme le pronostic généralement bon des enfants nés de mère PCR positif. Mais 3 des 33 enfants, tous nés par césarienne, présentent une pneumopathie typique de la Covid-19 survenant entre 2 et 4 jours après la naissance. Les prélèvements anaux et de la gorge étaient positifs au SARS-CoV-2. Aucune recherche n'a été effectuée dans le sang de cordon ou le liquide amniotique. Le seul enfant ayant nécessité une prise en charge en soins intensifs avait une hémoculture positive à Enterobacter. Aucun enfant n'est décédé. Les auteurs de l'étude concluent que la transmission du virus s'est produite après la naissance[466].
Étant donné le faible risque d'infection néonatale chez les nouveau-nés d'une mère infectée, il n'est pas suggéré de séparer la mère infectée et son bébé à la naissance[467].
Critères de guérison
Les critères de guérison selon la Commission chinoise de la santé sont[468] :
- température normale durant plus de trois jours ;
- disparition des symptômes respiratoires ;
- amélioration nette des images de tomodensitométrie thoracique ;
- deux résultats consécutifs du test RT-PCR négatifs, séparés par au moins un jour.
En France les critères de guérison et de sortie de confinement des personnes infectées sont précisés par le HCSP[469].
Immunisation
En avril 2020, l'OMS reste prudente : « Il n'y a actuellement aucune preuve que les personnes qui se sont remises de la Covid-19 et qui ont des anticorps sont protégées contre une deuxième infection »[470] ; à ce jour la présence d'anticorps dans le sang signifie simplement que la personne a été en contact avec le virus. L'OMS alerte les États qui — comme le Chili — envisagent de délivrer des « certificats d'immunité » aux personnes supposées guéries. Faute de preuves acquises entre janvier et avril 2020 que l'immunisation existe bien, ces certificats ou passeports pourraient ne pas être fiables, et alors aggraver la propagation virale (des personnes guéries s'exposeraient en pensant être protégées du virus, et une fois infectées seraient à nouveau contagieuses)[470].
Toutefois, la durée de l'immunité des anticorps peut être limitée à trois mois[471]. Des études montrent qu'une personne contaminée pourrait être immunisé de 6 mois à plusieurs années[472].
Connaissances
Chez des singes macaques ré-exposés au coronavirus après une première infection, la maladie n'a pas récidivé, mais on ne sait pas encore (fin avril) si ceci est transposable à l'homme ni si cette protection est systématique.
91 personnes ont été testées positives au SARS-CoV-2 en Corée du Sud, après avoir réuni les critères de guérison. Mais il se pourrait que plutôt qu'une réinfection, il s'agisse d'une réactivation du virus déjà présent dans l'organisme (ce que seule l'étude du génome viral pourrait prouver). Une autre explication pourrait être de faux négatifs lors de la supposée guérison et/ou de faux positifs lors du test fait après guérison[473],[474]. En , des études sont encore en cours en Allemagne où de nombreux tests ont été faits[470].
Après infection par le SARS-CoV-1 ou le MERS-CoV
La récurrence et l'ampleur des épidémies de SRAS et de MERS sont trop faibles pour permettre d'observer une possible immunité chez les personnes qui auraient été infectées dans le passé. Par ailleurs, aucune recherche basée sur l'inoculation n'a été tentée en raison du caractère hautement pathogène des virus du SRAS et du MERS. Une étude montrerait que les anticorps provoqués par le SRAS disparaissent au bout de trois ans[475].
Après une infection par le SARS-CoV-2 (épidémie de Covid-19)
Au , on ignore « si les anticorps IgG persistants (d'une infection au SARS-CoV-1) possèdent des activités de neutralisation du virus et peuvent fournir une protection complète contre l'infection par le SARS-CoV-1 ou une protection croisée contre le nouveau bétacoronavirus, SARS-CoV-2 »[476] ; les malades guéris de la Covid-19 semblent développer une certaine immunité au SARS-CoV-2, mais on ignore pour combien de temps, dans quelle mesure, et à quelles conditions (ex. : certains médicaments sont immunosuppresseurs… ou [dans le cas du SRAS] semblent avoir atténué la quantité d'anticorps produits dans les mois et années suivantes)[476], et on ignore encore s'il y a des exceptions à cette immunisation[477]. Les coronavirus sont, comme les virus grippaux, de gros virus à ARN qui mutent rapidement. Une possibilité est qu'une souche constitutive d'une nouvelle vague épidémique ou pandémique pourrait être assez différente de la précédente pour à nouveau infecter des gens ayant guéri de l'épidémie de Covid-19.
Le , l'OMS avertit qu'il n'existe aucune preuve que les anticorps produits par le SARS-CoV-2 possèdent des capacités agglutinantes permettant une protection efficace contre une réinfection[478].
Le , des chercheurs chinois annoncent dans Science avoir découvert, dans le sang de 10 patients guéris de la Covid-19, l'anticorps 4A8 efficace contre le coronavirus SARS-CoV-2, qui neutralise ce coronavirus en empêchant sa protéine Spike (indispensable au virus pour infecter des cellules) de fonctionner[479].
En juillet 2020, on admet que les taux d'anticorps neutralisants contre le SRAS-CoV-2 sont élevés durant quelques semaines puis déclinent. Mais ils semblent persister plus longtemps et à des taux plus élevés chez les patients plus sévèrement touchés ; selon l'immunologiste George Kassiotis (du Francis Crick Institute de Londres) « Plus il y a de virus, plus il y a d'anticorps et plus ils dureront », comme dans le cas du SRAS (pour lequel la plupart des malades perdaient leurs anticorps neutralisants dès les premières années, hormis pour ceux qui avaient été sévèrement atteints, lesquels possédaient encore des anticorps 12 ans après[404]).
En septembre 2020, alors que des suspicions de réinfections circulent depuis plusieurs mois, jusqu'alors sans preuves que la nouvelle infection n'était pas une simple continuation de la première[480], un premier cas documenté de réinfection prouvée est publié : il s'agit d'un Hong-Konguais, clairement recontaminé, 142 jours après sa première infection[481], plusieurs mois après avoir guéri d'un précédent épisode de Covid-19 ; sa seconde infection, acquise lors d'un séjour en Espagne était asymptomatique, suggérant que son système immunitaire se souvenait assez du virus pour atténuer les dégâts de la seconde infection[480]. Mais un autre cas a été repéré au Nevada quelques jours après, jugé plus préoccupant, car ce patient a alors présenté des symptômes plus graves que lors de sa première infection. Le système immunitaire pourrait-il protéger contre le virus tout en aggravant les choses ? s'interrogent des immunologiques, une crainte étant que certains patients ayant vécu une tempête de cytokines lors de leur première infection aient des cellules immunitaires répondant de manière disproportionnée en cas de nouvelle infection. Une autre crainte est que le SRAS-CoV-2 puisse continuer à circuler dans le monde, même là où une immunité collective existe (qu'elle soit naturelle ou créée par la vaccination). D'autres études sur des patients réinfectés permettront de mieux comprendre les corrélats protecteurs importants pour la conception du vaccin.
La seconde vague de Covid-19 pourrait apporter de nouveaux éléments pour évaluer la prévalence de ces réinfections (bénignes ou graves). Comprendre et quantifier ce phénomène est nécessaire pour bien modéliser et anticiper le risque épidémiologique, mais aussi pour évaluer la prévalence éventuelle d'une facilitation de l'infection par des anticorps (des indices indiquent qu'elle existe parfois), et aussi pour préparer les vaccins (qui doivent activer notre « mémoire immunologique », sans générer de symptômes graves)[480].
Le risque d'être réinfecté pourrait varier selon la dose initiale de virus, le(s) génome(s) de ce(s) virus, l’état général de santé général du patient, etc. autant d'éléments que l'on espère pouvoir mieux étudier lors de la seconde vague alors que les laboratoires sont mieux préparés à détecter ou confirmer ces cas[480].
Étude d'une infection à base d'une souche de coronavirus bénigne
Des études ont porté sur l'immunisation après une infection par des coronavirus responsables d'infection bénigne (rhumes). Une même personne peut avoir plusieurs fois dans l'année un rhume à coronavirus, mais il pourrait alors s'agir de sérotypes assez génétiquement différents pour échapper au système immunitaire.
- Une étude a porté sur 18 volontaires, volontairement infectés par le coronavirus 228E, puis de nouveau infectés avec la même souche : la maladie n'a pas chez eux récidivé[482].
- Parmi 15 volontaires infectées volontairement, puis de nouveau infectées un an après, plusieurs sujets ont au contraire, été réinfectés, mais avec des signes cliniques moins importants[483].
Après infection par le SARS-CoV-1 ou le MERS-CoV
Des mesures faites à moyen ou long termes sont disponibles sur l'immunisation naturelle après guérison pour des virus très similaires. Elles sont issues d'études faites après la pandémie de SRAS de 2002-2003[484] puis du MERS. Dans les deux cas elles ne concernent qu'un faible nombre de cas, et les études n'ont pas vérifié que l'immunité était fonctionnelle :
- En 2006, une étude sur la protection par des anticorps agglutinants contre le SARS-CoV-1 montre que la protection diminue nettement après deux à trois ans[485].
- Une prépublication chinoise récente (publiée le sur medRixv) a porté sur l'immunité à long terme d'un panel de 20 soignants chinois, faisant partie d'un cluster de 34 soignants atteints par le SRAS dans l'hôpital de Guangzhou[476] : dans ce cas (c'est-à-dire à la suite du SRAS de 2002-2003), les taux d'immunoglobulines anti-SARS-CoV-1 ont atteint un pic environ 12 mois après l'infection, pour ensuite rapidement décliner. Des anticorps étaient encore détectables 12 ans après chez ces 20 soignants, mais en faible quantité.
Plus précisément, un pic de concentration a été noté un an après l'infection (en 2004), suivi d'une diminution rapide pendant deux ans (de 2004 à 2006), puis d'un déclin moins rapide. Les auteurs notent que dans ce groupe, les patients traités à l'époque par corticoïdes (prednisone et méthylprednisolone) se sont ensuite montrés les moins immunisés (titrations d'anticorps plus basses)[476].
Les auteurs restent prudents et concluent : « Actuellement, nous ne savons pas si les anticorps IgG persistants possèdent des activités de neutralisation du virus et peuvent fournir une protection complète contre l'infection par le SRAS-CoV ou une protection croisée contre le nouveau bétacoronavirus, 2019-nCoV. Des études précédentes, nous avons prédit que la présence d'anticorps IgG pourrait au moins fournir une protection partielle contre l'infection par un coronavirus »[476]. Ces données éclairent les liens entre ce coronavirus et les mécanismes immunitaires, et peuvent orienter les directions à prendre pour des vaccins contre le SARS-CoV-1 et le SARS-CoV-2[476] ; les auteurs précisent que deux des soignants diagnostiqués il y a 17 ans comme atteint du SRAS ne présentaient lors de l'étude aucun anticorps, ajoutant que ces deux cas « méritent une enquête plus approfondie pour clarifier si ces deux sujets étaient des non-répondeurs qui n'ont pas développé du tout d'anticorps anti-SRAS-CoV-1 ou s'ils représentaient simplement deux cas mal diagnostiqués » (à l'époque — c'était avant que l'OMS ait officiellement reconnu l'entité SRAS — il n'existait pas de test, et leur pneumonie atypique pourrait potentiellement avoir une autre origine)[476]. - Un constat similaire a été fait pour le MERS[486].
Après une infection par le SARS-CoV-2 (épidémie de Covid-19)
Au , « nous ne savons pas si les anticorps IgG persistants (d'une infection au SARS-CoV-1) possèdent des activités de neutralisation du virus et peuvent fournir une protection complète contre l'infection par le SARS-CoV-1 ou une protection croisée contre le nouveau bétacoronavirus, SARS-CoV-2 »[476] ; on suppose que les malades guéris de la Covid-19 ont développé une certaine immunité au SARS-CoV-2, mais on ignore pour combien de temps, dans quelle mesure et à quelles conditions (ex. : certains médicaments sont immunosuppresseurs… ou dans le cas du SRAS semblent avoir atténué la quantité d'anticorps produits dans les mois et années suivantes)[476] et on ignore encore s'il y a des exceptions à cette immunisation[477]. Les coronavirus sont, comme les virus grippaux, des virus à ARN qui mutent rapidement. Une possibilité est qu'une souche constitutive d'une nouvelle vague épidémique ou pandémique pourrait être assez différente de la précédente pour à nouveau infecter des gens ayant guéri de l'épidémie de Covid-19.
Le , l'OMS avertit qu'il n'existe aucune preuve que les anticorps produits par le SARS-CoV-2 possèdent des capacités agglutinantes permettant une protection efficace contre une réinfection[478].
Le 22 juin 2020, des chercheurs chinois annonce dans Science avoir découvert, dans le sang de 10 patients qui ont guéri de la Covid-19, l'anticorps 4A8 efficace contre le coronavirus SARS-CoV-2, qui neutralise ce coronavirus en empêchant sa protéine Spike de fonctionner, alors que cette protéine est indispensable au virus pour infecter des cellules[479].
Généralement, les taux d'anticorps neutralisants contre le SRAS-CoV-2 sont élevés durant quelques semaines puis déclinent, mais ils semblent persister plus longtemps à des taux plus élevés chez les patients plus sévèrement touchés ; selon l'immunologiste George Kassiotis (du Francis Crick Institute de Londres) « Plus il y a de virus, plus il y a d'anticorps et plus ils dureront », comme dans le cas du SRAS (pour lequel la plupart des malades perdaient leurs anticorps neutralisants dès les premières années, hormis pour ceux qui avaient été sévèrement atteint, lesquels possédaient encore des anticorps 12 ans après[404].
Inconnues
L'immunité contre le SRAS-CoV-2 ne dépend pas que des anticorps, mais par exemple aussi des cellules T (essentielles pour l'immunité à long terme)[487],[488].
Début juillet 2020, on ne dispose pas encore d'indication sur la durée de l'immunité à long terme. Celle-ci n'est approximativement évaluée, par comparaison à d'autres coronavirus proches[489] suggérant que «l’immunité stérilisante» pourrait ne perdurer que quelques mois, mais qu'une immunité protectrice prévenant ou atténuant les symptômes pourrait, elle, perdurer plus longtemps[404].
Séquelles
Début septembre 2020, un nombre croissant d'indices ou preuves invitent à penser qu'« une réponse immunitaire renforcée est impliquée dans la physiopathologie d'un large éventail de complications de l'infection par le SRAS-CoV-2 », dont le syndrome de Guillain-Barré[490], le syndrome de Miller Fisher[491], l'encéphalite nécrosante aiguë[492], la myélite, l'encéphalomyélite aiguë disséminée[493], la myasthénie[494] ou des troubles neurologiques[495],[496],[497], rapportés après une Covid-19. L'immunothérapie a semblé avoir parfois un effet bénéfique[498].
Atteinte psychiatrique
Plus de la moitié des hospitalisés survivant présenteraient des symptômes de troubles psychiatriques (para ou post-infectieux) : TSPT, anxiété, insomnie, dépression, ou TOC à un mois de l'hospitalisation[499]. Des alertes sur des temps de récupération longs ont aussi été émises[499].
Atteinte génétique
Une recherche menée fin 2020 au MIT (Massachusetts Institute of Technology) et publiée en mai 2021 dans la revue scientifique PNAS [500] montre la possibilité d’une intégration de fragments du virus dans l'ADN du malade.
Questions sur la transmission sexuelle et l'infertilité masculine
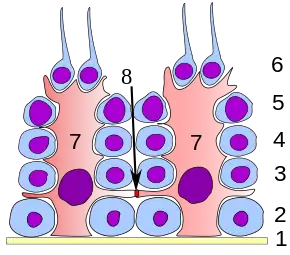
Le testicule est un réservoir pour plusieurs virus[501], dont le virus Zika comme démontré chez l'homme[502] et le VIH[503],[504], le virus étant alors sexuellement transmissible s'il passe dans le sperme. Dans une prépublication[505] publiée sur MedRxiv, des chercheurs de New York et de Bombay notent que dans le panel qu'ils ont suivi, les femmes se sont rétablies plus vite que les hommes[505]. Les auteurs pensent que le virus peut être relativement à l'abri du système immunitaire dans les testicules[505], comme cela a pu être montré pour d'autres virus[501]. Ils notent aussi que la protéine ACE2 est aussi présente en grande quantité dans le testicule, alors qu'elle est presque absente du tissu ovarien[505]. L'ACE2 est notamment présente dans les spermatogonies (cellules inactives jusqu'à la puberté), dans les cellules de Leydig et dans les cellules de Sertoli)[505] ; cependant, ces résultats issus de base de données n'ont pas été vérifiés expérimentalement et l'ACE2 seule ne permet pas l'entrée du virus dans les cellules. D'autres facteurs sont nécessaires telle que la protéase TMPRSS2. Or une autre étude montre que ces facteurs additionnels ne sont pas exprimés par les cellules testiculaires qui expriment ACE2[506]. Il n'est donc pas acquis que le SARS-CoV-2 puisse infecter les cellules testiculaires, mais si le virus peut infecter les testicules, le système immunitaire perturbé au sein de l'appareil reproducteur masculin, par des médiateurs inflammatoires notamment, pourrait altérer la barrière hémato-testiculaire et faciliter l'excrétion de virions dans le sperme[507].
Une autre prépublication, mi-avril, indique que le SARS-CoV-2 perturbe le système hormonal, avec notamment une augmentation significative de l'hormone lutéinisante [HL] observée dans le sang, alors que le ratio T/LH (c'est-à-dire entre testostérone [T] et l'hormone lutéinisante [LH]) de même que le ratio entre l'hormone folliculo-stimulante et l'hormone lutéinisante [HL] est diminué. Les auteurs en déduisent que la fonction gonadique des patients guéris devrait faire l'objet d'une attention particulière chez les hommes en âge de procréer[505]. Cette hypothèse est toutefois controversée par plusieurs scientifiques[508]. La Covid-19 pouvant donc peut-être altérer la fécondité masculine[509],[510],[511] en altérant le fonctionnement endocrinien, une étude massive a été envisagée car les études précédentes ne portaient que sur 81 sujets masculins âgés de 20 à 54 ans[512]. Cette étude sera basée sur plusieurs recherches préalables qui postulent que toutes les cellules exprimant des récepteurs pour SARS-CoV-2. Or, les testicules montrent le niveau d'expression le plus élevé de cette enzyme principalement liée aux spermatogonies, et aux cellules de Sertoli[513]. Tous les résultats suggèrent un risque potentiel du testicule humain face à l'attaque du SARS-CoV-2.
La revue JAMA rapporte plusieurs cas de patients chinois ayant contracté la Covid-19, dont en rémission, chez lesquels le virus a été retrouvé dans le sperme. « Les banques de sperme doivent-elles interrompre la cryogénisation de dons de sperme durant la pandémie de Covid-19 ? » s'interrogaient Bright & Woodward en avril 2020[514]. On sait en effet que certains patients virémiques (éventuellement asymptomatiques) excrètent des virus dans leur sperme — ceci était en 2017, déjà prouvé pour 27 virus différents[507] — et parfois longtemps (par exemple le virus Zika était encore présent dans le sperme d'hommes réputés guéris ou ne présentant plus de symptômes « jusqu'à 1 an après la guérison »)[515].
Selon Michael Bright Yakass et Bryan Woodward, les hommes atteint de Covid-19 excrètent a priori peu de virus dans leur sperme car « seuls des titres très faibles de SARS-CoV-2 ont été détectés dans des sites non respiratoires » de l'organisme humain[514] (y compris dans les selles humaines selon Holshue et al., 2020)[516]. « Cependant, « faible » est-il un risque acceptable si nous devons cryoconserver des échantillons de sperme pendant la pandémie[514] ? », d'autant que la plupart des virus à ARN se conservent parfaitement durant des décennies aux températures de cryoconservation s'ils ont été stockés séchés, dans des concentrations de protéines appropriées[517],[518]. On n'a pas de cas documentés de contamination clinique par coronavirus à partir de sperme cryoconservé, ce qui invite à penser que le risque est négligeable, mais en 2019-2020 au moins le SARS-CoV-2 pourrait être présent dans les échantillons de sperme congelés dans le monde entier. Bright & Woodward (2020) recommandent de remonter le niveau de biosécurité et de conserver les échantillons de la période pandémique dans des cryovaisseaux séparés en renforçant la traçabilité des échantillons cryoconservés envoyés entre cliniques et banques de spermes pendant et après la pandémie[514].
Mi-avril une revue d'étude basée sur 79 rapports, a porté sur la liaison de la « protéine de pointe » S1 du SARS-CoV-2 aux récepteurs présents sur les cellules des cellules reproductrices humaines (ces récepteurs étaient notamment l'ACE2, le CD26, l'ezrine et les cyclophilines (en))[519]. Cette étude a conclu que le SARS-CoV-1 peut provoquer une orchite grave (avec destruction de cellules germinales) ; les données alors disponible indiquent une diminution de la concentration et de la motilité des spermatozoïdes durant 72 à 90 jours après une Covid-19[519]. Une expression d'ACE2 (dépendante de la gonadotrophine a été constatée dans les ovaires, mais sans preuve que le SARS-CoV-2 nuise à la gamétogenèse[519].
Le 8 mai 2020, sur la base d'une analyse bio-informatique des bases de données de génome, protéome et transcriptome, une prépublication mise en ligne par 13 chercheurs chinois spécialistes en urologie et santé reproductive insiste sur l'ACE2 et TMPRSS2, deux protéines jugées nécessaires au virus pour qu'il puisse s'arrimer à une cellule et la pénétrer. Selon les bases de données, ces deux protéines sont effectivement fortement exprimés dans les organes génitaux masculins et le système urinaires associé. L'ACE2 est particulièrement présent à la surface des gamétocytes dans les testicules ; et il est aussi très présent dans les tubules rénaux proximaux. De plus les récepteurs des cytokines pro-inflammatoires (IL-6 ST en particulier) étaient remarquablement concentrés dans les cellules endothéliales, les macrophages et les cellules souches spermatogoniales dans les testicules et les cellules endothéliales rénales, évoquant des attaques auto-immunes (des endothélites sont d'ailleurs suspectées à échelle plus systémique)[520]. Correctement traiter la Covid-19 implique d'intégrer ces aspects de la maladies[521].
COVID longue
La COVID longue[522], également connue sous le nom de syndrome COVID chronique (SCC) [523],[524],[525] est utilisé pour nommer la condition caractérisée par des séquelles à long terme — persistant après la période de convalescence typique — de la maladie à coronavirus 2019. Les symptômes persistants comprennent la fatigue , les maux de tête, la dyspnée (essoufflement), l'anosmie (perte d'odorat), la parésie (faiblesse musculaire), une faible fièvre et les troubles cognitifs (agueusie, anosmie, troubles de l'attention...).
Des études sont en cours sur divers aspects de la COVID longue, mais en avril 2021, il est trop tôt pour tirer des conclusions, bien qu'une étude ait suggéré des facteurs de risque pour développer la maladie. Les systèmes de santé publiques de certains pays comme le NHS au Royaume-Uni, ont créé des structures spécialisées, et prodigué des conseils pour traiter ce genre de patients.
Une étude préliminaire de juillet 2021 relève la présence d'anticorps du virus d'Epstein-Barr (EBV) chez 73 % de patients souffrant de « Covid longe ». Ce virus de la même famille que l'herpès et responsable de la mononucléose infectieuse est fréquemment contracté à l'adolescence et reste latent chez 95 % des adultes. L'affaiblissement général et l'inflammation causés par la Covid-19 pourrait, chez certains patients, réactiver ce virus dormant. Les symptômes du « Covid long » ne seraient alors pas imputables directement au coronavirus mais à l'EBV[526].
Prévalence des patients souffrant de COVID longue
Pour une étude publiée dans le British Medical Journal, environ 10% des personnes testées positives pour le SRAS-CoV-2 présentent une gamme de symptômes qui perdurent au-delà de trois semaines[527]. Environ 2% des personnes testées positives déclarent avoir des symptômes qui perdurent au-delà de 12 semaines, ce que l'on appelle la COVID longue ou syndrome COVID chronique.
75 à 80% des patients hospitalisés pour des formes graves[528],[529] éprouvent des problèmes à long terme, notamment fatigue et dyspnée (essouflement)[530],[531],[532],[533].
Les patients avec une infection initiale sévère, en particulier ceux qui ont besoin d'une assistance respiratoire, sont également susceptibles de souffrir du syndrome de soins post-intensifs après la guérison[530].
Un rapport de cas et une revue systématique réalisée en Suède estiment qu'une COVID longue peut également survenir chez les enfants[534],[535]. Les symptômes courants chez les enfants étaient la fatigue, la dyspnée, les palpitations cardiaques ou les douleurs thoraciques, et il semblait y avoir une prédominance féminine[534].
Une étude de septembre 2020 du King's College de Londres, a dénombré 60 000 patients alors concernés par des symptômes relevant de la COVID longue au Royaume-Uni[536]. Les statistiques publiées en décembre par l'Office for National Statistics suggèrent que 21% des patients souffrent de symptômes à long terme. (Bien que ces statistiques ne rapportent que l'incidence post-COVID et non pré-COVID de ces symptômes, qui peuvent avoir été préexistants)[537],[538].
Facteurs de risque
Selon une étude du King's College de Londres initialement publiée le [539], les facteurs de risque les plus observés chez les patients souffrant d'une COVID longue sont[540],[541]:
- Âge supérieur à 50 ans
- Surpoids (IMC>30)
- Asthme
- Présenter plus de cinq symptômes (par exemple plus de toux, fatigue, maux de tête, diarrhée, perte de l'odorat) au cours de la première semaine de l'infection au COVID-19; cinq est le nombre médian relevé.
Symptômes observés
Les symptômes rapportés par les personnes atteintes d'une COVID longue comprennent[542],[543]:
- Troubles généraux
- Fatigue extrême
- Faiblesse musculaire
- Douleurs articulaires
- Douleurs aiguës dans les bras et les jambes
- Fièvre légère
- Diarrhées et vomissements
- Démangeaisons.
- Troubles rénaux
- Calculs rénaux
- Apparition de diabète.
- Troubles cardiaques
- Apparition d'hypertension
- Palpitations cardiaques.
- Troubles cognitifs
- Troubles de l'attention
- Mémoire défaillante
- Changements d'humeur
- Dépression et autres problèmes de santé mentale
- Troubles du sommeil.
- Troubles neurologiques
- Migraines
- Perte de goût (agueusie) et d'odorat (anosmie)
- Accidents vasculaires ischémiques[219]
- Accident vasculaire cérébral.
- Troubles pulmonaires et ORL
- Toux de longue durée
- Maux de gorge et difficultés de déglutition
- Essoufflement
- Douleurs à la poitrine.
Prévention
Le virus est sensible à tous les désinfectants habituels, solution hydroalcoolique, et au savon[544].
Mesures

La prévention vise essentiellement à éviter la contagion en suspendant tout contact proche avec une personne infectée confirmée et en limitant très fortement les autres contacts[545]. Ceci passe notamment par l'instauration de mesures-barrières comme la distanciation physique, l'arrêt des embrassades et des échanges manuels, le lavage fréquent des mains, l'utilisation de mouchoirs jetables ou encore la pratique de tousser dans son coude pour éviter la production d'aérosols, la désinfection des surfaces potentiellement contaminées telles que des poignées de portes, boutons d'ascenseurs, etc. L'aération des locaux s'ajoute à ces comportements-barrière[546].
Il est vivement conseillé aux personnes présentant un état grippal de surveiller leur température. L'ingestion de viande ou d'œuf mal cuits est déconseillée[547],[548].
La London School of Hygiene and Tropical Medicine publie une étude le 6 février 2020 montrant que les détecteurs thermiques des aéroports détectent moins de 40 % des personnes infectées[549] en se basant notamment sur cette publication[550].
Port du masque
Initialement, l'OMS ne recommandait pas le port du masque systématiquement, craignant qu'il procure un faux sentiment de sécurité. Le masque n'était recommandé que si on toussait ou éternuait, ou si on s'occupait d’une personne présumée infectée par le SARS-CoV-2[551].
Depuis l'été 2020, l'OMS recommande le port du masque dans les lieux très fréquentés, lorsqu’il est impossible de garder une distance d’au moins un mètre avec les autres à l'intérieur ou à l'extérieur, et dans les endroits mal ventilés ou dont on ignore la manière dont ils sont ventilés[552].
L'OMS rappelle en outre que le port du masque est sans intérêt s'il ne s’accompagne pas d'un lavage régulier des mains et son utilisation exige des précautions particulières. Le port du masque diminue considérablement la transmission des gouttelettes émises au cours de la parole[118]. La bonne manipulation du masque lors de sa mise en place et son retrait suivi d'un lavage des mains est primordiale.
Les masques avec valve sont des masques qui facilitent l'expiration pour des raisons de confort. Les masques avec valves sont surtout utilisés dans les professions dont l'activité physique nécessite une bonne ventilation du porteur (métier du bâtiment par exemple), et ne sont pas recommandés comme protection par l'OMS[553].
Masque chirurgical
Le masque chirurgical est conçu pour retenir les germes sortant des poumons de la personne qui le porte : il est porté par un chirurgien (d'où le qualificatif de ce masque) pour éviter surtout d'infecter son patient opéré[554]. Le port de ce masque peut apporter parfois un faux sentiment de sécurité[555].
Masque FFP2
Le masque de protection individuel (de type FFP2) est équipé d'un filtre qui empêche les germes de pénétrer dans l'organisme. Son efficacité dure de trois à huit heures[554]. Ce masque sert à protéger les personnels de santé lors de leurs soins aux personnes infectées. Ce masque porte le qualificatif de "bec de canard"[556].
Pour éviter la confusion entre les masques FFP1, FFP2 et FFP3, les élastiques sont jaunes pour les FFP1, blancs ou bleus pour les FFP2 et rouges pour les FFP3.
Masques alternatifs
Début avril 2020, les dirigeants de plusieurs pays changent de discours et recommandent de se couvrir le visage, avec un simple foulard ou un masque fait maison si besoin. En France, l’Académie nationale de médecine estime qu’un masque « grand public » devrait être rendu obligatoire pour toute sortie pendant et après le confinement[557].
Opposition au port du masque
Différents mouvements d'opposition au port du masque et aux mesures de confinement ou de restrictions des libertés durant la pandémie de Covid-19 ont vu le jour dans divers pays du monde.
Port de gants
Hormis si l'on est un soignant en contact avec un patient potentiellement infecté et que l'on a été au préalable formé aux bonnes pratiques, l'OMS précise que le port de gants est inutile et que « le fait de se laver les mains régulièrement protège mieux contre la Covid-19 que le port de gants en caoutchouc »[558].
Lavage des mains
Se laver régulièrement les mains avec du savon ou d’une solution hydroalcoolique est la plus importante des mesures de protection contre le SARS-CoV-2. Pour être efficace, le lavage au gel hydroalcoolique doit se faire en manches courtes, les ongles courts (1 mm ou moins) sans vernis, sans aucun bijou (ni alliance ni montre…) et les mains sèches et macroscopiquement propres (on ne désinfecte que ce qui est propre)[559].
Eau potable
Face à la pandémie de Covid-19 qui sévit en France, de nombreux gestionnaires d'approvisionnement en eau potable ont répondu à l’appel des Agences régionales de santé, suivant en cela les recommandations de l’Organisation mondiale de la santé. Elles leur demandent de modifier la chloration de l'eau, avec une augmentation du taux de 0,3 mg/l à 0,5 mg/l en sortie de station de traitement, avec une exposition au chlore libre pendant au moins 30 minutes[560]. C'est le cas en particulier à Rennes, Strasbourg, Toulouse, dans la région parisienne, etc.[561]
Vitamine D
La supplémentation régulière en vitamine D chez les personnes carencées pourrait avoir un effet bénéfique pour la prévention de la Covid-19[562]. Par contre, malgré des recommandations allant dans ce sens[563], une supplémentation massive ou au-delà des seuils de carence n'a pas d'effet bénéfique démontré[562].
Inactivation par la chaleur
De premiers travaux avaient montré que les CoV ne résistent pas à des températures de 200 °C durant une à vingt minutes. Puis une étude a montré qu'à 75 °C durant 15 minutes, il était également inactivé[564]. Ce type de désinfection est long et très consommateur d'énergie.
Une étude américaine plus récente (mars 2021) a montré que chauffer une solution contaminée par le betacoronavirus de l'hépatite murine à environ 72 °C durant une demi-seconde seulement permettait de réduire de 100 000 fois la concentration du fluide en virus actif[564]. Ce taux de réduction est estimé suffisant par les chercheurs pour que le risque d'infection soit alors proche de zéro pour un hôte humain. Selon les auteurs, un tel traitement thermique de l'air contaminé limiterait la transmission aérienne à longue distance[564].
83,4 °C durant 1,03 seconde, désactive la totalité des coronavirus de l'hépatite murine[564].
Désinformation
De nombreuses théories concernant les causes du virus, la propagation de celui-ci ou les traitements sont diffusées sur les médias sociaux, et s'avèrent être liées aux théories du complot, aux infox ou d'être de la désinformation. Elles sont, pour certaines, entretenues par des affirmations contradictoires émises par des dirigeants politiques, des autorités de santé et des scientifiques[565].
L’incertitude scientifique[566] sur ce nouveau virus voyant le jour dans un monde où les modes de fonctionnement, ainsi que la pression médiatique, sont différents des précédentes pandémies, amènent une sollicitation accrue de l’opinion de divers experts, qui ne sont parfois pas nécessairement qualifiés pour intervenir en cette situation de crise. Il faut prendre en compte l'importance des biais cognitifs et rhétoriques visibles dans les prises de position de certains « experts » dans cette crise sanitaire qui restent encore largement à étudier. L'expertise décroît en raison du nombre important d'experts sollicités. L'entropie des connaissances scientifiques complexifie la tâche des journalistes dans leur rôle de distributeurs d'informations sur le sujet, puisque la ligne de distinction entre informations prouvées et non fiables devient de plus en plus floue[567]. La science étant à la base des sociétés modernes et communément perçue comme un vecteur de certitude, la confusion au sein de la sphère scientifique, explique le scepticisme de certains publics en lien avec le virus de la Covid-19[568].
En outre, la modernité de la crise qui ne permet pas toujours l'accès à des études scientifiques solides, de long terme et évaluées par des pairs (garantie habituelle de fiabilité de la source), pour ainsi permettre aux individus d'exercer un jugement critique sur la qualité de l'information transmise. Les scientifiques ignorant volontairement les règles scientifiques élémentaires sont également une source d'alimentation des théories du complot[567]. L'information et son contraire continuent donc de monopoliser les médias, créant sur leur passage la perplexité du public en quête de réponses. De plus, une mauvaise compréhension de la démarche scientifique, avec la perception que des résultats mouvants au fil du temps seraient des signes de mensonge, facilite la relativisation de son rôle et le recours à des pseudo-sciences[569].
L'importance et la gravité de la pandémie ont suscité la publication de nombreuses études scientifiques. Quelques-unes ont réussi à être publiées en dépit de problèmes méthodologiques, ce qui a alimenté la désinformation, notamment sur les vaccins. Quatre revues scientifiques réputées ont dû retirer en des articles précédemment publiés mais insuffisamment validés[570].
Infographie
- Gildas Des Roseaux, « Comment fonctionnent les différents tests de dépistage du virus ? », sur Le Figaro, (consulté le )
- Marc Cherki, « Coronavirus: de nombreux freins à l’accélération des tests PCR », sur Le Figaro, (consulté le )
- Guillaume Balavoine, « Cinq cartes pour visualiser les disparités régionales face au Covid-19 », sur Le Figaro, (consulté le )
- Dossier : « Coronavirus : notre dossier spécial sur la pandémie de Covid-19 », sur La Croix (consulté le )
- Jonathan Parienté, Pierre Breteau, Maxime Ferrer et Léa Sanchez, « Coronavirus : âge, sexe, département… la hausse de la mortalité française en six graphiques », sur Le Monde, (consulté le )
- « En direct - Déconfinement : des réponses concrètes en début de semaine », sur Les Échos, (consulté le )
Notes et références
Notes
- Voir la section « Nom de la maladie ».
- En dehors du nom donné par l’OMS, on trouve parfois COronaVirus Infectious Disease 2019, cf. Jean-Paul Sardon, « De la longue histoire des épidémies au Covid-19 », sur cairn.info (consulté le ).
- Pour la linguiste Julie Neveux, cet argument n'est pas concluant car il existe des exceptions. Selon cette même logique le mot laser, par exemple, devrait être employé au féminin puisque son noyau est amplification[21].
Références
- « CoV-SRMO – Risque pour les Canadiens », (consulté le ).
- (en) Lidia Morawska et Donald K Milton, « It Is Time to Address Airborne Transmission of Coronavirus Disease 2019 (COVID-19) », Clinical Infectious Diseases, , ciaa939 (ISSN 1058-4838 et 1537-6591, PMID 32628269, PMCID PMC7454469, DOI 10.1093/cid/ciaa939, lire en ligne, consulté le ).
- (en-GB) Julian Tang, « Understanding 'aerosol transmission' could be key to controlling coronavirus », The Guardian, (ISSN 0261-3077, lire en ligne, consulté le ).
- R. Karia, I. Gupta, H. Khandait, A. Yandav et A. Yandav, « COVID-19 and its Modes of Transmission », SN Compr Clin Med., vol. 2, no 10, , p. 1798–1801 (PMID 32904860, PMCID 7461745, DOI 10.1007/s42399-020-00498-4, lire en ligne, consulté le ).
- « Covid-19 : maladie mortelle, mais à quel point ? », sur lepoint.fr (consulté le ).
- Au 4 juin 2021, le taux de décès va de 0% en Nouvelle-Calédonie à 9,41% au Mexique et à 19,58 au Yémen, https://coronavirus.politologue.com/
- « Allocution liminaire du Directeur général de l’OMS lors du point presse sur le 2019-nCoV du 11 février 2020 », sur www.who.int, Organisation mondiale de la santé, (consulté le ).
- (en) « Naming the coronavirus disease (COVID-19) and the virus that causes it », sur who.int, Organisation mondiale de la santé (consulté le ).
- « Maladie à coronavirus 2019 (Covid-19) : questions-réponses », sur who.int, Organisation mondiale de la santé (consulté le ).
- Emma Donada, « Doit-on dire «le» ou «la» Covid-19 ? », sur Libération.fr, (consulté le ).
- « Coronavirus Covid-19 », sur Info-coronavirus.be/ (consulté le ).
- « Coronavirus : contacts des autorités fédérales et cantonales », sur ch.ch (consulté le ).
- LOI n° 2020-290 du 23 mars 2020 d'urgence pour faire face à l'épidémie de covid-19, (lire en ligne).
- « Décret n° 2020-293 du 23 mars 2020 prescrivant les mesures générales nécessaires pour faire face à l'épidémie de covid-19 dans le cadre de l'état d'urgence sanitaire | Legifrance », sur legifrance.gouv.fr (consulté le ).
- Décret n° 2020-545 du 11 mai 2020 prescrivant les mesures générales nécessaires pour faire face à l'épidémie de covid-19 dans le cadre de l'état d'urgence sanitaire, (lire en ligne).
- Décret n° 2020-568 du 14 mai 2020 relatif au versement d'une prime exceptionnelle aux agents des établissements publics de santé et à certains agents civils et militaires du ministère des armées et de l'Institution nationale des invalides dans le cadre de l'épidémie de covid-19, (lire en ligne).
- Arrêté du 27 mai 2020 portant modification de la liste des actes et prestations mentionnée à l'article L. 162-1-7 du code de la sécurité sociale (diagnostic biologique de l'infection par le SARS-CoV-2) (lire en ligne).
- « Moniteur Belge - Belgisch Staatsblad », sur www.ejustice.just.fgov.be (consulté le ).
- « Le covid 19 ou La covid 19 », sur Académie française, (consulté le ).
- « Coronavirus: c'est "la" Covid-19, selon l'Académie française », sur Le HuffPost, (consulté le ).
- Frédéric Martel, « À l’Académie française on refuse toujours la féminisation des mots… sauf pour "la" Covid », sur franceculture.fr (France Culture), (consulté le ).
- « "Le" ou "la" Covid-19 ? L'Académie française plaide, un peu seule, pour le féminin », sur Franceinfo, (consulté le ).
- « Vu de Suisse. LE ou LA Covid-19 ? “Le monde francophone restera coupé en deux” », sur Courrier international, (consulté le ).
- « Coronavirus : l'Académie française fait sourire », sur Les Echos, (consulté le ).
- Mathieu Avanzi, « Le/la Covid ? Réouvrir ou rouvrir ? Les leçons de grammaire du coronavirus », sur The Conversation (consulté le ).
- « Le ou la Covid? Cinq membres de l'Académie française s'étonnent de ne pas avoir été consultés », sur LIndependant.fr, (consulté le ).
- « "Le" ou "La" Covid ? Au bout d'un an, les Français ont choisi leur camp », sur huffingtonpost.fr (Le HuffPost), (consulté le ).
- « Quel genre pour « Covid » ? Sondage Ifop pour Ernest », sur datapressepremium.com, (consulté le ).
- Vincent Mongaillard, « Covid, déconfinement, geste barrière… les mots de la pandémie entrent dans le dictionnaire », leparisien.fr, 27 mai 2020.
- « covid », sur LeRobert (consulté le ).
- « Covid, déconfinement, téléconsultation… Les mots de la pandémie dans Le Petit Robert 2021 », sur Le Telegramme, (consulté le ) : « Dans le cas de Covid, notre position a été rapidement claire : au Petit Robert, on rend compte de l’usage et on observe que la plupart des Français utilisent ce mot au masculin. Ils l’ont fait dès que le mot est apparu. Ils ont continué à le faire après la recommandation de l’Académie française. En revanche, le Québec l’emploie majoritairement au féminin. Et pas seulement en raison de la recommandation. Mais aussi parce que les Québécois emploient plus facilement les anglicismes au féminin que les Français. De ce fait, on a mis les deux genres. ».
- « "Covid" au masculin et sans majuscules dans Le Petit Robert 2022 », sur Franceinfo, (consulté le ).
- Le Point magazine, « Traçage, cluster… Les nouveaux mots du « Petit Larousse illustré » 2022 », sur Le Point, (consulté le ).
- Mohammed Aïssaoui et Alice Develey, « «Cluster», «réa», «racisé»... Découvrez les nouveaux mots du Petit Larousse », sur Le Figaro (consulté le ).
- « Doit-on dire "le" ou "la" Covid-19 ? », sur France Culture, (consulté le ).
- « COVID-19 », Le Grand Dictionnaire terminologique, Office québécois de la langue française (consulté le ).
- Zone Société- ICI.Radio-Canada.ca, « COVID-19 est un terme féminin, et voici pourquoi on vous a dit le contraire | Coronavirus : Ontario », sur Radio-Canada.ca (consulté le ).
- « COVID-19 », sur Termium Plus, (consulté le ).
- Discours du 12 avril 2020 « La COVID-19 est le défi de notre génération » https://www.youtube.com/watch?v=PAPqns6ST6U
- « Conférence de presse de M. François Legault, premier ministre », sur assnat.qc.ca, Assemblée nationale du Québec, (consulté le ).
- (en) Kelvin Kai-Wang To, Siddharth Sridhar, Kelvin Hei-Yeung Chiu, Derek Ling-Lung Hung, Xin Li, Ivan Fan-Ngai Hung, Anthony Raymond Tam, Tom Wai-Hin Chung, Jasper Fuk-Woo Chan, Anna Jian-Xia Zhang, Vincent Chi-Chung Cheng et Kwok-Yung Yuen, « Lessons learned 1 year after SARS-CoV-2 emergence leading to COVID-19 pandemic », Emerging Microbes & Infections, vol. 10, no 1, , p. 507–535 (ISSN 2222-1751, PMID 33666147, PMCID 8006950, DOI 10.1080/22221751.2021.1898291)
- (en) Chaolin Huang, Yeming Wang, Xingwang Li et Lili Ren, « Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China », The Lancet, vol. 395, no 10223, , p. 497–506 (ISSN 0140-6736 et 1474-547X, PMID 31986264, DOI 10.1016/S0140-6736(20)30183-5, lire en ligne, consulté le ).
- (en) « China’s prénom confirmed Covid-19 case traced back to November 17 », sur South China Morning Post, (consulté le )
- Na Zhu, Dingyu Zhang, Wenling Wang et Xingwang Li, « A Novel Coronavirus from Patients with Pneumonia in China, 2019 », New England Journal of Medicine, vol. 382, no 8, , p. 727–733 (ISSN 0028-4793, DOI 10.1056/NEJMoa2001017, lire en ligne, consulté le ).
- (en) « Novel Coronavirus( 2019-nCoV), situation report-1 », sur WHO (=OMS), .
- « Commune et mairie de Guillos : Actualités », sur www.guillos.fr (consulté le ).
- « Avec 811 morts en Chine, le nouveau coronavirus devient plus meurtrier que le SRAS », Le Monde.fr, (lire en ligne, consulté le ).
- (en) « Novel Coronavirus(2019-nCoV) Situation report-3 », sur WHO (=OMS), .
- (en) « Novel Coronavirus (2019-nCoV) Situation Report-7 », sur WHO (=OMS), .
- (en) OMS, « Novel Coronavirus (2019-nCoV) Situation Report-11 », sur www.who.int, Organisation mondiale de la santé, .
- (en) Peter Daszak, « We Knew Disease X Was Coming. It’s Here Now. », sur nytimes.com, .
- (en) Jason Gale, « Coronavirus May Be ‘Disease X’ Health Experts Warned About », sur bloomberg.com, .
- (en) David Mercer, « Coronavirus outbreak could be feared 'Disease X', says World Health Organisation adviser », sur news.sky.com, .
- « Appellation de la maladie à coronavirus 2019 (COVID-19) et du virus qui la cause », sur www.who.int, Organisation mondiale de la santé, (consulté le ).
- « Allocution liminaire du Directeur général de l’OMS lors du point presse sur la COVID-19 - 11 mars 2020 », sur www.who.int (consulté le ).
- (en) Markus Hoffmann, Hannah Kleine-Weber, Simon Schroeder et Nadine Krüger, « SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor », Cell, , S0092867420302294 (PMID 32142651, PMCID PMC7102627, DOI 10.1016/j.cell.2020.02.052, lire en ligne, consulté le ).
- (en) Hao Zhang, Zijian Kang, Haiyi Gong et Da Xu, « The digestive system is a potential route of 2019-nCov infection: a bioinformatics analysis based on single-cell transcriptomes », bioRxiv, , p. 2020.01.30.927806 (DOI 10.1101/2020.01.30.927806, lire en ligne, consulté le ).
- (en) Liu F., Long X., Zou W., Fang M., Wu W., Li W. et Zhang Z., « Highly ACE2 Expression in Pancreas May Cause Pancreas Damage After SARS-CoV-2 Infection », medRxiv, .
- (en) Yu Zhao, Zixian Zhao, Yujia Wang et Yueqing Zhou, « Single-cell RNA expression profiling of ACE2, the putative receptor of Wuhan 2019-nCov », bioRxiv, Bioinformatics, (DOI 10.1101/2020.01.26.919985, lire en ligne, consulté le ).
- Silva-Filho, J., Caruso-Neves, C. & Pinheiro, A. Angiotensin II type-1 receptor (AT1R) regulates expansion, differentiation, and functional capacity of antigen-specific CD8+ T cells. Sci Rep 6, 35997 (2016). DOI:10.1038/srep35997.
- « Chinese doctor discovers novel coronavirus in patient's cerebrospinal fluid - Global Times », sur www.globaltimes.cn (consulté le ).
- (en) Eric Vivier, Elena Tomasello, Myriam Baratin et Thierry Walzer, « Functions of natural killer cells », Nature Immunology, vol. 9, no 5, , p. 503–510 (ISSN 1529-2916, DOI 10.1038/ni1582, lire en ligne, consulté le ).
- (en) Meijuan Zheng, Yong Gao, Gang Wang et Guobin Song, « Functional exhaustion of antiviral lymphocytes in COVID-19 patients », Cellular & Molecular Immunology, , p. 1–3 (ISSN 2042-0226, PMCID PMC7091858, DOI 10.1038/s41423-020-0402-2, lire en ligne, consulté le ).
- (en) Stanley Perlman et Jason Netland, « Coronaviruses post-SARS: update on replication and pathogenesis », Nature Reviews Microbiology, vol. 7, no 6, , p. 439–450 (ISSN 1740-1526 et 1740-1534, PMID 19430490, PMCID PMC2830095, DOI 10.1038/nrmicro2147, lire en ligne, consulté le ).
- (en) Roman Wölfel, Victor M. Corman, Wolfgang Guggemos et Michael Seilmaier, « Virological assessment of hospitalized patients with COVID-2019 », Nature, , p. 1–10 (ISSN 1476-4687, DOI 10.1038/s41586-020-2196-x, lire en ligne, consulté le ).
- Wenling Wang, (2020) « Detection of SARS-CoV-2 in Different Types of Clinical Specimens » ; Research Letter ; 11 mars 2020 ; JAMA. Doi:10.1001/jama.2020.3786 (synthèse faite par des universitaires et chercheurs du CDC chinois à partir de 1 070 échantillons prélevés dans les trois jours suivant l’admission sur 205 patients hospitalisés (dont 19 % dans un état grave), dans trois hôpitaux (du Hubei, du Shandong et de Pékin, en Chine), entre le et le )).
- (en) People’s Liberation Army Professional Committee of Critical Care Medicine, Chinese Society on Thrombosis and Haemostasis, Jing-Chun Song, Gang Wang et Wei Zhang, « Chinese expert consensus on diagnosis and treatment of coagulation dysfunction in COVID-19 », Military Medical Research, vol. 7, no 1, , p. 19 (ISSN 2054-9369, PMID 32307014, PMCID PMC7167301, DOI 10.1186/s40779-020-00247-7, lire en ligne, consulté le ).
- « Un médecin chinois découvre le COVID-19 dans le liquide céphalorachidien d'un patient », sur french.peopledaily.com.cn (consulté le ).
- Ali Rismanbaf et Sara Zarei, « Liver and Kidney Injuries in COVID-19 and Their Effects on Drug Therapy; a Letter to Editor », Archives of Academic Emergency Medicine, vol. 8, no 1, (ISSN 2645-4904, PMID 32185369, PMCID 7075271, lire en ligne, consulté le ).
- (en) Pengfei Cui et autres, « Clinical features and sexual transmission potential of SARS-CoV-2 infected female patients: a descriptive study in Wuhan, China », MedRxiv, , p. 19 (lire en ligne).
- (en) Sufang Tian, Weidong Hu, Li Niu et Huan Liu, « Pulmonary Pathology of Early-Phase 2019 Novel Coronavirus (COVID-19) Pneumonia in Two Patients With Lung Cancer », Journal of Thoracic Oncology, vol. 15, no 5, , p. 700–704 (DOI 10.1016/j.jtho.2020.02.010, lire en ligne, consulté le ).
- (en) Ni Huang, Paola Perez, Takafumi Kato et Yu Mikami, « Integrated Single-Cell Atlases Reveal an Oral SARS-CoV-2 Infection and Transmission Axis », MedRxiv, Infectious Diseases (except HIV/AIDS), (PMID 33140061, PMCID PMC7605572, DOI 10.1101/2020.10.26.20219089, lire en ligne, consulté le ).
- (en) Joseph T. Wu, Kathy Leung et Gabriel M. Leung, « Nowcasting and forecasting the potential domestic and international spread of the 2019-nCoV outbreak originating in Wuhan, China: a modelling study », The Lancet, vol. 395, no 10225, , p. 689–697 (ISSN 0140-6736 et 1474-547X, PMID 32014114, DOI 10.1016/S0140-6736(20)30260-9, lire en ligne, consulté le ).
- Non, le taux de survie du Covid-19 n'est pas de 99,95%
- (en) Bai Y, Yao L, Wei T et al., « Presumed Asymptomatic Carrier Transmission of COVID-19. », JAMA, (DOI 10.1001/jama.2020.2565, lire en ligne).
- (en) Camilla Rothe, Mirjam Schunk, Peter Sothmann et Gisela Bretzel, « Transmission of 2019-nCoV Infection from an Asymptomatic Contact in Germany », New England Journal of Medicine, , NEJMc2001468 (ISSN 0028-4793 et 1533-4406, DOI 10.1056/NEJMc2001468, lire en ligne, consulté le ).
- « La grippe, une épidémie saisonnière », sur www.santepubliquefrance.fr (consulté le ).
- Cheng PK, Wong DA, Tong LK, et al. Viral shedding patterns of coronavirus in patients with probable severe acute respiratory syndrome. Lancet 2004;363:1699-1700.
- (en) Qun Li, Xuhua Guan, Peng Wu et Xiaoye Wang, « Early Transmission Dynamics in Wuhan, China, of Novel Coronavirus–Infected Pneumonia », New England Journal of Medicine, , NEJMoa2001316 (ISSN 0028-4793 et 1533-4406, DOI 10.1056/NEJMoa2001316, lire en ligne, consulté le ).
- Coronavirus, des experts répondent à vos questions – conférence de l’UNIGE, Université de Genève, mis en ligne par le Gvt français, 27 février 2020.
- (en) Lydia Bourouiba, « Turbulent Gas Clouds and Respiratory Pathogen Emissions: Potential Implications for Reducing Transmission of COVID-19 », JAMA, (ISSN 0098-7484, DOI 10.1001/jama.2020.4756, lire en ligne, consulté le ).
- (en-US) CDC, « Coronavirus Disease 2019 (COVID-19) – Prevention & Treatment », sur Centers for Disease Control and Prevention, (consulté le ).
- (en) Bianca Nogrady, What the data say about asymptomatic COVID infections, Nature, 587, 534-535, 18 novembre 2020
- (en-GB) Graham Russell et agencies, « China pivots to tackle 'silent' Covid-19 carriers as US says a quarter of cases may have no symptoms », The Guardian, (ISSN 0261-3077, lire en ligne, consulté le ).
- Jaimes, J. A., André, N. M., Millet, J. K. & Whittaker, G. R. Preprint at bioRxiv DOI:10.1101/2020.02.10.942185 (2020).
- Coutard, B. et al. Antiviral Res. DOI:10.1016/j.antiviral.2020.104742 (2020).
- (en) Fei Zhou, Guohui Fan, Zhibo Liu et Bin Cao, « SARS-CoV-2 shedding and infectivity – Authors' reply », The Lancet, vol. 0, no 0, (ISSN 0140-6736 et 1474-547X, DOI 10.1016/S0140-6736(20)30869-2, lire en ligne, consulté le ).
- (en) Roman Woelfel, Victor Max Corman, Wolfgang Guggemos et Michael Seilmaier, « Clinical presentation and virological assessment of hospitalized cases of coronavirus disease 2019 in a travel-associated transmission cluster », Pré-publication sur MedRxiv, Infectious Diseases (except HIV/AIDS), (DOI 10.1101/2020.03.05.20030502, lire en ligne, consulté le ).
- (en) Carmen L. Charlton, Esther Babady, Christine C. Ginocchio et Todd F. Hatchette, « Practical Guidance for Clinical Microbiology Laboratories: Viruses Causing Acute Respiratory Tract Infections », Clinical Microbiology Reviews, vol. 32, no 1, , e00042–18, /cmr/32/1/e00042–18.atom (ISSN 0893-8512 et 1098-6618, PMID 30541871, PMCID PMC6302358, DOI 10.1128/CMR.00042-18, lire en ligne, consulté le ).
- (en) Dennis K. M. Ip, Lincoln L. H. Lau, Kwok-Hung Chan et Vicky J. Fang, « The Dynamic Relationship Between Clinical Symptomatology and Viral Shedding in Naturally Acquired Seasonal and Pandemic Influenza Virus Infections », Clinical Infectious Diseases, , civ909 (ISSN 1058-4838 et 1537-6591, PMID 26518469, PMCID PMC4725380, DOI 10.1093/cid/civ909, lire en ligne, consulté le ).
- (en) « Covid-19 virus can produce more than thrice as many pathogens than Sars strain », sur South China Morning Post, (consulté le ).
- (en) Xi He, Eric H. Y. Lau, Peng Wu et Xilong Deng, « Temporal dynamics in viral shedding and transmissibility of COVID-19 », Nature Medicine, , p. 1–4 (ISSN 1546-170X, DOI 10.1038/s41591-020-0869-5, lire en ligne, consulté le ).
- (en) Ai Tang Xiao, Yi Xin Tong, Chun Gao et Li Zhu, « Dynamic profile of RT-PCR findings from 301 COVID-19 patients in Wuhan, China: a descriptive study », Journal of Clinical Virology, , p. 104346 (ISSN 1386-6532, PMCID PMC7151472, DOI 10.1016/j.jcv.2020.104346, lire en ligne, consulté le ).
- Fei Zhou & al. (2020) Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study ; The Lancet ; March 9, 2020.
- (en) Yuhan Xing, Wei Ni, Qin Wu et Wenjie Li, « Prolonged presence of SARS-CoV-2 in feces of pediatric patients during the convalescent phase », medrxiv.org (preprint server for health sciences), Infectious Diseases (except HIV/AIDS), (DOI 10.1101/2020.03.11.20033159, lire en ligne, consulté le ).
- Prolonged presence of SARS-CoV-2 in feces of pediatric patients during the convalescent phase, Yuhan Xing, Wei Ni, Qin Wu, Wenjie Li, Guoju Li, Jianning Tong, Xiufeng Song, Quansheng Xing, document non revu par les pairs, 3 mars 2020, DOI:10.1101/2020.03.11.20033159.
- (en-US) An Tang, Zhen-dong Tong, Hong-ling Wang et Ya-xin Dai, « Early Release - Detection of Novel Coronavirus by RT-PCR in Stool Specimen from Asymptomatic Child, China », Emerging Infectious Diseases journal - CDC, vol. 26, (DOI 10.3201/eid2606.200301, lire en ligne, consulté le ).
- (en) Shi Zao, « Preliminary estimation of the basic reproduction number of novel coronavirus (2019-nCoV) in China, », International Journal of Infectious Diseases, (lire en ligne).
- « Le taux de reproduction de COVID-19 est plus élevé que celui du SRAS ».
- « La contagiosité du coronavirus revue à la hausse », sur Futura (consulté le ).
- Ruian Ke, « High Contagiousness and Rapid Spread of Severe Acute Respiratory Syndrome Coronavirus 2 », sur Emerging Infectious Diseases journal (DOI 10.3201/eid2607.200282, consulté le ).
- (en) Yang Liu, Rosalind M. Eggo et Adam J. Kucharski, « Secondary attack rate and superspreading events for SARS-CoV-2 », The Lancet, vol. 395, no 10227, , e47 (ISSN 0140-6736 et 1474-547X, PMID 32113505, DOI 10.1016/S0140-6736(20)30462-1, lire en ligne, consulté le ).
- Le Dr Manuel Schibler, infectiologue et virologue, au Centre universitaire de Genève répond aux questions fréquentes concernant le Coronavirus de la maladie COVID-19, le 26 février 2020 : Combien de temps ce virus peut-il survivre sur les surfaces ? https://www.youtube.com/watch?v=aSFnboZLPGM.
- (en) Neeltje van Doremalen, Trenton Bushmaker, Dylan H. Morris et Myndi G. Holbrook, « Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1 », New England Journal of Medicine, , NEJMc2004973 (ISSN 0028-4793 et 1533-4406, DOI 10.1056/NEJMc2004973, lire en ligne, consulté le ).
- (en) Neeltje van Doremalen, Trenton Bushmaker, Dylan H. Morris, Myndi G. Holbrook, Amandine, Gamble, Brandi N. Williamson, Azaibi Tamin, Jennifer L. Harcourt, Natalie J. Thornburg, Susan Gerber, James O. Lloyd-Smith, Emmie de Wit, Vincent J. Munster (2020) [Aerosol and surface stability of HCoV-19 (SARS-CoV-6 2) compared to SARS-CoV-1] ; https://doi.org/10.1101/2020.03.09.20033217 ; Laboratory of Virology, National Institutes of Health, Hamilton, MT, États-Unis.
- Nicolas Martin, « Surfaces, aérosols : le coronavirus survit-il partout ? », sur France Culture, (consulté le ).
- « Une étude confirme le risque infectieux du Covid-19 dans l’air expiré », sur Santé Magazine, (consulté le ).
- (en) Wei Luo, Maimuna S. Majumder, Dianbo Liu et Canelle Poirier, « The role of absolute humidity on transmission rates of the COVID-19 outbreak », medRxiv, , p. 2020.02.12.20022467 (DOI 10.1101/2020.02.12.20022467, lire en ligne, consulté le ).
- « #VraiOuFake L'épidémie de coronavirus Covid-19 va-telle disparaître en avril grâce à la chaleur, comme l'assure Donald Trump ? », sur Franceinfo, (consulté le ).
- Covid-19 : où a-t-on le plus de risque d'être contaminé ?
- Covid : où se contamine-t-on le plus ? Les enseignements d'une étude américaine
- "Covid-19 : évitez les rassemblements privés" : l'appel de six médecins
- COVID-19 : les cas rattachés à des clusters ne représenteraient que 10% des contaminations
- Pablo Linde, « La noche se convierte en uno de los principales focos de expansión del coronavirus », El País, (lire en ligne, consulté le ).
- El País, « Últimas noticias del coronavirus, en directo », El País, (lire en ligne, consulté le ).
- [PDF] https://www.ecdc.europa.eu/sites/default/files/documents/Ventilation-in-the-context-of-COVID-19.pdf
- (en) Lisa Schnirring, « Doubts rise about China's ability to contain new coronavirus », sur CIDRAP - Center for Infectious Disease Research and Policy, News & Perspectives, (consulté le ).
- (en) Philip Anfinrud, Valentyn Stadnytskyi, Christina E. Bax et Adriaan Bax, « Visualizing Speech-Generated Oral Fluid Droplets with Laser Light Scattering », New England Journal of Medicine, , NEJMc2007800 (ISSN 0028-4793 et 1533-4406, DOI 10.1056/NEJMc2007800, lire en ligne, consulté le ).
- La rédaction avec AFP, « Le coronavirus pourrait ne jamais disparaître et se transmettrait par la parole, selon l'OMS », La Dépêche, (lire en ligne).
- AFP, « La propagation du coronavirus "éminemment" possible par la parole, selon une expérience », La Dépêche, (lire en ligne).
- [d'après une étude de Philip Anfinrud, de l'American Institute of physics] Hervé Morin et Audrey Lagadec, « Comment la parole et le vent diffusent le SARS-CoV-2 ? », Le Monde, no 23445, , p. 26 (ISSN 0395-2037, lire en ligne, consulté le ).
- Kampf G., Todt D., Pfaender S., Steinmann E. Persistence of coronaviruses on inanimate surfaces and its inactivation with biocidal agents. J Hosp Infect. 2020. http://doi.org/10.1016/j.jhin.2020.01.022.
- China News (2010) The SARS-COV-2 nucleic acid detected for the first time on the surface of door handle in Guangzhou and cleaning taken attention.
- Kampf G, Todt D, Pfaender S & Steinmann E (2020) Persistence of coronaviruses on inanimate surfaces and its inactivation with biocidal agents. Journal of Hospital Infection ; Mars 2020 , Vol.104, no 3, Pages 246–251.
- van Doremalen, N., Bushmaker, T., Morris, D., Holbrook, M., Gamble, A., Williamson, B.... & Lloyd-Smith J (2020) Aerosol and surface stability of HCoV-19 (SARS-CoV-2) compared to SARS-CoV-1. medRxiv.
- (en) Emanuel Goldman, « Exaggerated risk of transmission of COVID-19 by fomites », The Lancet Infectious Diseases, , S1473309920305612 (PMID 32628907, PMCID PMC7333993, DOI 10.1016/S1473-3099(20)30561-2, lire en ligne, consulté le ).
- (en) J Sizun, M.W.N Yu et P.J Talbot, « Survival of human coronaviruses 229E and OC43 in suspension and after drying onsurfaces: a possible source ofhospital-acquired infections », Journal of Hospital Infection, vol. 46, no 1, , p. 55–60 (DOI 10.1053/jhin.2000.0795, lire en ligne, consulté le ).
- (en) S. F. Dowell, J. M. Simmerman, D. D. Erdman et J.-S. J. Wu, « Severe Acute Respiratory Syndrome Coronavirus on Hospital Surfaces », Clinical Infectious Diseases, vol. 39, no 5, , p. 652–657 (ISSN 1058-4838 et 1537-6591, DOI 10.1086/422652, lire en ligne, consulté le ).
- (en-US) Apoorva Mandavilli, « 239 Experts With One Big Claim: The Coronavirus Is Airborne », The New York Times, (ISSN 0362-4331, lire en ligne, consulté le ).
- OMS (2020) Question and answer on coronaviruses.
- (en) Yun-yun Li, Ji-Xiang Wang et Xi Chen, « Can a toilet promote virus transmission? From a fluid dynamics perspective », Physics of Fluids, vol. 32, no 6, , p. 065107 (ISSN 1070-6631 et 1089-7666, PMID 32574232, PMCID PMC7301880, DOI 10.1063/5.0013318, lire en ligne, consulté le ).
- The SARS-COV-2 isolated from the stool specimens of patients with novel coronavirus-infected pneumonia by teams of Nanshan Zhong Professor and Lanjuan Li Professor ; Chinanews.
- R.F Service (2020) Does disinfecting surfaces really prevent the spread of coronavirus? ; 12 mars 2020 Science News/HealthCoronavirus | doi:10.1126/science.abb7058
- Hamming I, Timens W, Bulthuis ML, Lely AT, Navis G, van Goor H. Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis. J Pathol. 2004;203(2):631-637.
- Christian MD, Poutanen SM, Loutfy MR, Muller MP, Low DE. Severe acute respiratory syndrome. Clin Infect Dis. 2004;38:1420-1427.
- Peiris JS, Chu CM, Cheng VC, et al. Clinical progression and viral load in a community outbreak of coronavirus-associated SARS pneumonia: a prospective study. Lancet. 2003;361(9371):1767-1772.
- (en-US) Jianyun Lu, Jieni Gu, Kuibiao Li et Conghui Xu, « Early Release - COVID-19 Outbreak Associated with Air Conditioning in Restaurant, Guangzhou, China, 2020 - Volume 26, Number 7—July 2020 - Emerging Infectious Diseases journal - CDC », CDC, (DOI 10.3201/eid2607.200764, lire en ligne, consulté le ).
- Zeng Weibiao et al., Association of Daily Wear of Eyeglasses With Susceptibility to Coronavirus Disease 2019 Infection, 2020. DOI:10.1001/jamaophthalmol.2020.3906.
- (en-GB) Helen Davidson, « Hong Kong warns residents not to kiss pets after dog contracts coronavirus », The Guardian, (ISSN 0261-3077, lire en ligne, consulté le ).
- A dog has died after testing positive for coronavirus. Should pets of COVID-19 patients be quarantined? https://www.cbc.ca/news/health/coronavirus-dog-spread-humans-1.5487621
- (en) Smriti Mallapaty, « Coronavirus can infect cats — dogs, not so much », Nature, , d41586–020–00984-8 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/d41586-020-00984-8, lire en ligne, consulté le ).
- Camille Gévaudan, « Le coronavirus pourrait se transmettre entre chats », sur Libération.fr, (consulté le ).
- Deng, W., Bao, L., Gao, H., Xiang, Z., Qu, Y., Song, Z.... & Qi, F. (2020). Ocular conjunctival inoculation of SARS-CoV-2 can cause mild COVID-19 in Rhesus macaques. bioRxiv.
- franceinfo avec AFP, « Covid-19 : six pays ont rapporté des cas dans des élevages de visons, selon l'OMS », sur francetvinfo.fr, (consulté le ).
- « Covid-19 : pour la première fois en France la présence du virus a été détectée dans un élevage de visons en Eure-et-Loir, l'abattage de 1 000 bêtes ordonné », sur Franceinfo, (consulté le ).
- David Adam, « A la chasse aux virus », Courrier international (traduit du New Scientist), no 1576, , p. 38-39.
- (en) Lirong Zou, Feng Ruan, Mingxing Huang et Lijun Liang, « SARS-CoV-2 Viral Load in Upper Respiratory Specimens of Infected Patients », New England Journal of Medicine, , NEJMc2001737 (ISSN 0028-4793 et 1533-4406, DOI 10.1056/NEJMc2001737, lire en ligne, consulté le ).
- Tsang TK, Cowling BJ, Fang VJ, et al. Influenza A virus shedding and infectivity in households. J Infect Dis 2015;212:1420-1428.
- (en) Jsm Peiris, Cm Chu, Vcc Cheng et Ks Chan, « Clinical progression and viral load in a community outbreak of coronavirus-associated SARS pneumonia: a prospective study », The Lancet, vol. 361, no 9371, , p. 1767–1772 (DOI 10.1016/S0140-6736(03)13412-5, lire en ligne, consulté le ).
- (en) Covid-19: Asymptomatic cases may not be infectious, Wuhan study indicates, bmj.com, 1er décembre 2020, 371, doi.org/10.1136/bmj.m4695
- (en) Stephen A. Lauer, Kyra H. Grantz, Qifang Bi et Forrest K. Jones, « The Incubation Period of Coronavirus Disease 2019 (COVID-19) From Publicly Reported Confirmed Cases: Estimation and Application », Annals of Internal Medicine, (ISSN 0003-4819, DOI 10.7326/M20-0504, lire en ligne, consulté le ).
- Coronavirus chinois : la période d’incubation pourrait atteindre 24 jours Céline Deluzarche, futura-sciences, .
- (en-US) « Symptoms of Novel Coronavirus (2019-nCoV) | CDC », sur www.cdc.gov, (consulté le ).
- « Coronavirus : la période d'incubation moyenne se précise autour de cinq jours », sur www.lexpress.fr, (consulté le ).
- Source : Une infectiologue de l'hôpital Cochin (Paris), Odile Launay, « Coronavirus : "les délais d'incubation sont beaucoup plus courts, à peu près 5 jours", estime un médecin infectiologue », sur Franceinfo, (consulté le ).
- Temps d'incubation, modes de transmission, taux de mortalité… Une étude chinoise sur le coronavirus 2019-nCoV apporte de nouveaux éléments franceinfo – France Télévisions, .
- Clinical characteristics of 2019 novel coronavirus infection in Chinadoi.org, 6 février 2020.
- Étude du Johns Hopkins Bloomberg School of Public Health, de Baltimore associée à School of Public Health and Health Sciences du Massachusetts, et à la Ludwig-Maximilians-Universität de Munich
- (en) François-Xavier Lescure, Lila Bouadma, Duc Nguyen et Marion Parisey, « Clinical and virological data of the first cases of COVID-19 in Europe: a case series », The Lancet Infectious Diseases, vol. 0, no 0, (ISSN 1473-3099 et 1474-4457, DOI 10.1016/S1473-3099(20)30200-0, lire en ligne, consulté le ).
- « 'Weird as hell’: the Covid-19 patients who have symptoms for months », The Guardian, (lire en ligne, consulté le ).
- « Coronavirus SARS-CoV-2 : retour sur trois mois de mobilisation contre une maladie émergente (Covid-19) », sur Institut Pasteur, (consulté le ).
- « COVID-19 - History and exam | BMJ Best Practice », sur bestpractice.bmj.com (consulté le ).
- (en) Gareth Iacobucci, « Sixty seconds on . . . anosmia », BMJ, vol. 368, (ISSN 1756-1833, PMID 32209546, DOI 10.1136/bmj.m1202, lire en ligne, consulté le ).
- (en) Carol H. Yan, Farhoud Faraji, Divya P. Prajapati et Christine E. Boone, « Association of chemosensory dysfunction and Covid-19 in patients presenting with influenza-like symptoms », International Forum of Allergy & Rhinology, (DOI 10.1002/alr.22579, lire en ligne, consulté le ).
- « ALERTE ANOSMIE – COVID-19 – 20 mars 2020 », sur www.snorl.org (consulté le ).
- Jérôme Salomon, directeur de la Santé, « Perte de goût (agueusie) : causes et comment le retrouver ? », sur journaldesfemmes.fr, (consulté le ).
- Conseil National de l'ORL, « Diarrhées et perte de l’odorat et du goût peuvent être des symptômes du coronavirus », sur nouvelobs.com, Nouvel Obs, (consulté le ).
- T. Klejtman, « Atteintes dermatologiques au cours de l’infection à COVID-19 », JMV-Journal de médecine vasculaire, vol. 45, , S77 (DOI 10.1016/j.jdmv.2020.10.011, lire en ligne, consulté le ).
- (en) Billie Thomson, « Wuhan doctor, 42, whose skin turned dark due to coronavirus treatment 'dies after battling the deadly disease for nearly five months' », sur dailymail.co.uk, (consulté le ).
- Sciences et Avenir - Coronavirus : des engelures aux mains ou aux pieds pourraient être un nouveau symptôme du Covid-19
- Le Monde - Covid-19 : une maladie virale aux multiples visages
- (en) MASSACHUSETTS GENERAL HOSPITAL, « Some COVID-19 "long haulers" experience lasting skin problems », sur EurekAlert!, (consulté le ).
- (en) Marie Baeck et Anne Herman, « COVID toes: Where do we stand with the current evidence? », International Journal of Infectious Diseases, vol. 102, , p. 53–55 (PMID 33075530, PMCID PMC7566763, DOI 10.1016/j.ijid.2020.10.021, lire en ligne, consulté le ).
- (en) S-C Loon, « The severe acute respiratory syndrome coronavirus in tears », British Journal of Ophthalmology, vol. 88, no 7, , p. 861–863 (ISSN 0007-1161, PMID 15205225, PMCID PMC1772213, DOI 10.1136/bjo.2003.035931, lire en ligne, consulté le ).
- (en) E. de Wit, A. L. Rasmussen, D. Falzarano et T. Bushmaker, « Middle East respiratory syndrome coronavirus (MERS-CoV) causes transient lower respiratory tract infection in rhesus macaques », Proceedings of the National Academy of Sciences, vol. 110, no 41, , p. 16598–16603 (ISSN 0027-8424 et 1091-6490, PMID 24062443, PMCID PMC3799368, DOI 10.1073/pnas.1310744110, lire en ligne, consulté le ).
- (en) W M Chan, « Tears and conjunctival scrapings for coronavirus in patients with SARS », British Journal of Ophthalmology, vol. 88, no 7, , p. 968–969 (ISSN 0007-1161, PMID 15205249, PMCID PMC1772218, DOI 10.1136/bjo.2003.039461, lire en ligne, consulté le ).
- (en) Ping Wu, Fang Duan, Chunhua Luo et Qiang Liu, « Characteristics of Ocular Findings of Patients With Coronavirus Disease 2019 (COVID-19) in Hubei Province, China », JAMA Ophthalmology, (ISSN 2168-6165, PMID 32232433, PMCID PMC7110919, DOI 10.1001/jamaophthalmol.2020.1291, lire en ligne, consulté le ).
- (en) Wei-jie Guan, Zheng-yi Ni, Yu Hu et Wen-hua Liang, « Clinical Characteristics of Coronavirus Disease 2019 in China », N Engl J Med, , NEJMoa2002032 (ISSN 0028-4793 et 1533-4406, PMID 32109013, DOI 10.1056/NEJMoa2002032, lire en ligne, consulté le ).
- (en) Raffaele Nuzzi, Luigi Ludovico Carucci et Flavia Tripoli, « COVID-19 and ocular implications: an update », Journal of Ophthalmic Inflammation and Infection, vol. 10, no 1, , p. 20 (ISSN 1869-5760, PMID 32885277, PMCID PMC7471234, DOI 10.1186/s12348-020-00212-4, lire en ligne, consulté le ).
- (en) Peng Zhou, Xing-Lou Yang, Xian-Guang Wang et Ben Hu, « A pneumonia outbreak associated with a new coronavirus of probable bat origin », Nature, vol. 579, no 7798, , p. 270–273 (ISSN 0028-0836 et 1476-4687, PMID 32015507, PMCID PMC7095418, DOI 10.1038/s41586-020-2012-7, lire en ligne, consulté le ).
- (en) Preenie deS. Senanayake, Judy Drazba, Karen Shadrach et Amy Milsted, « Angiotensin II and Its Receptor Subtypes in the Human Retina », Investigative Opthalmology & Visual Science, vol. 48, no 7, , p. 3301 (ISSN 1552-5783, DOI 10.1167/iovs.06-1024, lire en ligne, consulté le ).
- Wagner J, Jan Danser AH, Derkx FH et al (1996) Demonstration of renin mRNA, angiotensinogen mRNA, and angiotensin converting enzyme mRNA expression in the human eye: evidence for an intraocular renin-angiotensin system. Br J Ophthalmol 80:159–163
- Yan Sun LL, Pan X, Jing M (2006) Mechanism of the action between the SARS-CoV S240 protein and the ACE2 receptor in eyes. J Virol 6:783–786
- Banu Bozkurt, Sait Eğrilmez, Tomris Şengör et Özlem Yıldırım, « The COVID-19 Pandemic: Clinical Information for Ophthalmologists », Turkish Journal of Ophthalmology, vol. 50, no 2, , p. 59–63 (ISSN 1300-0659 et 2147-2661, DOI 10.4274/tjo.galenos.2020.29805, lire en ligne, consulté le ).
- (en) Sudhi P. Kurup, Samira Khan et Manjot K. Gill, « Spectral domain optimal cohérence tomograhy in the évaluation and management of infections retinitis », Retina, vol. 34, no 11, , p. 2233–2241 (ISSN 0275-004X, DOI 10.1097/IAE.0000000000000218, lire en ligne, consulté le ).
- (en) Paula M Marinho, Allexya A A Marcos, André C Romano et Heloisa Nascimento, « Retinal findings in patients with COVID-19 », The Lancet, , S014067362031014X (PMCID PMC7217650, DOI 10.1016/S0140-6736(20)31014-X, lire en ligne, consulté le ).
- (en) Luca Carsana, Aurelio Sonzogni, Ahmed Nasr et Roberta Simona Rossi, « Pulmonary post-mortem findings in a series of COVID-19 cases from northern Italy: a two-centre descriptive study », The Lancet Infectious Diseases, , S1473309920304345 (PMCID PMC7279758, DOI 10.1016/S1473-3099(20)30434-5, lire en ligne, consulté le ).
- (en) Eunhee S Yi, Matthew J Cecchini et Melanie C Bois, « Pathologists in pursuit of the COVID-19 culprit », The Lancet Infectious Diseases, , S1473309920304497 (PMCID PMC7279719, DOI 10.1016/S1473-3099(20)30449-7, lire en ligne, consulté le ).
- (en) Lisa M Barton, Eric J Duval, Edana Stroberg et Subha Ghosh, « COVID-19 Autopsies, Oklahoma, USA », American Journal of Clinical Pathology, vol. 153, no 6, , p. 725–733 (ISSN 0002-9173 et 1943-7722, PMID 32275742, PMCID PMC7184436, DOI 10.1093/ajcp/aqaa062, lire en ligne, consulté le ).
- (en) Zhe Xu, Lei Shi, Yijin Wang et Jiyuan Zhang, « Pathological findings of COVID-19 associated with acute respiratory distress syndrome », The Lancet Respiratory Medicine, vol. 8, no 4, , p. 420–422 (PMID 32085846, PMCID PMC7164771, DOI 10.1016/S2213-2600(20)30076-X, lire en ligne, consulté le ).
- (en) Huilan Zhang, Peng Zhou, Yanqiu Wei et Huihui Yue, « Histopathologic Changes and SARS-CoV-2 Immunostaining in the Lung of a Patient With COVID-19 », Annals of Internal Medicine, vol. 172, no 9, , p. 629–632 (ISSN 0003-4819 et 1539-3704, DOI 10.7326/M20-0533, lire en ligne, consulté le ).
- (en) Sufang Tian, Weidong Hu, Li Niu et Huan Liu, « Pulmonary Pathology of Early-Phase 2019 Novel Coronavirus (COVID-19) Pneumonia in Two Patients With Lung Cancer », Journal of Thoracic Oncology, vol. 15, no 5, , p. 700–704 (PMID 32114094, PMCID PMC7128866, DOI 10.1016/j.jtho.2020.02.010, lire en ligne, consulté le ).
- (en) Nanshan Chen, Min Zhou, Xuan Dong et Jieming Qu, « Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study », The Lancet, vol. 0, no 0, (ISSN 0140-6736 et 1474-547X, DOI 10.1016/S0140-6736(20)30211-7, lire en ligne, consulté le ).
- M. Underner et G. Peiffer, « Tabagisme et maladie à coronavirus 2019 (COVID-19) », sur Revue des Maladies Respiratoires, (ISSN 0761-8425, DOI 10.1016/j.rmr.2020.04.001, consulté le ).
- (en) Michelle L. Holshue et Chas DeBolt, « First Case of 2019 Novel Coronavirus in the United States », sur New England Journal of Medicine, (ISSN 0028-4793, PMID 32004427, PMCID PMC7092802, DOI 10.1056/NEJMoa2001191, consulté le ), p. 929–936.
- (en) Wei Zhang et Rong-Hui Du, « Molecular and serological investigation of 2019-nCoV infected patients: implication of multiple shedding routes », sur Emerging Microbes & Infections, (ISSN 2222-1751, PMID 32065057, PMCID PMC7048229, DOI 10.1080/22221751.2020.1729071, consulté le ), p. 386–389.
- (en) Wenling Wang et Yanli Xu, « Detection of SARS-CoV-2 in Different Types of Clinical Specimens », sur JAMA, (ISSN 0098-7484, PMID 32159775, PMCID PMC7066521, DOI 10.1001/jama.2020.3786, consulté le ).
- (en) Fei Xiao et Meiwen Tang, « Evidence for Gastrointestinal Infection of SARS-CoV-2 », sur Gastroenterology, (PMID 32142773, PMCID PMC7130181, DOI 10.1053/j.gastro.2020.02.055, consulté le ), S0016508520302821.
- (en) Lauren M. Perry, Dana Pan, Thomas W. Loehfelm et Sooraj Tejaswi, « Pancreaticoportal Fistula Causing Hepatic Necrosis Treated With Pancreatic Duct Stenting: », The American Journal of Gastroenterology, , p. 1 (ISSN 0002-9270, DOI 10.14309/ajg.0000000000000554, lire en ligne, consulté le ).
- (en) Shihua Luo, Xiaochun Zhang et Haibo Xu, « Don't Overlook Digestive Symptoms in Patients With 2019 Novel Coronavirus Disease (COVID-19) », Clinical Gastroenterology and Hepatology, , S1542356520304018 (PMID 32205220, PMCID PMC7154217, DOI 10.1016/j.cgh.2020.03.043, lire en ligne, consulté le ).
- (ch) Fang Dan, Ma Jingdong, Guan Jialun et Wang Muru, « Manifestations of Digestive system in hospitalized patients with novel coronavirus pneumonia in Wuhan, China: a single-center, descriptive study », Chinese Journal of Digestion, vol. 40, no 00, , E005–E005 (ISSN 0254-1432, DOI 10.3760/cma.j.issn.0254-1432.2020.0005, lire en ligne, consulté le ).
- (en) Lei Pan, Mi Mu, Pengcheng Yang et Yu Sun, « Clinical Characteristics of COVID-19 Patients With Digestive Symptoms in Hubei, China: A Descriptive, Cross-Sectional, Multicenter Study », The American Journal of Gastroenterology, , p. 1 (ISSN 0002-9270, PMID 32287140, PMCID PMC7172492, DOI 10.14309/ajg.0000000000000620, lire en ligne, consulté le ).
- (en) Yunle Wan, Jie Li, Lihan Shen et Yifeng Zou, « Enteric involvement in hospitalised patients with COVID-19 outside Wuhan », The Lancet Gastroenterology & Hepatology, , S2468125320301187 (PMID 32304638, PMCID PMC7159861, DOI 10.1016/S2468-1253(20)30118-7, lire en ligne, consulté le ).
- Wai K. Leung, Ka-fai To, Paul K.S. Chan et Henry L.Y. Chan, « Enteric involvement of severe acute respiratory syndrome-associated coronavirus infection », Gastroenterology, vol. 125, no 4, , p. 1011–1017 (DOI 10.1016/S0016-5085(03)01215-0, lire en ligne, consulté le ).
- Bruce Spiess, « F1000Prime recommendation of Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. », ""Faculty opinions", (lire en ligne, consulté le ).
- Véronique Julia, « Coronavirus : le microbiote a peut-être aussi des choses à dire », sur www.franceinter.fr, (consulté le ).
- « Diversité du microbiote intestinal et formes graves de COVID-19 sont-elles liées ? », Caducé.net, (lire en ligne, consulté le ).
- (en) Yan-Chao Li, Wan-Zhu Bai et Tsutomu Hashikawa, « The neuroinvasive potential of SARS-CoV2 may play a role in the respiratory failure of COVID-19 patients », Journal of Medical Virology, vol. n/a, no n/a, (ISSN 1096-9071, DOI 10.1002/jmv.25728, lire en ligne, consulté le ).
- (en) Jhilik Dey, Md Tanjim Alam, Sreyashi Chandra et Jalaj Gupta, « Neuroinvasion of SARS-CoV-2 may play a role in the breakdown of respiratory center of the brain », Journal of Medical Virology, vol. n/a, no n/a, (ISSN 1096-9071, DOI 10.1002/jmv.26521, lire en ligne, consulté le ).
- Abdul Mannan Baig, Areeba Khaleeq, Usman Ali et Hira Syeda, « Evidence of the COVID-19 Virus Targeting the CNS: Tissue Distribution, Host–Virus Interaction, and Proposed Neurotropic Mechanisms », ACS Chemical Neuroscience, vol. 11, no 7, , p. 995–998 (ISSN 1948-7193 et 1948-7193, PMID 32167747, PMCID PMC7094171, DOI 10.1021/acschemneuro.0c00122, lire en ligne, consulté le ).
- Amsterdam Research, April 14, 2020 SARS‐CoV-2 in COVID-19 patients is likely to infect the brain
- (en) Ling Mao, Mengdie Wang, Shanghai Chen et Quanwei He, « Neurological Manifestations of Hospitalized Patients with COVID-19 in Wuhan, China: a retrospective case series study », medRxiv, , p. 2020.02.22.20026500 (DOI 10.1101/2020.02.22.20026500, lire en ligne, consulté le ).
- (en-US) Jamie Talan, « COVID-19: Neurologists in Italy to Colleagues in US: Look for Poorly-Defined Neurologic Conditions in Patients with the Coronavirus », Neurology Today, (lire en ligne, consulté le ).
- (en-US) Roni Caryn Rabin, « Some Coronavirus Patients Show Signs of Brain Ailments », The New York Times, (ISSN 0362-4331, lire en ligne, consulté le ).
- (en) Takeshi Moriguchi, Norikazu Harii, Junko Goto et Daiki Harada, « A first case of meningitis/encephalitis associated with SARS-Coronavirus-2 », International Journal of Infectious Diseases, vol. 94, , p. 55–58 (PMID 32251791, PMCID PMC7195378, DOI 10.1016/j.ijid.2020.03.062, lire en ligne, consulté le ).
- Yan-Chao Li, Wan-Zhu Bai et Tsutomu Hashikawa, « The neuroinvasive potential of SARS-CoV2 may play a role in the respiratory failure of COVID-19 patients », Journal of Medical Virology, vol. 92, no 6, , p. 552–555 (PMID 32104915, DOI 10.1002/jmv.25728).
- Covid-19 : une hypothèse suggère « une vague silencieuse » de troubles neurologiques liés au coronavirus
- Neurological consequences of COVID-19: The ‘Silent Wave’.
- INSERM, « Des résultats confirment la capacité du SARS-CoV-2 à infecter les neurones », presse.inserm.fr, (lire en ligne, consulté le ).
- Luc Ruidant, « Covid-19 : le risque de complications cardiovasculaires aiguës serait au moins triplé », le journal du medecin, (lire en ligne, consulté le ).
- « Nouveau coronavirus: réalité et incertitudes » (consulté le ).
- (en) Fei Zhou, Ting Yu, Ronghui Du et Guohui Fan, « Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study », The Lancet, vol. 0, no 0, (ISSN 0140-6736 et 1474-547X, DOI 10.1016/S0140-6736(20)30566-3, lire en ligne, consulté le ).
- (en) Chaomin Wu, Xiaoyan Chen, Yanping Cai et Jia’an Xia, « Risk Factors Associated With Acute Respiratory Distress Syndrome and Death in Patients With Coronavirus Disease 2019 Pneumonia in Wuhan, China », JAMA Internal Medicine, (ISSN 2168-6106, PMID 32167524, PMCID PMC7070509, DOI 10.1001/jamainternmed.2020.0994, lire en ligne, consulté le ).
- « Quelle la gestion de la prophylaxie antithrombotique chez les patients Covid-19 ? » (consulté le ).
- (en) Bianca Christensen, Emmanuel J. Favaloro, Giuseppe Lippi et Elizabeth M. Van Cott, « Hematology Laboratory Abnormalities in Patients with Coronavirus Disease 2019 (COVID-19) », Seminars in Thrombosis and Hemostasis, vol. 46, no 7, , p. 845–849 (ISSN 1098-9064, PMID 32877961, PMCID 7645834, DOI 10.1055/s-0040-1715458, lire en ligne, consulté le ).
- (en) D. S. Baranovskii, I. D. Klabukov, O. A. Krasilnikova et D. A. Nikogosov, « Prolonged prothrombin time as an early prognostic indicator of severe acute respiratory distress syndrome in patients with COVID-19 related pneumonia », Current Medical Research and Opinion, , p. 1 (ISSN 1473-4877, PMID 33210948, DOI 10.1080/03007995.2020.1853510, lire en ligne, consulté le ).
- (en) Ning Tang, Dengju Li, Xiong Wang et Ziyong Sun, « Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia », Journal of Thrombosis and Haemostasis, vol. 18, no 4, , p. 844–847 (ISSN 1538-7836, PMID 32073213, PMCID PMC7166509, DOI 10.1111/jth.14768, lire en ligne, consulté le ).
- (en) Lisa E. Gralinski, Armand Bankhead, Sophia Jeng et Vineet D. Menachery, « Mechanisms of Severe Acute Respiratory Syndrome Coronavirus-Induced Acute Lung Injury », mBio, vol. 4, no 4, , e00271–13 (ISSN 2150-7511, PMID 23919993, PMCID PMC3747576, DOI 10.1128/mBio.00271-13, lire en ligne, consulté le ).
- (en) Sufang Tian, Weidong Hu, Li Niu et Huan Liu, « Pulmonary Pathology of Early-Phase 2019 Novel Coronavirus (COVID-19) Pneumonia in Two Patients With Lung Cancer », Journal of Thoracic Oncology, vol. 15, no 5, , p. 700–704 (PMID 32114094, PMCID PMC7128866, DOI 10.1016/j.jtho.2020.02.010, lire en ligne, consulté le ).
- (en) Benjamin G. Chousterman, Filip K. Swirski et Georg F. Weber, « Cytokine storm and sepsis disease pathogenesis », Seminars in Immunopathology, vol. 39, no 5, , p. 517–528 (ISSN 1863-2297 et 1863-2300, DOI 10.1007/s00281-017-0639-8, lire en ligne, consulté le ).
- (ch) « 从SARS尸体解剖发现,浅析冠状病毒性疾病-19(COVID-19) - 中华病理学杂志 », Chinese Journal of Pathology, vol. 49, no 00, , E003–E003 (ISSN 0529-5807, DOI 10.3760/cma.j.issn.0529-5807.2020.0003, lire en ligne, consulté le ).
- Min Jin et Qiaoxia Tong, « Rhabdomyolysis as Potential Late Complication Associated with COVID-19 », Emerging Infectious Diseases, vol. 26, no 7, (ISSN 1080-6040 et 1080-6059, DOI 10.3201/eid2607.200445, lire en ligne, consulté le ).
- (en) Jsm Peiris, Cm Chu, Vcc Cheng et Ks Chan, « Clinical progression and viral load in a community outbreak of coronavirus-associated SARS pneumonia: a prospective study », The Lancet, vol. 361, no 9371, , p. 1767–1772 (PMID 12781535, PMCID PMC7112410, DOI 10.1016/S0140-6736(03)13412-5, lire en ligne, consulté le ).
- (en) Chong Py, Chui P, Ling Ae et Franks Tj, « Analysis of Deaths During the Severe Acute Respiratory Syndrome (SARS) Epidemic in Singapore: Challenges in Determining a SARS Diagnosis », National Institutes of Health, 2004 feb (PMID 14736283, lire en ligne, consulté le ).
- (en) Mohammad Madjid, Payam Safavi-Naeini, Scott D. Solomon et Orly Vardeny, « Potential Effects of Coronaviruses on the Cardiovascular System: A Review », JAMA Cardiology, (ISSN 2380-6583, DOI 10.1001/jamacardio.2020.1286, lire en ligne, consulté le ).
- Buongiorno News, Coronavirus: speranze dalla scoperta di Sandro Giannini, 10/04/2020
- International Business Times, NEW FACT? Reason for coronavirus lethality is heart problem not lungs, says Italian doctor, 11/04/2019
- Medscape France, COVID-19 Daily: Ventilator Protocols Questioned, Physician Rights, 05/04/2020
- Femme actuelle, Coronavirus : certains malades manquent d’oxygène sans souffrir de détresse respiratoire, 10/04/2020
- 2019-Novel Coronavirus (2019-nCoV): estimating the case fatality rate – a word of caution Battegay Manuela, Kuehl Richarda, Tschudin-Sutter Saraha, Hirsch Hans H., Widmer Andreas F., Neher Richard A., Céline Deluzarche, Swiss Medical Weekly, 07 février 2020.
- (en) Anna Fifield, « As families tell of pneumonia-like deaths in Wuhan, some wonder if China virus count is too low », The Washington Post, (lire en ligne).
- (en-GB) Lily Kuo et Lillian Yang, « Coronavirus: Chinese hospitals not testing patients, say relatives », The Guardian, (ISSN 0261-3077, lire en ligne, consulté le ).
- (en-US) Wenxin Fan, « Relatives Wonder Why Pneumonia Deaths Not in Coronavirus Tally », The Wall Street Journal, (ISSN 0099-9660, lire en ligne, consulté le ).
- (en) « Novel Coronavirus (2019-nCoV) situation reports », sur www.who.int (consulté le ).
- Vincent J. Munster, Marion Koopmans, Neeltje van Doremalen et Debby van Riel, « A Novel Coronavirus Emerging in China — Key Questions for Impact Assessment », New England Journal of Medicine, vol. 382, no 8, , p. 692–694 (ISSN 0028-4793, DOI 10.1056/NEJMp2000929, lire en ligne, consulté le ).
- (en) Zunyou Wu et Jennifer M. McGoogan, « Characteristics of and Important Lessons From the Coronavirus Disease 2019 (COVID-19) Outbreak in China: Summary of a Report of 72 314 Cases From the Chinese Center for Disease Control and Prevention », JAMA, (DOI 10.1001/jama.2020.2648, lire en ligne, consulté le ).
- The Novel Coronavirus Pneumonia Emergency Response Epidemiology Team. The epidemiological characteristics of an outbreak of 2019 novel coronavirus disease (COVID-19) — China, 2020 [lire en ligne=https://www.ncbi.nlm.nih.gov/pubmed/32064853].
- Bill Gates, « Responding to Covid-19 — A Once-in-a-Century Pandemic? », New England Journal of Medicine, vol. 0, no 0, , null (ISSN 0028-4793, DOI 10.1056/NEJMp2003762, lire en ligne, consulté le ).
- Anthony S. Fauci, H. Clifford Lane et Robert R. Redfield, « Covid-19 — Navigating the Uncharted », New England Journal of Medicine, (ISSN 0028-4793, DOI 10.1056/NEJMe2002387, lire en ligne, consulté le ).
- .
- (en) Lionel Roques, Etienne K. Klein, Julien Papaïx et Antoine Sar, « Using Early Data to Estimate the Actual Infection Fatality Ratio from COVID-19 in France », Biology, vol. 9, no 5, , p. 97 (DOI 10.3390/biology9050097, lire en ligne, consulté le ).
- Robert Verity, Lucy C Okell, Ilaria Dorigatti et Peter Winskill, « Estimates of the severity of coronavirus disease 2019: a model-based analysis », The Lancet Infectious Diseases, (ISSN 1473-3099, DOI 10.1016/s1473-3099(20)30243-7, lire en ligne, consulté le ).
- Preliminary result and conclusions of the COVID-19 case cluster study (Gangelt Municipality) University Hospital Bonn, 09 avril 2020.
- Covid-19 : une modélisation indique que près de 6 % des Français ont été infectés Communiqué de presse de l'Institut Pasteur, .
- (en) Yasemin Saplakoglu-Staff Writer 23 April 2020, « 1 in 5 people tested in New York City had antibodies for the coronavirus », sur livescience.com (consulté le ).
- COVID-19 Pandemic Planning Scenarios, Centers for Disease Control and Prevention, 20 mai 2020, notamment repris par CNN le 22 mai 2020.
- Victimes du Covid-19 en France : âge des décès aujourd'hui
- L'âge moyen des victimes du Covid-19 est-il de 81 ans ?
- (en) Nicola Davis et Niamh McIntyre, « How many will die of coronavirus in the UK? A closer look at the numbers », The Guardian, .
- (en) Xiaoping Chen, Wenjia Hu, Jiaxin Ling et Pingzheng Mo, « Hypertension and Diabetes Delay the Viral Clearance in COVID-19 Patients », medRxiv, Infectious Diseases (except HIV/AIDS), (DOI 10.1101/2020.03.22.20040774, lire en ligne, consulté le ).
- (en) Muthiah Vaduganathan, Orly Vardeny, Thomas Michel et John J.V. McMurray, « Renin–Angiotensin–Aldosterone System Inhibitors in Patients with Covid-19 », New England Journal of Medicine, , NEJMsr2005760 (ISSN 0028-4793 et 1533-4406, DOI 10.1056/NEJMsr2005760, lire en ligne, consulté le ).
- (en) Lei Fang, George Karakiulakis et Michael Roth, « Are patients with hypertension and diabetes mellitus at increased risk for COVID-19 infection? », The Lancet Respiratory Medicine, no 0, (ISSN 2213-2600 et 2213-2619, PMID 32171062, DOI 10.1016/S2213-2600(20)30116-8, lire en ligne, consulté le ).
- « NEJM Journal Watch: Summaries of and commentary on original medical and scientific articles from key medical journals », sur www.jwatch.org (consulté le ).
- (en-US) « Patients taking ACE-i and ARBs who contract COVID-19 should continue treatment, unless otherwise advised by their physician », sur American Heart Association (consulté le ).
- (en) Yingxia Liu, Fengming Huang, Jun Xu et Penghui Yang, « Anti-hypertensive Angiotensin II receptor blockers associated to mitigation of disease severity in elderly COVID-19 patients », MedRxiv, Infectious Diseases (except HIV/AIDS), (DOI 10.1101/2020.03.20.20039586, lire en ligne, consulté le ).
- « COVID-19 weekly surveillance report Data for the week of 23 - 29 Nov 2020 », sur www.euro.who.int (consulté le ).
- Jean-Paul Fritz, « Tabac, alcool et testicules ; pourquoi les hommes succombent plus au Covid que les femmes », sur L'Obs, (consulté le ).
- (en-GB) « COVID-19 – Global Health 50/50 » (consulté le ).
- « Covid-19 : les hommes, plus sévèrement atteints à cause de leurs testicules ? », sur Medisite (consulté le ).
- (en) Soumitra Ghosh et Robyn S. Klein, « Sex Drives Dimorphic Immune Responses to Viral Infections », The Journal of Immunology, vol. 198, no 5, , p. 1782–1790 (ISSN 0022-1767 et 1550-6606, PMID 28223406, PMCID PMC5325721, DOI 10.4049/jimmunol.1601166, lire en ligne, consulté le ).
- J. S. Torday, H. C. Nielsen, M. de M. Fencl et M. E. Avery, « Sex differences in fetal lung maturation », The American Review of Respiratory Disease, vol. 123, no 2, , p. 205–208 (ISSN 0003-0805, PMID 6894519, DOI 10.1164/arrd.1981.123.2.205, lire en ligne, consulté le ).
- (en) Heber C. Nielsen, Howard M. Zinman et John S. Torday, « Dihydrotestosterone Inhibits Fetal Rabbit Pulmonary Surfactant Production », Journal of Clinical Investigation, vol. 69, no 3, , p. 611–616 (ISSN 0021-9738, PMID 6916770, PMCID PMC371018, DOI 10.1172/JCI110488, lire en ligne, consulté le ).
- (en) H C Nielsen, « Androgen receptors influence the production of pulmonary surfactant in the testicular feminization mouse fetus. », Journal of Clinical Investigation, vol. 76, no 1, , p. 177–181 (ISSN 0021-9738, PMID 3839512, PMCID PMC423738, DOI 10.1172/JCI111943, lire en ligne, consulté le ).
- (en) Andy Goren, John McCoy, Carlos G. Wambier et Sergio Vano-Galvan, « What does androgenetic alopecia have to do with COVID-19? An insight into a potential new therapy », Dermatologic Therapy, , e13365 (DOI 10.1111/dth.13365, lire en ligne, consulté le ).
- (en) Wun-Ju Shieh, Cheng-Hsiang Hsiao, Christopher D. Paddock et Jeannette Guarner, « Immunohistochemical, in situ hybridization, and ultrastructural localization of SARS-associated coronavirus in lung of a fatal case of severe acute respiratory syndrome in Taiwan », Human Pathology, vol. 36, no 3, , p. 303–309 (PMID 15791576, PMCID PMC7112064, DOI 10.1016/j.humpath.2004.11.006, lire en ligne, consulté le ).
- (en) P. L. M. Dalpiaz, A. Z. Lamas, I. F. Caliman et R. F. Ribeiro Jr, « Sex Hormones Promote Opposite Effects on ACE and ACE2 Activity, Hypertrophy and Cardiac Contractility in Spontaneously Hypertensive Rats », PLOS ONE, vol. 10, no 5, , e0127515 (ISSN 1932-6203, PMID 26010093, PMCID PMC4444272, DOI 10.1371/journal.pone.0127515, lire en ligne, consulté le ).
- (en) Markus Hoffmann, Hannah Kleine-Weber, Simon Schroeder et Nadine Krüger, « SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor », Cell, vol. 181, no 2, , p. 271–280.e8 (DOI 10.1016/j.cell.2020.02.052, lire en ligne, consulté le ).
- (en) I. Glowacka, S. Bertram, M. A. Muller et P. Allen, « Evidence that TMPRSS2 Activates the Severe Acute Respiratory Syndrome Coronavirus Spike Protein for Membrane Fusion and Reduces Viral Control by the Humoral Immune Response », Journal of Virology, vol. 85, no 9, , p. 4122–4134 (ISSN 0022-538X, PMID 21325420, PMCID PMC3126222, DOI 10.1128/JVI.02232-10, lire en ligne, consulté le ).
- (en) Laura Mikkonen, Päivi Pihlajamaa, Biswajyoti Sahu et Fu-Ping Zhang, « Androgen receptor and androgen-dependent gene expression in lung », Molecular and Cellular Endocrinology, vol. 317, nos 1-2, , p. 14–24 (DOI 10.1016/j.mce.2009.12.022, lire en ligne, consulté le ).
- B. Lin, C. Ferguson, J. T. White et S. Wang, « Prostate-localized and androgen-regulated expression of the membrane-bound serine protease TMPRSS2 », Cancer Research, vol. 59, no 17, , p. 4180–4184 (ISSN 0008-5472, PMID 10485450, lire en ligne, consulté le ).
- ECDC, « Communicable disease threats report, CDTR, Week 27, 4-10 July 2021, All users »
- (en) Qiurong Ruan, Kun Yang, Wenxia Wang et Lingyu Jiang, « Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China », Intensive Care Medicine, (ISSN 0342-4642 et 1432-1238, PMID 32125452, PMCID PMC7080116, DOI 10.1007/s00134-020-05991-x, lire en ligne, consulté le ).
- Sylvie Riou-Milliot, « Le syndrome de détresse respiratoire aiguë, une urgence - Sciences et Avenir », sur Sciences et Avenir, (consulté le ).
- « Syndrome de détresse respiratoire aiguë : symptômes, causes, traitement », sur sante.journaldesfemmes.fr (consulté le ).
- (en) Fei Zhou, Ting Yu, Ronghui Du et Guohui Fan, « Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study », The Lancet, vol. 395, no 10229, , p. 1054–1062 (DOI 10.1016/S0140-6736(20)30566-3, lire en ligne, consulté le ).
- (en) Nanshan Chen, Min Zhou, Xuan Dong et Jieming Qu, « Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study », The Lancet, vol. 395, no 10223, , p. 507–513 (PMID 32007143, PMCID PMC7135076, DOI 10.1016/S0140-6736(20)30211-7, lire en ligne, consulté le ).
- (en) Puja Mehta, Daniel F. McAuley, Michael Brown et Emilie Sanchez, « COVID-19: consider cytokine storm syndromes and immunosuppression », The Lancet, vol. 395, no 10229, , p. 1033–1034 (ISSN 0140-6736 et 1474-547X, PMID 32192578, DOI 10.1016/S0140-6736(20)30628-0, lire en ligne, consulté le ).
- 135 patients de l'hôpital Jinyintan et 56 patient de l'hôpital de pneumologie de Wuhan
- (en) « Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID-19) », sur www.who.int (consulté le ).
- (en) Lennard Y W Lee, Jean-Baptiste Cazier, Thomas Starkey et Sarah E W Briggs, « COVID-19 prevalence and mortality in patients with cancer and the effect of primary tumour subtype and patient demographics: a prospective cohort study », The Lancet Oncology, , S1470204520304423 (DOI 10.1016/S1470-2045(20)30442-3, lire en ligne, consulté le ).
- « Covid-19 : procédure d'arrêt de travail simplifiée pour les personnes vulnérables considérées comme « à risque » », sur solidarites-sante.gouv.fr, ministère des Solidarités et de la Santé, 18 et 24 mars 2020 (consulté le ).
- Mathilde Gérard, « Covid-19 et obésité : « Le tissu adipeux servirait de réservoir de virus » », Le Monde, (lire en ligne
 , consulté le ).
, consulté le ). - (en) « The outbreak of coronavirus disease in China: Risk perceptions, knowledge, and information sources among prenatal and postnatal women », Women and Birth, (ISSN 1871-5192, DOI 10.1016/j.wombi.2020.05.010, lire en ligne, consulté le ).
- jean-pierre Changeux, Zahir Amoura, Felix Rey et Makoto Miyara, « A nicotinic hypothesis for Covid-19 with preventive and therapeutic implications », Qeios, (ISSN 2632-3834, DOI 10.32388/FXGQSB, lire en ligne, consulté le ).
- Libération, Le risque pour les fumeurs de développer une forme sévère du Covid-19 est augmenté de 50 %
- (en) Leen J M Seys, W Widagdo, Fien M Verhamme et Alex Kleinjan, « DPP4, the Middle East Respiratory Syndrome Coronavirus Receptor, is Upregulated in Lungs of Smokers and Chronic Obstructive Pulmonary Disease Patients », Clinical Infectious Diseases, vol. 66, no 1, , p. 45–53 (ISSN 1058-4838 et 1537-6591, PMID 29020176, PMCID PMC7108100, DOI 10.1093/cid/cix741, lire en ligne, consulté le ).
- (en) Fei Zhou, Ting Yu, Ronghui Du et Guohui Fan, « Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study », The Lancet, vol. 395, no 10229, , p. 1054–1062 (DOI 10.1016/S0140-6736(20)30566-3, lire en ligne, consulté le ).
- CDC COVID-19 Response Team Preliminary Estimates of the Prevalence of Selected Underlying Health Conditions Among Patients with Coronavirus Disease 2019 — United States, February 12 – March 28, 2020 MMWR; April 3, 2020; 69:382-6
- Véronique Julia, « La nicotine, une arme contre le Covid ? », sur www.franceinter.fr, (consulté le ).
- Pascale Santi, « Coronavirus : la proportion de fumeurs parmi les personnes atteintes du Covid-19 est faible », Le Monde, (lire en ligne, consulté le ).
- (en) Joshua M. Oakes, Robert M. Fuchs, Jason D. Gardner et Eric Lazartigues, « Nicotine and the renin-angiotensin system », American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, vol. 315, no 5, , R895–R906 (ISSN 0363-6119 et 1522-1490, PMID 30088946, PMCID PMC6295500, DOI 10.1152/ajpregu.00099.2018, lire en ligne, consulté le ).
- (en) Wei-jie Guan, Zheng-yi Ni, Yu Hu et Wen-hua Liang, « Clinical Characteristics of Coronavirus Disease 2019 in China », New England Journal of Medicine, , NEJMoa2002032 (ISSN 0028-4793 et 1533-4406, PMID 32109013, PMCID PMC7092819, DOI 10.1056/NEJMoa2002032, lire en ligne, consulté le ).
- (en) Arnaud Fontanet, Laura Tondeur, Yoann Madec et Rebecca Grant, « Cluster of COVID-19 in northern France : A retrospective closed cohort study », MedRxiv, Infectious Diseases (except HIV/AIDS), (DOI 10.1101/2020.04.18.20071134, lire en ligne, consulté le ).
- Le Figaro, OMS : le tabac cause 7 millions de décès par an
- Krause RM, Buisson B, Bertrand S, Corringer PJ, Galzi JL, Changeux JP, Bertrand D. Ivermectin: a positive allosteric effector of the alpha7 neuronal nicotinic acetylcholine receptor. Mol Pharmacol 1998; 53:283-94
- Voir chapitre ACE2 and TMPRSS2 expression patterns in specific patient populations in(en) Xiaohan Ren, Xiyi Wei, Guangyao Li et Shancheng Ren, « Multiple expression assessments of ACE2 and TMPRSS2 SARS-CoV-2 entry molecules in the urinary tract and their associations with clinical manifestations of COVID-19 », BioRxiv, Biochemistry, (DOI 10.1101/2020.05.08.083618, lire en ligne, consulté le ).
- Antoine Beau, « Nicotine et Covid-19: l'étude dépubliée à cause de ses liens avec l'industrie du tabac », sur www.huffingtonpost.fr, (consulté le ).
- C. L., « La théorie était fumeuse », Le Canard enchaîné, no 5243, .
- (en) David M G Halpin, Rosa Faner, Oriol Sibila et Joan Ramon Badia, « Do chronic respiratory diseases or their treatment affect the risk of SARS-CoV-2 infection? », The Lancet Respiratory Medicine, , S2213260020301673 (DOI 10.1016/S2213-2600(20)30167-3, lire en ligne, consulté le ).
- (en) Graziano Onder, Giovanni Rezza et Silvio Brusaferro, « Case-Fatality Rate and Characteristics of Patients Dying in Relation to COVID-19 in Italy », JAMA, (ISSN 0098-7484, DOI 10.1001/jama.2020.4683, lire en ligne, consulté le ).
- (en-US) CDCMMWR, « Preliminary Estimates of the Prevalence of Selected Underlying Health Conditions Among Patients with Coronavirus Disease 2019 — United States, February 12–March 28, 2020 », sur MMWR. Morbidity and Mortality Weekly Report, (ISSN 0149-2195, DOI 10.15585/mmwr.mm6913e2, consulté le ).
- Surveillances V (2020) The Epidemiological Characteristics of an Outbreak of 2019 Novel Coronavirus Diseases (COVID-19)—China, 2020. China CDC Weekly, 2(8), 113-122.
- (en) Yan Liu, Guofeng Liu, Hongjiang Wu et Weiyan Jian, « Sex differences in non-communicable disease prevalence in China: a cross-sectional analysis of the China Health and Retirement Longitudinal Study in 2011 », BMJ Open, vol. 7, no 12, , e017450 (ISSN 2044-6055 et 2044-6055, PMID 29247088, PMCID PMC5736028, DOI 10.1136/bmjopen-2017-017450, lire en ligne, consulté le ).
- Nan Su, Jiangtao Lin, Ping Chen et Jing Li, « Evaluation of asthma control and patient’s perception of asthma: findings and analysis of a nationwide questionnaire-based survey in China », Journal of Asthma, vol. 50, no 8, , p. 861–870 (ISSN 0277-0903, DOI 10.3109/02770903.2013.808346, lire en ligne, consulté le ).
- (en) Mutsuo Yamaya, Hidekazu Nishimura, Xue Deng et Mitsuru Sugawara, « Inhibitory effects of glycopyrronium, formoterol, and budesonide on coronavirus HCoV-229E replication and cytokine production by primary cultures of human nasal and tracheal epithelial cells », Respiratory Investigation, , S2212534520300058 (PMID 32094077, PMCID PMC7102607, DOI 10.1016/j.resinv.2019.12.005, lire en ligne, consulté le ).
- (en) Shutoku Matsuyama, Miyuki Kawase, Naganori Nao et Kazuya Shirato, « The inhaled corticosteroid ciclesonide blocks coronavirus RNA replication by targeting viral NSP15 », Microbiology, (DOI 10.1101/2020.03.11.987016, lire en ligne, consulté le ).
- Iwabuchi K, Yoshie K, Kurakami Y, Takahashi K, Kato Y & (2020) Morishima T COVID-19. Three cases improved with inhaled ciclesonide in the early to middle stages of pneumonia. Lire en ligne (en chinois)
- (en) Lauren J Stockman, Richard Bellamy et Paul Garner, « SARS: Systematic Review of Treatment Effects », PLoS Medicine, vol. 3, no 9, , e343 (ISSN 1549-1676, PMID 16968120, PMCID PMC1564166, DOI 10.1371/journal.pmed.0030343, lire en ligne, consulté le ).
- (en) on behalf of the Korean Society of Hypertension, Sungha Park, Hae Young Lee et Eun Joo Cho, « Is the use of RAS inhibitors safe in the current era of COVID-19 pandemic? », Clinical Hypertension, vol. 26, no 1, , p. 11 (ISSN 2056-5909, PMCID PMC7202902, DOI 10.1186/s40885-020-00144-0, lire en ligne, consulté le ).
- (en) Zeberg, H., Pääbo, S., The major genetic risk factor for severe COVID-19 is inherited from Neanderthals, Nature 587, p. 610–612 (2020). doi.org/10.1038/s41586-020-2818-3
- Hervé Morin, Covid-19 : un fragment d’ADN hérité de Néandertal favorise les formes graves de la maladie, lemonde.fr, 30 septembre 2020
- (en) The ancient Neanderthal in severe COVID-19, Science News, 30 septembre 2020
- (en) Ann Gibbons, Neanderthal gene found in many people may open cells to coronavirus and increase COVID-19 severity, sciencemag.org, 18 décembre 2020
- OMS, « Surveillance mondiale de l’infection humaine par le nouveau coronavirus (2019-nCoV) », sur who.int/fr/, (consulté le ).
- OMS, « Dépistage en laboratoire des cas suspects d’infection humaine par le nouveau coronavirus 2019 (2019-nCoV) », sur who.int/fr/, (consulté le ).
- (en) Elsevier, « Novel Coronavirus Information Center », sur Elsevier Connect (consulté le ).
- Ai T, Yang Z, Hou H, Zhan C, Chen C, et al. (2020) Correlation of chest CT and RT-PCR testing incoronavirus disease 2019 (COVID-19) in China: a report of 1014 cases. Radiology : 200642
- (en) Elaine Y P Lee, Ming-Yen Ng et Pek-Lan Khong, « COVID-19 pneumonia: what has CT taught us? », The Lancet Infectious Diseases, vol. 20, no 4, , p. 384–385 (PMID 32105641, PMCID PMC7128449, DOI 10.1016/S1473-3099(20)30134-1, lire en ligne, consulté le ).
- « Coronavirus : comment la France a développé son propre test pour détecter le virus », sur Franceinfo, (consulté le ).
- China National Health Commission. Diagnosis and treatment of 2019-nCoV pneumonia in China. In Chinese. Published February 8, 2020.
- (en) Victor M Corman, Olfert Landt, Marco Kaiser et Richard Molenkamp, « Detection of 2019 novel coronavirus (2019-nCoV) by real-time RT-PCR », Eurosurveillance, vol. 25, no 3, (ISSN 1560-7917, PMID 31992387, PMCID PMC6988269, DOI 10.2807/1560-7917.ES.2020.25.3.2000045, lire en ligne, consulté le ).
- « Coronavirus 2019 n-Cov », sur Ministère des Solidarités et de la Santé, .
- (en) Huanqin Han, Qingfeng Luo, Fan Mo et Lieming Long, « SARS-CoV-2 RNA more readily detected in induced sputum than in throat swabs of convalescent COVID-19 patients », The Lancet Infectious Diseases, , S1473309920301742 (DOI 10.1016/S1473-3099(20)30174-2, lire en ligne, consulté le ).
- (en) Wenling Wang, Yanli Xu, Ruqin Gao et Roujian Lu, « Detection of SARS-CoV-2 in Different Types of Clinical Specimens », JAMA, (ISSN 0098-7484, PMID 32159775, PMCID PMC7066521, DOI 10.1001/jama.2020.3786, lire en ligne, consulté le ).
- (en) Cong-Ying Song, Jia Xu, Jian-Qin He et Yuan-Qiang Lu, « COVID-19 early warning score : a multi-parameter screening tool to identify highly suspected patients (pré-publication) », MedRxiv, Infectious Diseases (except HIV/AIDS), 2020-03-08 (pré-publication) (DOI 10.1101/2020.03.05.20031906, lire en ligne, consulté le ).
- (en) Lauren M. Kucirka, MD, PhD, Stephen A. Lauer, PhD, Oliver Laeyendecker, PhD, MBA, Denali Boon, PhD, Justin Lessler, PhD, « Variation in False-Negative Rate of Reverse Transcriptase Polymerase Chain Reaction–Based SARS-CoV-2 Tests by Time Since Exposure », sur Annals of Internal Medicine, Annals of Internal Medicine, (consulté le ).
- Vingtcinq, « Variation in False-Negative Rate of Reverse Transcriptase... », sur Bibliovid (consulté le ).
- « Coronavirus : les formes graves de Covid-19 sont-elles liées à une forte charge virale ? Il est encore trop tôt pour l'affirmer », sur Franceinfo, (consulté le ).
- (en) Gavin M. Joynt et William KK Wu, « Understanding COVID-19: what does viral RNA load really mean? », The Lancet Infectious Diseases, vol. 0, no 0, (ISSN 1473-3099 et 1474-4457, DOI 10.1016/S1473-3099(20)30237-1, lire en ligne, consulté le ).
- (en) Xiaohua Chen, Binghong Zhao, Yueming Qu et Yurou Chen, « Detectable serum SARS-CoV-2 viral load (RNAaemia) is closely associated with drastically elevated interleukin 6 (IL-6) level in critically ill COVID-19 patients », medRxiv, , p. 2020.02.29.20029520 (DOI 10.1101/2020.02.29.20029520, lire en ligne, consulté le ).
- Chang L, Yan Y et Wang L (2020) Coronavirus Disease 2019: Coronaviruses and Blood Safety ; Transfus Med Rev. 21 février ; Epub 2020 Feb. 21 (résumé).
- (en) Xingwang Jia, Pengjun Zhang, Yaping Tian et Junli Wang, « Clinical significance of IgM and IgG test for diagnosis of highly suspected COVID-19 infection », medRxiv, , p. 2020.02.28.20029025 (DOI 10.1101/2020.02.28.20029025, lire en ligne, consulté le ).
- Antibody responses to SARS-CoV-2 in patients of novel coronavirus disease 2019 Juanjuan Zhao Jr., Quan Yuan, Haiyan Wang, Wei Liu, Xuejiao Liao, Yingying Su, Xin Wang, Jing Yuan, Tingdong Li, Jinxiu Li, Shen Qian, Congming Hong, Fuxiang Wang, Yingxia Liu, Zhaoqin Wang, Qing He, Zhiyong Li, Bin He, Tianying Zhang, Shengxiang Ge, Lei Liu, Jun Zhang, Ningshao Xia, Zheng ZhangDOI:10.1101/2020.03.02.20030189.
- « Premières indications pour les tests sérologiques du COVID-19 », sur Haute Autorité de Santé (consulté le ).
- « L’Institut Pasteur isole les souches du coronavirus 2019-nCoV détecté en France », sur Institut Pasteur, (consulté le ).
- (en) H. Rahman, I. Carter, K. Basile et L. Donovan, « Interpret with caution: an evaluation of the commercial AusDiagnostics versus in-house developed assays for the detection of SARS-CoV-2 virus », Journal of Clinical Virology, , p. 104374 (ISSN 1386-6532, DOI 10.1016/j.jcv.2020.104374, lire en ligne, consulté le ).
- (en) Jiang Gu, Encong Gong, Bo Zhang et Jie Zheng, « Multiple organ infection and the pathogenesis of SARS », Journal of Experimental Medicine, vol. 202, no 3, , p. 415–424 (ISSN 0022-1007, PMID 16043521, PMCID PMC2213088, DOI 10.1084/jem.20050828, lire en ligne, consulté le ).
- (en) Chu H., Zhou J., Wong B. H. et al., « Middle East respiratory syndrome coronavirus efficiently infects human primary T lymphocytes and activates the extrinsic and intrinsic apoptosis pathways. », The Journal of Infectious Diseases, no 213, , p. 904-914 (lire en ligne).
- (en) Xiaobo Yang, Yuan Yu, Jiqian Xu et Huaqing Shu, « Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study », The Lancet Respiratory Medicine, vol. 0, no 0, (ISSN 2213-2600 et 2213-2619, DOI 10.1016/S2213-2600(20)30079-5, lire en ligne, consulté le ).
- (en) Themoula Charalampous, Gemma L. Kay, Hollian Richardson et Alp Aydin, « Nanopore metagenomics enables rapid clinical diagnosis of bacterial lower respiratory infection », Nature Biotechnology, vol. 37, no 7, , p. 783–792 (ISSN 1087-0156 et 1546-1696, DOI 10.1038/s41587-019-0156-5, lire en ligne, consulté le ).
- (en) Michael J Cox, Nicholas Loman, Debby Bogaert et Justin O'Grady, « Co-infections: potentially lethal and unexplored in COVID-19 », The Lancet Microbe, , S2666524720300094 (DOI 10.1016/S2666-5247(20)30009-4, lire en ligne, consulté le ).
- (en) Matthieu Perreau et al., « The cytokines HGF and CXCL13 predict the severity and the mortality in COVID-19 patients », Pubmed, (lire en ligne, consulté le ) - DOI:10.1038/s41467-021-25191-5.
- (en) Jing Gong, Hui Dong, Song Qing Xia et Yi Zhao Huang, « Correlation Analysis Between Disease Severity and Inflammation-related Parameters in Patients with COVID-19 Pneumonia », medRxiv, , p. 2020.02.25.20025643 (DOI 10.1101/2020.02.25.20025643, lire en ligne, consulté le ).
- Tao Liu, Jieying Zhang, Yuhui Yang, Liling Zhang, Hong Ma, Zhengyu Li, Jiaoyue Zhang, Ji Cheng, Xiaoyu Zhang, Gang Wu, Jianhua Yi ; The potential role of IL-6 in monitoring coronavirus disease 2019. DOI:10.1101/2020.03.01.20029769 .
- (en) Lu Li, Shuang Li, Manman Xu et Sujun Zheng, « The level of plasma C-reactive protein is closely related to the liver injury in patients with COVID-19 », medRxiv, , p. 2020.02.28.20028514 (DOI 10.1101/2020.02.28.20028514, lire en ligne, consulté le ).
- Lymphopenia predicts disease severity of COVID-19: a descriptive and predictive study Li Tan, Qi Wang, Duanyang Zhang, Jinya Ding, Qianchuan Huang, Yi-Quan Tang, Qiongshu Wang, Hongming Miao medRxiv 2020.03.01.20029074; DOI:2020.03.01.20029074.
- (en) Dawei Wang, Bo Hu, Chang Hu et Fangfang Zhu, « Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel Coronavirus–Infected Pneumonia in Wuhan, China », JAMA, (ISSN 0098-7484, DOI 10.1001/jama.2020.1585, lire en ligne, consulté le ).
- (en-GB) Graham Readfearn, « Coronavirus: what happens to people's lungs when they get Covid-19? », The Guardian, (ISSN 0261-3077, lire en ligne, consulté le ).
- Feng Pan, Tianhe Ye, Peng Sun et Shan Gui, « Time Course of Lung Changes On Chest CT During Recovery From 2019 Novel Coronavirus (COVID-19) Pneumonia », Radiology, , p. 200370 (ISSN 0033-8419, DOI 10.1148/radiol.2020200370, lire en ligne, consulté le ).
- Bruno Benque (avec RSNA) : Coronavirus au scanner : des images différentes selon le stade d’évolution, article de Thema Radiologie ; vend 21 février 2020 d’après Adam Bernheim & al. (2020) ‘'Chest CT Findings in Coronavirus Disease-19 (COVID-19): Relationship to Duration of Infection ; RSNA Radiology ; mis en ligne le 02 février 2020 ; https://doi.org/10.1148/radiol.2020200463 (en).
- Chan JF, Yuan S, Kok KH et al. (2020) A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. Lancet ; 395 : 514–23.
- Shi H, Han X, Jiang N, et al. (2020) Radiological Findings from 81 patients with COVID-19 pneumonia in Wuhan, China: a descriptive study. Lancet Infect Dis; published online Feb 24. https://doi.org/10.1016/ S1473-3099(20)30086-4.
- Lee E.Y, Ng M.Y & Khong P.L (2020) COVID-19 pneumonia: what has CT taught us?. The Lancet Infectious Diseases.
- France TV, Coronavirus : une équipe de médecins du CHU de Besançon fait un lien entre covid-19 et embolie pulmonaire
- La Presse du Doubs, « CHU de Besançon : l'équipe du Pr Éric Delabrousse fait une découverte mondiale contre le Covid-19 ».
- (en) Nicole Lurie et Brendan G. Carr, « The Role of Telehealth in the Medical Response to Disasters », JAMA Internal Medicine, vol. 178, no 6, , p. 745 (ISSN 2168-6106, DOI 10.1001/jamainternmed.2018.1314, lire en ligne, consulté le ).
- (en) Judd E. Hollander et Brendan G. Carr, « Virtually Perfect? Telemedicine for Covid-19 », New England Journal of Medicine, , NEJMp2003539 (ISSN 0028-4793 et 1533-4406, DOI 10.1056/NEJMp2003539, lire en ligne, consulté le ).
- (en) Xiaolong Qi, Zicheng Jiang, Qian Yu et Chuxiao Shao, « Machine learning-based CT radiomics model for predicting hospital stay in patients with pneumonia associated with SARS-CoV-2 infection: A multicenter study », medRxiv, , p. 2020.02.29.20029603 (DOI 10.1101/2020.02.29.20029603, lire en ligne, consulté le ).
- « CoughVid », sur epfl.ch (consulté le ).
- « MaladieCoronavirus.fr », sur www.maladiecoronavirus.fr (consulté le ).
- « Bientôt des tests respiratoires pour diagnostiquer le coronavirus en moins d’une minute », sur Futura (consulté le ).
- Chiens de détection de la Covid-19 : des partenariats internationaux.
- (en) Licia Bordi, Emanuele Nicastri, Laura Scorzolini et Antonino Di Caro, « Differential diagnosis of illness in patients under investigation for the novel coronavirus (SARS-CoV-2), Italy, February 2020 », Eurosurveillance, vol. 25, no 8, , p. 2000170 (ISSN 1560-7917, DOI 10.2807/1560-7917.ES.2020.25.8.2000170, lire en ligne, consulté le ).
- « Maladie à coronavirus 2019 (COVID-19) : questions-réponses », OMS (consulté le ).
- Aude Lecrubier, « COVID-19 : les chiens renifleurs bientôt aux côtés des autres tests de dépistage », Mesdscape, 2 juin 2021.
- Autopsy in suspected COVID-19 cases, Hanley B et al, J Clin Pathol, .
- A pathological report of three COVID-19 cases by minimally invasive autopsies, Yao XH et al., .
- .
- (en) Brian Hanley, Sebastian B Lucas, Esther Youd et Benjamin Swift, « Autopsy in suspected COVID-19 cases », Journal of Clinical Pathology, vol. 73, no 5, , p. 239–242 (ISSN 0021-9746 et 1472-4146, DOI 10.1136/jclinpath-2020-206522, lire en ligne, consulté le ).
- « Maladie à coronavirus 2019 (COVID-19) : questions-réponses », sur OMS (consulté le ).
- (en) « Rapid Rollout of COVID Vaccines for ‘Everyone, Everywhere’ Critical to Blocking Further Resistant Strains, Secretary-General Tells International Forum - World », sur ReliefWeb (consulté le )
- WHO SAGE working group, « WHO SAGE Roadmap for prioritizing the use of COVID-19 vaccines in the context of limited supply », WHO Bulletin, (lire en ligne)
- Siri R. Kadire, Robert M. Wachter et Nicole Lurie, « Delayed Second Dose versus Standard Regimen for Covid-19 Vaccination », New England Journal of Medicine, vol. 384, no 9, , e28 (ISSN 0028-4793, DOI 10.1056/NEJMclde2101987, lire en ligne, consulté le )
- Kathleen Dooling, « An Additional Dose of mRNA COVID-19 Vaccine Following a Primary Series in Immunocompromised People. », CDC Advisory Board for Immunization Practices, (lire en ligne)
- (en) Patrick Hunziker, « Personalized-dose Covid-19 vaccination in a wave of virus Variants of Concern: Trading individual efficacy for societal benefit », Precision Nanomedicine, vol. 4, no 3, , p. 805–820 (DOI 10.33218/001c.26101, lire en ligne, consulté le )
- (en) Susie Neilson, « The co-founder of BioNTech designed the coronavirus vaccine it made with Pfizer in just a few hours over a single day », sur Business Insider France, (consulté le ).
- (en) Podcast, « The Creator of the Record-Setting Covid Vaccine », sur The Journal, (consulté le ).
- Nicolas Martin, « Peut-on vraiment espérer un vaccin ? », sur France Culture (consulté le ).
- (en) Ewen Callaway, « The race for coronavirus vaccines: a graphical guide », Nature, vol. 580, , p. 576–577 (DOI 10.1038/d41586-020-01221-y, lire en ligne, consulté le ).
- « Draft landscape of COVID-19 candidate vaccines ».
- David Culver et Ben Westcott, « People are traveling across China in the hopes of getting an experimental Covid-19 vaccine shot », CNN, .
- « Covid-19 : un vaccin « efficace à 90 % », selon des résultats préliminaires », Le Point, (lire en ligne).
- « Covid-19 : Moderna annonce que son candidat-vaccin est efficace à 94,5 % », Le Monde.fr, (lire en ligne, consulté le ).
- Cécile Ducourtieux, « Le Royaume-Uni devient le premier pays au monde à autoriser le vaccin Pfizer-BioNTech », Le Monde, (lire en ligne).
- Alexandre Counis, « Le Royaume-Uni met en scène sa vaste campagne de vaccination anti-Covid », Les Échos, (lire en ligne)
- « Covid-19 dans le monde : les États-Unis déplorent plus de 300 000 morts », Le Monde, (lire en ligne).
- « Covid-19 : Le vaccin de Pfizer et BioNTech autorisé aux États-Unis et en attente en Europe », Industrie pharma, (lire en ligne, consulté le ).
- « Coronavirus : l'Europe table sur le 23 décembre pour l'homologation du vaccin de Pfizer », sur lindependant.fr (consulté le ).
- « Moderna commence l'étude du vaccin Covid chez les enfants. ».
- Par Florence Méréo Le 19 janvier 2021 à 17h41 et Modifié le 19 janvier 2021 À 20h39, « Covid-19 : Mauricette, la première vaccinée de France, a reçu sa seconde injection », sur leparisien.fr, (consulté le ).
- Céline Deluzarche, « Pourquoi un taux de vaccination élevé peut paradoxalement favoriser l'émergence de variants résistants ? », sur Futura-sciences, (consulté le ).
- DOI:10.1038/s41598-021-95025-3.
- Kári Stefánsson rdy généticien, et PDG de DeCODE Genetics, basé à Reykjavik
- (en) Ewen Callaway, Heidi Ledford et Smriti Mallapaty, « Six months of coronavirus: the mysteries scientists are still racing to solve », Nature, vol. 583, no 7815, , p. 178–179 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/d41586-020-01989-z, lire en ligne, consulté le ).
- (en) Jiao Zhao, Yan Yang, Han-Ping Huang et Dong Li, « Relationship between the ABO Blood Group and the COVID-19 Susceptibility », medRxiv, , p. 2020.03.11.20031096 (DOI 10.1101/2020.03.11.20031096, lire en ligne, consulté le ).
- (en) Patrice Guillon, Monique Clément, Véronique Sébille, Jean-Gérard Rivain, Chih-Fong Chou, Nathalie Ruvoën-Clouet, Jacques Le Pendu, « https://doi.org/10.1093/glycob/cwn093 », Oxford Academic, (lire en ligne).
- France Inter, « Groupe sanguin et coronavirus, un hasard génétique », sur franceinter.fr, Radio publique, (consulté le ).
- INSERM, « Un quart des formes sévères de Covid-19 s’expliquent par une anomalie génétique ou immunologique », sur Salle de presse INSERM, (consulté le ).
- Qian Zhang et al., Inborn errors of type I IFN immunity in patients with life-threatening COVID-19, 2020.DOI:10.1126/science.abd4570.
- (en) Takaki Asano et al., « X-linked recessive TLR7 deficiency in ~1% of men under 60 years old with life-threatening COVID-19 », Science Immunology, (DOI 10.1126/sciimmunol.abl4348, lire en ligne, consulté le ).
- Paul Bastard et al., Auto-antibodies against type I IFNs in patients with life-threatening COVID-19, 2020. DOI:10.1126/science.abd4585
- (en) Paul Bastard et al., « Autoantibodies neutralizing type I IFNs are present in ~4% of uninfected individuals over 70 years old and account for ~20% of COVID-19 deaths », Science Immunology, (DOI 10.1126/sciimmunol.abl4340, lire en ligne, consulté le ).
- (en) Eric Y. Wang, Tianyang Mao, Jon Klein et Yile Dai, « Diverse Functional Autoantibodies in Patients with COVID-19 », Medrxiv, Infectious Diseases (except HIV/AIDS), (DOI 10.1101/2020.12.10.20247205, lire en ligne, consulté le ).
- (en-GB) Ian Sample, « 'Autoantibodies' may be driving severe Covid cases, study shows », The Guardian, (ISSN 0261-3077, lire en ligne, consulté le ) (Étude produite à partir de 194 malades et employés d'hôpitaux touchés à des degrés divers par le virus. Les auteurs ont recherche des autoanticorps ciblant près de 3 000 protéines humaines grâce à une technique de screening d'autoanticorps à haut débit, dénommée Rapid Extracellular Antigen Profiling ou REAP).
- (en) Roxanne Khamsi, « Rogue antibodies could be driving severe COVID-19 », sur nature.com, (consulté le ).
- (en) Hannah Peckham, Nina M. de Gruijter, Charles Raine et Anna Radziszewska, « Male sex identified by global COVID-19 meta-analysis as a risk factor for death and ITU admission », Nature Communications, vol. 11, no 1, , p. 6317 (ISSN 2041-1723, DOI 10.1038/s41467-020-19741-6, lire en ligne, consulté le ).
- (en) Eileen P. Scully, Jenna Haverfield, Rebecca L. Ursin et Cara Tannenbaum, « Considering how biological sex impacts immune responses and COVID-19 outcomes », Nature Reviews Immunology, vol. 20, no 7, , p. 442–447 (ISSN 1474-1733 et 1474-1741, PMID 32528136, PMCID PMC7288618, DOI 10.1038/s41577-020-0348-8, lire en ligne, consulté le ).
- (en) Safiya Richardson, Jamie S. Hirsch, Mangala Narasimhan et James M. Crawford, « Presenting Characteristics, Comorbidities, and Outcomes Among 5700 Patients Hospitalized With COVID-19 in the New York City Area », JAMA, vol. 323, no 20, , p. 2052 (ISSN 0098-7484, DOI 10.1001/jama.2020.6775, lire en ligne, consulté le ).
- (en) Shailendra Singh, Monica Chowdhry, Arka Chatterjee et Ahmad Khan, « Gender-Based Disparities in COVID-19 Patient Outcomes: A Propensity-matched Analysis », Medrxiv, Infectious Diseases (except HIV/AIDS), (DOI 10.1101/2020.04.24.20079046, lire en ligne, consulté le ).
- (en) Kristian Kragholm, Mikkel Porsborg Andersen, Thomas A Gerds et Jawad H Butt, « Association Between Male Sex and Outcomes of Coronavirus Disease 2019 (COVID-19)—A Danish Nationwide, Register-based Study », Clinical Infectious Diseases, , ciaa924 (ISSN 1058-4838 et 1537-6591, PMID 32634827, PMCID PMC7454435, DOI 10.1093/cid/ciaa924, lire en ligne, consulté le ).
- Jin, J.-M. et al. (2020) Gender Differences in Patients With COVID-19: Focus on Severity and Mortality. Front. Public Heal. 8, 152
- (en) Maha Abdullah, Pei-Shin Chai, Mun-Yee Chong et Eusni Rahayu Mohd Tohit, « Gender effect on in vitro lymphocyte subset levels of healthy individuals », Cellular Immunology, vol. 272, no 2, , p. 214–219 (DOI 10.1016/j.cellimm.2011.10.009, lire en ligne, consulté le ).
- (en) Bee-Wah Lee, Hui-Kim Yap, Fook-Tim Chew et Thuan-Chong Quah, « Age- and sex-related changes in lymphocyte subpopulations of healthy Asian subjects: From birth to adulthood », Cytometry, vol. 26, no 1, , p. 8–15 (ISSN 1097-0320, DOI 10.1002/(SICI)1097-0320(19960315)26:13.0.CO;2-E, lire en ligne, consulté le ).
- (en) Ida Maria Lisse, Peter Aaby, Hilton Whittle et Henrik Jensen, « T-lymphocyte subsets in West African children: Impact of age, sex, and season », The Journal of Pediatrics, vol. 130, no 1, , p. 77–85 (DOI 10.1016/S0022-3476(97)70313-5, lire en ligne, consulté le ).
- Delmas, M. C. et al. (1997). Gender difference in CD4+cell counts persist after HIV-1 infection. SEROCO Study Group. AIDS 11, 1071–1073
- (en) Masahiko Mori, Emily Adland, Paolo Paioni et Alice Swordy, « Sex Differences in Antiretroviral Therapy Initiation in Pediatric HIV Infection », PLOS ONE, vol. 10, no 7, , e0131591 (ISSN 1932-6203, PMID 26151555, PMCID PMC4494714, DOI 10.1371/journal.pone.0131591, lire en ligne, consulté le ).
- (en) A Hewagama, D Patel, S Yarlagadda et F M Strickland, « Stronger inflammatory/cytotoxic T-cell response in women identified by microarray analysis », Genes & Immunity, vol. 10, no 5, , p. 509–516 (ISSN 1466-4879 et 1476-5470, PMID 19279650, PMCID PMC2735332, DOI 10.1038/gene.2009.12, lire en ligne, consulté le ).
- G. Stoica, E. Macarie, V. Michiu et R. C. Stoica, « Biologic variation of human immunoglobulin concentration. I. Sex-age specific effects on serum levels of IgG, IgA, IgM and IgD », Medecine Interne, vol. 18, no 3, , p. 323–332 (ISSN 0377-1202, PMID 7414242, lire en ligne, consulté le ).
- (en) Katie L. Flanagan, Ashley L. Fink, Magdalena Plebanski et Sabra L. Klein, « Sex and Gender Differences in the Outcomes of Vaccination over the Life Course », Annual Review of Cell and Developmental Biology, vol. 33, no 1, , p. 577–599 (ISSN 1081-0706 et 1530-8995, DOI 10.1146/annurev-cellbio-100616-060718, lire en ligne, consulté le ).
- (en) S. L. Klein, I. Marriott et E. N. Fish, « Sex-based differences in immune function and responses to vaccination », Transactions of the Royal Society of Tropical Medicine and Hygiene, vol. 109, no 1, , p. 9–15 (ISSN 0035-9203 et 1878-3503, PMID 25573105, PMCID PMC4447843, DOI 10.1093/trstmh/tru167, lire en ligne, consulté le ).
- (en) Renata J. M. Engler, « Half- vs Full-Dose Trivalent Inactivated Influenza Vaccine (2004-2005): Age, Dose, and Sex Effects on Immune Responses », Archives of Internal Medicine, vol. 168, no 22, , p. 2405 (ISSN 0003-9926, DOI 10.1001/archinternmed.2008.513, lire en ligne, consulté le ).
- (en) D. Furman, B. P. Hejblum, N. Simon et V. Jojic, « Systems analysis of sex differences reveals an immunosuppressive role for testosterone in the response to influenza vaccination », Proceedings of the National Academy of Sciences, vol. 111, no 2, , p. 869–874 (ISSN 0027-8424 et 1091-6490, PMID 24367114, PMCID PMC3896147, DOI 10.1073/pnas.1321060111, lire en ligne, consulté le ).
- Berghöfer, B. et al. TLR7 Ligands Induce Higher IFN-α Production in Females. J. Immunol. 177, 2088–2096 (2006).
- (en) Sophie Laffont, Nelly Rouquié, Pascal Azar et Cyril Seillet, « X-Chromosome Complement and Estrogen Receptor Signaling Independently Contribute to the Enhanced TLR7-Mediated IFN-α Production of Plasmacytoid Dendritic Cells from Women », The Journal of Immunology, vol. 193, no 11, , p. 5444–5452 (ISSN 0022-1767 et 1550-6606, DOI 10.4049/jimmunol.1303400, lire en ligne, consulté le ).
- (en) Cyril Seillet, Sophie Laffont, Florence Trémollières et Nelly Rouquié, « The TLR-mediated response of plasmacytoid dendritic cells is positively regulated by estradiol in vivo through cell-intrinsic estrogen receptor α signaling », Blood, vol. 119, no 2, , p. 454–464 (ISSN 0006-4971 et 1528-0020, DOI 10.1182/blood-2011-08-371831, lire en ligne, consulté le ).
- Webb, K. et al. Sex and pubertal differences in the type 1 interferon pathway associate with both X chromosome number and serum sex hormone concentration. Front. Immunol. 10, 3167 (2019)
- Susanne Maria Ziegler et Marcus Altfeld, « Human Immunodeficiency Virus 1 and Type I Interferons—Where Sex Makes a Difference », Frontiers in Immunology, vol. 8, , p. 1224 (ISSN 1664-3224, PMID 29033943, PMCID PMC5625005, DOI 10.3389/fimmu.2017.01224, lire en ligne, consulté le ).
- (en) Susanne M. Ziegler, Claudia Beisel, Kathrin Sutter et Morgane Griesbeck, « Human pDCs display sex-specific differences in type I interferon subtypes and interferon α/β receptor expression », European Journal of Immunology, vol. 47, no 2, , p. 251–256 (DOI 10.1002/eji.201646725, lire en ligne, consulté le ).
- (en) Angela Meier, J Judy Chang, Ellen S Chan et Richard B Pollard, « Sex differences in the Toll-like receptor–mediated response of plasmacytoid dendritic cells to HIV-1 », Nature Medicine, vol. 15, no 8, , p. 955–959 (ISSN 1078-8956 et 1546-170X, PMID 19597505, PMCID PMC2821111, DOI 10.1038/nm.2004, lire en ligne, consulté le ).
- Les hormones sexuelles féminines pourraient protéger contre les formes graves de Covid-19, La Provence
- Graziano Pinna, Sex and COVID-19: A Protective Role for Reproductive Steroids, 2020. DOI:10.1016/j.tem.2020.11.004.
- Voigt E.A et al. (2019) Sex differences in older adults’ immune responses to seasonal influenza vaccination. Front. Immunol. 10, 180
- INSERM — Rôle possible de l’exposition aux perturbateurs endocriniens dans la sévérité de la Covid-19
- Les carences en vitamine D augmentent-elles le risque de gravité du Covid-19 ?
- Vitamin D Status in Hospitalized Patients with SARS-CoV-2 Infection, 2020. DOI:10.1210/clinem/dgaa733.
- Jeffrey E. Gold, Analysis of Measles-Mumps-Rubella (MMR) Titers of Recovered COVID-19 Patients, 2020. DOI:10.1128/mBio.02628-20.
- « Le vaccin contre les oreillons protégerait de la Covid-19 », sur Futura (consulté le ).
- Covid-19 : ce qu'il faut savoir quand on est enceinte en période de pandémie, France Info.
- Covid-19 : à l'hôpital de Saint-Denis, l'inquiétude autour des femmes enceintes contaminées, France Info.
- Wong SF, Chow KM, Leung TN, et al. Pregnancy and perinatal outcomes of women with severe acute respiratory syndrome. Am J Obstet Gynecol 2004; 191: 292–97.
- Lam CM, Wong SF, Leung TN, et al. A case-controlled study comparing clinical course and outcomes of pregnant and non-pregnant women with severe acute respiratory syndrome. BJOG 2004; 111: 771–74.
- Zhu H, Wang L, Fang C, et al. (2020) Clinical analysis of 10 neonates born to mothers with 2019‐nCoV pneumonia. Transl Pediatr.; 9: 51‐ 60.
- Isabelle Von Kohorn, Sydney R Stein, Beatrix T Shikani et Marcos J Ramos-Benitez, « In Utero SARS-CoV-2 Infection », Journal of the Pediatric Infectious Diseases Society, (ISSN 2048-7193, PMID 33089311, PMCID 7665603, DOI 10.1093/jpids/piaa127, lire en ligne, consulté le ).
- Asma Khalil, Erkan Kalafat, Can Benlioglu et Pat O'Brien, « SARS-CoV-2 infection in pregnancy: A systematic review and meta-analysis of clinical features and pregnancy outcomes », EClinicalMedicine, vol. 25, , p. 100446 (ISSN 2589-5370, PMID 32838230, PMCID 7334039, DOI 10.1016/j.eclinm.2020.100446, lire en ligne, consulté le ).
- (en) Huijun Chen, « Clinical characteristics and intrauterine vertical transmission potential of COVID-19 infection in nine pregnant women: a retrospective review of medical records », Lancet, (consulté le ).
- Maternal and neonatal outcomes of pregnant women with COVID-19 pneumonia: a case-control study Na Li, View ORCID ProfileLefei Han, Min Peng, Yuxia Lv, Yin Ouyang, Kui Liu, Linli Yue, Qiannan Li, Guoqiang Sun, Lin Chen, Lin Yang DOI:2020.03.10.20033605.
- (en) Kimberly A. Lackey, Ryan M. Pace, Janet E. Williams et Lars Bode, « SARS-CoV-2 and human milk: what is the evidence? », medRxiv, , p. 2020.04.07.20056812 (DOI 10.1101/2020.04.07.20056812, lire en ligne, consulté le ).
- Corwin A. Robertson, Sara A. Lowther, Thomas Birch et Christina Tan, « SARS and Pregnancy: A Case Report », Emerging Infectious Diseases, vol. 10, no 2, , p. 345–348 (ISSN 1080-6040 et 1080-6059, PMID 15030710, PMCID PMC3322896, DOI 10.3201/eid1002.030736, lire en ligne, consulté le ).
- (en) Elizabeth Centeno‐Tablante, Melisa Medina‐Rivera, Julia L. Finkelstein et Pura Rayco‐Solon, « Transmission of SARS‐CoV‐2 through breast milk and breastfeeding: a living systematic review », Annals of the New York Academy of Sciences, , nyas.14477 (ISSN 0077-8923 et 1749-6632, DOI 10.1111/nyas.14477, lire en ligne, consulté le ).
- (en) Christina Chambers, Paul Krogstad, Kerri Bertrand et Deisy Contreras, « Evaluation for SARS-CoV-2 in Breast Milk From 18 Infected Women », JAMA, vol. 324, no 13, , p. 1347 (ISSN 0098-7484, PMID 32822495, PMCID PMC7439212, DOI 10.1001/jama.2020.15580, lire en ligne, consulté le ).
- (en) Rüdiger Groß, Carina Conzelmann, Janis A Müller et Steffen Stenger, « Detection of SARS-CoV-2 in human breastmilk », The Lancet, vol. 395, no 10239, , p. 1757–1758 (PMID 32446324, PMCID PMC7241971, DOI 10.1016/S0140-6736(20)31181-8, lire en ligne, consulté le ).
- (en) Yanting Wu, Chen Liu, Lan Dong et Chenjie Zhang, « Viral Shedding of COVID-19 in Pregnant Women », SSRN Electronic Journal, (ISSN 1556-5068, DOI 10.2139/ssrn.3562059, lire en ligne, consulté le ).
- (en) Alisa Fox, Jessica Marino, Fatima Amanat et Florian Krammer, « Robust and Specific Secretory IgA Against SARS-CoV-2 Detected in Human Milk », iScience, vol. 23, no 11, , p. 101735 (PMID 33134887, PMCID PMC7586930, DOI 10.1016/j.isci.2020.101735, lire en ligne, consulté le ).
- (en) Veronique Demers-Mathieu, Dung M. Do, Gabrielle B. Mathijssen et David A. Sela, « Difference in levels of SARS-CoV-2 S1 and S2 subunits- and nucleocapsid protein-reactive SIgM/IgM, IgG and SIgA/IgA antibodies in human milk », Journal of Perinatology, (ISSN 0743-8346 et 1476-5543, PMID 32873904, PMCID PMC7461757, DOI 10.1038/s41372-020-00805-w, lire en ligne, consulté le ).
- (en) Per Brandtzaeg, « The Mucosal Immune System and Its Integration with the Mammary Glands », The Journal of Pediatrics, vol. 156, no 2, , S8–S15 (DOI 10.1016/j.jpeds.2009.11.014, lire en ligne, consulté le ).
- (en) Lingkong Zeng, Shiwen Xia, Wenhao Yuan et Kai Yan, « Neonatal Early-Onset Infection With SARS-CoV-2 in 33 Neonates Born to Mothers With COVID-19 in Wuhan, China », JAMA Pediatrics, (ISSN 2168-6203, DOI 10.1001/jamapediatrics.2020.0878, lire en ligne, consulté le ).
- (en) Chris Gale, Maria A. Quigley, Anna Placzek et Marian Knight, « Characteristics and outcomes of neonatal SARS-CoV-2 infection in the UK: a prospective national cohort study using active surveillance », The Lancet Child & Adolescent Health, vol. 5, no 2, , p. 113–121 (ISSN 2352-4642 et 2352-4650, PMID 33181124, DOI 10.1016/S2352-4642(20)30342-4, lire en ligne, consulté le ).
- China National Health Commission. Diagnosis and treatment of 2019-nCoV pneumonia in China. In Chinese. Published February 8, 2020. Accessed February 19, 2020http://www.nhc.gov.cn/yzygj/s7653p/202002/d4b895337e19445f8d728fcaf1e3e13a.shtml.
- Avis relatif aux critères cliniques de sortie d’isolement des patients ayant été infectés par le SARS-CoV-2 HCSP, 16 mars 2020
- « Coronavirus : « aucune preuve » d'une immunité des anciens malades, dit l'OMS », sur Les Echos, (consulté le ).
- « Immunity to Covid-19 could be lost in months, UK study suggests », The Guardian, (lire en ligne, consulté le ).
- Covid-19. Les anciens malades immunisés « pendant plusieurs années », selon une étude https://www.ouest-france.fr/sante/virus/coronavirus/covid-19-l-immunite-des-personnes-contaminees-pourrait-etre-durable-selon-une-etude-7057181
- (en) « South Korea reports recovered coronavirus patients testing positive again », Reuters, (lire en ligne, consulté le ).
- (en-US) Apoorva Mandavilli, « They Recovered From the Coronavirus. Were They Infected Again? », The New York Times, (ISSN 0362-4331, lire en ligne, consulté le ).
- Li-Ping Wu, Nai-Chang Wang, Yi-Hua Chang et Xiang-Yi Tian, « Duration of Antibody Responses after Severe Acute Respiratory Syndrome », Emerging Infectious Diseases, vol. 13, no 10, , p. 1562–1564 (ISSN 1080-6040 et 1080-6059, PMID 18258008, PMCID PMC2851497, DOI 10.3201/eid1310.070576, lire en ligne, consulté le ).
- (en) Xiaoqin Guo, Zhongmin Guo, Chaohui Duan et Zeliang chen, « Long-Term Persistence of IgG Antibodies in SARS-CoV Infected Healthcare Workers (pré-print, non encore relue par des pairs, étude rétrospective basée sur un panel de 34 soignants infectés par le SARS 17 ans plus tôt, dont 20 ont été suivis de 2003 à 2015 pour leur taux d'anticorps anti-SARS-CoV-1 dans leur sérum) », MedRxiv, Infectious Diseases (except HIV/AIDS), (DOI 10.1101/2020.02.12.20021386, résumé, lire en ligne, consulté le ).
- « Peut-on attraper une seconde fois la COVID-19? », La Presse, (lire en ligne, consulté le ).
- (en) « "Immunity passports" in the context of COVID-19 », sur www.who.int (consulté le ).
- Camille Gaubert, « Covid-19 : un nouvel anticorps issu de sang de patients guéris cible une partie inattendue du virus », sur sciencesetavenir.fr, (consulté le ).
- (en) Heidi Ledford, « Coronavirus reinfections: three questions scientists are asking », Nature, vol. 585, no 7824, , p. 168–169 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/d41586-020-02506-y, lire en ligne, consulté le ).
- Comme pour le second cas, les différences de génomes des SARS-CoV-2 en cause prouvaient qu'il s'agissait bien d'une vraie réinfection ; voir : (en) Kelvin Kai-Wang To, Ivan Fan-Ngai Hung, Jonathan Daniel Ip et Allen Wing-Ho Chu, « COVID-19 re-infection by a phylogenetically distinct SARS-coronavirus-2 strain confirmed by whole genome sequencing », Clinical Infectious Diseases, , ciaa1275 (ISSN 1058-4838 et 1537-6591, DOI 10.1093/cid/ciaa1275, lire en ligne, consulté le ).
- (en) Sylvia E. Reed, « The behaviour of recent isolates of human respiratory coronavirus in vitro and in volunteers: Evidence of heterogeneity among 229E-related strains », Journal of Medical Virology, vol. 13, no 2, , p. 179–192 (ISSN 1096-9071, DOI 10.1002/jmv.1890130208, lire en ligne, consulté le ).
- (en) K. A. Callow, H. F. Parry, M. Sergeant et D. A. J. Tyrrell, « The time course of the immune response to experimental coronavirus infection of man », Epidemiology and Infection, vol. 105, no 2, , p. 435–446 (ISSN 0950-2688 et 1469-4409, PMID 2170159, PMCID PMC2271881, DOI 10.1017/S0950268800048019, lire en ligne, consulté le ).
- Ip M, Chan PK, Lee N, et al. (2004) Seroprevalence of antibody to severe acute respiratory syndrome (SARS)-associated coronavirus among health care workers in SARS and non-SARS medical wards. Clin Infect Dis 2004;38:e116-8.
- (en) Hongying Mo, Guangqiao Zeng, Xiaolan Ren et Hui Li, « Longitudinal profile of antibodies against SARS-coronavirus in SARS patients and their clinical significance », Respirology, vol. 11, no 1, , p. 49–53 (ISSN 1440-1843, DOI 10.1111/j.1440-1843.2006.00783.x, lire en ligne, consulté le ).
- Daniel C. Payne, Ibrahim Iblan, Brian Rha et Sultan Alqasrawi, « Persistence of Antibodies against Middle East Respiratory Syndrome Coronavirus », Emerging Infectious Diseases, vol. 22, no 10, , p. 1824–1826 (ISSN 1080-6040 et 1080-6059, PMID 27332149, PMCID PMC5038413, DOI 10.3201/eid2210.160706, lire en ligne, consulté le ).
- (en) Alba Grifoni, Daniela Weiskopf, Sydney I. Ramirez et Jose Mateus, « Targets of T Cell Responses to SARS-CoV-2 Coronavirus in Humans with COVID-19 Disease and Unexposed Individuals », Cell, vol. 181, no 7, , p. 1489–1501.e15 (PMID 32473127, PMCID PMC7237901, DOI 10.1016/j.cell.2020.05.015, lire en ligne, consulté le ).
- (en) Ling Ni, Fang Ye, Meng-Li Cheng et Yu Feng, « Detection of SARS-CoV-2-Specific Humoral and Cellular Immunity in COVID-19 Convalescent Individuals », Immunity, vol. 52, no 6, , p. 971–977.e3 (PMID 32413330, PMCID PMC7196424, DOI 10.1016/j.immuni.2020.04.023, lire en ligne, consulté le ).
- (en) K. A. Callow, H. F. Parry, M. Sergeant et D. A. J. Tyrrell, « The time course of the immune response to experimental coronavirus infection of man », Epidemiology and Infection, vol. 105, no 2, , p. 435–446 (ISSN 0950-2688 et 1469-4409, PMID 2170159, PMCID PMC2271881, DOI 10.1017/S0950268800048019, lire en ligne, consulté le ).
- (en) Paola Alberti, Simone Beretta, Marco Piatti et Aristotelis Karantzoulis, « Guillain-Barré syndrome related to COVID-19 infection », Neurology - Neuroimmunology Neuroinflammation, vol. 7, no 4, , e741 (ISSN 2332-7812, PMID 32350026, PMCID PMC7217652, DOI 10.1212/NXI.0000000000000741, lire en ligne, consulté le ).
- (en) Consuelo Gutiérrez-Ortiz, Antonio Méndez-Guerrero, Sara Rodrigo-Rey et Eduardo San Pedro-Murillo, « Miller Fisher syndrome and polyneuritis cranialis in COVID-19 », Neurology, vol. 95, no 5, , e601–e605 (ISSN 0028-3878 et 1526-632X, DOI 10.1212/WNL.0000000000009619, lire en ligne, consulté le ).
- (en) Neo Poyiadji, Gassan Shahin, Daniel Noujaim et Michael Stone, « COVID-19–associated Acute Hemorrhagic Necrotizing Encephalopathy: Imaging Features », Radiology, vol. 296, no 2, , E119–E120 (ISSN 0033-8419 et 1527-1315, PMID 32228363, PMCID PMC7233386, DOI 10.1148/radiol.2020201187, lire en ligne, consulté le ).
- (en) Timothy Parsons, Sarah Banks, Chay Bae et Joel Gelber, « COVID-19-associated acute disseminated encephalomyelitis (ADEM) », Journal of Neurology, (ISSN 0340-5354 et 1432-1459, PMID 32474657, PMCID PMC7260459, DOI 10.1007/s00415-020-09951-9, lire en ligne, consulté le ).
- (en) Domenico A. Restivo, Diego Centonze, Alessandro Alesina et Rosario Marchese-Ragona, « Myasthenia Gravis Associated With SARS-CoV-2 Infection », Annals of Internal Medicine, , p. L20–0845 (ISSN 0003-4819 et 1539-3704, PMID 32776781, PMCID PMC7429993, DOI 10.7326/L20-0845, lire en ligne, consulté le ).
- (en) Carlos Manuel Romero-Sánchez, Inmaculada Díaz-Maroto, Eva Fernández-Díaz et Álvaro Sánchez-Larsen, « Neurologic manifestations in hospitalized patients with COVID-19: The ALBACOVID registry », Neurology, vol. 95, no 8, , e1060–e1070 (ISSN 0028-3878 et 1526-632X, DOI 10.1212/WNL.0000000000009937, lire en ligne, consulté le ).
- (en) R. Ross Reichard, Kianoush B. Kashani, Nicholas A. Boire et Eleni Constantopoulos, « Neuropathology of COVID-19: a spectrum of vascular and acute disseminated encephalomyelitis (ADEM)-like pathology », Acta Neuropathologica, vol. 140, no 1, , p. 1–6 (ISSN 0001-6322 et 1432-0533, PMID 32449057, PMCID PMC7245994, DOI 10.1007/s00401-020-02166-2, lire en ligne, consulté le ).
- (en) Ross W Paterson, Rachel L Brown, Laura Benjamin et Ross Nortley, « The emerging spectrum of COVID-19 neurology: clinical, radiological and laboratory findings », Brain, , awaa240 (ISSN 0006-8950 et 1460-2156, PMID 32637987, PMCID PMC7454352, DOI 10.1093/brain/awaa240, lire en ligne, consulté le ).
- (en) Lucía Llorente Ayuso, Pedro Torres Rubio, Rafael Fernando Beijinho do Rosário et María Luisa Giganto Arroyo, « Bickerstaff encephalitis after COVID-19 », Journal of Neurology, (ISSN 0340-5354 et 1432-1459, PMID 32880723, PMCID PMC7471525, DOI 10.1007/s00415-020-10201-1, lire en ligne, consulté le ).
- (en) « Survivors of Covid-19 show increased rate of psychiatric disorders, study finds », sur The Guardian, (consulté le ).
- "Reverse-transcribed SARS-CoV-2 RNA can integrate into the genome of cultured human cells and can be expressed in patient-derived tissues", https://www.pnas.org/content/118/21/e2105968118
- Anna Le Tortorec, Giulia Matusali, Dominique Mahé et Florence Aubry, « From Ancient to Emerging Infections: The Odyssey of Viruses in the Male Genital Tract », Physiological Reviews, (ISSN 1522-1210, PMID 32031468, DOI 10.1152/physrev.00021.2019, lire en ligne, consulté le ).
- Giulia Matusali, Laurent Houzet, Anne-Pascale Satie et Dominique Mahé, « Zika virus infects human testicular tissue and germ cells », The Journal of Clinical Investigation, vol. 128, no 10, 10 01, 2018, p. 4697–4710 (ISSN 1558-8238, PMID 30063220, PMCID 6159993, DOI 10.1172/JCI121735, lire en ligne, consulté le ).
- Vanessa Roulet, Anne-Pascale Satie, Annick Ruffault et Anna Le Tortorec, « Susceptibility of human testis to human immunodeficiency virus-1 infection in situ and in vitro », The American Journal of Pathology, vol. 169, no 6, , p. 2094–2103 (ISSN 0002-9440, PMID 17148672, PMCID 1762481, DOI 10.2353/ajpath.2006.060191, lire en ligne, consulté le ).
- Anna Le Tortorec, Roger Le Grand, Hélène Denis et Anne-Pascale Satie, « Infection of semen-producing organs by SIV during the acute and chronic stages of the disease », PloS One, vol. 3, no 3, , e1792 (ISSN 1932-6203, PMID 18347738, PMCID 2268241, DOI 10.1371/journal.pone.0001792, lire en ligne, consulté le ).
- (en) Aditi Shastri et Justin Wheat, « Delayed clearance of SARS-CoV2 in male compared to female patients: High ACE2 expression in testes suggests possible existence of gender-specific viral reservoirs », (DOI 10.1101/2020.04.16.20060566, consulté le ).
- (en) Lulin Zhou, Zubiao Niu, Xiaoyi Jiang et Zhengrong Zhang, « Systemic analysis of tissue cells potentially vulnerable to SARS-CoV-2 infection by the protein-proofed single-cell RNA profiling of ACE2, TMPRSS2 and Furin proteases », BioRXIV the preprint server for biology, Cell Biology, (DOI 10.1101/2020.04.06.028522., lire en ligne, consulté le ).
- Alex P. Salam et Peter W. Horby, « The Breadth of Viruses in Human Semen », Emerging Infectious Diseases, vol. 23, no 11, , p. 1922–1924 (ISSN 1080-6040 et 1080-6059, PMID 29048276, PMCID PMC5652425, DOI 10.3201/eid2311.171049, lire en ligne, consulté le ).
- .
- Ling Ma, Wen Xie, Danyang Li, Lei Shi, Yanhong Mao, Yao Xiong, Yuanzhen Zhang et Ming Zhang, « Effect of SARS-CoV-2 infection upon male gonadal function: A single center-based study », medRxiv, , p. 2020.03.21.20037267 (DOI 10.1101/2020.03.21.20037267, lire en ligne, consulté le ).
- « Le Quotidien du Médecin, le 7 avril 2020 », sur lequotidiendumedecin.fr (consulté le ).
- DailyMail, le 12 mars 2020.
- South China Morning Post le 26 mars 2020.
- scRNA-seq Profiling of Human Testes Reveals the Presence of ACE2 Receptor, a Target for SARS-CoV-2 Infection, in Spermatogonia, Leydig and Sertoli Cells (Zhengpin Wang ORCID & and Xiaojiang Xu)
- (en) Michael Bright Yakass et Bryan Woodward, « COVID-19: should we continue to cryopreserve sperm during the pandemic? », Reproductive BioMedicine Online, , S1472648320301838 (PMID 32334942, PMCID PMC7152920, DOI 10.1016/j.rbmo.2020.04.004, lire en ligne, consulté le ).
- (en) Fábio A. Kurscheidt, Cristiane S. S. Mesquita, Gabrielle M.Z.F. Damke et Edilson Damke, « Persistence and clinical relevance of Zika virus in the male genital tract », Nature Reviews Urology, vol. 16, no 4, , p. 211–230 (ISSN 1759-4812 et 1759-4820, DOI 10.1038/s41585-019-0149-7, lire en ligne, consulté le ).
- (en) Michelle L. Holshue, Chas DeBolt, Scott Lindquist et Kathy H. Lofy, « First Case of 2019 Novel Coronavirus in the United States », New England Journal of Medicine, vol. 382, no 10, , p. 929–936 (ISSN 0028-4793 et 1533-4406, PMID 32004427, PMCID PMC7092802, DOI 10.1056/NEJMoa2001191, lire en ligne, consulté le ).
- (en) Ernest A. Gould, « Methods for Long-Term Virus Preservation », Molecular Biotechnology, vol. 13, no 1, , p. 57–66 (ISSN 1073-6085, DOI 10.1385/MB:13:1:57, lire en ligne, consulté le ).
- Merrill D.R., Wade C.D., Fahnestock P., Baker R.O. (2018) Long-term and short-term stability of viruses depend on storage temperature and preservation method. Beiresources poster.|Lire en ligne= https://www.beiresources.org/Portals/2/PDFS/Long-Term%20and%20Short-Term%20Stability%20of%20Viruses.pdf.
- (en) James Segars, Quinton Katler, Dana B. McQueen et Alexander Kotlyar, « Prior and Novel Coronaviruses, COVID-19, and Human Reproduction: What Is Known? », Fertility and Sterility, , S001502822030385X (PMCID PMC7161522, DOI 10.1016/j.fertnstert.2020.04.025, lire en ligne, consulté le ).
- (en) Zsuzsanna Varga, Andreas J Flammer, Peter Steiger et Martina Haberecker, « Endothelial cell infection and endotheliitis in COVID-19 », The Lancet, vol. 395, no 10234, , p. 1417–1418 (PMID 32325026, PMCID PMC7172722, DOI 10.1016/S0140-6736(20)30937-5, lire en ligne, consulté le ).
- (en) Xiaohan Ren, Xiyi Wei, Guangyao Li et Shancheng Ren, « Multiple expression assessments of ACE2 and TMPRSS2 SARS-CoV-2 entry molecules in the urinary tract and their associations with clinical manifestations of COVID-19 », BioRXIV the preprint server of biology, Biochemistry, (DOI 10.1101/2020.05.08.083618, lire en ligne, consulté le ).
- « Un nouveau document d’orientation exhorte les décideurs à soutenir les patients, dont 1 sur 10 signale des symptômes de « COVID longue » », sur who.int, Organisation mondiale de la santé, (consulté le ).
- (en) Baig AM, « Chronic COVID Syndrome: Need for an appropriate medical terminology for Long-COVID and COVID Long-Haulers », Journal of Medical Virology, (PMID 33095459, DOI 10.1002/jmv.26624).
- (en-US) Staff, « Long-Term Effects of COVID-19 », Centres pour le contrôle et la prévention des maladies, (lire en ligne, consulté le ).
- (en-GB) « Overview | COVID-19 rapid guideline: managing the long-term effects of COVID-19 | Guidance | NICE », sur National Institute for Health and Care Excellence, (consulté le ).
- https://www.allodocteurs.fr/maladies/covid/covid-long-une-reactivation-du-virus-de-la-mononucleose-en-cause_31523.html
- (en-GB) Greenhalgh T, Knight M, A'Court C, Buxton M, Husain L, « Management of post-acute covid-19 in primary care », BMJ, vol. 370, , m3026 (PMID 32784198, DOI 10.1136/bmj.m3026, S2CID 221097768, lire en ligne).
- (en) Bridget Fitzgerald, « Long-haul COVID-19 patients will need special treatment and extra support, according to new guide for GPs », sur ABC News, Australian Broadcasting Corporation), (consulté le ).
- « Le Covid long toucherait trois malades hospitalisés sur quatre », sur franceculture.fr, (consulté le ).
- (en) Kelly Servick, « For survivors of severe COVID-19, beating the virus is just the beginning », Science, (ISSN 0036-8075, DOI 10.1126/science.abc1486, lire en ligne).
- (en-US) Ross JM, Seiler J, Meisner J, Tolentino L, « Summary of COVID-19 Long Term Health Effects: Emerging evidence and Ongoing Investigation », université de Washington, (consulté le ).
- (en-GB) « Living with Covid19. A dynamic review of the evidence around ongoing covid-19 symptoms (often called long covid) », National Institute fo Health Research, (DOI 10.3310/themedreview_41169, lire en ligne[archive du ]).
- (en-GB) « How long does COVID-19 last? », UK COVID Symptom Study, (consulté le ).
- (en) Ludvigsson JF, « Case report and systematic review suggest that children may experience similar long-term effects to adults after clinical COVID-19 », Acta Paediatrica, (PMID 33205450, PMCID 7753397, DOI 10.1111/apa.15673).
- (en-GB) Frances Simpson et Amali Lokugamage, « Counting long covid in children », sur The BMJ, (consulté le ).
- (en-GB) Sarah Boseley, « Coronavirus: 60,000 may have 'long Covid' for more than three months – UK study », sur The Guardian, (consulté le ).
- (en-GB) Nicola Davis, « Long Covid alarm as 21% report symptoms after five weeks », sur The Guardian, (consulté le ).
- (en-GB) Joanna Herman, « I'm a consultant in infectious diseases. 'Long Covid' is anything but a mild illness », sur The Guardian, (consulté le ).
- (en-GB) Sudre CH, Murray B, Varsavsky T, Graham MS, Penfold RS, Bowyer RC, Pujol JC, Klaser K, Antonelli M, Canas LS, Molteni E, « Attributes and predictors of Long-COVID: analysis of COVID cases and their symptoms collected by the Covid Symptoms Study App », MedRxiv, Preprint Server for the Health Sciences, (DOI 10.1101/2020.10.19.20214494, S2CID 224805406, lire en ligne, consulté le ).
- (en-GB) Gallagher J, « Long Covid: Who is more likely to get it? », BBC, (lire en ligne, consulté le ).
- (en) « New research identifies those most at risk from 'long COVID' », sur King's College London, (consulté le ).
- (en) Yelin D, Wirtheim E, Vetter P, Kalil AC, Bruchfeld J, Runold M, Guaraldi G, Mussini C, Gudiol C, Pujol M, Bandera A, Scudeller L, Paul M, Kaiser L, Leibovici L, « Long-term consequences of COVID-19: research needs », The Lancet. Infectious Diseases, vol. 20, no 10, , p. 1115–1117 (PMID 32888409, PMCID 7462626, DOI 10.1016/S1473-3099(20)30701-5, lire en ligne, consulté le ).
- (en) « Chinese study finds most patients show signs of ‘long Covid’ six months on », South China Morning Post, (lire en ligne, consulté le ).
- Futura Sciences.
- OMS, « Soins à domicile pour les patients présumés infectés par le nouveau coronavirus (virus de la COVID-19) qui présentent des symptômes bénins, et prise en charge des contacts », sur who.int/fr/, (consulté le ).
- BFM TV — Allemagne : le gouvernement ajoute l'aération aux gestes barrières contre le Covid-19.
- (en) « Coronavirus », sur www.who.int (consulté le ).
- Pierre Sautreuil, « Coronavirus en France : que faire en cas de symptômes ? », sur Le Figaro.fr, (consulté le ).
- (en) Billy J. Quilty, Sam Clifford, Stefan Flasche et NCoV working group2 of the Centre for Mathematical Modelling of Infectious Diseases CMMID, « Effectiveness of airport screening at detecting travellers infected with novel coronavirus (2019-nCoV) », Eurosurveillance, vol. 25, no 5, , p. 2000080 (ISSN 1560-7917, PMID 32046816, PMCID PMC7014668, DOI 10.2807/1560-7917.ES.2020.25.5.2000080, lire en ligne, consulté le ).
- Nisreen M.A. Okba, Marcel A. Müller, Wentao Li et Chunyan Wang, « Severe Acute Respiratory Syndrome Coronavirus 2−Specific Antibody Responses in Coronavirus Disease 2019 Patients », Emerging Infectious Diseases, vol. 26, no 7, (ISSN 1080-6040 et 1080-6059, DOI 10.3201/eid2607.200841, lire en ligne, consulté le ).
- « Nouveau coronavirus (2019-nCov) : conseils au grand public – Quand et comment utiliser un masque ? », sur www.who.int (consulté le ).
- « Questions-réponses sur les masques et la COVID-19 », sur www.who.int (consulté le ).
- Pandémie COVID-19 et masques de protection.
- Ministre de la Santé et de la Solidarité, « Les différents types de masques » (consulté le ).
- Amélie St-Yves, « Coronavirus : porter un masque, un faux sentiment de sécurité », sur Le Journal de Montréal (consulté le ).
- « nmmedical.fr - Matériel Médical », sur www.nmmedical.fr (consulté le ).
- « Faut-il généraliser le port du masque ? Le discours officiel commence à s’infléchir », Le Monde.fr, (lire en ligne, consulté le ).
- OMS.
- Cpias, Désinfection des mains par friction.
- (en) Retta Race, « What’s Known About Chlorine’s Impact On Coronavirus : Que sait-on de l'impact du chlore sur le coronavirus », sur Swim Swam, (consulté le ).
- Maville.com, « Coronavirus. Davantage de chlore dans votre eau potable ? On vous explique pourquoi », sur rennes.maville.com, (consulté le ).
- « Vitamine D et COVID19 : la supplémentation présente-t-elle un intérêt ? », sur VIDAL (consulté le ).
- « Effet bénéfique de la vitamine D dans la Covid : quelles sont les données ? », sur www.larevuedupraticien.fr (consulté le ).
- Yuqian Jiang, Han Zhang, Jose A. Wippold et Jyotsana Gupta, « Sub‐second heat inactivation of coronavirus using a betacoronavirus model », Biotechnology and Bioengineering, vol. 118, no 5, , p. 2067-2075 (ISSN 0006-3592, e-ISSN 1097-0290, PMID 33615450, PMCID PMC8013827, DOI 10.1002/bit.27720, lire en ligne, consulté le ).
- La santé des dirigeants politiques à l’épreuve du coronavirus : la transparence, exigence ambiguë.
- (en) Dr. Vinod Kumar Goyal, « The novel coronavirus 2019: A naturally occurring disaster or a biological weapon against humanity:A critical review of tracing the origin of novel coronavirus 2019 », Journal of Entomology and Zoology Studies, (ISSN 2349-6800, lire en ligne).
- Nicolas Villain, « Ultracrépidarianisme, biais cognitifs et Covid-19 », sur Revue de neuropsychologie, (consulté le ).
- Christopher Dornan, « La désinformation en science dans le contexte de la Covid-19 », sur Forum des politiques publiques, (consulté le ).
- Christpher Dornan, « La désinformation en science dans le contexte de la Covid-19 », sur Forum des politiques publiques, (consulté le ).
- AFP, « Covid-19 : désinformation et études scientifiques bancales à l'index », sur africanews.com, (consulté le ).
Voir aussi
Bibliographie
- Philippe Sansonetti, « Covid-19, chronique d’une émergence annoncée », La Vie des idées, (lire en ligne, consulté le )
- Pascal Marichalar, « Savoir et prévoir : Première chronologie de l’émergence du Covid-19 », La Vie des idées, (lire en ligne, consulté le ).
- Philippe Grandcolas et Jean-Lou Justine, « Covid-19 ou la pandémie d’une biodiversité maltraitée », The Conversation, (DOI https://doi.org/10.6084/m9.figshare.12040623.v1, lire en ligne, consulté le )

- Ressources pour la Covid-19, sur worldcat.org
- Jad Hatem, Petite théologie de la pandémie, Paris, éd. du Cygne, 2020.
- Ludovic Desjardins, « Clinique du COVID. Transfert et écriture à l’épreuve de la crise », Topique, (lire en ligne, consulté le )
- Julien Bokilo Lossayi, «Analyse comparative des mises en œuvre des politiques de lutte contre la pandémie du Covid-19 et d’anticipation de l’après crise», revue Polis, vol.22, n°1 et 2, décembre 2020, p. 157-189.
- Korstanje M. E & George B. Mobility and Globalization in the Aftermath of COVID-19: Emerging New Geographies in a Locked World. Basingstoke, UK: Palgrave Macmillan, 2021.
Articles connexes
- Betacoronavirus
- SARS-CoV-2
- Désinformation sur la pandémie de Covid-19
- Développement et recherche de médicaments contre la Covid-19
- Épidémie
- Grippe (classique ou saisonnière)
- Lymphohistiocytose hémophagocytaire secondaire
- Maladie à déclaration obligatoire
- Maladie infectieuse émergente
- Pandémie
- Pandémie de Covid-19
- Santé publique
- SARS-CoV-2 chez les animaux
- Syndrome inflammatoire de reconstitution immune
- Système immunitaire
- Syndrome de libération de cytokines
- Test diagnostique du SARS-CoV-2
- Lanjuan Li
Liens externes
- Ressources relatives à la santé :
- ICD-10 Version:2016
- MalaCards
- NCI Thesaurus
- (en) Diseases Ontology
- (en) DiseasesDB
- (en) Medical Subject Headings
- (no + nn + nb) Store medisinske leksikon
- Liste des publications scientifiques relatives à la Covid-19 et Sars-CoV-2 de medRxiv, arXiv, JAMA network, New England Journal of Medecine sur Coronavir.org
- Comparateur des courbes épidémiques nationales (sources ECDC)
- Guide de bonnes pratiques (en) Alhazzani, W. Møller, M. H. Arabi, M. Loeb et al., Surviving sepsis campaign: guidelines on the management of critically ill adults with Coronavirus Disease 2019 (COVID-19) - Un-edited accepted proof, European Society of Intensive Care Medicine and the Society of Critical Care Medicine, (DOI 10.1007/s00134-020-06022-5, lire en ligne)
- Portail de la maladie à coronavirus 2019