Antimoine
L'antimoine est l'élément chimique de numéro atomique 51, de symbole Sb. C'est un membre du groupe des pnictogènes. De propriétés intermédiaires entre celles des métaux et des non-métaux, l'antimoine est, avec l'arsenic, un métalloïde du cinquième groupe principal du tableau périodique. Il s'agit d'un élément faiblement électropositif. L'électronégativité selon Pauling est de l'ordre de 1,9, alors que celle de As avoisine 2.
Cet article concerne l'élément chimique, le corps simple et les composés chimiques caractéristiques. Pour les autres significations, voir Antimoine (homonymie).
Le corps simple antimoine est un métalloïde polymorphe, toxique et cancérigène, tout comme l'arsenic[8] (auquel il est souvent associé, par exemple dans les munitions à base de plomb).
L'adjectif antimonié qualifie un corps ou une matière qui contient de l'antimoine.
Histoire et étymologie
Le symbole Sb, choisi pour l'élément par Berzélius, fait référence au latin stibium, issu du grec στίμμι(ς) stimmi(s) ou στίββι stibbi, désignant les corps minéraux antimoniés en général, et la stibine en particulier. Le nom antimoine serait une altération de l'arabe الإثمد al-ʾiṯmid[9], un emprunt à l’ancien égyptien stim ou smdt par l'intermédiaire du copte ou du grec στίμμι stímmi[10].
La stibine est un trisulfure d'antimoine dont la poudre noire intense était connue dans l'Antiquité pour souligner le contour des yeux ou comme fard à cils[11], ou encore comme médicament pour soigner/prévenir les infections oculaires, et le terme est resté pour cet usage, bien que la première description d'une préparation n'apparaisse que dans un manuscrit de 1604.
Le stibium qui peut déjà désigner le corps simple gris métallique et stable des chimistes, ou l'antimoine natif des minéralogistes, est sûrement connu depuis le IVe millénaire av. J.‑C., notamment des Babyloniens. Un vase chaldéen en antimoine pur datant d'environ quatre mille ans avant notre ère a été retrouvé. Les Égyptiens des Ve et VIe dynasties égyptiennes se servaient de récipients en cuivre recouverts d'antimoine pour le transport de l'eau[12].
Dans l'Antiquité, les Égyptiens appelaient l'antimoine mśdmt. Les hiéroglyphes ne permettent que de supposer les voyelles mais la tradition arabe laisse supposer que la prononciation est mesdemet[13][source insuffisante].
Au Ier siècle apr. J.-C., Celse et Pline l'Ancien utilisent le terme latin stibium, signifiant dans la pratique « signe, marquage (par exemple du pourtour des yeux) », que le chercheur Jöns Jakob Berzelius a abrégé au XVIIIe siècle en Sb, devenu ainsi le symbole chimique de l'antimoine. Pline aurait baptisé ainsi son minerai mais avec une distinction entre formes mâle et femelle : le mâle désigne probablement la stibine (donc le sulfure d'antimoine), la femelle, décrite comme supérieure, plus lourde, plus brillante et moins friable, est probablement l'antimoine métallique trouvé à l'état naturel[14]. Pline utilise également les mots stimi, larbaris, alabastre, ainsi que platyophthalmos i.e. « grands yeux » en grec, d'après l'effet cosmétique du khôl.
Bien plus tard, il était bien connu des alchimistes du Moyen Âge sous le nom antimonium. Cette forme latine médiévale, attestée vers 1050, a une origine incertaine :
- selon l'étymologie populaire, une légende[15] explique l'origine de ce nom par une succession de décès survenus au Moyen Âge parmi des moines. Ils auraient effectué des travaux de recherche sur ce corps ou auraient été victimes de l'alchimiste Basile Valentin, élève de Paracelse. Celui-ci avait l'habitude de jeter les résidus de ses expériences dans la mangeoire de ses cochons pour les engraisser. Ce faisant, il aurait administré de l'antimoine aux porcs qui seraient ainsi devenus toxiques ;
- une autre étymologie pseudo-savante propose un terme grec hypothétique, antimonos, du grec anti, « à l'opposé de » et monos, « seul », parce qu'on croyait que ce métal ne se présentait jamais seul[16]. En effet, l'antimoine ne se trouve à l'état naturel que combiné à d'autres métaux comme le plomb[17]. Cependant le préfixe grec anti-, qui présente des valeurs diverses ( « en face, en échange, à son tour, équivalant à, contre... »), n'a jamais celle d'une simple négation ;
- Lippman[18] a conjecturé un terme grec, anthemonion (mascara, littéralement « fleurette ») et cite de nombreux termes apparentés en grec ancien décrivant des éléments chimiques ou biologiques ;
- les utilisations précoces du terme antimonium remontent à 1050-1100, par Constantin l'Africain dans des traités de médecine arabe[18] et plusieurs spécialistes pensent qu'il s'agit d'une altération scripturale de l'arabe الإثمد al-ʾiṯmid, un emprunt à l’ancien égyptien stim ou smdt par l'intermédiaire du copte ou du grec στίμμι [stímmi][10]. L'élément antimoine (et non le cosmétique, son sulfure) pouvait être nommé ithmid, athmoud, othmod, ou uthmod, ou encore athimar. Littré suggère que la première forme dérive de stimmida, forme accusative de stimmi[19]. Sarton le dérive lui aussi de ithmid[20]. D'autres possibilités incluent un hypothétique *as-stimmi, dérivé du grec ancien[21]. En effet le mot grec stimmi, utilisé par les poètes tragiques dès le Ve siècle av. J.-C., désignait dans l'Antiquité la stibine.
Il existe dès l'Antiquité une petite métallurgie extractive de l'antimoine ; elle se poursuit à l'époque médiévale. Elle est mieux connue dès l'époque moderne.

Plus récemment, les chimistes du XVIIIe siècle nommaient Mercure de vie, ou Poudre d'Algaroth, le beurre d'antimoine précipité par l'eau[22].
Voir la querelle de l'antimoine dans :
Isotopes
L'isotope antimoine 121 représente 57 pour cent de la masse estimée d'antimoine, il est le seul isotope stable avec l'antimoine 123.
Il existe une vingtaine d'isotopes radioactifs, dont les masses atomiques s'échelonnent de 113 à 134. Parmi ces isotopes assez mal connus, l'antimoine 125, radionucléide artificiel employé comme indicateur radioactif, sporadiquement présent dans l’environnement, très peu étudié, hormis sur quelques sites industriels pollués[23].
La littérature mentionne des formes (bio)méthylées (à faibles concentrations), qui pourraient être plus bioassimilables[23].
Sa cinétique environnementale est mal connue, mais il semble peu mobile dans les sols, et assez peu bioassimilable pour les plantes. Il ne semble pas être bioaccumulé ni faire l'objet de bioamplification dans les réseaux trophiques[23].
Dans les organismes, sa toxicité semble liée à son affinité pour les groupements thiols (liaison irréversible à des enzymes importants). Son éventuelle écotoxicité est mal connue. Selon l'IRSN, « les potentialités de transfert trophique n’ont jamais été étudiées »[23].
L'antimoine 124 est une source de rayons gamma. Associé au béryllium il a été utilisé pour faire diverger certains réacteurs nucléaires[24].
Occurrences dans les milieux naturels, minéralogie et géologie
Le clarke s'élève entre 0,7 et 0,2 ppm ou en moyenne 0,5 g par tonne[25]. L'antimoine est un élément rare, dix fois moins fréquent que l'arsenic. Il est toutefois présent dans plus de cent minéraux.
L'antimoine se trouve encore plus rarement dans la nature sous forme d'un élément natif, le Sb métallique dénommé antimoine natif souvent avec des traces d'arsenic, de fer et d'argent. Ce minéral est parfois en alliage avec l'arsenic natif, ainsi le stibarsen ou l'arite. La breithauptite est un antimoniure de nickel naturel.
Pour les analyses de cycle de vie et l'appréhension de l'épuisement des ressources dites abiotiques, l'antimoine est l'unité utilisée depuis 2004 pour quantifier une consommation de matière première[26]. La conversion des quantités brutes vers leur équivalent antimoine ou kg d'antimoine fait intervenir la quantité totale de matière première disponible sur terre. Ainsi il existe des estimations en milligramme d'antimoine par kilogramme, en milligramme d'antimoine par litre..., pour estimer la rareté d'une entité décrite.
Minéraux les plus communs
L’antimoine se trouve le plus facilement sous forme de sulfures, combiné, associé ou non avec d’autres métaux (plomb, cuivre, argent).

Sulfures
- La stibine ou antimonite (Sb2S3) est la forme la plus fréquente, largement majoritaire. Son nom provient du grec stibi qui signifie noir d’antimoine. Elle est de couleur gris acier, d’une densité d = 4,6.
- La berthiérite (FeSb2S4). Son nom lui a été donné en hommage à Pierre Berthier qui en fut le découvreur en 1827 à Chazelles dans le Puy-de-Dôme en France. Sa densité est également d = 4,6.
 Berthiérite de la mine Herja près de Kisbánya, Baia Mare, Maramures, Roumanie. Belle pièce à groupement de lamelles ou lames parfois de plus de 10 cm. Taille globale 16.7 x 10.0 x 8.5 cm.
Berthiérite de la mine Herja près de Kisbánya, Baia Mare, Maramures, Roumanie. Belle pièce à groupement de lamelles ou lames parfois de plus de 10 cm. Taille globale 16.7 x 10.0 x 8.5 cm.
La berthiérite se confond assez facilement avec la stibine. Pour les distinguer, il faut faire une attaque à l'hydroxyde de potassium (KOH). La stibine réagit plus facilement que la berthiérite en produisant un enduit jaune.
La gudmundite est un sulfure de fer et de d'antimoine FeSbS du groupe des arsénopyrites. La Wakabayashilite [(As,Sb)6S9][As4S5] est un sulfure complexe d'As et Sb.
Il existe une nombreuse famille de sulfosels d’antimoine contenant divers éléments métalliques comme le plomb, l’argent, le zinc, le cuivre, etc. C’est le plomb qui est le plus fréquemment représenté. On peut citer par exemple :
- avec des cations plomb :
- ardaïte Pb19Sb13S35Cl7
- bénavidésite Pb4(Mn,Fe)Sb6S14
- franckéite (Pb,Sn)6Fe2+Sn2Sb2S14
- jamesonite Pb4FeSb6S14
- semseyite Pb9Sb8S14
- boulangérite Pb5Sb4S11
- plagionite Pb5Sb8S11
- madocite Pb17Sb16S41
- ménéghinite Pb13CuSb7S24
- guettardite Pb(Sb,As)2S4
- twinnite Pb(Sb,As)2S4
- zinkénite Pb6Sb14S27
- avec des cations cuivre :
- bournonite CuPbSbS3
- tétraédrite (Cu, Fe, Ag, Zn)12Sb4S13
- chalcostibite CuSbS2
- freibergite (Ag,Cu,Fe)12(Sb,As)4S13
- galkhaïte (Cs, Ti)(Hg, Cu, Zn)6(As, Sb)4S12
- autres cations :
- ullmannite NiSbS
- allemontite ou stibarsen AsSb
- dyscrasite Ag3Sb
- pyrargyrite Ag3SbS3
- stéphanite Ag5SbS4
- miargyrite AgSbS2
- nagyagite AuPb(Sb,Bi)Te2-3S6
- routhiérite Tl(Cu,Ag)(Hg,Zn)2(As,Sb)2S6
- vrbaïte Tl4Hg3Sb2As8S20

Oxydes
Les oxydes sont généralement colorés.
- De couleur blanche ou grise :
- sénarmontite (Sb2O3 cubique)
- valentinite (Sb2O3 orthorhombique).
- de couleur jaune :
- stibiconite (Sb3O6(OH))
- de couleur rouge :
- kermésite (Sb2S2O) ou antimoine rouge. Ce nom minéral provient du persan « qurmizq » qui signifie rouge foncé.
- livingstonite HgSb4O8
Hydroxydes et oxohydroxydes
- shakhovite Hg4SbO3(OH)3
Corps simples et corps composés chimiques

Le rayon atomique de l'antimoine avoisine 1,41 Å, il est situé entre celui de l'arsenic 1,21 Å et celui du bismuth 1,62 Å. L'énergie d'ionisation est également respectivement intermédiaire, 199 kcal/mol entre 226 kcal/mol et 168 kcal/mol. Les principales critères physico-chimiques, des ponts thermodynamiques à l'enthalpie de formation atomique, confirment l'évolution du métalloïde As vers le métal véritable au sens chimique que représente le bismuth. Toutefois, du fait sa polarisabilité médiocre, l'antimoine se rapproche souvent bien plus de l'arsenic.
Propriétés physiques et chimiques des corps simples

En dehors de l'antimoine gris ou semi-métallique, assez analogue à l'arsenic gris, le corps simple antimoine existe sous trois formes solides, dont deux instables notamment à la chaleur (jaune Sb4 et noire) qui redonne la forme stable grise et une explosive.
La condensation rapide des vapeurs d'antimoine donne une forme jaune non métallique de structure tétraédrique, soit Sb4
D'aspect blanc argenté et cassant, le corps simple Sbgris métal de densité 6,7 est un semi-métal brillant. Il ne ternit pas à l'air à température ambiante. Il conduit très mal la chaleur et assez mal l'électricité. Sa conductivité électrique n'atteint que 4 % de celle du corps simple métal cuivre.
Très cassant du fait de l'énergie de cohésion abaissée aux joints de grain, il peut être facilement réduit en poudres fines.

Cette forme stable, constituée de macromolécules dont les atomes sont agencés en un réseau cristallin trigonal, fond au-dessus de 630 °C et bout vers 1 380 °C. Il se vaporise très lentement au rouge blanc. L'antimoine liquide augmente de volume en se solidifiant.
Il est soluble dans les acides sulfurique, nitrique et phosphorique concentrés et à chaud. Il engendre alors lentement ce que l'on croyait de l'acide antimonique, mais qui se trouvent sous la forme d'ions antimoniates Sb(OH)6-.
L'antimoine impur peut être purifié par fusion avec du carbonate de soude ou Na2CO3 (et éventuellement du charbon actif).
Alliages
Il forme facilement des alliages avec les principaux métaux usuels, dont le plomb, le cuivre ou les métaux précieux. Il est souvent considéré comme un élément durcissant dans les alliages, comme ceux à base de plomb (Pb) et d'étain (Sn). Avec le bismuth, il forme des alliages dits antimoniure de bismuth de proportions variées qui présentent de multiples propriétés électriques.
Il forme aussi des associations avec l'arsenic.
Chimie des corps simples
La valence de l'antimoine dans ses composés peut être II, III, V et accessoirement -III.
L'antimoine perd des électrons et forme des ions Sb3+, hydrolysé en SbO+ ou même précipité en Sb(O{H)2+ en milieu acide. L'antimoine Sb de valence V, ou Sb(V) se situe à un niveau d'énergie supérieure de 0,58 e.V de Sb(III). L'oxyde Sb2O5 est insoluble virtuellement en solution acide. Il s'agit d'un oxydant modérément fort.
L'antimoine corps simple ou Sb0 (Sb au degré d'oxydation zéro ou élémentaire) n'est qu'à un niveau d'énergie inférieure de 0,21 e.V par rapport à Sb(III). Sb(-III) représenté par l'hydrogène antimonié SbH3 plonge à - 0,51 e.V par rapport à Sb0.
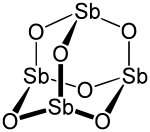
L'antimoine corps simple réagit au rouge avec le gaz oxygène. L'oxyde amphotère formé Sb2O3 est volatile. Il s'agit d'une poudre blanche et cristalline, insoluble dans l'eau. Chauffé, elle devient jaune, mais refroidie, redevient blanche. La sénarmontite octédrique, en réalité de maille cubique, se transforme en fleur d'antimoine, sous forme de rhomboèdres (empilement de plans de symétrie C3) homologues de la valentinite.
- Sb2O3 sénarmontite ou cristal de maille cubique → Sb2O3 fleur d'antimoine structure valentinite instable avec


L'antimoine s'enflamme spontanément dans le gaz chlore. Le chlorure normalement formé est un pentachlorure SbCl5, et il faut réchauffer ce corps lentement vers 200 °C pour former le trichlorure SbCl3. Néanmoins, le trichlorure d'antimoine peut être obtenu avec les corps simples si la température est contrôlé à 200 °C. Il est facilement obtenu par réaction de l'antimoine avec l'eau régale, avec un excès d'acide chlorhydrique. Il s'agit d'une masse incolore, molle et hygroscopique, qui porte le nom commun caractéristique de "beurre d'antimoine".
Le trifluorure d'antimoine peut être également facilement obtenu, ainsi que le pentafluorure d'antimoine.

L'antimoine réagit à chaud avec les autres corps simples halogènes brome et l'iode. avec le fluor, le chimiste obtient un corps incolore et volatile, le trifluorure d'antimoine SbF3.
L'hydrure d'antimoine SbH3 est le gaz d'"hydrogène stibié" ou hydrogène antimonié des anciens, encore appelée stibine en chimie analytique. Ce gaz toxique, très instable, est un produit de réduction en milieu acide, obtenu par exemple en versant de l'antimoine dans une solution d'acide où barbote des copeaux de zinc, provoquant une ébullition d'hydrogène réactif. Il est comparativement obtenu en moindre quantité que l'arsine, mais beaucoup plus que la bismuthine plus instable, si l'opération concerne respectivement les corps simples arsenic et bismuth. Ce gaz n'existe pas en solution alcaline, il se décompose en Sb et en hydrogène. Mais sa décomposition exothermique peut survenir à la moindre excitation à l'état gazeux :
- 2 SbH3 gaz instable → 2 Sb poudre cristal + 3 H2 gaz avec
Les corps composés antimoniés
_2_(18739923680).jpg.webp)
L'antimoine est présent dans de nombreux composés minéraux, souvent associé avec le plomb, sous forme d'oxydes, de sulfures, de sulfoxydes, d'oxychlorures...
L'acide antimonique HSb(OH)6 est inconnu en pratique : il n'existe que l'ion antimoniate, par exemple dans le pyroantimoniate de sodium NaSb(OH)6, encore écrit par convention Na2Sb2O5(OH)2. 5 H2O, le pyroantimoniate de potassium.

Le trisulfure d'antimoine Sb2S3 apparaît communément sous la forme de cristaux allongés, gris noir, à éclat métallique net. Il s'agit de la stibine de maille orthorhombique des minéralogistes. Mentionnons la forme allotropique amorphe rouge (rouge orangée) du trisulfure d'antimoine Sb2S3, celle-ci est relativement instable et un faible apport d'énergie, pas seulement thermique, la retransforme en la première forme cristalline gris noir.
Ainsi
- Sb2S3 rouge orangé, amorphe, chauffé et secoué → Sb2S3 cristaux allongés gris-noir type stibine avec
Le Sb est présent dans de nombreux composés organométalliques. Ainsi il existe des acétates, des tartrates, des gluconates...
Analyse qualitative et dosage quantitatif
Lors du test de Marsh, le miroir d'antimoine obtenu par décomposition de l'hydrogène stibié (stibine) ou hydrure d'antimoine sur la surface du verre, n'est pas dissous par la solution d'hypochlorite, contrairement au miroir d'arsenic. L'antimoine en milieu acide réagit avec un hydrogénosulfure ou avec l'ion hydrogénosulfure pour former un sulfure orangé insoluble. C'est ce précipité coloré qui permettait autrefois d'attester la présence d'antimoine.

Il est possible de séparer As et Sb à l'état de sulfures en dissolvant sélectivement Sb2S3 plus basique dans l'acide chlorhydrique et As2S3 plus acide dans le carbonate d'ammonium.
La quantité d’antimoine dans différents milieux est quantifiable par différentes méthodes analytiques. Pour dissocier l’antimoine de la matrice de son milieu, il faut, la plupart du temps, effectuer une digestion à l’aide d’un acide. Vue la grande toxicité de l’antimoine, l’INRS offre deux services de détection pour les composés d’antimoine dans le sang et l’urine, soient l’ICP-MS ou la SAA-four de graphite[27].
Les raies d'absorption sont intenses dans l'Ultra-Violet proche.
Toxicologie
L'antimoine et la plupart de ses composés sont très toxiques ou toxiques, et souvent également irritants pour les muqueuses et la peau, voire l'estomac et l'intestin (après ingestion).
Le gaz antimoniure d'hydrogène ou hydrure d'antimoine présente une toxicité comparable à l'arsine. La limite de tolérance dans l'atmosphère de travail est 0,5 mg/m3 d'air. Il est parfois retrouvé dans l'eau en bouteille (à partir du PET qui en relargue)[28] et dans l'eau potable[29] ; vu sa toxicité, Santé Canada a émis une norme provisoire de concentration maximale acceptable pour l’eau potable qui est de 6 µg/L[30].
En France, il existe deux fiches toxicologiques sur le site de l'INRS[31]:
- sur le trioxyde d'antimoine[32] (synonymes : anhydride antimonieux, antimoine trioxyde, diantimoine trioxyde, oxyde antimonieux, oxyde d’antimoine(III), sesquioxyde d’antimoine ; numéro CAS : 1309-64-4) ;
- sur l’hydrure d'antimoine[33] (synonymes : antimoine trihydrure, hydrogène antimonié, hydrure d’antimoine, stibine ; numéro CAS : 7803-52-3).
L'antimoine semble être sous certaines formes toxique pour le spermatozoïde, génotoxique (clastogène[34],[35]) et reprotoxique[36],[37],[38]. Puis l'embryon, le foetus et la femme enceinte et l'enfant y sont a priori beaucoup plus vulnérables que l'adulte en termes de risques. Aussi le « Volet périnatal » du programme national de biosurveillance a-t-il notamment porté sur l’imprégnation des femmes enceintes par l’antimoine. A l'occasion du suivi d'une cohorte de 4 145 femmes enceintes de la « Cohorte Elfe » ; femmes ayant accouché en France en 2011, hors Corse et TOM)[39] le dosage urinaire de 990 femmes enceintes a révélé la présence d'antimoine au-delà des seuils de détection dans 70 % des échantillons d’urine analysées (moyenne géométrique : 0,04 μg/L ; avec 0,06 μg/g de créatinine, soit un niveau proche des moyennes trouvées chez la femme (enceinte ou non, en France et à l’étranger) lors d'études précédentes[39]. Ce travail a montré que l'imprégnation des femmes enceintes par ce métalloïde croît avec la consommation de tabac et avec la consommation d’eau embouteillée)[39]. En zone industrielle et urbaine, l'air pourrait parfois être une source de contamination à des doses éventuellement problématique pour l'embryon ou la femme enceinte[40].
Usages


Corps simple et alliages
Le corps simple trop cassant ou aux propriétés mécaniques désastreuses est très rarement employé seul. Il s'agit plutôt d'un additif. Il était présent dans le "métal d'Alger", le "métal de la Reine".
C'est ainsi un composant fréquent d'alliages notamment de métaux comme le plomb (dont il augmente la dureté) servant à la fabrication :
- des batteries au plomb[41] (qu'il durcit) ;
- de plaques d'accumulateurs plomb-acide (5 %) ;
- des alliages complexes pour caractères ou poinçons d'imprimerie ;
 Pièce monétaire en alliage CuSb "Tomimotosen Tobishimaike" fin du VIIe siècle, Musée des monnaies et devises de Tokyo.
Pièce monétaire en alliage CuSb "Tomimotosen Tobishimaike" fin du VIIe siècle, Musée des monnaies et devises de Tokyo. - des alliages pour soudure plomb-antimoine-étain (environ 80 %, 15 % et 5 %) ;
- des « plombs » des balles et grenailles de cartouches de guerre et de chasse ou de tir sportif, ce qui explique que des quantités significatives d'arsenic et d'antimoine (en plus du plomb) puissent être retrouvées comme polluant du sol d'anciens stands de tir ou champs de tir[42], y compris sous des formes lixiviables contaminantes des eaux superficielles et/ou des nappes phréatiques[43]. Des taux d'antimoine de 19 à 349 μg/L ont été relevés pour des taux de plomb variant de 7 à 1495 μg Pb/L dans l'eau interstitielle sur un site étudié par Okkenhaug & al; (2016).
- des alliages de revêtement de métaux ou à propriété antifriction, notamment pour palier, ou parfois à base de plomb ou d'étain notamment pour fondre dans des moules (voir Matériaux utilisables pour le frottement).
- le cuivre antimonié servait de monnaie autrefois en Chine et au Japon ; il fait partie des premiers alliages de cuivre utilisés au début de l'Âge du bronze car l'antimoine en augmentait la résistance.
- la poudre de Sb (ou de divers composés purifiés) donne un effet de scintillement aux feux d'artifice.
- Il sert à la fabrication de semi-conducteurs.
Par exemple, InSb, GaSb sont utilisés :- pour la détection dans l'infrarouge
- pour les sondes à effet Hall (détection de champ magnétique)
Corps composés


L'antimoine est présent dans un grand nombre de catalyseurs, comme dans certains pigments. Il a aussi divers emplois industriels et médicaux.
Sous forme d'oxyde Sb2O3 : il diminue la propagation des flammes dans les matières plastiques[44].
Il entre aussi dans la composition du PET comme résidu de catalyseur de la réaction de polymérisation[45], devenant contaminant de l'eau pour sa part qui est désorbée du plastique des bouteilles.
Les oxydes d'antimoine permettent de produire un verre blanc opaque.
Les composés d'antimoine entrent dans la composition de nombreuses glaçures. Le trifluorure d'antimoine SbF3 est un agent décapant ou un agent fluorant. Il est aussi utilisé en poterie.
Le beurre d'antimoine ou SbCl3 est un produit intermédiaire de la chimie de l'antimoine. Cette base de Lewis sert pour élaborer des catalyseurs, des réactifs pour la synthèse de la vitamine A.
.jpg.webp)
Le trisulfure Sb2S3 peut servir à former des pâtes pour allumage des allumettes. Il sert en pyrotechnie, ainsi que dans l'élaboration des verres rouges.
Utilisation médicale
Dans l'Antiquité, l'antimoine était utilisé comme source de médicament vomitif, et ses composés étaient employés en particulier dans des cosmétiques, comme la stibine préalablement broyée pour élaborer le khôl.
Des coupes ou récipients en alliages à base de Sb servaient à conserver du vin, dont certains composants réagissent avec l'antimoine pour former des corps toxiques à effet vomitif puissant. Ainsi les riches fêtards romains pouvaient, après s'être fait vomir, continuer à engloutir des mets raffinés, servis par leurs esclaves. Cet usage abusif est passé dans la médecine gréco-romaine.

En 1566, le Parlement de Paris en interdit l'usage en médecine[réf. souhaitée], une mesure que la faculté de Montpellier refusa de respecter.
Le , Louis XIV est victime d'une grave intoxication alimentaire lors de la prise de Bergues dans le Nord. Le lundi 8 juillet, il reçoit les derniers sacrements et on commence à préparer sa succession. Mais François Guénault (1586-1667), le médecin d'Anne d'Autriche, lui donne un émétique à base d'antimoine et de vin, qui le guérit « miraculeusement ». Le roi autorise l'usage de l'antimoine à des fins médicales.
Ses composés sont utilisés pour guérir des maladies parasitaires, comme l'antimoniate de méglumine pour la leishmaniose humaine et canine[46].
En pharmacie, il existe des pommades stibiées censées atténuer la douleur.
Production et commerce
Minerais d'antimoine et traitements directs
Les principaux minerais d'antimoine sont par ordre la stibine Sb2S3 présents en filons massifs (peut-être plus de 71 % de la production directe), la valentinite Sb2O3 autrefois en Algérie), l'(oxy)hydroxyde d'antimoine Sb2O4. H2O. L'exploitation des autres oxydes d'antimoine ou hydroxydes d'antimoine est encore plus rare.
En 1990, les principaux pays extracteurs de minerais d'antimoine sont la Chine, la Russie, l'Afrique du Sud, la Bolivie, le Mexique, le Canada et l'Australie.
Les minerais principalement à base de stibine, mais aussi de quartz ou d'autres reliquats rocheux sont concassés, enrichis par flottation, puis fondus vers 550−600 °C. Une masse grise s'écoule au fond du creuset car la stibine ou trisulfure d'antimoine est facilement fusible. Elle cristallise ensuite en aiguilles cristallines, cette masse est dénommée "antimoine cru".
Le métal est ensuite obtenu par grillage des sulfures et/ou par réduction via le monoxyde de carbone, opérations perfectionnées par les fondeurs français à la Belle Époque.
Donnons d'abord la réaction exothermique de grillage au four tournant :
- Sb2S3 solide cristal en aiguilles + 9 O2 gaz (de l'air) → 2 Sb2O3 poudre solide + 6 SO2 gaz anhydride sulfureux avec
Elle est suivie par la réduction par le charbon de bois (charbon actif) qui s'opère dans un four de fusion, c'est-à-dire un four à montée de chauffe rapide. Voilà la réaction globale :
- 2Sb2O3 solide cristal pulvérulent + 3 C charbon de bois → 4 Sb dépôt en rhomboèdres + 3 CO2 gaz anhydride carbonique
Donnons enfin la réaction de grillage dans un four à fosse.
- 2 Sb2O3 solide cristal pulvérulent + Sb2S3 solide cristal en aiguilles → 6 Sb dépôt en rhomboèdres + 3 SO2 gaz anhydride sulfureux
Le raffinage de l'antimoine est typique de celui des semi-métaux. Il peut s'effectuer par sublimation ou par fusion de zone.
Production industrielle actuelle
C'est le plus souvent un sous-produit du raffinage ou de la métallurgie du plomb, du cuivre et de l'argent. Mais une partie non négligeable de l'antimoine peut également être récupérée au cours du traitement des ordures.
L'antimoine est une ressource non renouvelable, produite dans les pays suivants :
| Pays | Tonnes | % du total |
|---|---|---|
| République populaire de Chine | 126 000 | 81,5 |
| Russie | 12 000 | 7,8 |
| Afrique du Sud | 5 023 | 3,3 |
| Tadjikistan | 3 480 | 2,3 |
| Bolivie | 2 430 | 1,6 |
| Total 5 pays | 148 933 | 96,4 |
| Total monde | 154 538 | 100,0 |
Chiffres de 2003, métal contenu dans les minerais et concentrés, source : L'état du monde 2005
La Chine produisait en 2006 87 % de l'approvisionnement mondial[47].
La production globale, incluant la récupération des ordures, en 1990 atteignait déjà 90 000 t.
Histoire de la production

À la Belle Époque, la France figurait parmi les tout premiers producteurs mondiaux d'antimoine avec les sites mayennais de Laval, corses d'Ersa, de Luri ou de Meria, auvergnats de Massiac, d'Ouche ou de la vallée de la Sianne, où le fondeur Emmanuel Chatillon améliore le procédé de grillage, l'industriel métallurgiste Emmanuel Basse Vitalis rationalise son extraction et sa production... sans oublier les mines notamment algériennes de la compagnie des mines de la Lucette.

La France fut ainsi le premier producteur mondial d’antimoine entre 1890 et 1910 grâce à la production de la Compagnie des mines de La Lucette, propriétaire de gisements en Mayenne, près de Laval, et des mines d'antimoine d'Auvergne.
Commerce en France
En 2016, la France est importatrice nette d’antimoine, d'après les douanes françaises. Le prix moyen à la tonne à l'import est de 5 500 €[48].
Notes et références
- (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832 - 2838 (DOI 10.1039/b801115j)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC, , 89e éd., p. 10-203
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0)
- (en) Thomas R. Dulski, A manual for the chemical analysis of metals, vol. 25, ASTM International, , 251 p. (ISBN 0803120664, lire en ligne), p. 71
- Base de données Chemical Abstracts interrogée via SciFinder Web le 15 décembre 2009 (résultats de la recherche)
- Entrée « Antimony » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 22 août 2018 (JavaScript nécessaire)
- « Antimoine » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Gabriela Ungureanu, , Sílvia Santos, , Rui Boaventura, , Cidália Botelho, Arsenic and antimony in water and wastewater: Overview of removal techniques with special reference to latest advances in adsorption Journal of Environmental Management, Volume 151, 15 March 2015, Pages 326–342
- Dictionnaire étymologique des mots français venant de l'arabe, du turc et du persan, Georges A. Bertrand
- (de) Karl Lokotsch, Etymologisches Wörterbuch der Europäischen (Germanischen, Romanischen und Slavischen) Wörter Orientalischen Ursprungs, Carl Winter's Universitätsbuchhandlung C. F. Wintersche Buchdruckerei, (lire en ligne)
- Jean-Pierre Tricot, CURRUS TRIOMPHAL!S ANTIMONII ou LE TRIOMPHE DE LA IATROGENESE
- Antimoine sur universalis.fr
- Cité par W. F. Albright "Notes on Egypto-Semitic Etymology. II", The American Journal of Semitic Languages and Literatures, Vol. 34, No. 4. (Jul., 1918), p. 215–255 (p. 230)
- Pline l'Ancien, L'Histoire Naturelle, XXIII, 23
- Voir par exemple Diana Fernando, Alchemy : an illustrated A to Z (1998)
- Paul Depovere, La classification périodique des éléments. La merveille fondamentale de l'Univers, De Boeck Supérieur, , p. 98.
- (de) Edmund von Lippmann (1919) Entstehung und Ausbreitung der Alchemie, teil 1. Berlin: Julius Springer, p. 643-5
- Lippmann, p. 642
- Greek-Englis Lexicon de Liddel-Scott-Jones : la déclinaison et la vocalisation varient ; Endlich, F.M. On Some Interesting Derivations of Mineral Names, The American Naturalist, Vol. 22, No. 253. (Jan., 1888), p. 21–32 (p. 28) ; Celse, 6.6.6 ff ; Pline, L'Histoire Naturelle 33.33 ; Lewis and Short : Latin Dictionary.
- Sarton, George. (1935) Review of Al-morchid fi'l-kohhl, ou Le guide d'oculistique, traduit par Max Meyerhof. Isis (1935), 22(2):539-542
- Endlich, p. 28, l'avantage de as-stimmi serait qu'il partage une syllabe entière avec antimonium.
- Source Encyclopédie ou dictionnaire raisonné des sciences, des arts et des métiers
- [PDF] IRSN, Fiche radionucléide - Antimoine 125 et environnement, 25 p.
- [PDF] Sciences & Avenir no 360, février 1977
- Alain Foucault, opus cité.
- [www.developpement-durable.gouv.fr/document144505 Fichier source PDF]
- Dosage de l'antimoine sanguin - Biotox - INRS (Institut national de recherche et de sécurité)
- Shotyk W, Krachler M, Chen B. Contamination of Canadian and European bottled waters with antimony from PET containers . J Environ Monit. 2006;8(2):288- 92
- OMS/WHO (2003) Antimony in Drinking-water ;14
- Page 2 - Recommandations pour la qualité de l'eau potable au Canada : documentation à l'appui : Antimoine
- Sécurité et santé au travail : INRS
- Trioxyde de diantimoine, FT 198
- Trihydrure d'antimoine, FT 202
- Gurnani, N., Sharma, A., & Talukder, G. (1992). Comparison of the clastogenic effects of antimony trioxide on micein vivo following acute and chronic exposure. Biometals, 5(1), 47-50|résumé.
- Gurnani, N., Sharma, A., & Talukder, G. (1993). Comparison of clastogenic effects of antimony and bismuth as trioxides on mice in vivo. Biological trace element research, 37(2-3), 281-292|résumé
- Elliott, B. M., Mackay, J. M., Clay, P., & Ashby, J. (1998). An assessment of the genetic toxicology of antimony trioxide. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 415(1), 109-117|résumé.
- Beliaeva AP. The effect of antimony on the generative function.(0016 -9919
- Jelnes J.E (1988). Semen quality in workers producing reinforced plastic | Reproductive Toxicology, 2(3-4), 209-212.|résumé
- : métaux et métalloïde des recherches de la cohorte Elfe ; Décembre 2016 ; SANTÉ PUBLIQUE France / Imprégnation des femmes enceintes par les polluants de l’environnement en France en 2011. Volet périnatal du programme national de biosurveillance|PDF, 224p|Aussi disponible à partir de l’URL : www.santepubliquefrance.fr
- Fort M, Grimalt JO, Querol X, Casas M, Sunyer J. Evaluation of atmospheric inputs as possible sources of antimony in pregnant women from urban areas . Science of The Total Environment. 2016;544:391 -9
- BRGM (2012) Panorama 2011 du marché de l'antimoine – Rapport public . Orléans: BRGM, Contract No.: RP -61342- FR
- Kerstin Hockmann, , Susan Tandy, , Markus Lenz, , René Reiser, , Héctor M. Conesa, , Martin Keller, , Björn Studer, , Rainer Schulin (2015), Antimony retention and release from drained and waterlogged shooting range soil under field conditions ; Chemosphere, Volume 134, September 2015, Pages 536–543
- Okkenhaug G, Gebhardt KAG, Amstaetter K, Bue HL, Herxel H, Almås ÅR, Cornelissen G, Breedveld GD, Rasmussen G, Mulder J (2016) Antimony (Sb) and lead (Pb) in contaminated shooting range soils: Sb and Pb mobility and immobilization by iron based sorbents, a field study. Journal of Hazardous Materials 307:336-343.
- NRC (2000) Toxicological Risks of Selected Flame -Retardant Chemicals | Washington, DC: National Research Council.
- admin.ch, Antimoine dans les denrées alimentaires et repas de commodité conditionnés en barquettes de PET, 23.08.2007. Consulté le 10 juin 2013.
- « Med'Vet - Médicament GLUCANTIME® », sur www.med-vet.fr (consulté le )
- Arnaud de la Grange, « Pékin joue de l'arme des « terres rares » », Le Figaro, 25 octobre 2010
- « Indicateur des échanges import/export », sur Direction générale des douanes. Indiquer NC8=81101000 (consulté le )
Voir aussi
Bibliographie
- Hubert Brill, Jean-Jacques Perichaud, « Les gisements d'antimoine » dans Les richesses du sous-sol en Auvergne et Limousin, 1986, édité par la ville d'Aurillac, p. 165-178.
- Couto, H., Roger, G., Moëlo, Y., & Bril, H. (1990). Le district à antimoine-or Dúrico-Beirão (Portugal): évolution paragénétique et géochimique; implications métallogéniques. Mineralium Deposita, 25(1), S69-S81 (https://link.springer.com/article/10.1007/BF00205252#page-1 Lien vers pages 1 et 2 (extrait)]).
- Pierre-Christian Guiollard, La mine d'or et d'antimoine de la Lucette, auteur-éditeur, 1996.
- Pierre-Christian Guiollard, L'Industrie minière de l'antimoine et du tungstène", Editions Atlantica, 2010.
- Nicolas Lemery, Traité de l'antimoine, contenant l'analyse chymique de ce mineral [et] un recueil d'un grand nombre d'opérations rapportées à l'Académie Royale des Sciences ..., Chez Jean Boudot, 1707, 670 page. en ligne
- [PDF] IRSN, Fiche pédagogique sur l'antimoine-125 (125Sb) et l'environnement, 25 p.
- Lauwers LF, Roelants A, Rosseel PM, Heyndrickx B, Baute L. (1990) Oral antimony intoxications in man | Critical care medicine. ;18(3):324-6.
Articles connexes
- Acide fluoroantimonique
- Acide magique, un superacide
- Antimoine (maladie professionnelle)
- Antimoine natif
- Antimoniate de méglumine
- Antimonite
- Antimoniure d'aluminium semi-conducteur
- Antimoniure de gallium semi-conducteur
- Antimoniure d'indium semi-conducteur
- Balle (projectile)
- Barbe (cristallographie)
- Cervantite ou ocre d'antimoine
- Compagnie des mines de La Lucette
- Éléments de la période 5
- Éléments du bloc p
- Grenaille ou Grenaille de plomb
- Hydrure d'antimoine
- Isotopes de l'antimoine
- Jaune de Naples ou antimoniate de Pb
- Mascara originel
- Pentafluorure d'antimoine
- Plomb typographique, Poinçon (imprimerie)
- Régule
- Semi-conducteur III-V
- Pnictogène et Pnicture
- Stibarsen
- Stibine (minéral) ou antimonite, stibnite
- Stibogluconate de sodium
- Sulfure d'antimoine (III)
- TAGS
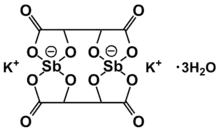
- Tartrate d'antimoine et de potassium ou tartre émétique
- Tellurure d'antimoine
- Trichlorure d'antimoine ou beurre d'antimoine des Anciens
- Trifluorure d'antimoine
- Trioxyde d'antimoine
- Vermillon d'antimoine
Liens externes
- Métallurgie de l'antimoine, traduction du texte écrit en 1894 par Carl Schnabel (de)
- Fiche antimoine de la SCF
- BRGM, Panorama 2011 du marché de l'antimoine, juillet 2012
- Claire König, Tout savoir sur l'antimoine, futura-sciences, 2 février 2009 ou en version PDF complète
- Sb sur le site de l'Union des PPC
- (en) Images d'antimoine sous différentes formes
- (en) « Technical data for Antimony » (consulté le ), avec en sous-pages les données connues pour chaque isotope
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||
| Métaux Alcalins |
Alcalino- terreux |
Lanthanides | Métaux de transition |
Métaux pauvres |
Métal- loïdes |
Non- métaux |
Halo- gènes |
Gaz nobles |
Éléments non classés |
| Actinides | |||||||||
| Superactinides | |||||||||
- Portail des minéraux et roches
- Portail de la chimie


