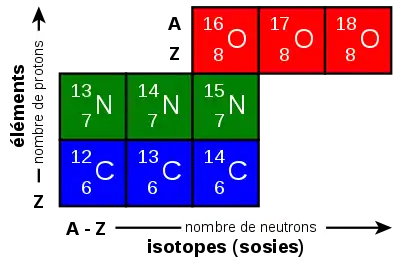
Isotope
On appelle isotopes (d'un certain élément chimique) les nucléides partageant le même nombre de protons (caractéristique de cet élément), mais ayant un nombre de neutrons différent. Autrement dit, si l'on considère deux nucléides dont les nombres de protons sont Z et Z', et les nombres de neutrons N et N', ces nucléides sont dits isotopes si Z = Z' et N ≠ N'.
Par extension, on appelle souvent isotope un nucléide caractérisé par son nombre de protons Z et son nombre de neutrons N (ou son nombre de masse A = Z + N), mais sans distinction concernant son spin ou son état énergétique.
Contexte — En physique nucléaire et en chimie, chaque noyau d'atome ou nucléide est défini par son nombre de protons Z (appelé aussi numéro atomique, qui définit d'ailleurs le type d'élément chimique), son nombre de neutrons N, son spin s et son niveau énergétique.
Les isotopes ne doivent pas être confondus avec :
- les isotones, nucléides ayant le même nombre de neutrons mais un nombre de protons différent (Z ≠ Z' mais N = N') ;
- les isobares, nucléides ayant des nombres de protons différents, des nombres de neutrons différents, mais des nombres de masse identiques (Z ≠ Z', N ≠ N', mais Z + N = A = A' = Z' + N') ;
- les isomères, nucléides ayant le même nombre de protons Z et le même nombre de neutrons N (donc aussi le même nombre de masse A), mais pas le même spin ni le même niveau énergétique.
Notation
Chaque isotope est représenté par un symbole A
ZM composé de :
- son symbole chimique M (H, He, Li, etc.) ;
- son nombre de masse A (égal au nombre de nucléons de l'atome), placé en haut et à gauche du symbole chimique ;
- son numéro atomique Z, placé en bas et à gauche du symbole chimique.
Le carbone 12 et le carbone 14, deux isotopes de l'élément carbone, sont ainsi notés 12
6C et 14
6C. Le numéro atomique est souvent omis, car redondant avec le symbole chimique[alpha 1] : 12C et 14C, par exemple.
On peut également représenter les isotopes par leur nom suivi de leur nombre de masse séparé par une espace (et non un tiret, contrairement à l'anglais) : carbone 14, oxygène 18, fer 56, etc.
Cas particulier de l'hydrogène : les isotopes les plus courants de l'hydrogène sont normalement notés 1H (protium), 2H (deutérium) et 3H (tritium), mais l'IUPAC admet aussi (sans toutefois le recommander) l'usage des symboles D et T pour le deutérium et le tritium[alpha 2], en raison de l'effet isotopique marqué de ces isotopes par rapport au protium.
Propriétés
Les propriétés des atomes étant essentiellement régies par leurs cortèges électroniques, les isotopes d'un même élément chimique ont essentiellement les mêmes propriétés physiques et chimiques, qualitativement et quantitativement[alpha 3]. La différence de masse entre isotopes, parce qu'elle affecte l'énergie cinétique des atomes et des molécules, entraîne cependant de légères différences de propriétés, appelées effets isotopiques. Ces effets sont d'autant plus importants que la différence relative de masse est grande ; ils sont donc maximaux pour l'hydrogène (la masse de 2H est le double de celle de 1H) et minimaux pour les éléments les plus lourds (la masse de 235U, par exemple, n'est supérieure à celle de 234U que de 0,4 %).
- Un premier effet concerne les propriétés à l'équilibre. Quand dans un corps simple on remplace un atome par un isotope plus lourd, on augmente notamment, mais légèrement, les températures de fusion et d'ébullition, ainsi que les chaleurs latentes correspondantes (de fusion et de vaporisation). Leurs valeurs sont ainsi de 3,81 °C, 101,42 °C, 6,132 kJ/mol et 41,521 kJ/mol pour l'eau lourde 2H216O, contre 0 °C, 100 °C, 6,007 kJ/mol et 40,657 kJ/mol pour l'eau légère 1H216O.
- Un second effet concerne la vitesse des processus de retour à l'équilibre (écoulement, diffusion, réactions chimiques, etc.). Quand dans un corps simple on remplace un atome par un isotope plus lourd, toutes ces vitesses sont diminuées. La viscosité de l'eau à 20 °C est ainsi de 1,246 7 × 10−3 Pa s pour l'eau lourde, contre 1,001 6 × 10−3 Pa s pour l'eau légère.
Ces effets sont mis à profit pour séparer les isotopes (pour la recherche, la médecine et l'industrie nucléaire, notamment). Les températures d'ébullition légèrement différentes ont par exemple permis les premiers enrichissements isotopiques par distillation à l'aide d'une colonne de distillation à bande tournante[1]. L'enrichissement en 235U de l'uranium naturel se fait aujourd'hui par diffusion thermique, diffusion à l'état gazeux, centrifugation ou séparation électromagnétique.
Stabilité
Il existe 80 éléments chimiques ayant au moins un isotope stable, de l'hydrogène 1H au plomb 82Pb (81 éléments si l'on inclut le bismuth 83Bi[alpha 4]). Le technétium 43Tc, le prométhium 61Pm et tous les éléments de numéro atomique supérieur à 83 n'ont, quant à eux, aucun isotope stable.
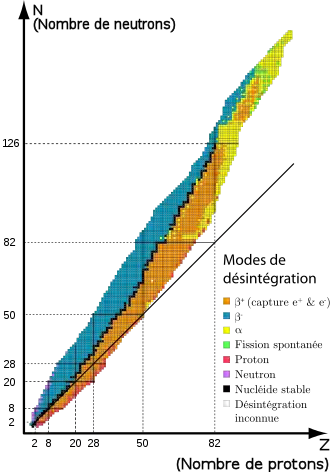
Le noyau d'un atome est constitué d'une part de protons qui se repoussent sous l'action de l'interaction électromagnétique (les charges électriques de même nature se repoussent) mais qui s'attirent sous l'action de l'interaction forte. Dans un noyau, la stabilité est donc assurée par l'interaction forte, et par les neutrons qui, éloignant les protons les uns des autres, diminuent l'intensité de la répulsion électromagnétique entre les protons, d'où les propriétés suivantes :
Pour ces centaines d'isotopes naturels, les nombres respectifs de protons et de neutrons semblent respecter certaines règles :
- le nombre de neutrons est à peu près égal à celui des protons pour les éléments légers ; à partir du 21Sc, le nombre de neutrons devient supérieur au nombre de protons, l'excédent dépassant 50 % pour les éléments les plus lourds ;
- certains noyaux particulièrement stables contiennent des protons ou des neutrons (ou les deux) en nombre égal à un des « nombres magiques » suivants : 2, 8, 20, 28, 50, 82, 126. Selon les théories actuelles, ces valeurs correspondraient à des noyaux possédant des couches complètes de neutrons ou de protons.
- les éléments de nombre Z impair possèdent moins d'isotopes stables que les éléments de nombre Z pair.
Il existe des milliers de noyaux instables, de durée de vie très courte (jusqu'à 10−23 seconde), qui ne peuvent être produits qu'en laboratoire. On les qualifie de noyaux exotiques, notamment en raison de leurs propriétés spécifiques (grandes déformations, halos de neutron, etc.).
Utilisations
Analyse isotopique
Un exemple très connu de couple d'isotopes est constitué par le carbone : le carbone est présent en grande majorité sous son isotope de poids atomique 12 (le « carbone 12 ») ; d'autre part, on peut trouver en faible quantité l'isotope de poids atomique 14 (le carbone 14), qui est chimiquement strictement équivalent au carbone 12, mais qui est radioactif. En effet, les neutrons supplémentaires du noyau rendent l'atome instable. Il se désintègre en donnant de l'azote 14 et en émettant un rayonnement bêta.
- Le rapport 18O/16O (par exemple dans les apatites des fossiles de vertébrés) permet, dans une certaine mesure, de reconstituer certains paléoclimats[2] ;
- Dans le domaine médical (médecine légale, médecine du travail, toxicologie, etc.) l'analyse isotopique permet de différencier diverses sources de contamination, et souvent d'identifier ainsi la source d'une intoxication[3] ;
- Dans le domaine de l'évaluation environnementale, l'analyse isotopique d'un organisme, du sol ou de sédiments permet de différentier la partie naturelle de la part anthropique d'une contamination par certains métaux, dont le plomb[4]. Sur la base de signatures isotopiques particulières, on peut distinguer le plomb de céramiques, du plomb issu de la combustion du charbon et de l'essence[4]. On peut ainsi tracer l'origine d'une pollution actuelle ou passée (déposée dans les sédiments). On a ainsi pu montrer que dans la Baie de San Simón (partie intérieure de la Ría de Vigo située au nord-ouest de l'Espagne), selon les époques, l'homme a été responsable de 25 à 98 % des apports de plomb trouvé dans les échantillons de la zone intertidale, et de 9 à 84 % dans les échantillons subtidaux. Les variations temporelles observées dans les carottes de sédiments ont pu être reliées, d'abord aux retombées de fumées de combustion de charbon (60 à 70 % du plomb de la baie) avant la création d'une usine de céramique dans la région (dans les années 1970), qui est alors devenue la principale source de plomb (de 95 à 100 % des apports), avant qu'une nouvelle source soit dominante : l'essence plombée[4]. L'histoire des immiscions de plomb dans l'environnement de cette baie a pu être ainsi déterminée pour tout le XXe siècle, et même pour le XIXe siècle pour la zone subtidale[4].
- L'analyse isotopique est utilisée dans les études du réseau trophique. En effet, les consommateurs présentent une signature isotopique directement reliée à celle de leurs aliments (elle en diffère peu, et suivant une loi connue). En analysant les rapports isotopiques d'un consommateur et de ses aliments potentiels, il est possible de reconstituer le régime probable du consommateur[5].
- La lutte contre les fraudes utilise la précision de ces analyses pour élucider des responsabilités criminelles (détermination de la marque d'une cartouche de chasse ou origine d'une balle à partir d'un échantillon de plomb) ou de fraudes alimentaires[6] (par exemple l'analyse des rapports isotopiques stables (13C/12C et 15N/14N) d'échantillons de viande d'agneau (mesurée par spectrométrie de masse isotopique) permet de confirmer ou infirmer une origine géographique, ou même de savoir si l'animal a uniquement tété le lait de sa mère, ou reçu des supplémentations solides (maïs, soja…) ou été nourri d'herbe naturelle[6]…
Ces analyses permettent aussi de différencier certains types d'agneau, mais aussi de vin, de jus de fruits, de miel[6] ou de produits laitiers et fromages (dont AOC par exemple[7]).
Un simple échantillon haché solide suffit et permet d'acquérir l'information pour un grand nombre de métabolites (acides aminés, acides gras, sucres, etc.)[8].
Séparation des isotopes par centrifugation
La proportion de l'isotope stable par rapport à l'isotope instable est la même dans l'atmosphère et dans les tissus des êtres vivants, mais elle varie régulièrement au cours du temps à la mort de l'individu, puisque les échanges sont stoppés. C'est sur cette variation que se base la plus connue des méthodes de datation radioactive par couple d'isotopes, qui est la méthode de datation par le carbone 14. C'est certainement l'application la plus importante du concept d'isotope. Les traceurs isotopiques sont une autre application de ce concept.
Une application majeure est la séparation des isotopes 235U et 238U de l'uranium, aussi appelé enrichissement ; cette séparation est obtenue par diffusion gazeuse ou par centrifugation d'hexafluorure d'uranium UF6.
La centrifugation se réalise dans une cascade de centrifugeuses qui élèvent petit à petit le taux de 235U dans le mélange 235U-238U, pour des applications civiles (enrichissement de 5 %) ou militaires (90 %).
Les centrifugeuses sont des cylindres étroits tournant à vitesse élevée. La force centrifuge est égale à M.ω2.r où M est la masse unitaire, ω la vitesse angulaire de rotation et r le rayon du cylindre. Pour éviter une rupture mécanique, on choisit r petit et, afin d'avoir une force appréciable, on choisit ω très élevée (la force est proportionnelle au carré de la vitesse de rotation). Le taux d'enrichissement recherché est obtenu en disposant une quantité importante de centrifugeuses en série (des milliers). Ce mode de séparation est utilisé par des industriels canadiens, russes, européens.
Table des isotopes
Les demi-vies sont indiquées par la couleur de la cellule de chaque isotope ; les isotopes ayant deux modes de désintégration qui diffèrent par leur demi-vie ont des couleurs de fond et de bordure différentes.
| Él | Instable | Simplement listés mais non détaillés |
| Él | 1-10 jours | |
| Él | 10-100 jours | |
| Él | 100 jours - 10 années | |
| Él | 10-10 000 années | |
| Él | >10 000 années | |
| Él | Radioélément naturel. Période < 1012 a | |
| Él | Stable. Période > 1012 a | Couleur de fond grise et bordure ocre si le radionucléide est présent dans la nature |
| p | 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | 2 | 3 | 4 | 5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| n | H | He | Li | Be | B | 6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | D | 3He | 4Li | 5Be | 6B | C | 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | T | 4He | 5Li | 6Be | 7B | 8C | N | 8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 | 4H | 5He | 6Li | 7Be | 8B | 9C | 10N | O | 9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 | 5H | 6He | 7Li | 8Be | 9B | 10C | 11N | 12O | F | 10 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5 | 6H | 7He | 8Li | 9Be | 10B | 11C | 12N | 13O | 14F | Ne | 11 | 12 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6 | 7H | 8He | 9Li | 10Be | 11B | 12C | 13N | 14O | 15F | 16Ne | Na | Mg | 13 | 14 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7 | 9He | 10Li | 11Be | 12B | 13C | 14N | 15O | 16F | 17Ne | 18Na | 19Mg | Al | Si | 15 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 8 | 10He | 11Li | 12Be | 13B | 14C | 15N | 16O | 17F | 18Ne | 19Na | 20Mg | 21Al | 22Si | P | 16 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 9 | 12Li | 13Be | 14B | 15C | 16N | 17O | 18F | 19Ne | 20Na | 21Mg | 22Al | 23Si | 24P | S | 17 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 10 | 14Be | 15B | 16C | 17N | 18O | 19F | 20Ne | 21Na | 22Mg | 23Al | 24Si | 25P | 26S | Cl | 18 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 11 | 15Be | 16B | 17C | 18N | 19O | 20F | 21Ne | 22Na | 23Mg | 24Al | 25Si | 26P | 27S | 28Cl | Ar | 19 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 12 | 16Be | 17B | 18C | 19N | 20O | 21F | 22Ne | 23Na | 24Mg | 25Al | 26Si | 27P | 28S | 29Cl | 30Ar | K | 20 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 13 | 18B | 19C | 20N | 21O | 22F | 23Ne | 24Na | 25Mg | 26Al |
27Si | 28P | 29S | 30Cl | 31Ar | 32K | Ca | 21 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 14 | 19B | 20C | 21N | 22O | 23F | 24Ne | 25Na | 26Mg | 27Al | 28Si | 29P | 30S | 31Cl | 32Ar | 33K | 34Ca | Sc | 22 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 15 | 21C | 22N | 23O | 24F | 25Ne | 26Na | 27Mg | 28Al | 29Si | 30P | 31S | 32Cl | 33Ar | 34K | 35Ca | 36Sc | Ti | 23 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 16 | 22C | 23N | 24O | 25F | 26Ne | 27Na | 28Mg | 29Al | 30Si | 31P | 32S | 33Cl | 34Ar | 35K | 36Ca | 37Sc | 38Ti | V | 24 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 17 | 24N | 25O | 26F | 27Ne | 28Na | 29Mg | 30Al | 31Si | 32P | 33S | 34Cl | 35Ar | 36K | 37Ca | 38Sc | 39Ti | 40V | Cr | 25 | 26 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 18 | 25N | 26O | 27F | 28Ne | 29Na | 30Mg | 31Al | 32Si | 33P | 34S | 35Cl | 36Ar | 37K | 38Ca | 39Sc | 40Ti | 41V | 42Cr | Mn | Fe | 27 | 28 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 19 | 27O | 28F | 29Ne | 30Na | 31Mg | 32Al | 33Si | 34P | 35S | 36Cl | 37Ar | 38K | 39Ca | 40Sc | 41Ti | 42V | 43Cr | 44Mn | 45Fe | Co | Ni | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 20 | 28O | 29F | 30Ne | 31Na | 32Mg | 33Al | 34Si | 35P | 36S | 37Cl | 38Ar | 39K | 40Ca | 41Sc | 42Ti | 43V | 44Cr | 45Mn | 46Fe | 47Co | 48Ni | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 21 | 30F | 31Ne | 32Na | 33Mg | 34Al | 35Si | 36P | 37S | 38Cl | 39Ar | 40K | 41Ca | 42Sc | 43Ti | 44V | 45Cr | 46Mn | 47Fe | 48Co | 49Ni | 29 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 22 | 31F | 32Ne | 33Na | 34Mg | 35Al | 36Si | 37P | 38S | 39Cl | 40Ar | 41K | 42Ca | 43Sc | 44Ti | 45V | 46Cr | 47Mn | 48Fe | 49Co | 50Ni | Cu | 30 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 23 | 33Ne | 34Na | 35Mg | 36Al | 37Si | 38P | 39S | 40Cl | 41Ar | 42K | 43Ca | 44Sc | 45Ti | 46V | 47Cr | 48Mn | 49Fe | 50Co | 51Ni | 52Cu | Zn | 31 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 24 | 34Ne | 35Na | 36Mg | 37Al | 38Si | 39P | 40S | 41Cl | 42Ar | 43K | 44Ca | 45Sc | 46Ti | 47V | 48Cr | 49Mn | 50Fe | 51Co | 52Ni | 53Cu | 54Zn | Ga | 32 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 25 | 36Na | 37Mg | 38Al | 39Si | 40P | 41S | 42Cl | 43Ar | 44K | 45Ca | 46Sc |
47Ti | 48V | 49Cr | 50Mn | 51Fe | 52Co | 53Ni | 54Cu | 55Zn | 56Ga | Ge | 33 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 26 | 37Na | 38Mg | 39Al | 40Si | 41P | 42S | 43Cl | 44Ar | 45K | 46Ca | 47Sc | 48Ti | 49V | 50Cr | 51Mn | 52Fe | 53Co | 54Ni | 55Cu | 56Zn | 57Ga | 58Ge | As | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 27 | 39Mg | 40Al | 41Si | 42P | 43S | 44Cl | 45Ar | 46K | 47Ca | 48Sc | 49Ti | 50V |
51Cr | 52Mn |
53Fe | 54Co | 55Ni | 56Cu | 57Zn | 58Ga | 59Ge | 60As | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 28 | 40Mg | 41Al | 42Si | 43P | 44S | 45Cl | 46Ar | 47K | 48Ca | 49Sc | 50Ti | 51V | 52Cr | 53Mn | 54Fe | 55Co | 56Ni | 57Cu | 58Zn | 59Ga | 60Ge | 61As | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 29 | 42Al | 43Si | 44P | 45S | 46Cl | 47Ar | 48K | 49Ca | 50Sc | 51Ti | 52V | 53Cr | 54Mn | 55Fe | 56Co | 57Ni | 58Cu | 59Zn | 60Ga | 61Ge | 62As | 34 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 30 | 44Si | 45P | 46S | 47Cl | 48Ar | 49K | 50Ca | 51Sc | 52Ti | 53V | 54Cr | 55Mn | 56Fe | 57Co | 58Ni | 59Cu | 60Zn | 61Ga | 62Ge | 63As | Se | 35 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 31 | 46P | 47S | 48Cl | 49Ar | 50K | 51Ca | 52Sc | 53Ti | 54V | 55Cr | 56Mn | 57Fe | 58Co |
59Ni | 60Cu | 61Zn | 62Ga | 63Ge | 64As | 65Se | Br | 36 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 32 | 48S | 49Cl | 50Ar | 51K | 52Ca | 53Sc | 54Ti | 55V | 56Cr | 57Mn | 58Fe | 59Co | 60Ni | 61Cu | 62Zn | 63Ga | 64Ge | 65As | 66Se | 67Br | Kr | 37 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 33 | 49S | 50Cl | 51Ar | 52K | 53Ca | 54Sc | 55Ti | 56V | 57Cr | 58Mn | 59Fe | 60Co |
61Ni | 62Cu | 63Zn | 64Ga | 65Ge | 66As | 67Se | 68Br | 69Kr | Rb | 38 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 34 | 51Cl | 52Ar | 53K | 54Ca | 55Sc | 56Ti | 57V | 58Cr | 59Mn | 60Fe | 61Co | 62Ni | 63Cu | 64Zn | 65Ga | 66Ge | 67As | 68Se | 69Br | 70Kr | 71Rb | Sr | 39 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 35 | 53Ar | 54K | 55Ca | 56Sc | 57Ti | 58V | 59Cr | 60Mn | 61Fe | 62Co | 63Ni | 64Cu | 65Zn | 66Ga | 67Ge | 68As | 69Se | 70Br | 71Kr | 72Rb | Y | 40 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 36 | 55K | 56Ca | 57Sc | 58Ti | 59V | 60Cr | 61Mn | 62Fe | 63Co | 64Ni | 65Cu | 66Zn | 67Ga | 68Ge | 69As | 70Se | 71Br | 72Kr | 73Rb | Zr | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 37 | 57Ca | 58Sc | 59Ti | 60V | 61Cr | 62Mn | 63Fe | 64Co | 65Ni | 66Cu | 67Zn | 68Ga | 69Ge | 70As | 71Se | 72Br | 73Kr | 74Rb | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 38 | 59Sc | 60Ti | 61V | 62Cr | 63Mn | 64Fe | 65Co | 66Ni | 67Cu | 68Zn | 69Ga | 70Ge | 71As | 72Se | 73Br | 74Kr | 75Rb | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 39 | 60Sc | 61Ti | 62V | 63Cr | 64Mn | 65Fe | 66Co | 67Ni | 68Cu | 69Zn | 70Ga | 71Ge |
72As | 73Se | 74Br | 75Kr | 76Rb | 77Sr | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 40 | 62Ti | 63V | 64Cr | 65Mn | 66Fe | 67Co | 68Ni | 69Cu | 70Zn | 71Ga | 72Ge | 73As | 74Se | 75Br | 76Kr | 77Rb | 78Sr | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 41 | 63Ti | 64V | 65Cr | 66Mn | 67Fe | 68Co | 69Ni | 70Cu | 71Zn | 72Ga | 73Ge | 74As | 75Se | 76Br | 77Kr | 78Rb | 79Sr | 81Zr | 41 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 42 | 65V | 66Cr | 67Mn | 68Fe | 69Co | 70Ni | 71Cu | 72Zn | 73Ga | 74Ge | 75As | 76Se | 77Br |
78Kr | 79Rb | 80Sr | 81Y | 82Zr | Nb | 42 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 43 | 67Cr | 68Mn | 69Fe | 70Co | 71Ni | 72Cu | 73Zn | 74Ga | 75Ge | 76As | 77Se |
78Br | 79Kr |
80Rb | 81Sr | 82Y | 83Zr | 84Nb | Mo | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 44 | 69Mn | 70Fe | 71Co | 72Ni | 73Cu | 74Zn | 75Ga | 76Ge | 77As | 78Se | 79Br |
80Kr | 81Rb | 82Sr | 83Y | 84Zr | 43 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 45 | 71Fe | 72Co | 73Ni | 74Cu | 75Zn | 76Ga | 77Ge | 78As | 79Se |
80Br | 81Kr |
82Rb | 83Sr |
84Y | 85Zr | 86Nb | 87Mo | Tc | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 46 | 72Fe | 73Co | 74Ni | 75Cu | 76Zn | 77Ga | 78Ge | 79As | 80Se | 81Br | 82Kr | 83Rb | 84Sr | 85Y | 86Zr | 87Nb | 88Mo | 44 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 47 | 74Co | 75Ni | 76Cu | 77Zn | 78Ga | 79Ge | 80As | 81Se | 82Br |
83Kr | 84Rb |
85Sr |
86Y | 87Zr | 88Nb | 89Mo | 90Tc | Ru | 45 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 48 | 75Co | 76Ni | 77Cu | 78Zn | 79Ga | 80Ge | 81As | 82Se | 83Br | 84Kr | 85Rb | 86Sr | 87Y |
88Zr | 89Nb | 90Mo | 91Tc | 92Ru | Rh | 46 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 49 | 77Ni | 78Cu | 79Zn | 80Ga | 81Ge | 82As | 83Se | 84Br | 85Kr |
86Rb |
87Sr |
88Y |
89Zr |
90Nb | 91Mo | 92Tc | 93Ru | Pd | 47 | 48 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 50 | 78Ni | 79Cu | 80Zn | 81Ga | 82Ge | 83As | 84Se | 85Br | 86Kr | 87Rb | 88Sr | 89Y |
90Zr |
91Nb |
92Mo | 93Tc | 94Ru | 95Rh | Ag | Cd | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 51 | 80Cu | 81Zn | 82Ga | 83Ge | 84As | 85Se | 86Br | 87Kr | 88Rb | 89Sr | 90Y |
91Zr | 92Nb |
93Mo |
94Tc | 95Ru | 96Rh | 97Pd | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 52 | 82Zn | 83Ga | 84Ge | 85As | 86Se | 87Br | 88Kr | 89Rb | 90Sr | 91Y |
92Zr | 93Nb |
94Mo | 95Tc |
96Ru | 97Rh | 98Pd | 99Ag | 100Cd | 49 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 53 | 83Zn | 84Ga | 85Ge | 86As | 87Se | 88Br | 89Kr | 90Rb | 91Sr | 92Y | 93Zr | 94Nb |
95Mo | 96Tc |
97Ru | 98Rh | 99Pd | 100Ag | 101Cd | In | 50 | 51 | 52 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 54 | 85Ga | 86Ge | 87As | 88Se | 89Br | 90Kr | 91Rb | 92Sr | 93Y | 94Zr | 95Nb |
96Mo | 97Tc |
98Ru | 99Rh |
100Pd | 101Ag | 102Cd | Sn | Sb | Te | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 55 | 86Ga | 87Ge | 88As | 89Se | 90Br | 91Kr | 92Rb | 93Sr | 94Y | 95Zr | 96Nb | 97Mo | 98Tc | 99Ru | 100Rh | 101Pd | 102Ag | 103Cd | 104In | 107Te | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 56 | 88Ge | 89As | 90Se | 91Br | 92Kr | 93Rb | 94Sr | 95Y | 96Zr | 97Nb | 98Mo | 99Tc |
100Ru | 101Rh |
102Pd | 103Ag | 104Cd | 105In | 108Te | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 57 | 89Ge | 90As | 91Se | 92Br | 93Kr | 94Rb | 95Sr | 96Y | 97Zr | 98Nb | 99Mo | 100Tc | 101Ru | 102Rh | 103Pd | 104Ag | 105Cd | 106In | 107Sn | 109Te | 53 | 54 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 58 | 91As | 92Se | 93Br | 94Kr | 95Rb | 96Sr | 97Y | 98Zr | 99Nb | 100Mo | 101Tc | 102Ru | 103Rh |
104Pd | 105Ag |
106Cd | 107In | 108Sn | I | Xe | 55 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 59 | 92As | 93Se | 94Br | 95Kr | 96Rb | 97Sr | 98Y | 99Zr | 100Nb | 101Mo | 102Tc | 103Ru | 104Rh | 105Pd | 106Ag |
107Cd | 108In | 109Sn | 110Sb | 111Te | 113Xe | Cs | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 60 | 94Se | 95Br | 96Kr | 97Rb | 98Sr | 99Y | 100Zr | 101Nb | 102Mo | 103Tc | 104Ru | 105Rh |
106Pd | 107Ag |
108Cd | 109In | 110Sn | 111Sb | 112Te | 113I | 114Xe | 56 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 61 | 96Br | 97Kr | 98Rb | 99Sr | 100Y | 101Zr | 102Nb | 103Mo | 104Tc | 105Ru | 106Rh | 107Pd |
108Ag |
109Cd | 110In | 111Sn | 112Sb | 113Te | 114I | 115Xe | 116Cs | Ba | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 62 | 97Br | 98Kr | 99Rb | 102Zr | 103Nb | 104Mo | 105Tc | 106Ru | 107Rh | 108Pd | 109Ag |
110Cd | 111In |
112Sn | 113Sb | 114Te | 115I | 116Xe | 117Cs | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 63 | 99Kr | 102Y | 104Nb | 105Mo | 106Tc | 107Ru | 108Rh | 109Pd | 110Ag |
111Cd |
112In | 113Sn |
114Sb | 115Te | 116I | 117Xe | 118Cs | 119Ba | 57 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 64 | 100Kr | 105Nb | 106Mo | 107Tc | 108Ru | 109Rh | 110Pd | 111Ag |
112Cd | 113In |
114Sn | 115Sb | 116Te | 117I | 118Xe | 119Cs | La | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 65 | 106Nb | 107Mo | 108Tc | 109Ru | 110Rh | 111Pd | 112Ag | 113Cd |
114In |
115Sn | 116Sb | 117Te | 118I | 119Xe | 120Cs | 121Ba | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 66 | 108Mo | 109Tc | 110Ru | 111Rh | 112Pd | 113Ag | 114Cd | 115In |
116Sn | 117Sb | 118Te | 119I | 120Xe | 121Cs | 122Ba | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 67 | 110Tc | 111Ru | 112Rh | 113Pd | 114Ag | 115Cd |
116In | 117Sn |
118Sb | 119Te |
120I | 121Xe | 122Cs | 123Ba | 58 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 68 | 112Ru | 113Rh | 114Pd | 115Ag | 116Cd | 117In | 118Sn | 119Sb | 120Te | 121I | 122Xe | 123Cs | 124Ba | 125La | Ce | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 69 | 113Ru | 114Rh | 115Pd | 116Ag | 117Cd | 118In | 119Sn |
120Sb |
121Te |
122I | 123Xe | 124Cs | 125Ba | 126La | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 70 | 116Pd | 117Ag | 118Cd | 119In | 120Sn | 121Sb | 122Te | 123I | 124Xe | 125Cs | 126Ba | 127La | 59 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 71 | 117Pd | 118Ag | 119Cd | 120In | 121Sn |
122Sb |
123Te |
124I | 125Xe | 126Cs | 127Ba | 128La | 129Ce | Pr | 60 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 72 | 118Pd | 119Ag | 120Cd | 121In | 122Sn | 123Sb | 124Te | 125I | 126Xe | 127Cs | 128Ba | 129La | 130Ce | Nd | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 73 | 120Ag | 121Cd | 122In | 123Sn |
124Sb |
125Te |
126I | 127Xe |
128Cs | 129Ba | 130La | 131Ce | 132Pr | 61 | 62 | 63 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 74 | 121Ag | 122Cd | 123In | 124Sn | 125Sb | 126Te | 127I | 128Xe | 129Cs | 130Ba | 131La | 132Ce | 133Pr | 134Nd | Pm | Sm | Eu | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 75 | 122Ag | 124In | 125Sn |
126Sb |
127Te |
128I | 129Xe |
130Cs | 131Ba |
132La | 133Ce | 134Pr | 135Nd | 137Sm | 64 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 76 | 123Ag | 124Cd | 125In | 126Sn | 127Sb | 128Te | 129I | 130Xe | 131Cs | 132Ba | 133La | 134Ce | 135Pr | 136Nd | 137Pm | 138Sm | 139Eu | Gd | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 77 | 126In | 127Sn | 128Sb | 129Te |
130I | 131Xe |
132Cs | 133Ba |
134La | 135Ce | 136Pr | 137Nd | 138Pm | 139Sm | 140Eu | 65 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 78 | 127In | 128Sn | 129Sb | 130Te | 131I | 132Xe | 133Cs | 134Ba | 135La | 136Ce | 137Pr | 138Nd | 139Pm | 140Sm | 141Eu | 142Gd | Tb | 66 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 79 | 128In | 129Sn | 130Sb | 131Te |
132I | 133Xe | 134Cs |
135Ba |
136La | 137Ce | 138Pr | 139Nd | 140Pm | 141Sm | 142Eu | 143Gd | Dy | 67 | 68 | 69 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 80 | 129In | 130Sn | 131Sb | 132Te | 133I | 134Xe | 135Cs |
136Ba |
137La | 138Ce | 139Pr | 140Nd | 141Pm | 142Sm | 143Eu | 144Gd | Ho | Er | Tm | 70 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 81 | 130In | 131Sn | 132Sb | 133Te | 134I | 135Xe | 136Cs |
137Ba |
138La | 139Ce |
140Pr | 141Nd | 142Pm | 143Sm | 144Eu | 145Gd | 146Tb | 147Dy | Yb | 71 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 82 | 131In | 132Sn | 133Sb | 134Te | 135I | 136Xe | 137Cs | 138Ba | 139La | 140Ce | 141Pr | 142Nd | 143Pm | 144Sm | 145Eu | 146Gd | 147Tb | 148Dy | 150Er | 151Tm | Lu | 72 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 83 | 132In | 133Sn | 134Sb | 135Te | 136I | 137Xe | 138Cs | 139Ba | 140La | 141Ce | 142Pr | 143Nd | 144Pm | 145Sm | 146Eu | 147Gd | 148Tb | 149Dy | 150Ho | 151Er | Hf | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 84 | 134Sn | 135Sb | 136Te | 137I | 138Xe | 139Cs | 140Ba | 141La | 142Ce |
143Pr | 144Nd |
145Pm | 146Sm | 147Eu | 148Gd | 149Tb | 150Dy | 151Ho | 152Er | 153Tm | 154Yb | 155Lu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 85 | 136Sb | 137Te | 138I | 139Xe | 140Cs | 141Ba | 142La | 143Ce | 144Pr | 145Nd | 146Pm | 147Sm | 148Eu | 149Gd | 150Tb | 151Dy | 152Ho | 153Er | 154Tm | 155Yb | 156Lu | 157Hf | 73 | 74 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 86 | 138Te | 139I | 140Xe | 141Cs | 142Ba | 143La | 144Ce | 145Pr | 146Nd | 147Pm | 148Sm |
149Eu | 150Gd | 151Tb | 152Dy | 153Ho | 154Er | 155Tm | 156Yb | 158Hf | Ta | W | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 87 | 140I | 141Xe | 142Cs | 143Ba | 144La | 145Ce | 146Pr | 147Nd | 148Pm |
149Sm |
150Eu |
151Gd | 152Tb | 153Dy | 154Ho | 155Er | 156Tm | 157Yb | 159Hf | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 88 | 141I | 142Xe | 143Cs | 144Ba | 145La | 146Ce | 147Pr | 148Nd | 149Pm | 150Sm | 151Eu | 152Gd |
153Tb | 154Dy | 155Ho | 156Er | 157Tm | 158Yb | 160Hf | 162W | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 89 | 142I | 143Xe | 144Cs | 145Ba | 146La | 147Ce | 148Pr | 149Nd | 150Pm | 151Sm | 152Eu |
153Gd | 154Tb | 155Dy | 156Ho | 157Er | 158Tm | 161Hf | 163W | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 90 | 144Xe | 145Cs | 146Ba | 147La | 148Ce | 149Pr | 150Nd | 151Pm | 152Sm | 153Eu | 154Gd | 155Tb | 156Dy | 157Ho | 158Er | 159Tm | 160Yb | 161Lu | 164W | 75 | 76 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 91 | 145Xe | 146Cs | 148La | 149Ce | 150Pr | 151Nd | 152Pm | 153Sm | 154Eu |
155Gd | 156Tb |
157Dy | 158Ho | 159Er | 160Tm | 161Yb | 162Lu | 165W | Re | Os | 77 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 92 | 150Ce | 151Pr | 152Nd | 153Pm | 154Sm | 155Eu | 156Gd | 157Tb | 158Dy | 159Ho | 160Er | 161Tm | 162Yb | 166W | Ir | 78 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 93 | 151Ce | 154Pm | 155Sm | 156Eu | 157Gd | 158Tb |
159Dy | 160Ho | 161Er | 162Tm | 163Yb | 164Lu | 166Ta | 169Os | Pt | 79 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 94 | 154Nd | 156Sm | 157Eu | 158Gd | 159Tb | 160Dy | 161Ho | 162Er | 163Tm | 164Yb | 165Lu | 166Hf | 167Ta | 170Os | 171Ir | Au | 80 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 95 | 157Sm | 158Eu | 159Gd | 160Tb | 161Dy | 162Ho | 163Er | 164Tm | 165Yb | 166Lu | 167Hf | 168Ta | 170Re | 171Os | 172Ir | 173Pt | Hg | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 96 | 159Eu | 160Gd | 161Tb | 162Dy | 163Ho |
164Er | 165Tm | 166Yb | 167Lu | 168Hf | 169Ta | 170W | 172Os | 171Ir | 174Pt | 175Au | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 97 | 160Eu | 161Gd | 162Tb | 163Dy | 164Ho | 165Er | 166Tm | 167Yb | 168Lu | 169Hf | 170Ta | 171W | 172Re | 173Os | 174Ir | 175Pt | 176Au | 177Hg | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 98 | 162Gd | 163Tb | 164Dy | 165Ho | 166Er | 167Tm | 168Yb | 169Lu |
170Hf | 171Ta | 172W | 174Os | 175Ir | 176Pt | 177Au | 178Hg | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 99 | 164Tb | 165Dy | 166Ho |
167Er |
168Tm | 169Yb |
170Lu | 171Hf | 172Ta | 173W | 174Re | 175Os | 176Ir | 177Pt | 178Au | 179Hg | 81 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 100 | 166Dy | 167Ho | 168Er | 169Tm | 170Yb | 171Lu |
172Hf | 173Ta | 174W | 175Re | 176Os | 177Ir | 178Pt | 179Au | 180Hg | Tl | 82 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 101 | 167Dy | 168Ho | 169Er | 170Tm | 171Yb | 172Lu |
173Hf | 174Ta | 175W | 176Re | 177Os | 178Ir | 179Pt | 181Hg | Pb | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 102 | 169Ho | 170Er | 171Tm | 172Yb | 173Lu | 174Hf |
175Ta | 176W | 177Re | 178Os | 179Ir | 180Pt | 181Au | 182Hg | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 103 | 170Ho | 171Er | 172Tm | 173Yb | 174Lu | 175Hf | 176Ta | 177W | 178Re | 179Os | 180Ir | 181Pt | 182Au | 183Hg | 184Tl | 185Pb | 83 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 104 | 172Er | 173Tm | 174Yb | 175Lu | 176Hf | 177Ta | 178W | 179Re | 180Os | 181Ir | 182Pt | 183Au | 184Hg | 185Tl | 186Pb | Bi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 105 | 173Er | 174Tm | 175Yb |
176Lu |
177Hf |
178Ta | 179W | 180Re | 181Os | 182Ir | 183Pt | 184Au | 185Hg | 186Tl | 187Pb | 84 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 106 | 175Tm | 176Yb |
177Lu |
178Hf |
179Ta | 180W | 181Re | 182Os | 183Ir | 184Pt | 185Au | 186Hg | 187Tl | 188Pb | 189Bi | Po | 85 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 107 | 176Tm | 177Yb | 178Lu | 179Hf |
180mTa |
181W | 182Re |
183Os | 184Ir | 185Pt | 186Au | 187Hg | 188Tl | 189Pb | 190Bi | At | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 108 | 178Yb | 179Lu | 180Hf |
181Ta | 182W | 183Re | 184Os | 185Ir | 186Pt | 187Au | 188Hg | 189Tl | 190Pb | 191Bi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 109 | 180Lu | 181Hf | 182Ta |
183W |
184Re |
185Os | 186Ir | 187Pt | 188Au | 189Hg | 190Tl | 191Pb | 192Bi | 193Po | 194At | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 110 | 182Hf |
183Ta | 184W | 185Re | 186Os |
187Ir | 188Pt | 189Au | 190Hg | 191Tl | 192Pb | 193Bi | 194Po | 195At | 86 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 111 | 183Hf | 184Ta | 185W |
186Re |
187Os | 188Ir | 189Pt | 190Au | 191Hg | 192Tl | 193Pb | 194Bi | 195Po | 196At | Rn | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 112 | 184Hf | 185Ta | 186W | 187Re | 188Os | 189Ir | 190Pt | 191Au | 192Hg | 193Tl | 194Pb | 195Bi | 196Po | 197At | 87 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 113 | 185Hf | 186Ta | 187W | 188Re | 189Os |
190Ir |
191Pt | 192Au | 193Hg | 194Tl | 195Pb | 196Bi | 197Po | 198At | Fr | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 114 | 188W | 189Re | 190Os |
191Ir |
192Pt | 193Au | 194Hg | 195Tl | 196Pb | 197Bi | 198Po | 199At | 200Rn | 88 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 115 | 189W | 190Re | 191Os | 192Ir |
193Pt |
194Au | 195Hg |
196Tl | 197Pb | 198Bi | 199Po | 200At | 201Rn | Ra | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 116 | 190W | 191Re | 192Os |
193Ir |
194Pt | 195Au |
196Hg | 197Tl | 198Pb | 199Bi | 200Po | 201At | 202Rn | 203Fr | 89 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 117 | 192Re | 193Os | 194Ir | 195Pt |
196Au |
197Hg |
198Tl | 199Pb | 200Bi | 201Po | 202At | 203Rn | 204Fr | Ac | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 118 | 194Os | 195Ir | 196Pt | 197Au |
198Hg |
199Tl | 200Pb | 201Bi | 202Po | 203At | 204Rn | 205Fr | 206Ra | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 119 | 195Os | 196Ir | 197Pt | 198Au | 199Hg | 200Tl | 201Pb | 202Bi | 203Po | 204At | 205Rn | 206Fr | 207Ra | 90 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 120 | 196Os | 197Ir | 198Pt | 199Au | 200Hg | 201Tl | 202Pb |
203Bi | 204Po | 205At | 206Rn | 207Fr | 208Ra | 209Ac | Th | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 121 | 198Ir | 199Pt | 200Au | 201Hg | 202Tl | 203Pb |
204Bi | 205Po | 206At | 207Rn | 208Fr | 209Ra | 210Ac | 91 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 122 | 200Pt | 201Au | 202Hg | 203Tl | 204Pb |
205Bi | 206Po | 207At | 208Rn | 209Fr | 210Ra | 211Ac | Pa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 123 | 201Pt | 202Au | 203Hg | 204Tl | 205Pb | 206Bi | 207Po | 208At | 209Rn | 210Fr | 211Ra | 212Ac | 213Th | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 124 | 203Au | 204Hg | 205Tl | 206Pb | 207Bi | 208Po | 209At | 210Rn | 211Fr | 212Ra | 213Ac | 214Th | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 125 | 204Au | 205Hg | 206Tl | 207Pb |
208Bi | 209Po | 210At | 211Rn | 212Fr | 213Ra | 214Ac | 215Th | 216Pa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 126 | 206Hg | 207Tl | 208Pb | 209Bi |
210Po | 211At | 212Rn | 213Fr | 214Ra | 215Ac | 216Th | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 127 | 208Tl | 209Pb | 210Bi |
211Po | 212At | 213Rn | 214Fr | 215Ra | 216Ac | 217Th | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 128 | 209Tl | 210Pb | 211Bi | 212Po | 213At | 214Rn | 215Fr | 216Ra | 217Ac | 218Th | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 129 | 210Tl | 211Pb | 212Bi | 213Po | 214At | 215Rn | 216Fr | 217Ra | 218Ac | 219Th | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 130 | 212Pb | 213Bi | 214Po | 215At | 216Rn | 217Fr | 218Ra | 219Ac | 220Th | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 131 | 213Pb | 214Bi | 215Po | 216At | 217Rn | 218Fr | 219Ra | 220Ac | 221Th | 222Pa | 92 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 132 | 214Pb | 215Bi | 216Po | 217At | 218Rn | 219Fr | 220Ra | 221Ac | 222Th | 223Pa | U | 93 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 133 | 217Po | 218At | 219Rn | 220Fr | 221Ra | 222Ac | 223Th | 224Pa | Np | 94 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 134 | 218Po | 219At | 220Rn | 221Fr | 222Ra | 223Ac | 224Th | 225Pa | 226U | Pu | 95 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 135 | 221Rn | 222Fr | 223Ra | 224Ac | 225Th | 226Pa | 227U | 228Np | Am | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 136 | 222Rn | 223Fr | 224Ra | 225Ac | 226Th | 227Pa | 228U | 229Np | 96 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 137 | 223Rn | 224Fr | 225Ra | 226Ac | 227Th | 228Pa | 229U | 230Np | 232Am | Cm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 138 | 224Rn | 225Fr | 226Ra | 227Ac | 228Th | 229Pa | 230U | 231Np | 232Pu | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 139 | 225Rn | 226Fr | 227Ra | 228Ac | 229Th | 230Pa | 231U | 232Np | 233Pu | 234Am | 97 | 98 | 99 | 100 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 140 | 226Rn | 227Fr | 228Ra | 229Ac | 230Th | 231Pa | 232U | 233Np | 234Pu | 235Am | 236Cm | Bk | Cf | Es | Fm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 141 | 228Fr | 229Ra | 230Ac | 231Th | 232Pa | 233U | 234Np | 235Pu | 236Am | 237Cm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 142 | 229Fr | 230Ra | 231Ac | 232Th | 233Pa | 234U | 235Np | 236Pu | 237Am | 238Cm | 239Bk | 240Cf | 241Es | 242Fm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 143 | 232Ac | 233Th | 234Pa | 235U |
236Np |
237Pu | 238Am | 239Cm | 240Bk | 241Cf | 242Es | 243Fm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 144 | 234Th | 235Pa | 236U | 237Np | 238Pu | 239Am | 240Cm | 241Bk | 242Cf | 243Es | 244Fm | 101 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 145 | 235Th | 236Pa | 237U | 238Np | 239Pu | 240Am | 241Cm | 242Bk | 243Cf | 244Es | 245Fm | Md | 102 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 146 | 236Th | 237Pa | 238U | 239Np | 240Pu | 241Am | 242Cm | 243Bk | 244Cf | 245Es | 246Fm | No | 103 | 104 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 147 | 238Pa | 239U | 240Np | 241Pu | 242Am |
243Cm | 244Bk | 245Cf | 246Es | 247Fm | 248Md | Lr | Rf | 105 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 148 | 240U | 241Np | 242Pu | 243Am | 244Cm | 245Bk | 246Cf | 247Es | 248Fm | 249Md | 250No | Db | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 149 | 243Pu | 244Am | 245Cm | 246Bk | 247Cf | 248Es | 249Fm | 250Md | 251No | 252Lr | 253Rf | 106 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 150 | 244Pu | 245Am | 246Cm | 247Bk | 248Cf | 249Es | 250Fm | 251Md | 252No | 253Lr | 254Rf | 255Db | Sg | 107 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 151 | 245Pu | 246Am | 247Cm | 248Bk |
249Cf | 250Es | 251Fm | 252Md | 253No | 254Lr | 255Rf | 256Db | Bh | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 152 | 246Pu | 247Am | 248Cm | 249Bk | 250Cf | 251Es | 252Fm | 253Md | 254No | 255Lr | 256Rf | 257Db | 258Sg | 108 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 153 | 249Cm | 250Bk | 251Cf | 252Es | 253Fm | 254Md | 255No | 256Lr | 257Rf | 258Db | 259Sg | 260Bh | Hs | 109 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 154 | 250Cm | 251Bk | 252Cf | 253Es | 254Fm | 255Md | 256No | 257Lr | 258Rf | 259Db | 260Sg | 261Bh | Mt | 110 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 155 | 251Cm | 252Bk | 253Cf | 254Es |
255Fm | 256Md | 257No | 258Lr | 259Rf | 260Db | 261Sg | 262Bh | 263Hs | Ds | 111 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 156 | 253Bk | 254Cf | 255Es | 256Fm | 257Md | 258No | 259Lr | 260Rf | 261Db | 262Sg | 263Bh | 264Hs | 265Mt | Rg | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 157 | 254Bk | 255Cf | 256Es | 257Fm | 258Md | 259No | 260Lr | 261Rf | 262Db | 263Sg | 264Bh | 265Hs | 266Mt | 267Ds | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 158 | 256Cf | 257Es | 258Fm | 259Md | 260No | 261Lr | 262Rf | 263Db | 264Sg | 265Bh | 266Hs | 267Mt | 268Ds | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 159 | 259Fm | 260Md | 261No | 262Lr | 263Rf | 264Db | 265Sg | 266Bh | 267Hs | 268Mt | 269Ds | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 160 | 262No | 263Lr | 264Rf | 265Db | 266Sg | 267Bh | 268Hs | 269Mt | 270Ds | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 161 | 269Hs | 270Mt | 271Ds | 272Rg | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 162 | 271Mt | 272Ds | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Notes et références
Notes
- On indique le numéro atomique quand il aide à la compréhension, et notamment dans les réactions nucléaires et les réactions de désintégration pour comprendre le sort de chaque type de particule (proton ou neutron).
- Quand on utilise les symboles D et T, le symbole H désigne le protium au lieu de l'élément chimique. On écrit alors H2O, HDO et D2O les formules chimiques de l'eau légère, de l'eau semi-lourde et de l'eau lourde.
- Compte tenu du rapport des masses, pour ce qui concerne les grandeurs par unité de masse.
- On sait depuis 2003 que le bismuth 209 est radioactif, mais sa demi-vie est tellement grande (19 × 1018 années donc plus d'un milliard de fois l'âge de l'univers !) que pour toute considération pratique on peut le considérer comme stable.
Références
- Milton H. Wahl and Harold C. Urey (1935). J. Chem. Phys. 3, 411. The Vapor Pressures of the Isotopic Forms of Water. « http://jcp.aip.org/resource/1/jcpsa6/v3/i7/p411_s1 »(Archive • Wikiwix • Archive.is • Google • Que faire ?).
- Živilė Žigaité, Le rapport 18O/16O dans les apatites des vertébrés du Paléozoïque : possibilités et limites des reconstitutions paléoclimatiques ; Palaeoclimate and Stable Isotope Geochemistry
- S. C. Maisant, A. F. Villa, J. Poupon, J. Langrand et R. Garnier, « L’analyse isotopique du plomb: un outil utile en santé au travail quand les sources d’exposition au plomb sont multiples », Archives des Maladies Professionnelles et de l'Environnement, vol. 77, no 3, , p. 485 (résumé).
- (en) P. Álvarez-Iglesias, B. Rubio et J. Millos, « Isotopic identification of natural vs. anthropogenic lead sources in marine sediments from the inner Ría de Vigo (NW Spain) », Science of The Total Environment, vol. 437, , p. 22-35.
- N Hette-Tronquart, J Belliard, Caractérisation des réseaux trophiques en cours d’eau, 2016 ()
- E. Piasentier, R. Valusso, F. Camin, G. Versini, Stable isotope ratio analysis for authentication of lamb meat ; Meat Science, Volume 64, Issue 3, July 2003, Pages 239–247 ([Résumé])
- M.A Brescia, M Monfreda, A Buccolieri, C Carrino, Characterisation of the geographical origin of buffalo milk and mozzarella cheese by means of analytical and spectroscopic determinations ; Food Chemistry Volume 89, Issue 1, January 2005, Pages 139–147 (résumé)
- D. Sacco, M.A. Brescia, A. Buccolieri, A. Caputi Jambrenghi, Geographical origin and breed discrimination of Apulian lamb meat samples by means of analytical and spectroscopic determinations ; Meat Science Volume 71, Issue 3, November 2005, Pages 542–548 (Résumé)
Voir aussi
Articles connexes
- Isobare (chimie)
- Isotone
- Classification périodique des éléments
- Période radioactive
- Radioactivité
- Noyau exotique
- Table des isotopes
- Isotope stable
- Hydrologie isotopique
- Radioisotope synthétique
- Chronologie isotopique
- Méthodes scientifiques de l'archéologie
- Paléontologie
- Paléoclimatologie
- Rapport isotopique
Liens externes
- (en) The Isotopes Project Home Page (Compilation et diffusion de données sur les isotopes)
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
- Portail de la physique
- Portail de la chimie