Carbone
Le carbone est l'élément chimique de numéro atomique 6 et de symbole C. Il possède trois isotopes naturels :
- 12C et 13C qui sont stables ;
- 14C qui est radioactif de demi-vie 5 730 années ce qui permet de dater des éléments utilisant du carbone pour leur structure[alpha 1].
Cet article concerne l'élément chimique. Pour les autres significations, voir Carbone (homonymie).
Le carbone est l'élément le plus léger du groupe 14 du tableau périodique. Le corps simple carbone présente plusieurs formes allotropiques dont principalement le graphite et le diamant. L'élément carbone forme divers composés inorganiques comme le dioxyde de carbone CO2, et une grande variété de composés organiques et de polymères. C'est l'élément de base de toutes les formes de vie connues.
Le carbone est le 4e élément le plus abondant dans l'univers et le 15e le plus abondant dans la croûte terrestre. Il est présent sur Terre à l'état de corps simple (charbon et diamants), de composés inorganiques (CO2) et de composés organiques (biomasse, pétrole et gaz naturel). De nombreuses structures basées sur le carbone ont également été synthétisées : charbon actif, noir de carbone, fibres, nanotubes, fullerènes et graphène.
La combustion du carbone sous toutes ses formes a été le fondement du développement technologique dès la préhistoire. Les matériaux à base de carbone ont des applications dans de nombreux autres domaines : matériaux composites, batteries lithium-ion, dépollution de l'air et de l'eau, électrodes pour les fours à arc ou la synthèse de l'aluminium, etc.
Histoire et étymologie
Le nom carbone vient du latin carbo, carbōnis (« charbon »)[10]. La fabrication de carbone sous forme de charbon de bois par pyrolyse du bois sous une couche de terre était aussi connue des Romains[11]. Le carbone sous sa forme diamant est connu depuis l'antiquité en Asie, il est aussi mentionné dans l'ancien testament[12]. Son nom vient aussi du romain adámas, adámantis (« acier dur »).
La notion d'élément carbone apparaît lorsque René Antoine Ferchault de Réaumur étudie la formation d'acier à partir de fer, il constate que cette transformation correspond à l'absorption d'un élément par le fer[13]. En 1772, Antoine Lavoisier étudie ensuite la combustion de charbon et de diamants, il constate la formation quantitative de dioxyde de carbone mais ne détecte pas la formation d'eau. Il prouve ainsi que ces deux matériaux sont formés uniquement de carbone.
Le graphite naturel était connu depuis l'antiquité, mais sa nature n'était pas comprise car on le confondait avec la molybdénite et on croyait que c'était une forme de plomb[11]. En 1779, Carl Wilhelm Scheele démontre, lui aussi par oxydation du graphite, qu'il est composé principalement de carbone. En 1787, la Nomenclature chimique de Louis-Bernard Guyton-Morveau lui consacre un article en définissant le carbone comme la forme pure du charbon[14].
Le nom « carbone » n'apparaît dans le dictionnaire de l'Académie française qu'à sa 6e édition (1832-5). Le XIXe siècle correspond à l'essor du carbone pour la production d'énergie. Par exemple, en 1865, Antoine César Becquerel publie le contenu en carbone des principales formes de bois d'énergie achetés à l'époque à Paris[15] :
- 1 stère de bois dur (chêne, l'orme, le charme, le hêtre et le frêne) : 140 kilos ;
- 1 stère de bois blanc (bouleau, le tremble, le peuplier et les bois résineux) : 87 kilos ;
- 1 stère de bois à fagots et cotrets : 122 kilos.
L'histoire est ensuite marquée par l'importance accrue du carbone, on peut citer par exemple :
- 1828 : découverte des composés organiques et de la chimie organique (voir article Friedrich Wöhler) ;
- 1842 : avec la résistance des matériaux, August Wöhler pose les fondements de la future « science des matériaux » ;
- 1985 : découverte des fullerènes par Robert Curl, Harold Kroto et Richard Smalley ;
- 2004 : découverte du graphène par Andre Geim, composé d'une seule couche de Graphite.
Élément
Formation
L'élément carbone n'est pas directement issu du Big Bang (nucléosynthèse primordiale), car les conditions de sa formation n'étaient pas réunies (la dilatation et le refroidissement de l'univers ont été trop rapides). Le carbone est en revanche produit en masse dans le cœur des étoiles très massives, dites de la branche horizontale, où trois noyaux d'hélium fusionnent (réaction triple alpha).
Le carbone est présent sur Terre depuis la formation de celle-ci. Il existe sous forme de sédiments, charbon, pétrole, et également sous sa forme pure graphite, diamant. Les diamants naturels pouvant se trouver dans la kimberlite des cheminées d'anciens volcans, notamment en Afrique du Sud et dans l'Arkansas. On peut parfois trouver des diamants microscopiques dans certaines météorites.
Isotopes et masse atomique
Le carbone possède deux isotopes stables dans la nature :
- 12C (abondance = 98,93 %) qui a été choisi comme nucléide de référence unique pour la masse atomique 12, après plusieurs propositions (anciennement l’hydrogène, puis conjointement avec l’oxygène pour les chimistes).
- 13C (abondance = 1,07 %).
La masse atomique du carbone, 12,010 7, est légèrement supérieure à 12 en raison de la présence de l'isotope, 13C.
Le carbone possède aussi deux radio-isotopes :
- 14C : période radioactive de 5 730 ans couramment utilisé pour la datation d'objets archéologiques jusqu'à 50 000 ans. Il ne sera d'aucune utilité pour les archéologues de demain, intéressés par les trésors de la civilisation actuelle, car les explosions thermonucléaires, réalisées dans l'atmosphère à partir des années 1960, ont créé des excès considérables.
- 11C a une période de 20 minutes. Cette courte période et la relative facilité de substituer un atome de 11C à un atome de carbone 12C (stable) en font un isotope utilisé en médecine nucléaire, notamment en tomographie à émission de positon. Les radiotraceurs les plus utilisés à ce jour sont le 11C-Raclopride qui se fixe préférentiellement sur les récepteurs dopaminergiques D2, et le 11C-Acétate utilisé en imagerie cardiaque.
Structure électronique
Le carbone possédant six électrons adopte une configuration électronique à l'état fondamental 1s2 2s2 2p2. Il possède quatre électrons sur sa couche de valence, ce qui lui permet de former quatre liaisons covalentes, dont des liaisons de type (première liaison avec un atome) ou de type (seconde ou troisième liaison). Les liaisons de type sont toujours accompagnées d'une liaison de type . Le recouvrement des fonctions électroniques dans une liaison est plus faible. Ces liaisons sont donc moins « solides ».
Corps simple
État solide
 |
 | |
Huit formes du carbone : diamant, graphite, lonsdaléite, buckminsterfullerène et deux autres fullerènes, amorphe, et nanotube de carbone. |
Le carbone est présent dans la nature dans deux formes allotropiques principales :
- le graphite, empilement de structures cristallines hexagonales et monoplanes (graphène), et de couleur grise. C'est la forme stable à température et pression ambiante ;
- le diamant, de structure cristalline tétraédrique (structure type « diamant ») est transparent. C'est la forme stable à haute température et haute pression, métastable à température et pression ambiante.
Dans les conditions de pression normales, le carbone est sous la forme graphite, dans laquelle chaque atome est lié à trois autres dans une couche d'anneaux hexagonaux fusionnés, comme ceux des composés aromatiques hydrocarbonés. Grâce à la délocalisation des orbitales , le graphite conduit l'électricité. Le graphite est mou, car les liaisons chimiques entre les plans sont faibles (2 % de celles des plans) et les couches glissent donc facilement les unes par rapport aux autres.

Sous très haute pression, le carbone cristallise dans un système cubique à face centrée nommé diamant, dans lequel chaque atome est lié à quatre autres (distance interatomique de 136 pm). Le diamant, grâce à la résistance des liaisons carbone-carbone, est, avec le nitrure de bore, la matière la plus dure à rayer. À température ambiante, la métamorphose en graphite est si lente qu'elle est indécelable. Sous certaines conditions, le carbone se cristallise en lonsdaléite, une forme similaire au diamant mais hexagonale. De toutes les pierres précieuses, le diamant est la seule à se consumer complètement.
En plus du graphite (pur sp2) et du diamant (pur sp3), le carbone existe sous forme amorphe et hautement désordonnée (a-C). Ces formes amorphes du carbone sont un mélange de sites à trois liaisons de type graphite ou à quatre liaisons de type diamant. De nombreuses méthodes sont utilisées pour fabriquer du a-C : pulvérisation, évaporation par faisceau d'électrons, dépôt à l'arc électrique, ablation laser, etc. En 2019, la molécule cyclique C18 (pur sp1) a été synthétisée par élimination des groupes CO dans l'oxyde C24O6[16].
Les oignons de carbone sont des structures basées sur une structure de type fullerène, mais dont la paroi est constituée de plusieurs couches de carbone.
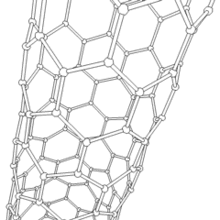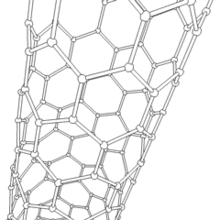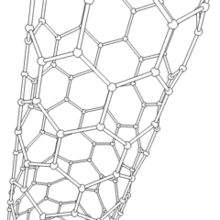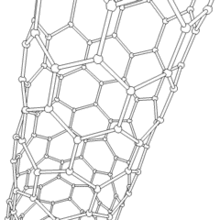
Les formes cylindriques du carbone sont appelées nanotubes (nanotube de carbone, abréviation : NTC). Elles ont été découvertes dans le culot se formant à la cathode de l'arc électrique durant la synthèse de fullerènes. Ces objets de diamètre nanométrique et de longueur atteignant parfois le millimètre se présentent comme des plans de carbone d'épaisseur monoatomique (ou graphène) enroulés sur eux-mêmes et formant un tube de diamètre nanométrique). Les nanotubes dont la paroi n'est constituée que d'un seul plan de carbone sont dits « monofeuillets ». Les nanotubes fabriqués par la méthode de l'arc électrique sont presque tous « multifeuillets ».
Le graphène est constitué d'un plan unique de carbone d'épaisseur monoatomique. Le graphène peut être simplement obtenu en prélevant un plan unique de carbone d'un cristal de graphite.
Conjointement à ces structures, on observe un grand nombre de nanoparticules polyédriques. À l'image des oignons et des nanotubes multifeuillets, les observations en microscopie électronique en transmission haute résolution ((en) HRTEM : High-resolution Transmission Electron Microscopy) révèlent que ces nanoparticules de carbone sont constituées de plusieurs couches de graphène, fermées, laissant une cavité nanométrique en leur centre.
Liquide et gaz
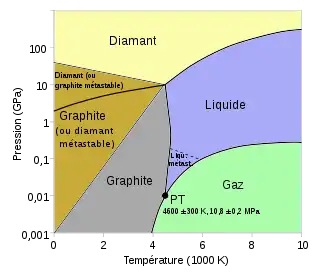
À pression atmosphérique le carbone (graphite) se sublime à 4 100 K. Sous forme gazeuse, il se constitue habituellement en petites chaînes d'atomes appelées carbynes. Refroidies très lentement, celles-ci fusionnent pour former les feuilles graphitiques irrégulières et déformées qui composent la suie. Parmi ces dernières, on trouve en particulier, la forme sphérique monofeuillet C60 appelée fullerène, ou plus précisément buckminsterfullerène, et ses variétés Cn (20 ≤ n ≤ 100), qui forment des structures extrêmement rigides.
Le carbone liquide ne se forme qu'au-dessus de la pression et de la température du point triple, et donc au-delà de 10,8 ± 0,2 MPa (environ 100 fois la pression atmosphérique) et 4 600 ± 300 K[alpha 2].
Composés
Le carbone est le composant essentiel des composés organiques, qui contiennent fréquemment au moins une liaison carbone-hydrogène[alpha 3]. Cependant le carbone existe aussi dans la nature sous forme inorganique, principalement sous la forme de dioxyde de carbone, et sous forme minérale.
Carbone organique
La chimie du carbone est essentiellement covalente. Le carbone est à la base d'une multitude de composés pouvant contenir un grand nombre d'atomes, en association avec l'hydrogène, l'oxygène, l'azote, les halogènes, le phosphore, le soufre, et les métaux, par liaisons simples, doubles ou triples. L'étude et la synthèse de ces composés constituent la chimie organique. Les principaux composés organiques du carbone sont les « hydrocarbures » des molécules associant carbone et hydrogène. On classe les hydrocarbures en trois familles :
- les alcanes, où le carbone forme des liaisons sp3 (« simples ») : méthane CH4, éthane C2H6, etc. ;
- les alcènes, où au moins un carbone forme des liaisons (« double ») (carbones sp2) : éthène (éthylène) C2H4, propène C3H6, etc. ;
- les alcynes, où au moins un carbone forme des liaisons (« triple ») (carbones sp) : éthyne (acétylène) C2H2, propyne C3H4, etc.
Suivant le nombre d'atomes de carbone, on fait précéder le suffixe -ane, -ène ou -yne :
- méth-
- éth-
- prop-
- but-
- pent-
- hex-
- hept-
- oct-
- non-
- déc-
La rotation est libre autour des liaisons simples carbone-carbone. En revanche, les liaisons doubles ou triples sont rigides : la liaison double est planaire, les angles de liaison autour des atomes de carbone sont 120°. Cela conduit à la formation de diastéréomères, c'est-à-dire de composés ayant la même formule chimique mais une disposition différente des atomes dans l'espace. La liaison triple est linéaire.
En outre, le carbone sp3 peut former des composés chiraux (du grec kheir (ἣ χείρ), la main). Le cas le plus simple est un composé possédant 4 substituants différents autour d'un atome de carbone. Suivant la disposition dans l'espace de ces substituants, on obtient deux molécules qui sont différentes : elles ne sont pas superposables, il s'agit d'une paire d'énantiomères. Les énantiomères sont l'image l'un de l'autre dans un miroir (comme nos deux mains).
Dans les hydrocarbures aromatiques, les atomes de carbone forment des cycles ou noyaux stabilisés par des liaisons π délocalisées.
Carbone inorganique
Ce type d'atomes de carbone est relativement rare en termes de variété par rapport aux carbones organique et minéral. Il se présente le plus souvent sous forme de complexes inorganiques ou organo-métalliques qui intègrent un atome de carbone nu ou une molécule de CO ou de CO2, dans leurs sphères de coordination. Par exemple :
Carbone minéral
La molécule de dioxyde de carbone CO2 existe à l'état gazeux dans l'atmosphère terrestre. Une certaine quantité de ce CO2 se dissout dans les eaux océaniques et continentales, et une partie du CO2 dissous réagit avec la molécule d'eau pour former de l'acide carbonique H2CO3 suivant la réaction :H2O + CO2(dissous) ⇔ H2CO3.
Puis H2CO3 (dihydrogénocarbonate, ou acide carbonique), étant un diacide, cède ses deux protons dans la mesure des constantes d'acidité des couples acido-basiques (H2CO3/HCO3–) et (HCO3–/CO32–) et de la composition initiale en solutés acido-basiques de l'eau selon les équations :H2CO3 + H2O ⇔ HCO3– (ion hydrogénocarbonate, ou bicarbonate) + H3O+ (ion hydronium, ou proton hydraté)et :HCO3– + H2O ⇔ CO32– (ion carbonate) + H3O+.
Or il se trouve que dans l'eau de mer, ce système de carbonates est présent en grandes quantités et dans des proportions telles qu'il joue un rôle tampon fondamental dans l'acidité de l'eau océanique (pH 8,1-8,4) qu'il permet de rendre très stable. Ce taux de carbonates (et de borates, pour être exact) s'appelle l'alcalinité ou titre alcalimétrique complet (TAC, mesuré en degrés français, ou kH mesuré en °allemands ; il existe d'autres unités. Le mieux est de parler en ppm, ou parties par million). Ce pH a permis à des quantités « géologiques » de tests calcaires de protozoaires planctoniques de former des roches sédimentaires calcaires constituées essentiellement d'un cristal de carbonate de calcium et de magnésium (mélange qu'on appelle le calcaire) : la pierre de Paris, le marbre, etc. Toute cette chimie est traditionnellement incluse dans la chimie inorganique, c'est-à-dire minérale, bien qu'il y ait évidemment de nombreux points sur lesquels cela ne se justifie pas. Ainsi, on pourra qualifier le carbone contenu dans le dioxyde de carbone, l'acide carbonique, l'hydrogénocarbonate et le carbonate, de carbone inorganique. C'est aussi valable pour le carbone diamant et les autres variétés allotropiques du cristal de carbone.
Dangers du carbone et de ses composés
Le carbone pur a une faible toxicité pour les humains et peut être manipulé et même ingéré en toute sécurité sous la forme de graphite ou de charbon de bois. Il est résistant à la dissolution ou l'attaque chimique, même dans le contenu acide du tractus digestif, par exemple.
En revanche, le disulfure de carbone CS2, quoique de structure similaire au dioxyde de carbone, est un liquide hautement toxique utilisé comme solvant (vulcanisation du caoutchouc).
Les autres oxydes de carbone sont le monoxyde de carbone CO, et le suboxyde de carbone C3O2, moins commun. Le monoxyde de carbone est un gaz incolore et inodore, formé par combustion incomplète des composés organiques ou du carbone pur (charbon). Le monoxyde de carbone se lie plus fortement que l'oxygène, à l'hémoglobine sanguine pour former de la carboxyhémoglobine, un composé stable. Le résultat de cette réaction est l'empoisonnement des molécules d'hémoglobine, ce qui peut être mortel (voir l'entrée en question).
L'ion cyanure CN- a un comportement chimique similaire à un ion halogénure. Les sels contenant l'ion cyanure sont hautement toxiques. Le cyanogène, un gaz de composition (CN)2 est également proche des halogènes.
Avec les métaux, le carbone forme des carbures C4- ou des acétylures C22-. Quoi qu'il arrive, avec une électronégativité de 2,5, le carbone préfère former des liaisons covalentes. Quelques carbures sont des treillis covalents, comme le carbure de silicium, SiC, qui ressemble au diamant, et est d'ailleurs utilisé pour la taille de ceux-ci.
La toxicité des nouvelles formes allotropiques du carbone (fullerènes, nanotubes, graphène) est aujourd'hui très étudiée. À l'état natif, ces nanostructures restent difficiles à filtrer dans l'air et pourraient constituer un danger qu'il est nécessaire d'évaluer[20]. À noter que dans le cadre de leur utilisation, ces composés se trouvent généralement dispersés dans un solvant, ou fixés sur un substrat solide.
Notes et références
Notes
- Voir Datation par le carbone 14.
- Le carbone n'étant liquide que dans des conditions difficiles à atteindre, et par ailleurs sans grand intérêt pratique, l'expression fusion du carbone désigne généralement sa fusion nucléaire et non sa fusion au sens ordinaire du terme.
- Il existe des composés organiques qui ne contiennent pas de liaison C-H, par exemple l'urée ou l'hexachloroéthane.
Références
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0)
- L' IUPAC Commission on Isotopic Abundances and Atomic Weights donne: min: 12,0096 max: 12,0116 moy: 12,0106 ± 0,001; valeur cohérente avec une teneur en isotope 13 de 1,0565 %
- (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832 - 2838 (DOI 10.1039/b801115j)
- Paul Arnaud, Brigitte Jamart, Jacques Bodiguel, Nicolas Brosse, Chimie Organique 1er cycle/Licence, PCEM, Pharmacie, Cours, QCM et applications, Dunod, , 710 p., Broché (ISBN 2100070355)
- "Ionization Energies of Atoms and Atomic Ions," in CRC Handbook of Chemistry and Physics, 91st Edition (Internet Version 2011), W. M. Haynes, ed., CRC Press/Taylor and Francis, Boca Raton, FL., p. 10-203
- (en) D. D. L. CHUNG, « Review Graphite », Journal of Materials Science (en), vol. 37, , p. 1475 – 1489 (DOI 10.1023/A:1014915307738)
- (en) Jenő Sólyom, Fundamentals of the physics of solids vol. 1 Structure and Dynamics, Springer, , 204 p.
- Base de données Chemical Abstracts interrogée via SciFinder Web le 15 décembre 2009 (résultats de la recherche)
- « Carbone » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Définitions lexicographiques et étymologiques de « Carbone » (sens Étymol. et Hist.) dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales
- (en) M. E. Weeks, « The discovery of elements. I. Elements known to the ancient world », Journal of Chemical Education, vol 9(1) 1932, p. 4-10
- Ancien Testament, Ex., 28:18; 39:11; Eze., 28:13
- R.-A. Ferchault de Réaumur "L'art de convertir le fer forgé en acier, et l'art d'adoucir le fer fondu, ou de faire des ouvrages de fer fondu aussi finis que le fer forgé" (1722)
- Méthode de nomenclature chimique proposée par MM. de Morveau, Lavoisier, Bertholet et de Fourcroy, 1787, p. 44.
- Becquerel (Antoine César, M.), Mémoire sur les forêts et leur influence climatérique (exemplaire numérisé par Google) ; 1865, voir pages 124 et suivantes.
- (en) Katharina Kaiser, Lorel M. Scriven, Fabian Schulz, Przemyslaw Gawel, Leo Gross et Harry L. Anderson, « An sp-hybridized molecular carbon allotrope, cyclo[18]carbon », Science, vol. 365, no 6459, , p. 1299-1301 (DOI 10.1126/science.aay1914).
- (en) J. M. Zazula, « On Graphite Transformations at High Temperature and Pressure Induced by Absorption of the LHC Beam » [PDF], sur CERN, (consulté en ).
- Chemistry of the elements, N.N. Greenwood (en) and A. Earnshaw, Pergamon press, 1994, p. 356. (ISBN 0-08-022057-6).
- Chemistry of the elements, N.N. Greenwood and A. Earnshaw, Pergamon press, 1994, p. 331. (ISBN 0-08-022057-6).
- INRS, Myriam Ricaud, Dominique Lafon et Frédérique Roos, Les nanotubes de carbones : quels risques, quelle prévention ?, 2008.
Voir aussi
Bibliographie
- Patrick Bernier et Serge Lefrant, Le carbone dans tous ses états, Taylor & Francis, , 584 p. (lire en ligne)
- Gérard Borvon, Histoire du carbone et du CO2, Vuibert, 2013
- Bernadette Bensaude-Vincent, Sacha Loeve, Carbone. Ses vies, ses œuvres, Le Seuil, , 349 p. (lire en ligne)
Articles connexes
Liens externes
- (en) « Technical data for Carbon » (consulté le ), avec en sous-pages les données connues pour chaque isotope
- (en) Los Alamos National Laboratory - Carbon
- (en) WebElements.com - Carbon
- (en) EnvironmentalChemistry.com - Carbon
- Lavoisier et la naissance du mot carbone
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||
| Métaux Alcalins |
Alcalino- terreux |
Lanthanides | Métaux de transition |
Métaux pauvres |
Métal- loïdes |
Non- métaux |
Halo- gènes |
Gaz nobles |
Éléments non classés |
| Actinides | |||||||||
| Superactinides | |||||||||
- Portail de la chimie
