Polymère
Les polymères (étymologie : du grec polus, plusieurs, et meros, partie) constituent une classe de matériaux. D'un point de vue chimique, un polymère est un ensemble constitué de plusieurs macromolécules[1] (molécule constituée de la répétition de nombreuses sous-unités).
Cet article concerne les polymères en chimie organique et en biochimie. Pour les polymères en chimie minérale, voir Polymère inorganique. Pour les « polymères » comportant un petit nombre d'éléments, voir Oligomère.


Les polymères les plus connus sont :
- les fibres naturelles :
- fibres de polyholoside (polymère de sucres) :
- les acides nucléiques : ADN et ARN sont des polymères de nucléotides reliés par des liaisons covalentes ;
- fibres protéiques : cuir (collagène), soie et laine (kératine), etc. ;
- les protéines qui sont des polymères d'acides aminés ;
- les matières plastiques ;
- les caoutchoucs naturels (latex) et artificiels ;
- les colles ;
- les peintures ;
- les résines.
Ils sont très utilisés pour les matrices des matériaux composites.
Ils ont les propriétés générales suivantes :
- ce sont des matériaux « légers », ils ont une masse volumique faible (en général inférieure à 1 500 kg·m-3, soit une densité par rapport à l'eau inférieure à 1,5) ;
- ils sont en général souples, les polymères thermoplastiques ont un module de Young inférieur à environ 3 GPa, comparé à environ 20 GPa pour les bétons, 70 GPa pour l'aluminium et 200 GPa pour l'acier ;
- ils ne sont stables qu'à des températures modérées. La plupart des polymères thermoplastiques se ramollissent ou fondent à des températures comprises entre 100 °C et 250 °C ; un polymère est dit « thermostable » s'il résiste à 300 °C durant quelques instants, la plupart des polymères se dégradent à des températures supérieures ;
- ce sont des isolants électriques et thermiques, sauf cas particuliers.
Les propriétés sont déterminées par :
- la nature chimique des macromolécules, et en particulier des liaisons qui peuvent s'établir entre les atomes de la chaîne et des chaînes voisines ; les liaisons interatomiques peuvent être souples ou rigides, faibles ou fortes ;
- la « forme » de la macromolécule : il peut s'agir d'une chaîne linéaire longue ou courte, ou bien d'une structure ramifiée, réticulée. Les macromolécules peuvent se placer au hasard ou bien sont alignées. Elles peuvent s'imbriquer pour former des cristallites ;
- la formulation (nature, taux des ingrédients) : outre les macromolécules, on introduit divers constituants (charge éventuellement renforçante, plastifiant, antioxydant, durcisseur, système de vulcanisation pour un élastomère, agent anti-ozonant, ignifugeant, colorant, déshydratant, agent de mise en œuvre, conducteur électrique, etc.).
Les polymères de synthèse sont devenus l'élément essentiel d'un nombre très important d'objets de la vie courante, dans lesquels ils ont souvent remplacé les substances naturelles. Ils sont présents dans de nombreux domaines industriels. Un domaine émergent important se concentre désormais sur les polymères supramoléculaires formés par des liaisons non-covalentes.
Il existe une corrélation étroite entre le produit national brut (PNB) d'un pays et sa consommation de polymères[2].
Historique
Les polymères naturels ont été parmi les premiers matériaux utilisés par l'Homme : bois et fibres végétales, cuir, tendons d'animaux, laine, etc.
La notion de macromolécule n'est apparue que tardivement dans l'histoire de la chimie. Bien que présagée par Wilhelm Eduard Weber ou encore Henri Braconnot au début du XIXe siècle, de nombreux chercheurs ne voient là que des agrégats ou micelles. Le terme « polymère » est utilisé pour la première fois en 1866 par Marcellin Berthelot[3]. La vulcanisation du caoutchouc en 1844 et la production de la Bakélite en 1910 figurent parmi les premières applications industrielles. Mais il faut attendre les années 1920-1930 pour que l'idée de macromolécule soit acceptée, notamment grâce aux travaux d'Hermann Staudinger.
Le développement industriel consécutif de la science macromoléculaire a été accéléré ensuite par la Seconde Guerre mondiale. Les États-Unis ont été privés lors de leur entrée en guerre de leur approvisionnement en caoutchouc naturel en provenance d'Asie du Sud-Est. Ils ont alors lancé un immense programme de recherche visant à trouver des substituts de synthèse.
Procédés de mise en œuvre
Pour répondre à toutes les exigences en termes de formes et de cadences, plusieurs méthodes de mise en forme des matériaux polymères ont été développées, dont :
- extrusion au moyen d'une filière : procédé continu pour fabriquer des profilés complexes, plaques, feuilles, films, etc., cadence de production élevée ; une variante est la coextrusion ;
- filage : souvent à partir du polymère à l'état fondu ; obtention de fibres textiles (marques Tergal, Térylène (sv), Dacron, nylon[4], Rilsan, Orlon, lycra[4], Tyvek, Dyneema, Kevlar, etc.) ;
- injection : grande variété de pièces, bonne précision et bon aspect de surface, cadence élevée (éléments d'appareils ménagers, engrenages, pompes, etc.) ;
- moulage par soufflage : procédé discontinu pour fabriquer des corps creux (bouteilles, flacons, etc.),
- extrusion-gonflage : élaboration de films, sacs, etc., à la différence de l'extrusion-soufflage, ce procédé n'utilise pas de moule ;
- rotomoulage : pièce fermée, pouvant être de très grandes dimensions (citernes, jouets, ballons, etc.) ;
- thermoformage : convient très bien pour des pièces de grande surface et de faible épaisseur (emballages, pièces pour l'automobile et le bâtiment, baignoires, etc.) ;
- moulage par compression ou par compression-transfert : procédés applicables aux résines thermodurcissables prépolymérisées (partiellement polymérisées) (phénoplastes, aminoplastes, polyesters insaturés, etc.).
Concernant les plastiques renforcés, une quinzaine de procédés de mise en œuvre est de nos jours disponible (pultrusion…).
Galerie

 Pièce en matière plastique moulée par injection
Pièce en matière plastique moulée par injection

 Un pneu, issu d’élastomères et de fibres synthétiques
Un pneu, issu d’élastomères et de fibres synthétiques
Exemples
Polymères naturels
- Polysaccharides : cellulose et hémicelluloses (bois, fibres végétales), amylose et amylopectine (amidon), glycogène, pullulane, chitine (cuticule d'arthropodes et paroi d'eumycètes), mannanes, galactanes, fructanes, etc.
- Glycosaminoglycanes
- Lignine (bois)
- Acides nucléiques : ADN et ARN
- Scléroprotéines : kératines (phanères), collagènes, élastines, conchyoline, soie, etc.
- Polyisoprénoïdes (caoutchouc naturel)
- Polyhydroxyalkanoates
Polymères artificiels
- Cellulosiques : acétate de cellulose (CA), nitrocellulose
Polymères synthétiques
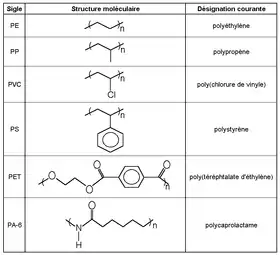
- Polyoléfines, dont les polymères de grande consommation polyéthylène (PE) et polypropylène (PP). Ce dernier est un polymère de synthèse très important[6].
- Vinyliques : polymère de grande consommation poly(chlorure de vinyle) (PVC), poly(chlorure de vinyle) surchloré (PVC-C) (chloropolymères), etc. ; poly(acétate de vinyle) (PVAC) ; alcool polyvinylique (PVAL)
- Styréniques : polymère de grande consommation ;
- Polyesters saturés : poly(téréphtalate d'éthylène) (PET) ; poly(téréphtalate de butylène) (PBT) ; poly(naphtalate d'éthylène) (PEN) ou insaturés (UP)
- Polyamides (PA) : PA 6, PA 6-6, PA 11, PA 12, PA 4-6, etc.
- Polyuréthanes (PUR) saturés ou réticulés
- Polycarbonate (PC)
- Acryliques : poly(méthacrylate de méthyle) (PMMA) ; polyacrylonitrile (PAN)
- Aminoplastes
- Phénoplastes
- Polyacétals : polyoxyméthylène (POM)
- Silicones (SI)
- Polyimides (PI)
- Halogénés
- Chlorés : poly(chlorure de vinyle) (PVC) ; poly(chlorure de vinyle) surchloré (PVC-C) ; poly(chlorure de vinylidène) (PVDC)
- Fluorés : polytétrafluoroéthylène (PTFE), plus connu sous le nom de Téflon ; polyfluorure de vinyle (PVF) ; polyfluorure de vinylidène (PVDF) ; éthylène tétrafluoroéthylène (ETFE) ; perfluoroalkoxy (PFA)
- Polydiméthylsiloxane (PDMS)
- Époxydes (EP)
- Thermostables : polyétheréthercétone (PEEK) ; polymère à cristaux liquides (LCP)
- Élastomères
- Élastomères thermoplastiques (TPE) : copolymères séquencés[7] styrène-butadiène-styrène (SBS), polyuréthanes thermoplastiques (TPU), etc.
- Polymères électroactifs (EAPs)
Mélanges polymère-polymère
Les mélanges polymère-polymère thermoplastiques (en anglais, polyblend ; « alliage » est un terme impropre) sont des mélanges mécaniques intimes de deux (ou plusieurs) polymères différents et compatibles. À la différence des copolymères, il ne se forme pas de liaison chimique. Exemples :
Notion de macromolécule
Un polymère tridimensionnel est constitué d'une seule macromolécule qui se développe dans les trois directions de l'espace[8] ; cette macromolécule tridimensionnelle atteint des dimensions macroscopiques (ex. : un phénoplaste).
Une macromolécule est une molécule de masse moléculaire élevée, généralement constituée par la répétition d'atomes ou de groupes d'atomes, appelés unités constitutives et dérivant, de fait ou conceptuellement[9], de molécules de faible masse moléculaire[1].
Dans de nombreux cas, une molécule peut être considérée comme ayant une masse moléculaire élevée lorsque l'addition ou la suppression d'une ou de quelques unités n'a qu'un effet négligeable sur les propriétés moléculaires[1].
En fait, il n'existe que très peu d'exemples de macromolécules qui ne soient obtenues par la répétition d'une unité structurale[10]. On les trouve plutôt dans le domaine des macromolécules naturelles, certaines protéines notamment[11].
Le terme polymère a encore actuellement plusieurs définitions selon le point de vue qu'on adopte. On peut encore trouver les oligomères (qui ne sont pas constitués de macromolécules) inclus dans la famille des polymères[12]. Auparavant, et encore récemment, les polymères proprement dits (au sens actuel du terme) étaient aussi appelés « hauts polymères »[13],[14]. On peut noter que l'expression « degré de polymérisation » est toujours utilisée pour désigner le nombre d'unités monomères aussi bien d'une macromolécule que d'une molécule oligomère[15].
Un polymère est organique (le plus souvent) ou inorganique.
Il est issu de l'enchaînement covalent d'un grand nombre de motifs monomères identiques ou différents.
Un polymère peut être naturel (ex. : polysaccharides, ADN) ; artificiel, obtenu par modification chimique d'un polymère naturel (ex. : acétate de cellulose, méthylcellulose, galalithe) ; ou synthétique, préparé par polymérisation de molécules monomères (ex. : polystyrène, polyisoprène synthétique).
Les polyoléfines, représentées principalement par les polymères thermoplastiques de grande consommation polyéthylène et polypropylène, constituent la plus importante famille de polymères.
Généralités
Un polymère peut se présenter sous forme liquide (plus ou moins visqueux) ou solide à température ambiante. À l'état solide, il peut être utilisé comme matériau moyennant des propriétés mécaniques suffisantes[16]. Un polymère liquide à température ambiante peut être transformé en matériau s'il est réticulable ; les élastomères sont des matériaux obtenus par réticulation de polymères linéaires liquides à température ambiante.
Les polymères ont un comportement viscoélastique. En effet, ils démontrent simultanément des propriétés élastiques et un caractère visqueux.
L'enchaînement des motifs monomères peut se faire de façon linéaire (polymères linéaires), présenter des ramifications aléatoires (polymères branchés et hyperbranchés) ou systématiques et régulières (dendrimères).
Du fait des degrés de liberté de la conformation (disposition dans l'espace) de chaque motif monomère, la conformation du polymère résulte de cet enchaînement mais également des interactions entre motifs.
Les polymères fabriqués à partir d'un seul type de monomère sont désignés par homopolymère (ex. : polyéthylène, polystyrène). Dès qu'au moins deux types de monomère participent à la formation des macromolécules, on parlera de copolymères (cas du styrène-butadiène). La variété des copolymères est très importante. Ces matériaux possèdent des propriétés physico-chimiques et mécaniques intermédiaires avec celles obtenues sur les homopolymères correspondants.
On distingue deux grandes catégories de réactions chimiques permettant la préparation des polymères : la polymérisation en chaîne ou polyaddition (pour produire par exemple le polyéthylène, le polypropylène, le polystyrène) et la polymérisation par étapes ou polycondensation (pour synthétiser par exemple le poly(téréphtalate d'éthylène), de sigle PET).
Le terme « polymère » désigne des matières abondantes et variées : des protéines les plus ténues aux fibres de Kevlar haute résistance. Certains polymères sont utilisés en solution par exemple dans les shampooings ; d'autres forment des matériaux solides.
Pour ces applications, les polymères sont généralement mélangés à d'autres substances – charges telles la craie (matière très bon marché), plastifiants, additifs tels les antioxydants, etc. – dans des opérations de formulation. La fabrication des objets finis résulte la plupart du temps d'une opération de mise en œuvre qui relève souvent du domaine de la plasturgie.
Classification

Les polymères sont souvent classés d'après leurs propriétés thermomécaniques. On distingue :
- les polymères thermoplastiques, qui deviennent malléables quand ils sont chauffés, ce qui permet leur mise en forme ;
- les élastomères, qui sont déformables de manière réversible ;
- les élastomères thermoplastiques (TPE) ;
- les polymères thermodurcissables, qui durcissent de façon irréversible, le plus souvent sous l'action de la chaleur en présence de réactifs.
La description des polymères en tant qu'objet physique permettant de comprendre leurs propriétés relève de la physique statistique.
Structure et conformation
Séquence primaire
Les polymères sont des substances composées de macromolécules résultant de l'enchaînement covalent (voir Liaison covalente) de motifs de répétition identiques ou différents les uns des autres. La masse molaire de ces molécules dépasse souvent 10 000 g/mol. Les liaisons covalentes constituant le squelette macromoléculaire sont le plus souvent des liaisons carbone-carbone (cas du polyéthylène, du polypropylène, etc.), mais peuvent également résulter de la liaison d'atomes de carbone avec d'autres atomes, notamment l'oxygène (cas des polyéthers et des polyesters) ou l'azote (cas des polyamides). Il existe aussi des polymères pour lesquels l'enchaînement résulte de liaisons ne comportant pas d'atomes de carbone (polysilanes, polysiloxanes, etc.).
Cet enchaînement de motifs répétés présente chez les polymères les plus simples une structure linéaire, un peu comme un collier de perles. On peut également rencontrer des chaînes latérales (elles-mêmes plus ou moins branchées), résultant soit d'une réaction parasite au cours de la synthèse du polymère (par exemple dans le cas du polyéthylène basse densité ou PEBD), soit d'une réaction de greffage pratiquée volontairement sur le polymère pour en modifier les propriétés physico-chimiques.
Dans le cas où la macromolécule est composée de la répétition d'un seul motif – ce qui résulte le plus souvent de la polymérisation d'un seul type de monomère –, on parle d'homopolymères. Si au moins deux motifs différents sont répétés, on parle de copolymères. Voir aussi Terpolymère.
On distingue ensuite plusieurs types de copolymères suivant la manière dont les motifs monomères sont répartis dans les chaînes moléculaires :
- dans le cas le plus fréquent, on a un copolymère statistique, où les différents motifs monomères se mélangent en fonction de la réactivité et de la concentration de ceux-ci. Les propriétés mécaniques sont alors moyennées ;
- en revanche, dans un copolymère séquencé (l'anglicisme copolymère à blocs est parfois utilisé) ou un copolymère alterné, il peut y avoir combinaison des propriétés mécaniques.

Il existe parfois des liaisons covalentes vers d'autres parties de chaînes polymères. On parle alors de molécules « branchées » ou ramifiées. On sait synthétiser par exemple des molécules en peigne ou en étoile. Lorsque de nombreuses chaînes ou chaînons ont été réunis par un certain nombre de liaisons covalentes, ils ne forment plus qu'une macromolécule gigantesque ; on parle alors de réseau macromoléculaire ou de gel.
Cohésion
Les forces qui assurent la cohésion de ces systèmes sont de plusieurs types : interactions de van der Waals ou liaisons hydrogène. Leur intensité est respectivement de 2 à 16 kJ·mol-1, et 40 kJ·mol-1. Il existe également des interactions liées aux charges.
La densité d'énergie cohésive (valeurs tabulées) permet d'avoir une idée de la cohésion des polymères.
Polymères linéaires
Lors de la réaction de polymérisation, lorsque chaque unité monomère est susceptible de se lier à deux autres, la réaction produit une chaîne linéaire. Typiquement, ce cas est celui des polymères thermoplastiques.
Du fait des degrés de liberté de la conformation de chaque unité monomère, la façon dont la chaîne occupe l'espace n'est cependant pas rectiligne.
Notion de maillon statistique
Chaque unité monomère présente une certaine rigidité. Souvent, cette rigidité influence l'orientation de l'unité monomère voisine. Toutefois, cette influence s'estompe au fur et à mesure que l'on s'éloigne de l'unité monomère initiale et finit par disparaître au-delà d'une distance , dite « longueur d'un maillon statistique de la chaîne ». Techniquement, cette longueur est la longueur de corrélation de l'orientation d'un maillon. Elle se nomme longueur de persistance du polymère.
Ayant introduit cette notion, il est alors possible de renormaliser la chaîne en considérant maintenant le maillon statistique comme son motif élémentaire. Pour décrire la conformation de cette chaîne, les particularités propres à la structure chimique du motif monomère n'interviennent plus.
Chaîne idéale (ou gaussienne)
Le cas le plus simple est celui de l'enchaînement linéaire de maillons n'exerçant pas d'interaction entre eux. À l'état liquide, la chaîne adopte dans l'espace une conformation qui pour une molécule donnée change sans cesse du fait de l'agitation thermique. À l'état de solide amorphe ou à un instant donné dans le cas d'un liquide, la conformation des chaînes est différente d'une molécule à l'autre. Cette conformation obéit néanmoins à des lois statistiques.
Soit dans la séquence primaire de la chaîne un maillon donné pris pour origine. Lorsque les maillons n'interagissent pas, la probabilité que le maillon de la chaîne soit à une distance de l'origine obéit à une loi normale ou loi Gaussienne de moyenne nulle et de variance . Une longueur caractéristique de la chaîne est la distance entre ses deux extrémités (dite « distance bout-à-bout »). La moyenne arithmétique de est nulle. Ainsi, pour caractériser la taille de la pelote que forme la chaîne, il faut considérer la moyenne quadratique, notée ici . En raison de la loi normale, cette moyenne varie comme la racine carrée du nombre de maillons.
La conformation statistique d'une telle chaîne est l'analogue de la trace laissée par un marcheur aléatoire où représente le nombre de pas de la marche, leur longueur et le déplacement carré moyen du marcheur.
Dans les années 1970, Pierre-Gilles de Gennes a montré l'analogie entre la description d'une chaîne polymère et les phénomènes critiques. Aussi, l'utilisation de la lettre pour désigner l'exposant, obéit à la nomenclature des exposants critiques. Les objets rencontrés dans les phénomènes critiques ont des propriétés d'autosimilarité et peuvent être décrits en termes de géométrie des fractales, dans ce cas l'exposant représente l'inverse de la dimension fractale .
Une conformation gaussienne des chaînes se rencontrent dans deux cas :
- lorsque les chaînes sont nombreuses et entremêlées (analogie avec un plat de spaghetti). Un maillon donné est alors entouré indifféremment par les maillons de la chaîne à laquelle il appartient et par les maillons des chaînes voisines. Les interactions des uns et des autres avec ce maillon se compensent exactement ;
- lorsqu'une chaîne est seule à une température particulière appelée température - à laquelle les forces attractives de van der Waals entre deux maillons sont exactement compensées par les forces répulsives dites de « volume exclu » (cette force répulsive provient du fait que deux maillons ne peuvent physiquement être en même temps au même endroit).
Chaîne gonflée (ou à « volume exclu »)
Lorsque les interactions répulsives entre maillons d'une même chaîne dominent (typiquement à température plus haute que la température -), la conformation de la chaîne s'en trouve « gonflée » par rapport à sa conformation idéale. Dans ce cas, la valeur de l'exposant et la taille caractéristique de la pelote que forme la chaîne sont supérieures à celle d'une chaîne idéale.
La valeur approchée de cet exposant fut établie par Paul Flory dans les années 1940. Bien qu'il ait été démontré depuis que le raisonnement utilisé à l'époque était erroné, la valeur est étonnamment proche de la valeur exacte trouvée depuis par les méthodes beaucoup plus sophistiquées du groupe de renormalisation.
En termes de marche aléatoire, une chaîne gonflée correspond à la trace laissée par un marcheur effectuant une marche aléatoire autoévitante.
Chaîne globulaire
Lorsque les interactions attractives entre maillons d'une même chaîne dominent (typiquement à température plus basse que la température -), la chaîne s'effondre sur elle-même et adopte une conformation compacte dite « globulaire » (à opposer au terme « pelote » utilisé pour les conformations idéale ou gonflée). Dans ce cas :
Le terme « conformation compacte » se comprend mieux en écrivant la relation « taille caractéristique-nombre de maillons » sous la forme , qui exprime que le volume du globule est proportionnel au nombre de maillons. Ce comportement est celui d'un objet homogène dont la masse volumique est une constante indépendante de sa taille.
Polymères en solution
Implicitement nous avons considéré jusqu'ici une chaîne seule dont les maillons seraient comme les molécules d'un gaz. Dans la pratique, les chaînes sont soit en présence de leurs semblables, très proches les unes des autres et entremêlées (cas évoqué au paragraphe « chaîne gaussienne »), soit en présence d'un solvant. Ce dernier cas est celui d'une solution de polymère.
En solution, la conformation du polymère résulte du bilan des interactions « monomère-monomère », « monomère-solvant » et « solvant-solvant ». Il est possible de rendre compte de ce bilan au moyen d'un paramètre effectif d'interaction, appelé paramètre de Flory-Huggins (en). Trois cas sont envisageables :
- bon solvant : le couple polymère-solvant est tel qu'un monomère minimise son énergie libre lorsqu'il est entouré de molécules de solvant. Les interactions effectives entre maillons de la chaîne sont donc répulsives, favorisant ainsi la dispersion des polymères et leur solubilisation (d'où le terme « bon solvant »). C'est le cas d'un polymère dans un solvant constitué de monomères, par exemple le polystyrène en solution dans le styrène ;
- solvant - : le bilan des interactions entre maillons de la chaîne est nul. Ce cas se rencontre à une température précise (température -) qui n'est pas toujours accessible expérimentalement. Lorsque cette température est accessible, le solvant est qualifié de . Par exemple, le cyclohexane est un solvant - du polystyrène à 35 °C ;
- mauvais solvant : les interactions effectives entre maillons de la chaîne sont attractives. Dans ce cas, la solubilisation (dispersion) des polymères n'est pas directement réalisable, elle peut se faire à température suffisamment élevée pour que le solvant soit « bon ». En refroidissant, les polymères peuvent se trouver en mauvais solvant mais rester dispersés si la solution est suffisamment diluée. Ce cas peut également se rencontrer pour des polymères séquencés dont l'une des séquences (majoritaire) serait en situation de bon solvant, permettant ainsi la solubilisation et forçant une autre séquence à se trouver en situation de mauvais solvant.
En solution suffisamment diluée, les chaînes sont bien séparées les unes des autres. La conformation d'une chaîne ne dépend alors que du bilan des interactions effectives entre ses propres maillons. En solvant -, la conformation est idéale (), en bon solvant elle est gonflée () et en mauvais solvant elle est globulaire ().
Polymères branchés et transition sol-gel
Certaines molécules ont la propriété de pouvoir se lier aléatoirement à au moins trois autres durant leur réaction de polymérisation. Les polymères qui en résultent ne sont plus linéaires mais branchés et réticulés et leur taille très largement distribuée. La moyenne de cette distribution augmente avec l'avancement de la réaction. L'ensemble de la population des molécules est soluble (on la désigne par le terme sol) jusqu'à ce que la molécule la plus grande soit de taille macroscopique et connecte les deux bords du récipient contenant le bain de réaction. Cette molécule est appelée le gel. Typiquement, ce type de réaction est à la base des résines thermodurcissables.
L'apparition du gel confère au bain de réaction, initialement liquide, une élasticité qui est la caractéristique d'un solide. Cette transition de phase est bien décrite par un modèle de percolation (conjecture émise en 1976 de façon indépendante par Pierre-Gilles de Gennes et Dietrich Stauffer (de) et bien vérifiée expérimentalement depuis) qui prévoit la forme de la fonction de distribution, , du nombre de monomères de chaque molécule[pas clair] et la façon dont elles occupent l'espace. Jusqu'à la molécule la plus grande, est une loi de puissance du type :
Une taille caractéristique, , de chaque molécule peut être définie par la moyenne quadratique des distances entre monomères[réf. nécessaire], on parle de rayon de giration. La relation entre cette longueur et le nombre de monomères est également une loi de puissance :
où est la dimension fractale des molécules. Les valeurs particulières de ces exposants font qu'ils obéissent à la relation dite d'hyperéchelle reliant les exposants critiques à la dimension de l'espace .
L'implication majeure de cette relation est que les polymères branchés occupent l'espace à la façon des poupées russes, les petits à l'intérieur du volume occupé par les plus grands.
Diffusion de rayonnement
Les caractéristiques structurales des polymères sont accessibles expérimentalement par des expériences de diffusion élastique de rayonnement : diffusion de la lumière, diffusion aux petits angles des rayons X (en) et des neutrons (en).
Ces expériences consistent à éclairer un échantillon par une onde plane, monochromatique, de vecteur d'onde . Une partie de cette onde est déviée par les atomes constituants l'échantillon. Les ondes ainsi diffusées produisent des interférences dont l'analyse peut fournir des renseignements sur certaines caractéristiques de l'échantillon.
L'intensité totale, , de l'onde diffusée dans une certaine direction est recueillie à une distance de l'échantillon. En toute généralité, on peut écrire :
où est l'intensité de l'onde incidente (exprimée en nombre de particules, photons ou neutrons selon le rayonnement, par unité de temps et de surface). La grandeur , appelée section efficace différentielle de diffusion de l'échantillon, est homogène à une surface et contient l'information qui nous intéresse.
La diffusion élastique de rayonnement suppose que les ondes diffusées, de vecteur d'onde , sont de même longueur d'onde que l'onde incidente : et ont la même norme. La section efficace différentielle de diffusion est mesurée en fonction du vecteur de diffusion .
Si l'échantillon est isotrope, la mesure ne dépend pas de l'orientation de mais uniquement de sa norme qui s'écrit :
où est la longueur d'onde et l'angle de diffusion.
Solutions diluées de polymères : petites valeurs de q
Pour une solution suffisamment diluée de polymères, on peut montrer que la section efficace différentielle de diffusion s'écrit (cf. Diffusion élastique de rayonnement)
où est le nombre de chaînes en solution, le volume de chacune d'elles (c'est-à-dire la somme des volumes de tous ses monomères[réf. nécessaire] et non pas le volume de la sphère contenant la pelote), et un facteur représentant le contraste entre le polymère et le solvant et qui dépend du rayonnement utilisé. Ce facteur de contraste peut se mesurer où se calculer à partir de données tabulées : c'est une grandeur connue dans la plupart des cas.
La grandeur est appelée facteur de forme des polymères en solution. C'est une grandeur normalisée telle que . Pour une chaîne polymère de maillons de masse molaire et de masse volumique , l'équation précédente devient :
où est la concentration de la solution exprimée en masse par unité de volume (g/cm par exemple).
On peut montrer (voir Diffusion élastique de rayonnement), qu'à petit vecteur de diffusion comparé à la taille moyenne des pelotes, la section efficace par unité de volume s'écrit :
est une grandeur caractéristique de la taille moyenne des pelotes que forment les chaînes. Cette grandeur appelée « rayon de giration » est la moyenne quadratique des distances des monomères au centre de gravité de chaque pelote[réf. nécessaire].
Pour une solution très diluée, de concentration connue et pour un rapport également connu : la grandeur mesurée, , varie de façon affine avec le carré du vecteur de diffusion. L'ordonnée à l'origine permet de déterminer le nombre de maillons des chaînes en solution. La pente de la droite permet de déterminer le rayon de giration . Ce type d'expériences a permis de vérifier les relations entre ces deux grandeurs et de déterminer en particulier l'exposant qui les unit.
Solutions diluées de polymères : loi d'échelle
Les objets ordinaires ont une masse, , qui varie comme la puissance 1, 2 ou 3 de leur taille . Pour les objets fractals, cette puissance n'est pas nécessairement entière :
est la dimension fractale de cette famille d'objets. Elle caractérise la façon dont ils remplissent l'espace.
Les fractals sont le plus souvent autosimilaires, c'est-à-dire invariants par changement d'échelle.
Une fois grossie, une petite partie est statistiquement semblable à l'objet entier.
Observons sous différents grossissements la pelote que forme une chaîne polymère de rayon de giration . Si est la taille de la zone observable, pour (petit grossissement), la masse visible, , est égale à la masse totale . Par contre, pour (fort grossissement), la masse visible décroît lorsque le grossissement augmente. Supposons une loi du type :
Pour déterminer l'exposant , on utilise un argument d'échelle qui postule[17] :
- qu'une seule longueur est pertinente pour décrire l'objet (ici son rayon ) ;
- qu'à fort grossissement, la mesure est insensible à (on ne peut déduire la masse totale de l'objet en n'observant qu'une partie). Ce qui s'exprime par .
La relation précédente donne .
C'est ce qui se passe lors d'une expérience de diffusion de rayonnement pour laquelle l'échelle d'observation peut être assimilée à l'inverse du vecteur de diffusion : . En solution très diluée, la grandeur physique donnant accès à la masse d'un objet est la section efficace de diffusion cohérente par unité de volume, de concentration et de contraste :
Dans le régime intermédiaire du vecteur de diffusion tel que , la mesure sonde l'intérieur de l'objet et est sensible à son autosimilarité. L'argument d'échelle postule qu'une seule longueur est pertinente (or est déjà nécessaire à ) et que l'expérience est insensible à .
Une expérience de diffusion de rayonnement réalisée à grand vecteur de diffusion par rapport au rayon de giration des chaînes donne directement accès à la dimension fractale des chaînes en solution. Cette façon de déterminer utilise l'autosimilarité d'une chaîne seule, tandis que la précédente basée sur des mesures à petit vecteur de diffusion utilise l'autosimilarité des chaînes entre elles.
Nomenclature
La nomenclature IUPAC recommande de partir du motif de base de la répétition. Cependant de très nombreux polymères ont des noms usuels ne respectant pas cette nomenclature, mais sont basés sur le nom des molécules servant à synthétiser le polymère. Exemple : le polymère de formule est couramment appelé polyéthylène (sigle PE). Pour respecter la nomenclature IUPAC, il devrait être nommé « polyméthylène » car le motif constitutif n'est pas le groupe éthylène mais le groupe méthylène .
Nomenclature des homopolymères
Il existe à présent deux nomenclatures recommandées par l'IUPAC :
- la nomenclature systématique, appropriée aux communications scientifiques ;
- la nomenclature dérivée des précurseurs, nomenclature alternative officielle pour les homopolymères, dans laquelle figurent des noms usuels.
Références : les recommandations de l'IUPAC et le glossaire du JORF du pour les adaptations en langue française[18].
Terminologies préliminaires
| Terme IUPAC | Terme JORF | Définition |
|---|---|---|
| Unité constitutive | Unité constitutive | Atome ou groupe d'atomes, incluant les atomes ou groupes d'atomes éventuellement attachés, qui constituent une partie fondamentale de la structure d'une macromolécule. |
| Unité constitutive de répétition (CRU : constitutional repeating unit)[19] | Motif constitutif (MC) | La plus petite unité constitutive dont la répétition conduit à une macromolécule régulière*. |
| Unité monomère | Unité monomère | Unité constitutive la plus grande de la structure d'une macromolécule formée à partir d'une seule molécule de monomère. |
(*) Macromolécule régulière : macromolécule qui résulte de la répétition d'unités constitutives toutes identiques et reliées entre elles de la même manière.
- Nom trivial : nom dont aucune partie n'a de signification structurale. Exemple : urée.
- Nom semi-systématique : nom donné à un composé et dont une partie seulement a une signification structurale.
Exemples : propane (ane désigne un alcane), glycérol (ol désigne le groupe hydroxyle des alcools et des phénols).
- Nom systématique : nom donné à un composé et dont les différentes parties ont une signification structurale précise.
Exemples : pentane (penta- = cinq (atomes de carbone), et ane), 1,3-thiazole.
Utilisation des nomenclatures
1 - Nomenclature systématique
Elle est basée sur la structure des macromolécules constituant les polymères ; l'unité structurale est l'unité constitutive de répétition (CRU), ou motif constitutif (MC).
- Élaboration du nom
- a) sélectionner le motif constitutif
- b) nommer le motif
- c) nommer le polymère ; son nom est formé en combinant le préfixe poly avec le nom du motif constitutif placé entre parenthèses.
2 - Nomenclature dérivée des précurseurs
Les précurseurs servant à synthétiser les polymères sont le plus souvent des monomères.
- Les noms des monomères de cette nomenclature doivent être de préférence issus de la nomenclature systématique mais peuvent être également des noms semi-systématiques ou triviaux lorsqu'ils sont bien établis par l'usage.
- Le nom dérivé du précurseur d'un homopolymére est formé en combinant le préfixe poly avec le nom du monomère. Quand ce dernier comporte plus d'un mot ou en cas d'ambiguïté, le nom du monomère est placé entre parenthèses.
3 - Exemples
3-1 Monomère : l'éthène (formule semi-développée)
- Nom dérivé du précurseur : polyéthène
- Unité monomère : (groupe éthylène)
- Motif constitutif : (groupe méthylène)
- Nom systématique du polymère : poly(méthylène)
- Structure moléculaire :
Remarque : la formule est plus souvent utilisée ; elle est acceptable en raison de son utilisation passée et de la tentative de conserver une certaine similitude avec les formules d’homopolymères issus d’autres monomères dérivés de l’éthène, comme celui de l’exemple 3-2. Le nom du polymère associé à cette formule est polyéthylène ; le nom éthylène devrait être utilisé pour désigner le groupe divalent seulement, et non pour nommer le monomère (éthène)[20].
3-2 Monomère : le chlorure de vinyle (nom systématique : chloroéthène)
- Nom dérivé du précurseur : poly(chlorure de vinyle)
- Motif constitutif : , ou
- Unité monomère : id°.
- Sélection du motif constitutif
- Celui-ci est écrit pour une lecture de gauche à droite (numérotation des atomes dans le même sens), le substituant doit être placé sur le carbone de plus petit indice :
- plutôt que
- ⇒ Motif constitutif :
- Nom du motif constitutif : tout se passe comme si l'atome de chlore se substituait à un atome sur le carbone numéro du groupe éthylène
- Nom : 1-chloroéthylène
- Nom systématique du polymère : poly(1-chloroéthylène)
- Structure moléculaire :
3-3 Récapitulation et autres exemples
Source : nomenclature des polymères organiques monocaténaires réguliers (recommandations IUPAC 2002 en anglais)[20].
| Structure | Nom dérivé du précurseur (le préféré est proposé en premier) |
Nom systématique |
|---|---|---|
| polyéthène polyéthylène |
poly(méthylène) | |
| poly(chlorure de vinyle) | poly(1-chloroéthylène) | |
( : groupe phényle) |
polystyrène | poly(1-phényléthylène) |
| * | poly(oxyde d'éthylène) | poly(oxyéthylène) |
| polyformaldéhyde | poly(oxyméthylène) | |
| ** | poly(buta-1,3-diène) polybutadiène |
poly(but-1-ène-1,4-diyle) |
| poly(alcool vinylique) *** | poly(1-hydroxyéthylène) | |
| poly(téréphtalate d'éthylène) **** | poly(oxyéthylèneoxytéréphtaloyle) |
(*) Le motif est constitué de deux sous-unités : (préfixe oxy-) et (groupe éthylène) ; l'hétéroatome O a priorité sur la sous-unité carbonée ; il est placé en première position.
(**) La priorité revient à la sous-unité la plus insaturée : .
(***) Certains polymères sont obtenus par modification chimique d'autres polymères de telle façon que l'on puisse penser que la structure des macromolécules qui constitue le polymère a été formée par homopolymérisation d'un monomère hypothétique. Ces polymères peuvent être considérés comme étant des homopolymères. C'est le cas du poly(alcool vinylique)[21].
(****) De nombreux polymères sont obtenus par réaction entre monomères mutuellement réactifs. Ces monomères peuvent facilement être visualisés comme ayant réagi pour donner un monomère implicite dont l'homopolymérisation conduirait à un produit qui peut être vu comme un homopolymère[21]. Le poly(téréphtalate d'éthylène) est obtenu par réaction entre l'acide téréphtalique (acide dicarboxylique) et l'éthylène glycol (diol) ; ces monomères ont réagi pour donner un monomère implicite.
Notes et références
- Voir les définitions du glossaire IUPAC : (en) « polymer », Compendium of Chemical Terminology [« Gold Book »], IUPAC, 1997, version corrigée en ligne : (2006-), 2e éd.
et (en) « macromolecule (polymer molecule) », Compendium of Chemical Terminology [« Gold Book »], IUPAC, 1997, version corrigée en ligne : (2006-), 2e éd.
et leurs adaptations en langue française dans le JORF du 1er mars 2002 : [PDF] Termes généraux de la chimie. - Jean-Pierre Mercier, Gérald Zambelli, Wilfried Kurz, « Introduction à la science des matériaux », PPUR, 3e éd., 1999
- Service de Sciences des Polymères, « Printemps des Sciences 2010 - Les polymères - Université libre de Bruxelles » [PDF], sur inforsciences8.ulb.ac.be, (consulté le )
- OQLF, « La typographie - Marques de commerce »,
- Le PA-6 (polycaprolactame) appartient à la famille des polymères thermoplastiques techniques (ceux-ci possèdent des caractéristiques mécaniques élevées et sont très onéreux).
- (en) Charles E. Wilkes, James W. Summers et Charles Anthony Daniels, PVC Handbook, Munich, Hanser Verlag, , 723 p. (ISBN 1-56990-379-4, lire en ligne), p. 14
- À la différence des copolymères homogènes (statistiques ou alternés), les polymères séquencés (polymères blocs) présentent deux températures de transition vitreuse, identiques à celles mesurées sur les homopolymères correspondants.
- Bulletin de l'union des physiciens, no 790-791 (consacré aux matériaux), janvier - février 1997, § Macromolécules ou polymères tridimensionnels, p. 94, Voir l'article [PDF].
- 1er exemple : l'alcool polyvinylique, de formule -(CH2CHOH)n-, n'est pas obtenu par polymérisation de l'énol de formule H2C=CHOH (éthénol), qui est instable ; la molécule d'éthénol est la molécule monomère conceptuelle, mais pas réelle ; cf. Traité des Matériaux, vol. 13, Chimie des polymères, J.-P. Mercier, E. Maréchal, PPUR, 1996 (ISBN 978-2-88074-240-9) p. 382, 383 (E. Maréchal a contribué à la préparation du IUPAC : Glossaire des termes de base en science des polymères (Recommandations 1996)).
2e exemple, choisi parmi les composés inorganiques : dans le cas des silicones (composés macromoléculaires ou oligomères) de formule générale -(R2SiO)n-, les molécules monomères conceptuelles R2Si=O n'existent pas (elles n'ont jamais pu être isolées) ; source : Chimie inorganique, Huheey. Keiter & Keiter, De Boeck Université, 1996, p. 749 (ISBN 978-2-8041-2112-9) ; voir le titre « Fabrication » dans l'article « Silicone ».
3e exemple : un certain nombre de polymères sont obtenus par réaction entre deux monomères polyfonctionnels, par exemple l'hexaméthylènediamine H2N-(CH2)6-NH2 et l'acide adipique HOOC-(CH2)4-COOH. La réaction s'effectue par étapes ; la première étape conduit à un dimère de formule H2N-(CH2)6-NH-CO-(CH2)4-COOH (>N-CO- est le groupe caractéristique des amides), selon l'équation :- H2N-(CH2)6-NH2 + HOOC-(CH2)4-COOH → H2N-(CH2)6-NH-CO-(CH2)4-COOH + H2O.
- Une unité constitutive de répétition est la plus petite unité constitutive dont la répétition constitue une macromolécule régulière ; pour plus de détails, voir les définitions 1.4, 1.8, 1.14 et 1.15 dans le IUPAC : Glossaire des termes de base en science des polymères (Recommandations 1996). Dans la version en anglais, on utilise l'abréviation CRU pour désigner cette unité structurale (voir la (en) version originale du glossaire) ; en français, sa traduction UCR ne semble utilisée que pour désigner l'« unité constitutive répétitive » des polymères tridimensionnels (voir par exemple Analyse physico-chimique des polymères).
- Phrases extraites de l'ouvrage : Chimie Organique - Une initiation, J.-P. Mercier, P. Godard, PPUR, 1995 (ISBN 978-2-88074-293-5) p. 237
- Voir par exemple ce cours de Faculté de médecine : « Structures fonctions » (2002 - 2003)
- « La polymérisation consiste en la réunion les unes aux autres des molécules d'un composé simple, appelé le monomère, pour donner, sans aucune élimination, un composé de poids (sic) moléculaire plus élevé (multiple entier de celui du monomère), appelé polymère. Le nombre de molécules de monomères soudées les unes aux autres peut être très grand (plusieurs centaines, et même plusieurs milliers) ; on parle alors de haut polymère » ; phrases extraites de l'ouvrage : « Cours de chimie organique », P. Arnaud, Gauthier-Villars, 1966, p. 288. Ou encore : « oligo : préfixe signifiant « peu » et utilisé pour les composés comportant un nombre d'unités répétitives intermédiaire entre celui des monomères et des hauts polymères » ; source : R. Panico et al., Nomenclature et terminologie en chimie organique - Classes fonctionnelles. Stéréochimie, Techniques de l'ingénieur, 1996, p. 66 (ISBN 2-85-059-001-0).
- Voir également J. Angenault La Chimie : dictionnaire encyclopédique, Paris, Dunod, 1995 (ISBN 2-10-002-497-3) ; consulter notamment les articles cellulose et polymérisation (degré de).
- Glossaire IUPAC : (en) « degree of polymerization », Compendium of Chemical Terminology [« Gold Book »], IUPAC, 1997, version corrigée en ligne : (2006-), 2e éd.
- Traité des matériaux, vol. 1, 3e éd., Introduction à la science des matériaux, PPUR (1999) (ISBN 978-2-88074-402-1) p. 1, 344, 345.
- (en) Pierre-Gilles de Gennes, Scaling concepts in polymer physics, Cornell University Press, 1993, 4e éd., 324 p. (ISBN 978-0-8014-1203-5)
- 1. IUPAC : Glossaire des termes de base en science des polymères (Recommandations 1996)
Glossary of basic terms in polymer science ((en), version originale du document précédent)
Nomenclature des polymères, d'après les recommandations de l'IUPAC 2001
[PDF] Nomenclature des polymères organiques monocaténaires réguliers, 2002 (en)
R. Panico, J.-C. Richer, Nomenclature IUPAC des composés organiques, Masson (1994) (ISBN 978-2-225-84479-9)
2. JORF : [PDF] Termes généraux de la chimie
Vocabulaire des polymères (version abrégée du document précédent). - Constitutional repeating unit (CRU)
- (en) [PDF] Nomenclature des polymères organiques monocaténaires réguliers, Recommandations IUPAC 2002. Voir le tableau en annexe : « 11.2 Structure- and source-based names for common polymers »
- Voir les définitions 2.4 et 3.3, homopolymères et homopolymérisation dans le IUPAC : Glossaire des termes de base en science des polymères (Recommandations 1996).
Annexes
Articles connexes
Liens externes
Bibliographie
- (en) J.M.G. Cowie et Valeria Arrighi, Polymers: Chemistry and Physics of Modern Materials, CRC Press, 2007, 3e éd., 499 p. (ISBN 978-0-8493-9813-1)
- J.-L. Halary et F. Lauprêtre, De la macromolécule au matériau polymère, Belin, coll. Échelles, 2006, 334 p. (ISBN 978-2-7011-3422-2)
- J.-L. Halary, F. Lauprêtre et L. Monnerie, Mécanique des matériaux polymères, Belin, coll. Échelles, 2008, 432 p. (ISBN 978-2-7011-4591-4)
- Rémi Deterre et Gérard Froyer, Introduction aux matériaux polymères, Paris, Tec & Doc Lavoisier, , 212 p. (ISBN 2-7430-0171-2)
- Michel Fontanille et Yves Gnanou, Chimie et physico-chimie des polymères, Paris, Dunod, coll. « Sciences Sup », , 3e éd., 576 p. (ISBN 978-2-10-058915-9)
- Portail de la chimie
- Portail de la physique
- Portail des sciences des matériaux