Allotropie du carbone
Les formes allotropiques du carbone présentes naturellement à l'état solide sur terre sont le carbone amorphe et trois formes cristallisées, le graphite, le diamant et la lonsdaléite.

D'autres ont d'abord été synthétisées, tels les fullerènes (dont l'archétype C60), les nanotubes de carbone, le carbone vitreux et la nanomousse, mais on a découvert ensuite que de petites quantités de fullerènes et de nanotubes se formaient naturellement lors de combustions incomplètes.
Certains allotropes ne sont encore que présumés (hexagonite), ou observés uniquement dans l'espace (C2, C3, C5), ou même seulement conjecturés.
État solide
| Forme | Hybridation[1] | Structure | Existence |
|---|---|---|---|
| Graphite | sp2 | cristal hexagonal bidimensionnel empilé cristal trigonal (métastable) |
naturelle |
| Graphène | sp2 | cristal hexagonal bidimensionnel |
naturelle (mélangé au graphite), synthétique (mono-couche) |
| Diamant | sp3 | cristal cubique (tétraédrique) | naturelle synthétique |
| Lonsdaléite (« diamant hexagonal ») | sp3 | cristal hexagonal tridimensionnel | |
| Fullerène (nanosphères de carbone) | sp2 | cluster | synthétique |
| Nanotubes de carbone & oignons, nanobuds, mégatubes, anneaux |
sp2 (et sp3 ?) | à simple, double ou multiple parois | synthétique |
| Carbone amorphe.
Charbon, suie, noir de carbone, quenched carbon (« carbone trempé ») |
sp2-sp3 | pas de structure cristalline
agrégat de cristaux |
naturelle
synthétique (Q-Carbon) |
| Nanomousse (carbone méso-poreux) |
sp2 | cluster | synthétique |
| Carbyne | sp | polymère linéaire | naturel (précurseur de la suie)
synthétique (intermédiaire) |
| Chaoite | sp ? | polymère linéaire ? | peut-être dans les météorites |
| Carbone moléculaire (C2, C3, C5) |
? | cyclique | synthétique |
| Carbone vitreux | sp2 | synthétique | |
| Carbone métalloïde | théorique | ||
| Hexagonite | sp-sp2 | théorique | |
| Prismatique C8 | cluster | théorique |
Historique
Le carbone était connu principalement sous deux formes, le diamant et le graphite qu'on expliquait jusqu'en 1970 par le type de liaisons carbone à carbone le constituant, respectivement sp2 et sp3. Il fallut néanmoins considérer d'autres modèles structuraux pour expliquer correctement d'autres formes créées par des techniques et conditions de plus en plus diversifiées (carbonisation, graphitisation, combustion et notamment à la flamme oxyacétylénique, décharge d'arc électrique).
Avec des propriétés différentes, ces nouveaux allotropes furent caractérisées par microscopie électronique, spectroscopie, spectrographie aux rayons X, et la diffraction (voir la revue historique de Donnet 2009[2]). Par exemple les fullerènes furent mis en évidence en laboratoire en 1985, dont on dû reconnaitre et distinguer au-delà des liaisons planes sp2 homologues au graphène, une structure globale sphérique.
Typologie
Carbone amorphe
Le carbone amorphe est une forme du carbone qui ne possède pas de structure cristalline, ou en fait qui est hautement désordonnée (a-C). Ces formes amorphes du carbone sont un mélange de sites à trois liaisons de type graphite ou à quatre liaisons de type diamant. Il est présent dans ce qu'on désigne usuellement par charbon, suie, et noir de charbon, lesquels sont sensu stricto, non pas des allotropes, mais des polycristaux au sein d'une matrice amorphe.
Voir l'article carbone amorphe.
Diamant et lonsdaléite
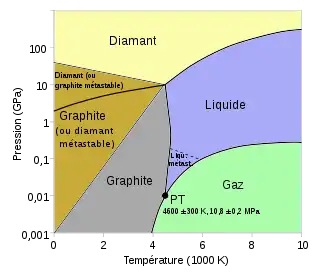
Le diamant est une forme cristalline du carbone où les atomes de carbone sont coordonnés à 4 autres par liaisons sp3 formant un réseau cristallographique cubique. Le diamant existe à l'état naturel, mais il est aussi synthétisé par diverses méthodes : techniques HP-HT (haute pression, haute température), dépôt chimique en phase vapeur, et vaporisation d'une solution éthanol-eau (méthode Tequila). Stable à haute pression mais métastable à pression atmosphérique, le diamant se transforme très lentement vers l'état stable graphite dans les conditions prévalant à la surface de la Terre ; cette transformation est cependant trop lente pour être observable.
Un diamant à structure hexagonale existe aussi, la lonsdaléite. Cet allotrope, beaucoup plus rare, a été découvert en 1967 dans un cratère météoritique, et synthétisé la même année, indépendamment, lors d'expériences à haute pression (13 GPa) et haute température (> 1000 °C)[3].
Graphite et graphène
Le graphite[4] est une forme cristalline stable du carbone où les atomes de carbone sont coordonnés à trois autres par liaisons sp2 dans un plan cristallographiques hexagonal 2 % des atomes sont engagés dans les plans voisins. Loin de cet état cristallin parfait, un graphite peut combiner une variété de structures, incluant des nappes de structure graphène (feuillets : plans à structure hexagonale non reliés), des lacunes d'atomes dans les plans graphitiques, et des atomes interstitiels insérés entre ces plans, et des structures plus amorphe (voir noir de carbone).
Nanomousse
La nanomousse, ou carbone meso-poreux, est obtenue par vaporisation de graphite sous atmosphère inerte (argon). C'est la seule forme allotropique du carbone possédant des propriétés magnétiques.
Fullerène et nanotubes de carbone
Les fullerènes[5] sont une forme cristalline du carbone où les atomes de carbone sont coordonnés à 4 autres par liaisons sp2 formant un réseau cristallographique sphérique creux. Le cristal type est le Buckminsterfullerène (C60), mais il en existe de 40 à 540 atomes de carbone (C40, C70, C540). Découverts en 1985 en laboratoire, ils sont produits par décharge d'arcs électriques, mais ils furent aussi identifiés dans des noirs de carbone préparés industriellement par la méthode au four. Les sphères cristallines forment des agrégats (clusters). Il existe aussi des structures dites en oignons (structure de type fullerène, mais dont la paroi est constituée de plusieurs couches de carbone).
Les nanotubes de carbone sont des formes cristallines cylindriques creuses du carbone (feuille de graphène enroulée). Il existe:
- des nanotubes de carbone monofeuillets, (en anglais Single-walled Carbon Nanotubes, SWNT) ;
- des nanotubes de carbone deux, ou multi-feuillets, (en anglais Double,- or Multi-walled Carbon Nanotubes, DWNT, MWNT).
Leurs propriétés sont exceptionnelles :
- d'un point de vue mécanique: ils présentent à la fois une excellente rigidité, comparable à celle de l'acier, tout en étant extrêmement légers.
- d'un point de vue électrique et optique: les nanotubes mono-feuillets se comportent soit comme des métaux (métalloïdes) soit comme de semi-conducteurs en fonction de leur géométrie.
Carbyne, chaoite (et fibres de carbone)
Une variété de fibres de carbone (utilisées dans les matériaux composites pour leur résistance mécanique dans le sens de la fibre) fut produite et décrite depuis les années 1970 à 1980, plus ou moins pures après des traitements thermiques et mécaniques de polymères (polyacrylonitrile, cellulose...).
Les plus purs, qu'on désigne par le terme générique de carbyne[6], sont obtenus par graphitisation, et ont comme propriétés remarquables de séparer des constituants de phases liquide ou gaz, ou de catalyser des réactions, propriétés surprenantes comparées aux charbons actifs ayant des surfaces spécifiques pourtant très supérieures. Leur structure de base est une chaine linéaire de carbone moléculaire électriquement neutre (des carbynes substitués par du carbone et polymériques).
La chaoite[6], ou carbone blanc, est un minéral décrit dans certains gneiss graphitiques (shock-fused graphite gneiss) du cratère Ries en Bavière, et dans des météorites, ce qui reste contesté. Il forme des cristaux de 2 à 15 μm, interstitiels dans des lamelles de graphite, avec une couleur de réflexion gris à blanc, un éclat sub-métallique, une diaphanéité opaque, légèrement plus durs que le graphite (Mohs : 1 à 2), de densité calculée 3,43. Sa structure est hexagonale et dihexagonale et sa symétrie est dipyramidale. Son profil de diffraction électronique l'apparente à une structure carbyne[7] mais ceci a été contesté et attribué à des impuretés[8].
Allotropes du carbone putatifs ou théoriques
Le carbone n'est pas un élément métallique (c'est un non-métal), néanmoins certains allotropes du carbone (notamment le graphite) ont des propriétés qui les rapprochent des métalloïdes.
Un allotrope théorique de forme cristalline hexagonale a été décrit, nommé hexagonite[9] (à ne pas confondre avec l'inosilicate mal nommé hexagonite).
Un autre allotrope théorique a été proposé avec une structure prismatique (à 120°), Prismatique C8[10].
Les prismanes ne sont pas des allotropes, mais des chaines de carbone (analogue au carbyne) substituées par de l'hydrogène.
La chaoite est un allotrope encore controversé (voir si dessus, avec le Carbyne).
Notes et références
- Bernier & Lefrant (1997), p. 45
- « Les allotropes du carbone: une grande famille », Donnet, L'actualité chimique, mars-avril 2006, p.295-296.
- (en) F. P. Bundy et J. S. Kasper, « Hexagonal Diamond—A New Form of Carbon », The Journal of Chemical Physics, vol. 46, , p. 3437 (DOI 10.1063/1.1841236).
- Bernier & Lefrant (1997), p. 55-56
- Bernier & Lefrant (1997), p. 59-68
- Bernier & Lefrant (1997), p. 54-55
- (en) A.G. Whittaker et P.L. Kintner, « Carbon: observation on the new allotropic form », Science, vol. 165, , p. 589.
- (en) P.P.K. Smith et P.R. Buseck, « Carbyne forms of carbon: do they exist? », Science, vol. 216, , p. 984-986.
- (en) Chapitre 5 : « Carbon Bonding and Structures: Advances in Physics and Chemistry », Carbon Material: Chemistry and Physics, Springer Science ; « High Pressure Synthesis of the Carbon Allotrope Hexagonite with Carbone Nanotubes in a Diamond Anvil Cell », L.J. Bucknum et E.A. Castro, Journal of Chemical Theory and Computation 03/2006; 2(3).
- (en) Leonid A. Openov et Vladimir F. Elesin, « Prismane C8: A New Form of Carbon? », Pis'ma v ZhETF, vol. 68, , p. 695-699 (lire en ligne)
- (en) J. Tennyson, « Molecules in Space » dans (en) Stephen Wilson (dir.), Handbook of Molecular Physics and Quantum Chemistry, vol. 3, Chichester, John Wiley & Sons, (ISBN 978-0-471-62374-8), partie III, p. 358
- (en) Galazutdinov, G. A.; Musaev, F. A.; Krełowski, J., « On the detection of the linear C5 molecule in the interstellar medium », Monthly Notices of the Royal Astronomical Society, vol. 325, no 4, 08/2001, p. 1332-1334 (DOI 10.1046/j.1365-8711.2001.04388.x).
Voir aussi
Bibliographie
- Patrick Bernier et Serge Lefrant, Le carbone dans tous ses états, Taylor & Francis, , 584 p. (ISBN 978-90-5699-056-5, lire en ligne)