Algue
Les algues /alg/ sont des organismes vivants capables de photosynthèse oxygénique dont le cycle de vie se déroule généralement en milieu aquatique. Elles constituent une part très importante de la biodiversité et la base principale des chaînes alimentaires des eaux douces, saumâtres et marines. Diverses espèces sont utilisées pour l'alimentation humaine, l'agriculture ou l'industrie.
l'appellation « Algues » s'applique en français à plusieurs taxons distincts.

Taxons concernés
- Domaine des Eubacteria
- Classe des Cyanophyceae ou Oxyphotobacteria
- Domaine des Eukaryota
- Division des Glaucophyta ou Glaucocystophyta
- Division des Rhodophyta
- Sous-division des Cyanidiophytina
- Classe des Cyanidiophyceae
- Sous-division des Rhodophytina
- Classe des Bangiophyceae
- Classe des Compsopogonophyceae
- Classe des Florideophyceae
- Classe des Porphyridiophyceae
- Classe des Rhodellophyceae
- Classe des Stylonematophyceae
- Sous-division des Cyanidiophytina
- Division des Chlorobionta ou Viridiplantae
- Sous-division des Chlorophyta
- Classe des Prasinophyceae
- Classe des Pedinophyceae
- Classe des Ulvophyceae
- Classe des Chlorophyceae
- Classe des Trebouxiophyceae
- Sous-division des Streptophyta
- Classe des Mesostigmatophyceae
- Classe des Chlorokybophyceae
- Classe des Klebsormidiophyceae
- Classe des Zygnematophyceae ou Conjugatophyceae
- Classe des Coleochaetophyceae
- Classe des Charophyceae
- Sous-division des Chlorophyta
- Division des Cryptophyta
- Classe des Cryptophyceae ou Cryptomonadea ou Cryptomonadophyceae
- Division des Euglenozoa
- Classe des Euglenophyceae ou Euglenoida
- Division des Cercozoa
- Classe des Chlorarachniophyceae
- Division des Haptophyta ou Prymnesiophyta
- Classe des Pavlovophyceae
- Classe des Prymnesiophyceae
- Division des Dinophyta
- Classe des Dinophyceae
- Classe des Blastodiniphyceae
- Classe des Noctiluciphyceae
- Classe des Syndiniophyceae
- Division des Ochrophyta ou Heterokontophyta
- Classe des Bacillariophyceae ou Diatomophyceae
- Classe des Bolidophyceae
- Classe des Parmophyceae
- Classe des Pelagophyceae
- Classe des Pedinellophyceae
- Classe des Dictyochophyceae
- Classe des Pinguiophyceae
- Classe des Raphidophyceae
- Classe des Phaeothamniophyceae
- Classe des Chrysomerophyceae
- Classe des Xanthophyceae ou Tribophyceae
- Classe des Schizocladiophyceae
- Classe des Phaeophyceae ou Melanophyceae ou Fucophyceae
- Classe des Eustigmatophyceae
- Classe des Chrysophyceae
Les algues ne constituent pas un groupe évolutif unique, mais rassemblent toute une série d'organismes pouvant appartenir à des groupes phylogénétiques très différents[1]. De fait, les algues ont souvent été définies par défaut, par simple opposition aux végétaux terrestres ou aquatiques pluricellulaires.
L'étude des algues s'appelle la phycologie. Le terme d'algologie est parfois utilisé, mais il désigne également la branche de la médecine qui traite de la douleur[2].
De nombreuses estimations ont fait varier le nombre d’espèces d’algues de 30 000 à plus d'un million. Malgré les incertitudes quant aux organismes qui devraient être considérés comme des algues, un inventaire établi en 2012, d'après la base de données AlgaeBase (qui inclut 15 phyla et 64 classes mais ne prend pas en compte les quelque 200 000 espèces de diatomées, microalgues siliceuses), recense 72 500 espèces d’algues différentes[3].
Étymologie
Le mot « algue » est issu le mot latin alga[4] de même signification. Son étymologie est obscure. Bien que certaines spéculations le rapprochent du latin algēre, « avoir froid »[5], aucune raison connue ne permet d'associer les algues à la température. Une source plus vraisemblable serait *allĭga « liant, entrelaçant » (dérivé de adlĭgātĭo action de lier).
Le mot grec ancien pour « algue » est φῦκος / phŷkos, ce qui pouvait signifier soit l'algue elle-même (probablement une algue rouge), soit un colorant rouge qui en dérive. En effet, la latinisation fūcus désignait avant tout le rouge cosmétique. Son étymologie est également incertaine, mais un candidat potentiel est le terme hébreux biblique פוך / pūk, « peinture », un fard à paupières utilisé par les anciens égyptiens et d'autres habitants de Méditerranée orientale. Il pourrait alors s'agir de n'importe quelle couleur : noir, rouge, vert ou bleu.
L'étude moderne des algues, marines ou d'eau douce, est appelée soit phycologie, soit algologie, selon que la racine grecque ou latine est utilisée. Le mot fucus est repris dans un certain nombre de taxons.
Description générale, typologie
Les algues sont des végétaux polyphylétiques
Dans l'acception la plus large du terme, les algues rassemblent :
- des organismes procaryotes : les Cyanobactéries (autrefois nommées « algues bleues » ou Cyanophycées) ;
- des eucaryotes :
- divers groupes à espèces unicellulaires (Euglénophytes, Cryptophytes, Haptophytes, Glaucophytes, etc.),
- d'autres groupes à espèces unicellulaires ou pluricellulaires :
- les « algues rouges » ou Rhodophyta,
- les Stramenopiles (regroupant notamment les Diatomées et les « algues brunes » ou Phéophycées),
- et enfin des végétaux assez proches des plantes terrestres : les « algues vertes », qui comprennent entre autres les Ulvophycées.
La morphologie est donc très diversifiée : de nombreuses espèces sont unicellulaires, éventuellement mobiles, d'autres forment des filaments cellulaires ou des lames simples, d'autres développent des architectures complexes et différenciées, par apposition cellulaire ou par enchevêtrement de filaments tubulaires. Les algues ne possèdent cependant pas de tissus nettement individualisés, comme on peut en trouver parmi les végétaux terrestres vasculaires. Les couleurs des algues, qui peuvent être très variées (verte, jaune, rouge, brune...) ont servi, dans le sillage de Lamouroux à désigner les différents « groupes » taxinomiques d'algues.
Bien que pouvant appartenir à des groupes non apparentés, les algues peuvent constituer des groupes écologiques pertinents : les macroalgues marines, le phytoplancton, etc.
Des algues en symbiose
Certaines algues contribuent à des formes symbiotiques stabilisées très répandues dans la nature, telles que les lichens et les coraux zooxanthellés, mais certaines espèces peuvent aussi être impliquées dans des formes de symbioses plus rares ou plus insolites, par exemple avec certaines éponges d'eau douce comme Spongilla lacustris, avec des mollusques nudibranches comme Phyllodesmium longicirrum et même, cas unique connu chez les Vertébrés, avec la salamandre maculée Ambystoma maculatum.
Il existe quelques cas d'algues parasites[réf. nécessaire].
Des plantes aquatiques non apparentées aux algues
Tous les végétaux aquatiques ne sont cependant pas des algues. Plusieurs groupes de plantes terrestres se sont adaptés à une existence immergée en eau douce (des mousses, les fougères Hydropteridales, diverses Spermaphytes dont les Potamogetonacées, les Hydrocharitacées, les Utriculaires, etc.).
Quelques familles de plantes à fleurs vivent même exclusivement ou partiellement dans la mer (Zostéracées, Posidoniacées, Cymodoceaceae, certaines Hydrocharitaceae, Ruppiaceae et Zannichelliaceae) constituant des herbiers marins.
Des algues en milieu terrestre
À l'inverse, de nombreuses algues unicellulaires ont conquis des habitats terrestres très diversifiés, pourvu qu'ils soient au moins un peu humides.
Ainsi, Chlamydomonas nivalis vit dans les glaciers. Des algues verdissent de nombreuses écorces d'arbres. L'algue Klebsormidium est fréquemment trouvée sur les façades d'Europe ainsi que d'autres espèces selon Ortega-Calvo et al.(1991)[6] ; Rindi et Guiry (2004)[7] ; Barberousse (2006)[8] et Rindi (2004)[9],[10], dont Trentepohlia, Trebouxia, Prasiola et Chlorella ou encore une espèce du genre Trentepohlia est responsable des traînées rougeâtres sur le ciment de poteaux électriques, de murs ou sur le crépi de mortier appliqué sur certaines façades de bâtiments, par exemple assez fréquemment dans l'ouest de la France. Des murs peuvent être teintés de jaune-orangé, brun ou bordeaux en raison de la présence de caroténoïdes et de produits de dégradation de la chlorophylle (les phycobiliprotéines) issus d’algues, de cyanobactéries et de microchampignons. La colonisation de crépis par des bactéries chemo-organotrophiques et/ou les produits de dégradation des cyanobactéries et des algues enrichies en fer provoque une coloration rouge et rose des façades selon Warscheid et Braams (2000)[11], cités par Estelle Dalod dans sa thèse sur l'influence de la composition chimique de mortiers sur leur biodétérioration par les algues[12].
 Algues vertes (et mousses) sur vieux mur humide
Algues vertes (et mousses) sur vieux mur humide Algues rouges sur mur (Bretagne)
Algues rouges sur mur (Bretagne) trainées rouges
trainées rouges Algues rouges sur mur
Algues rouges sur mur
Taxinomie (Classification des algues)
« Algues » procaryotes
Traditionnellement, on classait les Cyanobactéries parmi les algues, référencées comme cyanophytes ou algues bleu-vert, bien que certains traités les en aient exclues. Elles apparaissent déjà dans des fossiles du Précambrien, datant d'environ 3,8 milliards d'années. Elles auraient joué un grand rôle dans la production de l'oxygène de l'atmosphère. Leurs cellules ont une structure procaryote typique des bactéries. La photosynthèse se produit directement dans le cytoplasme. Lorsqu'elles sont en symbiose avec un champignon, elles forment un lichen.
Elles sont à l'origine des chloroplastes des cellules eucaryotes, et ont ainsi permis aux végétaux de réaliser la photosynthèse, à la suite d'une endosymbiose.
Algues eucaryotes

Toutes les autres algues sont eucaryotes. Chez-elles, la photosynthèse se produit dans des structures particulières, entourées d'une membrane, qu'on appelle chloroplastes. Ces structures contiennent de l'ADN et sont similaires aux cyanobactéries validant l'hypothèse de l'endosymbiose.
Trois groupes de végétaux ont des chloroplastes « primaires » :
- les Chlorobiontes dont font partie les plantes vertes ;
- les algues rouges ou Rhodophytes ;
- les Glaucophytes.
Dans ces groupes, le chloroplaste est entouré par 2 membranes. Ceux des algues rouges ont plus ou moins la pigmentation typique des cyanobactéries, alors que la couleur verte, et celle des plantes supérieures, est due à la chlorophylle a et b. L'analyse biochimique des membranes permet raisonnablement de soutenir l'hypothèse que ces groupes ont un ancêtre commun, c'est-à-dire que l'existence des chloroplastes serait la conséquence d'un seul événement endosymbiotique[1].
Deux autres groupes, les Euglénophytes et les Chlorarachniophytes, ont des chloroplastes verts contenant de la chlorophylle a et b. Ces chloroplastes sont entourés, respectivement, de trois ou quatre membranes et furent probablement acquis de l'incorporation d'une algue verte. Ceux des Chlorarachniophytes contiennent un petit nucléomorphe, reste du noyau de la cellule. On suppose que les chloroplastes des Euglénophytes ont seulement 3 membranes parce qu'ils furent acquis par myzocytose plutôt que par phagocytose.

Les autres algues ont toutes des chloroplastes contenant des chlorophylles a et c. Ce dernier type de chlorophylle n'est pas connu du moindre procaryote ou chloroplaste primaire, mais des similarités génétiques suggèrent une relation avec l'algue rouge. Ces groupes comprennent :
- les hétérokontophytes (par exemple : algues dorées, diatomées, algues brunes) ;
- les haptophytes (par exemple : coccolithophores) ;
- les cryptophytes ;
- les dinoflagellés.
Dans les trois premiers de ces groupes (Chromista), le chloroplaste a 4 membranes retenant un nucléomorphe chez les Cryptophytes, et on suppose maintenant qu'ils ont en commun un ancêtre coloré. Le chloroplaste des Dinoflagellés typiques a 3 membranes, mais il y a une diversité considérable dans les chloroplastes de ce groupe, quelques membres ayant acquis leurs plastes par d'autres sources. Les Apicomplexa, un groupe de parasites étroitement apparentés, ont aussi des plastes dégénérés appelés apicoplastes, différents toutefois des véritables chloroplastes, qui semblent avoir une origine commune avec ceux des dinoflagellés.
Appartenance des algues, selon diverses classifications
- Dans le plus ancien système à 3 règnes, les algues sont dans le règne végétal, parmi les thallophytes, avec les champignons et les lichens.
- Dans le système à 5 règnes (de Robert Harding Whittaker), les algues sont réparties entre les Plantae et les Protista.
- En classification phylogénétique, les algues sont réparties en 11 groupes dans un groupe polyphylétique.
Genres d'algues

Quelques genres, classés selon Catalogue Of Life :
- Phylum Cyanobacteria : à ce phyllum appartiennent les Stromatolites.
- Phylum Haptophyta
- Calcidiscus (coccolithophore) (Unicellulaire)
- Phylum Ochrophyta
- Alaria
- Stypopodium
- Cystoseira
- Durvillaea
- Eisenia (Aramé)
- Fucus
- Himanthalia
- Laminaria
- Macrocystis
- Protococcus = Phaeococcus
- sargasse
- Vaucheria
- Phylum Chlorophyta
- Acetabularia (Unicellulaire)
- Blidingia, Bryopsis
- Caulerpa, Chlamydomonas (Unicellulaire), Chlorella (Unicellulaire), Cladophora , Codium
- Dictyota
- Enteromorpha
- Haematococcus
- Mougeotia, Monostroma
- Nitella
- Oedogonium
- Pediastrum, Prasiola
- Spirogyra
- Ulothrix, Ulva
- Volvox
- Zoochlorella, Zygnema
- Phylum Rhodophyta
- Asparagopsis
- Ceramium, Chondrus (Carragheen), Corallina
- Feldmannophycus
- Gelidium
- Lithothamnium
- Nemalion
- Porphyra
- Phylum Dinophyta
- Zooxanthella = Endodinium (Unicellulaire)
Algues fossiles
- Girvanella (Cyanobacteria)
- Diplopora
Un des projets collaboratifs de Tela botanica porte sur la création d'une base de données Algues[13] pour les algues (macroalgues et microalgues marines, saumâtres, dulçaquicoles et terrestres) de France métropolitaine, et éventuellement ensuite des territoires d'outre-mer.
Formes des algues
La plupart des algues les plus simples sont unicellulaires flagellés ou amoeboïdes, mais des formes coloniales et non-mobiles se sont développées indépendamment dans plusieurs de ces groupes. Les niveaux d'organisation les plus courants, dont plusieurs peuvent intervenir dans le cycle de vie d'une espèce, sont les suivants :
- Colonial - petit groupe ordinaire de cellules mobiles.
- Capsoïde - cellules non mobiles incluses dans un mucilage.
- Coccoïde - des cellules individuelles non-mobiles avec des parois cellulaires.
- Palmelloïde - des cellules non-mobiles incluses dans le mucilage.
- Filamenteux - une kyrielle de cellules non-mobiles connectées ensemble, quelquefois ramifiées.
- Membraneux - des cellules formant un thalle avec une différenciation partielle des tissus.
Des niveaux plus élevés d'organisation ont même été atteints, menant à des organismes avec des différenciations complètes des tissus. Ce sont les algues brunes qui peuvent atteindre 70 m de long (varech) ; les algues rouges et les algues vertes. Les formes les plus complexes se trouvent chez les algues vertes (voir Charales), dans une lignée qui a conduit aux plantes supérieures. Le point où ces dernières commencent et où les algues s'arrêtent est marqué habituellement par la présence d'organes reproductifs munis de couches de cellules protectrices, une caractéristique qu'on ne trouve pas dans les autres groupes d'algues.
Écologie des algues
Les algues constituent, avec les bactéries et le zooplancton, une part essentielle importante de l'écologie aquatique et de l'environnement marin notamment. Elles ont adopté des modes de vie très divers, certaines vivant même hors de l'eau. Grâce à des spores résistantes, nombre d'entre elles ont une capacité exceptionnelle de résistance. Le vent, les embruns et les oiseaux migrateurs[14] contribuent à leur dispersion.
Les algues jouent un rôle fondamental dans le cycle du carbone[15]. En effet, elles fixent le carbone atmosphérique via la photosynthèse et contribuent ainsi à limiter l'effet de serre.
Bien qu'elles soient toutes pourvues de chlorophylle, elles peuvent être autonomes (autotrophes ou saprophytes), parasites, ou vivre en symbiose.
- Algues autotrophes
- Algues flottantes du plancton
- Algues unicellulaires, en colonies lâches ou filamenteuses formant le phytoplancton,
- Algues flottantes de grande taille : les sargasses, algues brunes adaptées à la vie flottante, elles ont donné leur nom à la mer des Sargasses, ou bien algues brunes ou rouges qui forment des boules ou pelotes flottantes appelées aegagropiles.
- Algues thermophiles
- Algues aériennes
- Algues fixées
- sur des rochers : épilithes
- Ce sont les algues des côtes rocheuses fixées par des crampons robustes aux rochers ou aux galets jusqu'à une profondeur de 50 à 75 m, mais elles se raréfient très rapidement avec la profondeur au-delà de 30 m, les radiations utiles à la photosynthèse étant absorbées par l'eau de mer. Elles se développent plus sur des côtes en pente douce qui forment des plates-formes littorales étendues. C'est parmi ces algues qu'on trouve les espèces géantes : les laminaires, les Durvillea de Nouvelle-Zélande longue de 10 m, ou les Nereocystis de la côte Ouest de l'Amérique du Nord dont les frondes peuvent atteindre 50 m de long.
- NB : la posidonie (Posidonia oceanica), espèce endémique de Méditerranée, n'est pas une algue, mais une plante à fleurs de la famille des Posidoniacées. La zostère est également une plante à fleurs. Quant à la salicorne, c'est une plante terrestre halophile (qui aime le sel).
- sur des animaux : épizoïques
- sur des végétaux : épiphytes
- sur du bois : épixyles
- sur des rochers : épilithes
- Algues flottantes du plancton
- Algues saprophytes
- Algues parasites
- Algues symbiotiques :
- on appelle zoochlorelles ou zooxanthelles les algues vivant en association avec des organismes animaux, selon qu'il s'agit d'algues vertes ou d'algues brunes. Les organismes concernés sont des spongiaires, des cnidaires, des bryozoaires ou des protozoaires.
- avec des champignons : les lichens. Toutes les algues qui prennent part à la formation de lichens sont des Chlorophycées, la plupart unicellulaires.
Les macroalgues croissent surtout dans les eaux peu profondes et procurent des habitats différents. Les microalgues, qui composent le phytoplancton, sont à la base de la chaîne alimentaire marine. Le phytoplancton peut être présent en forte densité là où les nutriments sont abondants, par exemple dans les zones de remontée d'eau ou eutrophisées. Elles peuvent alors former des efflorescences, et changer la couleur de l'eau.
Les marées vertes qui peuvent couvrir certaines plages d'un matelas nauséabond de quelques décimètres d'épaisseur et de quelques mètres voire dizaines de mètres de large, sont dues à la prolifération d'algues vertes, essentiellement Ulva lactuca, dans un milieu enrichi en nitrates par le ruissellement dans les zones d'agriculture intensive ou par un traitement insuffisant des eaux usées de zones urbaines.
La consommation animale de populations algales est le fait de filtreurs (microalgues, spores d'algues), de brouteurs d'algues (animaux marins qui raclent ou sucent, à l'aide de leur radula, les algues microscopiques, les jeunes germinations des macroalgues) ou de patureurs (animaux broutant des morceaux de macroalgues, principalement les poissons phytophages). La pression animale sur ces populations provient essentiellement des animaux de la zone de balancement des marées qui ont également une répartition étagée : Mollusques Gastéropodes (Littorines, aplysies, Gibbules, Troques, Pourpres, Patelles) et des Crustacés Cirripèdes représentés par plusieurs espèces de Balanes[16].
Les algues offrent des supports à l'épifaune fixée (ascidies, vers polychètes), abritent une macrofaune vagile (crabes, oursins) et une microfaune importantes servant de nourriture à différents prédateurs (poissons, crustacés)[17].
Utilisations
Historique
Le plus ancien document attestant de l'usage médicinal des algues remonte en Chine avec le Shennong bencao jing, ouvrage traitant des drogues végétales, animales et minérales et dont la paternité a été attribuée à un empereur mythique Shennong vivant aux environs de 2800 av. J.-C. Un chapitre entier de ce livre traite des algues et recommande notamment l'usage d'algues brunes riches en iode (Laminaria digitata, Laminaria saccharina, Fucus vesiculosus, Sargassum) dans le traitement du goitre, réalisant une iodothérapie avant la lettre[18]. L'auteur chinois Sze Teu écrit en 600 av. J.-C. « certaines algues sont les seuls mets dignes de la table d'un roi » mais la civilisation gréco-romaine se montre moins enthousiaste pour les végétaux marins (la seule exception étant les matrones romaines qui destinent le Fucus à des usages cosmétiques. Ainsi Virgile écrit dans l’Énéide « nihil vilior alga » (rien de plus vil que les algues)[19].
L'exploitation des goémons comme engrais remonte au moins au haut Moyen Âge en France. L'exploitation du varech devient industrielle à partir du XVIe siècle[20].
Légume méprisé car situé en bas de la chaîne des êtres d'Aristote, l'algue est parfois consommée par les populations littorales pour faire face aux difficultés et aux menaces de disettes, cette consommation étant supplantée par celle de la pomme de terre dont la culture s'étend en Europe pendant toute la première moitié du XVIIIe siècle et contribue à mettre fin aux famines endémiques[21].
Les décennies 1990 et 2000 voient les algues être stigmatisées : les plages doivent en être débarrassées pour les touristes qui veulent des plages « propres » et les marées vertes produisent un effet désastreux sur l'opinion publique ; mais leur retour en grâce est amorcé avec la valorisation de nombreux produits à base d'algues pour l'industrie cosmétique, l'alimentation, la médecine, la thalassothérapie, etc.[22]
Alimentation humaine
_holding_a_senile_man_in_her_lap_and_feeding_Wellcome_L0023028.jpg.webp)
Une cinquantaine d'espèces d'algues comestibles sauvages ou cultivées[23] sont utilisées pour l'alimentation humaine, soit directement, soit sous forme de compléments alimentaires, soit sous forme d'additifs :
- Comme aliment direct, les algues sont une sorte de légume, comme la laitue de mer (Ulva lactuca). Au goût généralement d'iode mais aussi de caramel, violette ou champignon, souvent vendues sous forme séchée (nori, wakame, hijiki) ou fraîches conservées dans le sel (haricot de mer)[23], elles contiennent généralement des protéines, sels minéraux et vitamines. Elles n'ont cependant pour le moment qu'une importance marginale dans la plupart des pays occidentaux, à l'exception notable de certaines îles ou régions proches de la mer : Grande-Bretagne (Pays de Galles) ou Bretagne par exemple. Elles tiennent une place plus importante dans l'alimentation de nombreux pays d'Extrême-Orient : Chine, Corée du Sud, Japon, Viêt Nam.
- Les compléments alimentaires incluent par exemple la spiruline, microalgue bleue, commercialisée sous forme de gélule comme complément particulièrement riche en protéines, acide γ-linolénique et en vitamines.
- Les additifs pour l'industrie agroalimentaire incluent par exemple l'Aramé ou le fucus vésiculeux (ce dernier également connu sous les noms de varech ou goémon) ; l'algine[24] ou acide alginique, utilisée comme liant dans les charcuteries. Les carraghénanes extraits de Chondrus crispus sont des gélifiants utilisés couramment dans les flans, pâtes dentifrices…
Les algues sont aussi une source d'oligo-éléments, notamment de magnésium et d'iode, qui font souvent défaut à l'alimentation dans les pays industrialisés (ceux qui consomment peu de poisson notamment, et qui consomment du sel raffiné dépouillé de son iode naturel). Elles renferment également des polyphénols antioxydants appelés phlorotanins.
Il faut éviter la consommation d'algues qui vivent dans l'eau polluée, car certains polluants sont absorbés par ces végétaux. C'est le cas par exemple avec les rejets d'eau radioactive près des centrales nucléaires côtières, des centres de retraitement de déchets radioactifs (Windscale en Grande-Bretagne, usine de la Hague en France par exemple) ou des lieux d'expérimentation de bombes atomiques (l'atoll de Moruroa en Polynésie française par exemple) : les teneurs en radionucléides peuvent alors rendre ces algues dangereuses pour la santé.
Alimentation animale
On note l'utilisation ancienne du goémon dans la fabrication de farines et tourteaux incorporés aux aliments composés, pour volailles notamment.
En Bretagne, le goémon était utilisé pour l'alimentation des vaches.
Engrais et amendements
Le goémon, ou varech, est récolté sur les côtes, notamment en Bretagne depuis très longtemps pour en faire de l'engrais. Autrefois, il servait aussi à produire de la soude et de la potasse. Il existe plusieurs façons d'utiliser les algues comme engrais naturels pour l'usage agricole ou de jardinage.
- Ramassage à l'automne de préférence ; après les cultures, le déposer sur la terre et l'enfouir (bêchage superficiel) - ce n'est valable que pour les algues rouge ou verte.
- Pour les autres types d'algues (laminaires, varech), étaler et laisser sécher pour évacuer le chlorure de sodium ; ceci autorise un ramassage étalé sur l'année en fonction des tempêtes.
- Mélanger à un compost de déchets ménagers - maturité obtenue au bout de 6 mois. Les algues contiennent 70 % de matières organiques et beaucoup d'éléments minéraux : azote 2 %, potasse 3 % (le fucus en contient 6 %), phosphore en faible quantité 0,3 %, calcium 2 %, magnésium 1 %, soufre 1 à 8 %, sodium 5 %, fer, nickel, cuivre, zinc, iode, manganèse. La richesse des algues en produits fertilisants ne doit pas faire oublier la présence de sel (sodium) dont l'excès occasionne une infertilisation par brûlure des sols.
Deux usages sont préconisés : l'alternance des types de fumure 1 an sur 2 (algue-fumier animal) ; et une utilisation modérée 2 à 3 kg/m2 ou 20 tonnes par hectare. Lors du ramassage, il faut prendre en compte le sable associé aux dépôts d'algue d'estran, il peut représenter 25 à 30 % du poids total, et selon la nature du sol à amender, il est susceptible de fragiliser la structure de rétention aqueuse des sols initiaux ou au contraire alléger des sols un peu lourd.
Le maërl, ou Phymatolithon calcareum (Lithothamnium calcareum), une algue rouge calcifiée, était utilisé pour l'amendement des sols acides. Les fonds à maërl sont maintenant protégés.
Certaines entreprises comme Goëmar font des recherches sur les algues utilisées comme auxiliaire de culture grâce à leurs propriétés de biostimulant (stimulation de la défense des plantes et augmentation de leur capacité d'absorption de nutriments)[25].
Usages industriels
Certaines substances tirées des algues, notamment l'algine, déjà citée, sont utilisées comme gélifiants, épaississants, émulsifiants, dans de nombreuses industries : pharmacie, cosmétiques, matières plastiques, peintures…
L'agar-agar sert de base pour la fabrication des milieux de culture bactériologique.
Phymatolithon calcareum (Lithothamnium) fournit un calcaire poreux utilisé pour la filtration de l'eau.
La capacité des algues à filtrer l'eau en concentrant ses constituants est également utilisable dans des stations d'épuration des eaux usées (villes) ou des eaux sortant d'installations industrielles (industrie chimique notamment). Il reste à choisir ce qu'il est fait de ces algues devenues des déchets, en général toxiques.
Il est également possible de fabriquer du plastique biodégradable à partir d'algues, sans faire appel au pétrole. C'est ce qu'a réalisé un ingénieur breton, Rémy Lucas, qui a créé l'entreprise Algopack en 2010[26],[27].
Production de biocarburants
C'est probablement à partir d'algues que les biocarburants pourront être produits avec le meilleur rendement[28],[29] rendant ainsi envisageable une production en quantité significative sans déforestation massive. Des cultures d'algues unicellulaires à forte teneur en lipides (50 % à 80 % en masse) et à temps de doublement rapide (de l'ordre de 24 h) permettent en effet une production de biodiesel moins polluante et incomparablement plus efficace que l'agriculture intensive de végétaux terrestres : les superficies nécessaires sont 30 fois moindres.
Plusieurs techniques de production sont étudiées :
- Culture en étang.
- Culture sous serre.
- Culture dans des bioréacteurs fortement insolés[30], où la production d'algues est accélérée par barbotage de CO2 (évitant ainsi le rejet immédiat de ce gaz à effet de serre issu d'une industrie polluante comme une cimenterie, une centrale électrique thermique à flamme).
Les lipides extraits de cette biomasse peuvent être utilisés :
- soit directement comme huile végétale pour alimenter les moteurs diesel
- à 100 % pour ceux qui le tolèrent : tracteurs, moteurs de bateaux, moteurs de camions et voitures de modèles des années 1990 ;
- ou en mélange à du gazole, jusqu'à 50 % sans modification, pour les moteurs récents, plus sensibles,
- soit soumis à une transesterification pour produire du biodiesel. Les résidus peuvent encore être valorisés, par exemple par une fermentation produisant du bioéthanol.
Une limite de cette filière est la nécessité d'alimenter les cultures d'algues en fortes concentrations de CO2. Tant que ce CO2 sera issu de l'exploitation d'une énergie fossile, on ne pourra pas considérer cette source de biocarburant comme une énergie renouvelable.
La microalgue euglena est un exemple tangible de biocarburant à base d'algue. En effet, en 2015, la société japonaise Euglena (entreprise) fournit quotidiennement un bus en biocarburant, composé à hauteur de 1% d'euglena[31]. La société a aussi pour ambition de développer du biocarburant pour avion, et a annoncé vouloir l’utiliser à l’occasion des Jeux olympiques d'été de 2020, mais aucun avion n’a pour le moment volé avec du biocarburant produit par la société[32],[33].
Propriétés antifouling des algues
Les macroalgues marines constituent une source de recherche non négligeable pour les molécules antifouling[34]. En effet ces organismes sont sujets au biofouling avec l’adhésion de multiples organismes tels que des bactéries, des microalgues, d’autres macroalgues ou encore divers mollusques. Il y a par exemple entre 102 et 107 cellules.cm-2 de bactéries épiphytes selon les espèces de macroalgues[35]. Le développement de biofouling peut avoir des effets délétères pour l’algue. En effet, le recouvrement de leur surface d’échange par les organismes invasifs peut limiter l’accès aux nutriments[36] mais aussi à la lumière, empêchant la photosynthèse. Les microorganismes adhérés peuvent également être pathogènes pour l’algue et nuire à son développement[37]. Pour contrer le biofouling, la macroalgue développe donc des moyens de défense chimiques et physiques. Par exemple, l’algue peut endiguer l’invasion d’organismes en générant des dérivés réactifs de l’oxygène (ROS)[2], mais aussi en sécrétant des métabolites secondaires biocides ou répulsifs (molécules anti-quorum sensing[38]). Certaines macroalgues présentent également une topographie particulière de surface[39], recouverte d’une couche mucilagineuse inhospitalière limitant la fixation d’organismes.
Les revêtements antifouling écoresponsables peuvent donc s’inspirer des algues pour inhiber l’adhésion des organismes sur une surface, à la fois en imitant leur topographie de surface, mais aussi en y greffant des molécules d’algues à visée antifouling. Quelques exemples de molécules et leur spectre d’action sont présentés dans le tableau ci-dessous.
| Algue | Type d’activité | Composé actif |
| Caulerpa prolifera | Antibactérienne, antialgale | Esters Acetylène sesquiterpenoide[40] |
| Sargassum spp. | Anti-algale | Phlorotanin[41] |
| Laurencia viridis | Anti-diatomée | Dehydrothyrsiferol[42] |
| Grateloupia turuturu | Anti-balane | Floridoside [43] |
| Ulvaria obscura | Anti-appétante | Dopamine[44] |
Effet anti-inflammatoire des algues
Les principales familles de molécules anti-inflammatoires présentes chez les macroalgues sont les polysaccharides sulfatés, les acides gras polyinsaturés (PUFAs), le vidadol A et B, les caroténoïdes (fucoxanthine, astaxanthine), les alcaloïdes (caulerpine), les terpénoïdes, et la phéophytine a[45].
La fucoxantine est un dérivé des caroténoïdes et a été isolé chez l’algue brune Myagropsis myagroides. Des études in vitro sur des lignées cellulaires de macrophages de souris RAW 264 induites par LPS ont permis de montrer qu’il y a principalement inhibition de la production de NO de manière dose-dépendante par la fucoxantine et que ceci est dû à l’inhibition de la transcription de iNOS (en). Il y a donc inhibition de la sécrétion de cytokine et en particulier de TNFα. La fucoxanthine réduit aussi la translocation vers le noyau des protéines P50 et P65 et donc la dégradation, dans le cytoplasme, de l’inhibiteur de B (ikB) ce qui induit la diminution de la transactivation du facteur NFkB et inhibe la phosphorylation des protéines kinases mitogènes (MAPKs, JNK, ERK…). De plus, des tests LDH ont permis d’établir la non cytotoxicité de la fucoxantine [46].
La caulerpine est un alcaloïde bi-indolé. Plusieurs isomères de la caulerpine ont été isolés chez les rhodophycées et les chlorophycées. Pour étudier in vivo l’effet anti-inflammatoire de la caulerpine, deux modèles ont été utilisés chez la souris : l’œdème de l’oreille induit par des capsaicines et la l’inflammation du péritoine induite par des carrageenans. Une inhibition de la formation de l’œdème des oreilles de souris de 56 % est observée lorsqu’il y a eu préalablement traitement à la caulerpine. De même, il y a réduction de l’inflammation du péritoine chez les souris traitées à la caulerpine. Des mécanismes d’action similaires à l’indométhacine tels que l’inhibition de COX et des phosphilases A sont possibles. La caulerpine est aussi antinociceptive, anti-tumorale, régulatrice de croissance et a des propriétés stimulantes pour la croissance de la racine des plantes[47].
Une étude in vitro révèle que la phéophytine a isolée d’Ulva (Enteromorpha) prolifera supprime l’induction de la production d’anion superoxyde par un composé pro-inflammatoire. La phéophytine inhibe la chimiotaxie des leucocytes ainsi que la formation de l’œdème de l’oreille de souris et ce, in vivo[48].
L’effet cytotoxique d’un ensemble de polysaccharides sulfatés extraits de l’algue Sargassum hemiphyllum a été testé in vitro en mesurant la prolifération cellulaire ainsi que la production de LDH ; il n’y a pas d’effet cytotoxique détectable in vitro. Des analyses in vitro semblent montrer que les polysaccharides inhibent la formation des médiateurs de l’inflammation tels que les cytokines. Ces études mènent les chercheurs à penser que les polysaccharides sulfatés interagissent avec la voie de formation du facteur de transcription trimérique NF-kB en séquestrant l'un des monomères à l’extérieur du noyau [49].
Adaptation aux ultraviolets
En zone intertidale, les algues, qui sont des organismes fixés, sont soumises à de nombreux stress, dont le rayonnement ultraviolet (UV). Les UV provoquent un stress oxydant en entraînant la formation de dérivés réactifs de l’oxygène (DRO) comme le peroxyde d'hydrogène (H2O2). Ces DRO peuvent endommager l'ADN, et provoquer la peroxydation des lipides et la carboxylation des protéines au sein des cellules. À long terme, cela peut engendrer le vieillissement cellulaire, des cancers, ou encore des inflammations. Afin de tolérer ces stress, les algues possèdent des stratégies d’adaptation comme la synthèse de métabolites secondaires photoprotecteurs.
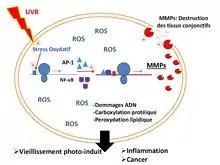
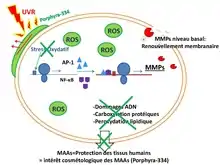
Il existe chez les algues une diversité importante de molécules photoprotectrices, qui agissent de différentes manières : filtres UVA-filtre UVB, molécules induisant la mélanogénèse, molécules réflectrices, anti-oxydantes et cicatrisantes. Leurs propriétés intéressent de plus en plus les industriels, notamment en cosmétique : l’objectif est de trouver des filtres naturels afin de réduire les filtres chimiques présents dans les crèmes solaires afin de limiter les réactions d’allergies et réduire la pollution des milieux par ces substances. Les molécules photoprotectrices qui sont le plus fréquemment retrouvées chez les algues sont les acides aminés analogues de la mycosporine ou MAA (pour l'anglais mycosporine-like amino acid). Pour les algues n’ayant pas de MAA pour se protéger des UV, il existe d’autres types de molécules comme les phlorotanins ou les caroténoïdes.
Acides aminés de type mycosporine
Les MAA sont présents chez de nombreux organismes (mollusques, macroalgues, bactéries, cyanobactéries…). Les MAA sont de petits métabolites secondaires, d’une grande diversité structurale et possédant la propriété de chromophore : ils ont la possibilité de former un nuage électronique délocalisé pouvant entrer en résonance avec des rayons incidents d’une longueur d’onde donnée. Par exemple, le porphyra-334, extrait de Porphyra umbilicalis, capte et reflète les UV d’une longueur d’onde de 334 nm (UVA) sans produire de dérivés réactifs de l'oxygène. Leur synthèse est induite par l’exposition aux rayonnements solaires.
Leur propriété photoprotectrice est transmise le long de la chaine trophique jusqu’au consommateur secondaire. Par exemple, les oursins doivent se nourrir d’algues possédant des MAA afin de conférer à leurs œufs une résistance solaire permettant leur bon développement. Récemment, une équipe de chercheurs a mis en évidence l’efficacité photoprotectrice des MAA et notamment la porphyra-334 chez des fibroblastes humains. La porphyra-334 ne semble pas toxique pour ces cellules et semble réduire leur sénescence. Cette MAA limite le stress en reflétant les radiations UVA, réduisant le stress oxydatif lié à l'exposition aux UV et réduit la synthèse de métalloprotéases matricielles (MMP) impliquées dans la destruction des tissus conjonctifs. La porphyra-334 est également impliquée dans la capture des DRO impliqués dans les dommages ADN, peroxydation des lipides et carboxylation des protéines.
Ainsi les MAA présentent un haut potentiel cosmétique dans la protection solaire et la lutte contre la sénescence cellulaire.
Phlorotanins
Les phlorotanins sont des polyphénols trouvés chez les algues brunes. Ce sont des oligomères de phloroglucinol avec une variété de combinaison entrainant une diversité importante de ces molécules. Ils ont différents rôles comme la protection contre les herbivores. Ils sont suspectés de protéger les algues contre les UVB puisque leur spectre d’absorption présente un pic à environ 270 nm (UVB). En 2011, une équipe de chercheurs a démontré que les phlorotanins avaient un effet photoprotecteur chez des embryons de poisson-zèbre. En effet, les phlorotanins réduisent la génération de dérivés réactifs de l'oxygène, l’hyperpigmentation et la mort cellulaire liées à une exposition aux UVB chez ces embryons.
Algues toxiques et nuisibles
Des algues unicellulaires microscopiques (Dinoflagellées) peuvent rendre toxiques pour l'homme les mollusques (moules, huîtres, praires, coques, palourdes…) et interdire leur consommation sous peine de troubles gastro-entériques graves ou, plus rarement, d'atteintes neuromusculaires ; c'est un phénomène assez récurrent dans la mytiliculture du bassin de Thau en Languedoc et sur les côtes de l'Atlantique, notamment en Bretagne et en Vendée.
Sargassum muticum, algue brune introduite accidentellement en Europe en 1973 avec des huitres japonaises, a colonisé rapidement le littoral atlantique de l'Espagne à la Norvège ainsi que la Méditerranée occidentale jusqu'à Venise. Elle a remplacé certaines espèces (laminairia saccharina en particulier) et a pu constituer une nuisance importante pour la conchyliculture. Ce phénomène a été clairement caractérisé pour la première fois dans les années 1970, les pollutions augmentant de manière importante dans les années 1980, avant de se stabiliser dans les années 1990.
Caulerpa taxifolia, algue verte tropicale échappée accidentellement du musée océanographique de Monaco est devenue depuis quelques années envahissante en mer Méditerranée au détriment de la végétation autochtone, entre autres les herbiers de posidonie. Elle présente une faible toxicité et n'est pas consommée par la faune locale.
Les goémoniers considèrent comme une « mauvaise herbe » Saccorhiza polyschides, une laminaire très robuste, sans intérêt économique, qui colonise rapidement les rochers dépouillés par l'exploitation des Laminaria digitata.
Notes et références
- Voir en particulier les ouvrages :
- Bruno de Reviers, Biologie et phylogénie des algues, vol. 1 : tome 1, Paris, Belin, coll. « Belin Sup Sciences / Biologie », , 352 p. [détail des éditions] (ISBN 978-2-7011-3083-5, ISSN 1158-3762)
- Bruno de Reviers, Biologie et phylogénie des algues : tome 2, vol. 2 : tome 2, Paris, Belin, coll. « Belin Sup Sciences / Biologie », , 256 p. [détail des éditions] (ISBN 978-2-7011-3512-0, ISSN 1158-3762)
- (en) Florian Weinberger et Michael Friedlander, « Response of Gracilaria Conferta (rhodophyta) to Oligoagars Results in Defense Against Agar-Degrading Epiphytes », Journal of Phycology, vol. 36, no 6, , p. 1079–1086 (ISSN 1529-8817, DOI 10.1046/j.1529-8817.2000.00003.x, lire en ligne, consulté le )
- (en) Michael D. Guiry, « How many species of algae are there? », Journal of Phycology, vol. 48, no 5, , p. 1057 (DOI 10.1111/j.1529-8817.2012.01222.x, lire en ligne).
- Plus précisément de son accusatif singulier algam.
- (en) Eric Partridge. Origins: a short etymological dictionary of modern English, 1983, p. 12 : lire en ligne 1983
- Ortega-Calvo J.J, Hernandez-Marine M, Saiz-Jimenez C (1991) Biodeterioration of building materials by cyanobacteria and algae. International Biodeterioration 28, 165–185
- Rindi, F., Guiry, M.D., (2004) Composition and spatial variability of terrestrial algal assemblages occuring at the bases of urban walls in Europe. Phycol. 43, 225–235.
- Barberousse H (2006) Etude de la diversité des algues et cyanobactéries colonisant les revêtements de façade en France et recherche des facteurs favorisant leur implantation (PhD Thesis). Muséum National d’Histoire Naturelle, Paris
- Rindi F, Guiry M.D, (2004, 2008) Composition and spatial variability of terrestrial algal assemblages occuring at the bases of urban walls in Europe. Phycol. 43, 225–235.
- Rindi F, Guiry M.D, López-Bautista J.M (2008) Distribution, morphology and phylogeny of Klebsormidium (Klebsormidiales, Charophyceae) in urban environments in Europe. Journal of Phycology 44, 1529–1540
- Warscheid T & Braams J, (2000) Biodeterioration of stone : a review. International Biodeterioration & Biodegradation 46, 343–368.
- Estelle Dalod (2015) Influence de la composition chimique de mortiers sur leur biodétérioration par les algues. Génie des procédés. Ecole Nationale Supérieure des Mines de Saint-Etienne <NNT : 2015EMSE0777>. <tel-01148160>
- Projet de Tela botanica à partir de la basealg du programme catminat
- Schlichting, H.E.J. (1960) The role of waterfowl in the dispersalof algae. Transactions of the American Microscopical Society, 79,160–166.
- Duarte CM, Middelburg JJ, Caraco N (2005) Major role of marine vegetation on the oceanic carbon cycle. Biogeosciences 2(1):1–8
- Jacqueline Cabioc'h, Jean-Yves Floc'h, Charles-François Boudouresque, Alexandre Meinesz, Marc Verlaque, Guide des algues des mers d'Europe, Delachaux et Niestlé, , p. 41
- (en) Raymond Seed & Raymond J. O'Connor, « Community Organization in Marine Algal Epifaunas », Annual Review of Ecology and Systematics, vol. 12, , p. 49-74
- (en) Joël Fleurence et Ira Levine, Seaweed in health and disease prevention, Academic Press, , p. 377.
- (en) Valentine Jackson Chapman, The Algae, Macmillan, , p. 11.
- Jacqueline Cabioc'h, Jean-Yves Floc'h, Alain Le Toquin, Charles François Boudouresque, Alexandre Meinesz, Marc Verlaque, Guide des algues des mers d'Europe, Delachaux et Niestlé, , p. 24
- Philippe Meyzie, L'alimentation en Europe à l'époque moderne, Armand Colin, , p. 125.
- Sébastien Marrec, Algues. Les champs du possible, revue ArMen, numéro 208, septembre-octobre 2015.
- Isabelle Quenin, chronique Mangez des algues ! sur Europe 1, 21 juillet 2011
- Les algues : une « agroressource » d'avenir. Des expériences autour des algues décrites sur CultureSciences Chimie, un site ENS-DGESCO.
- « Chez Goëmar, la mer au service de la nature », sur agriculture.gouv.fr,
- Rémi Douat, « Innovation : il fait du plastique avec des algues », Le Parisien, 9 août 2013, lire en ligne
- (en) France's plastic revolution [Production de télévision], David Coti, président d'Algopack, dans earthrise sur Al Jazeera English (, 10:36 minutes) YouTube. Consulté le . La scène se produit à 2'18".
- http://www.unh.edu/p2/biodiesel/article_alge.html Widescale Biodiesel Production from Algae
- http://www1.eere.energy.gov/biomass/pdfs/biodiesel_from_algae.pdf A Look Back at the U.S. Department of Energy’s Aquatic Species Program: Biodiesel from Algae
- http://bfs-france.com/technologie.html
- Daniel Eskenazi Tokyo, « Des bus japonais roulent à l’algue », Le Temps, (lire en ligne, consulté le ).
- Investor, « Japanese startup Euglena aims to produce biofuel for Tokyo Olympics », sur theinvestor.co.kr (consulté le ).
- « Food, face cream and jet fuel : Japanese firm finds many uses for algae », sur CNNMoney (consulté le ).
- (en) Hans Uwe Dahms et Sergey Dobretsov, « Antifouling Compounds from Marine Macroalgae », Marine Drugs, vol. 15, no 9, , p. 265 (DOI 10.3390/md15090265, lire en ligne, consulté le )
- (en) MM Bengtsson, K Sjøtun et L Øvreås, « Seasonal dynamics of bacterial biofilms on the kelp Laminaria hyperborea », Aquatic Microbial Ecology, vol. 60, no 1, , p. 71–83 (ISSN 0948-3055 et 1616-1564, DOI 10.3354/ame01409, lire en ligne, consulté le )
- Ditte B. Hermund, Merichel Plaza, Charlotta Turner et Rosa Jónsdóttir, « Structure dependent antioxidant capacity of phlorotannins from Icelandic Fucus vesiculosus by UHPLC-DAD-ECD-QTOFMS », Food Chemistry, vol. 240, , p. 904–909 (DOI 10.1016/j.foodchem.2017.08.032, lire en ligne, consulté le )
- (en) Julieta Muñoz et Ravi Fotedar, « Epiphytism of Gracilaria cliftonii (Withell, Millar & Kraft) from Western Australia », Journal of Applied Phycology, vol. 22, no 3, , p. 371–379 (ISSN 0921-8971 et 1573-5176, DOI 10.1007/s10811-009-9469-y, lire en ligne, consulté le )
- (en) A. P. Carvalho, D. Batista, S. Dobretsov et R. Coutinho, « Extracts of seaweeds as potential inhibitors of quorum sensing and bacterial growth », Journal of Applied Phycology, vol. 29, no 2, , p. 789–797 (ISSN 0921-8971 et 1573-5176, DOI 10.1007/s10811-016-1014-1, lire en ligne, consulté le )
- James Chapman, Claire Hellio, Timothy Sullivan et Robert Brown, « Bioinspired synthetic macroalgae: Examples from nature for antifouling applications », International Biodeterioration & Biodegradation, vol. 86, , p. 6–13 (DOI 10.1016/j.ibiod.2013.03.036, lire en ligne, consulté le )
- Vangelis Smyrniotopoulos, Dennis Abatis, Leto-A. Tziveleka et Christina Tsitsimpikou, « Acetylene Sesquiterpenoid Esters from the Green Alga Caulerpa prolifera », Journal of Natural Products, vol. 66, no 1, , p. 21–24 (ISSN 0163-3864, DOI 10.1021/np0202529, lire en ligne, consulté le )
- Noboru Nakajima, Naoki Sugimoto, Kaori Ohki et Mitsunobu Kamiya, « Diversity of phlorotannin profiles among sargassasacean species affecting variation and abundance of epiphytes », European Journal of Phycology, vol. 51, no 3, , p. 307–316 (ISSN 0967-0262, DOI 10.1080/09670262.2016.1159340, lire en ligne, consulté le )
- Francisco Cen-Pacheco, Adrián J. Santiago-Benítez, Celina García et Sergio J. Álvarez-Méndez, « Oxasqualenoids from Laurencia viridis: Combined Spectroscopic–Computational Analysis and Antifouling Potential », Journal of Natural Products, vol. 78, no 4, , p. 712–721 (ISSN 0163-3864, DOI 10.1021/np5008922, lire en ligne, consulté le )
- Claire Hellio, Christelle Simon-Colin, Anthony Clare et Eric Deslandes, « Isethionic Acid and Floridoside Isolated from the Red Alga, Grateloupia turuturu, Inhibit Settlement of Balanus amphitrite Cyprid Larvae », Biofouling, vol. 20, no 3, , p. 139–145 (ISSN 0892-7014, PMID 15545063, DOI 10.1080/08927010412331279605, lire en ligne, consulté le )
- (en) Kathryn L. Van Alstyne, Amorah V. Nelson, James R. Vyvyan et Devon A. Cancilla, « Dopamine functions as an antiherbivore defense in the temperate green alga Ulvaria obscura », Oecologia, vol. 148, no 2, , p. 304–311 (ISSN 0029-8549 et 1432-1939, DOI 10.1007/s00442-006-0378-3, lire en ligne, consulté le )
- Anti-inflammatory compounds of macroalgae origin: A review, Jaswir et Monsur, 2011
- Evaluation of anti-inflammatory effect of fucoxanthin isolated from brown algae in Lipopolysaccharide-stimulated RAW 264.7 macrophages, Heo et al., 2010
- The antinociceptive and anti-inflammatory activities of caulerpin, a bisindole alkaloid isolated from seaweeds of the genus Caulerpa, Everton et al., 2009
- Potent anti-inflammatory activities of pheophytin a derived from edible green alga Enteromorpha prolifera, Okai et al., 1997
- Inhibition of Lipopolysaccharide (LPS)-induced Inflammatory Responses by Sargassum hemiphyllum Sulfated Polysaccharide Extract in Raw 264.7 Macrophage Cells, Hwang et al., 2010
Voir aussi
Articles connexes
Liens externes
- (fr) CEVA - Centre d'étude et de valorisation des algues
- (en) Algaebase, inventaire des algues du monde.
- Histoire de la chimie des algues en Bretagne. De la soude à l'iode jusqu'aux alginates.
- Portail de la biologie marine
- Portail de la botanique
- Portail du monde maritime
- Portail origine et évolution du vivant
- Portail de la microbiologie
- Portail de la phycologie
