Défense des plantes contre les herbivores
La défense des plantes contre les herbivores ou résistance des plantes-hôtes (HPR, pour l'anglais host-plant resistance) comprend une série d'adaptations qui ont évolué chez les plantes pour améliorer leur survie et leur reproduction en réduisant l'impact des herbivores. Les plantes peuvent ressentir qu'elles sont touchées[2] et peuvent recourir à diverses stratégies pour se défendre contre les dommages causés par les herbivores. Ces défenses peuvent être structurales ou mécaniques, basées sur des structures particulières (comme les épines ou les trichomes) ; soit chimiques par la production de métabolites secondaires, ou substances allélochimiques, qui influencent le comportement, la croissance ou la survie des herbivores. Ces défenses chimiques peuvent agir comme répulsifs ou comme toxines pour les herbivores, ou diminuer la digestibilité des plantes.



Cette capacité qui se base sur les grands principes des interactions plante-agent pathogène (avec parfois une spirale d'adaptations et de contre-adaptations, résultante de la coévolution antagoniste) a pu être favorisée par la sélection naturelle optimisant la valeur adaptative des plantes en présence d'évènements d'herbivorie. Elle est, avec la tolérance des végétaux et l'évitement dans le temps ou dans l'espace (comportement qui réduit la probabilité pour la plante d'être découverte, par dissémination des graines, plutôt que leur concentration, une taille réduite, une croissance dans des lieux peu accessibles aux herbivores et une phénologie différente[3]), la principale stratégie de défense des plantes contre les herbivores[4].
Chaque type de défense peut être soit constitutive (toujours présente chez la plante), soit induite (en) (produite en réaction au dommage ou au stress causé par les herbivores).
Historiquement les insectes sont les herbivores les plus significatifs (les deux tiers des espèces étant herbivores[5]) et l'évolution des plantes terrestres est étroitement associée à celle des insectes. Tandis que la plupart des défenses des plantes sont dirigées contre les insectes, d'autres défenses ont évolué pour viser les herbivores vertébrés, comme les oiseaux et les mammifères. L'étude des défenses des plantes contre les herbivores est importante, non seulement du point de vue de l'évolution, mais aussi pour l'effet direct que ces défenses ont sur l'agriculture, y compris sur les ressources alimentaires pour l'homme et le bétail ; comme agents bénéfiques dans les programmes de lutte biologique ; ainsi que dans la recherche sur les plantes d'importance médicale.
Évolution des caractères défensifs
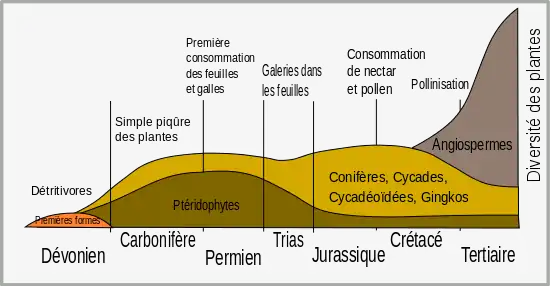
Les plantes ont longtemps gardé l'image d'êtres immobiles, passifs, vulnérables à l'attaque d'une multitude d'organismes pathogènes. L'expression populaire « être un légume » reflète bien cet état d'esprit. « Pourtant, la maladie chez les végétaux reste l'exception, car, au cours de l'évolution, les plantes ont appris à se défendre[6]. »
L'histoire évolutive des plantes est marquée par les pressions de sélection imposées aux plantes par les insectes phytophages depuis leur apparition. Cette phytophagie peut parfois induire des dommages importants, qui peuvent affecter le succès reproducteur d’une plante, ou la dynamique des populations végétales. Pour faire face à cette pression, les végétaux ont développé de nombreuses stratégies de défense. Cependant, à leur tour, les insectes phytophages ont aussi pu s’adapter à ces innovations, afin de pouvoir continuer à exploiter leur habitat. Les plantes et leurs insectes phytophages se livrent à une perpétuelle course aux armements et sont donc dans un équilibre dynamique dont la rupture peut entraîner soit la prolifération des insectes, soit celle des végétaux qui ont élaboré plusieurs lignes de défense : barrières constitutives physiques (paroi cellulaire qui peut être lignifiée, cuticule) et chimiques (substances antimicrobiennes), barrières induites (éliciteurs des réactions de défense)[7].
Les premières plantes terrestres ont évolué à partir des plantes aquatiques lors de la conquête des continents il y a environ 450 millions d'années à l'époque de l'Ordovicien. De nombreuses plantes se sont adaptées à un milieu terrestre carencé en iode en enlevant l'iode de leur métabolisme. De fait, l'iode n'est essentiel que pour les cellules animales[8]. Une importante action anti-parasitaire est provoquée par le blocage du transport de l'iodure des cellules animales inhibant le symport sodium/iodure (NIS). De nombreux pesticides végétaux sont des glycosides (comme la digitoxine cardiaque) et les glycosides cyanogéniques qui libèrent du cyanure, lequel, en bloquant le cytochrome c oxydase et le NIS, est toxique uniquement pour la plupart des parasites et des herbivores et non pour les cellules végétales dans lesquelles il semble être utile dans la phase de dormance des graines. L'iodure n'est pas un pesticide, mais est oxydée par la peroxydase végétale en iode, lequel est un oxydant puissant, capable de tuer les bactéries, les champignons et les protozoaires[9].
Les premières plantes terrestres n'avaient pas de système vasculaire et étaient tributaires de l'eau libre pour leur reproduction. Les plantes vasculaires sont apparues plus tard et leur diversification a commencé à l'époque du Dévonien (-400 Ma). Leur dépendance réduite à l'égard de l'eau résulte d'adaptations telles que des revêtements de protection pour réduire l'évaporation des tissus. La reproduction et la dispersion des plantes vasculaires dans ces conditions sèches ont été atteintes grâce à l'évolution des structures spécialisées des graines.
La diversification des plantes à fleurs (angiospermes) durant la période du Crétacé est associée à l'explosion soudaine de la spéciation chez les insectes[10]. Cette diversification des insectes représente une force sélective importante dans l'évolution des plantes, et a conduit à la sélection de plantes munies d'adaptations défensives. Les premiers insectes herbivores étaient des mandibulés qui mordent et mâchent la végétation, mais la coévolution avec les plantes vasculaires a conduit à d'autres formes d'insectes herbivores, comme les suceurs de sève, les mineuses qui creusent des galeries dans le limbe des feuilles, les cécidogènes qui forment des galles et les suceurs de nectar[11].
L'abondance relative des différentes espèces de plantes dans les communautés écologiques, y compris les forêts et les prairies, peut être en partie déterminée par le niveau de composés défensifs dans les différentes espèces [12].
Comme le coût de remplacement des feuilles abîmées est plus élevé dans des conditions où les ressources sont rares, il se peut aussi que les plantes poussant dans des zones où l'eau et les nutriments sont rares puissent investir plus de ressources dans les défenses anti-herbivores.
Premières traces de l'existence des herbivores

Nos connaissances sur les herbivores dans les temps géologiques proviennent de trois sources : les plantes fossilisées qui peuvent conserver des preuves de défenses (comme les épines), ou de dégâts liés aux herbivores ; l'observation de débris végétaux dans les fæces animales fossilisées ; et la constitution des pièces buccales des herbivores[13].
Alors que les herbivores ont été longtemps considérés comme un phénomène du Mésozoïque, on a trouvé des traces de leur existence à des périodes aussi anciennes que les premiers fossiles peuvent le démontrer. Il est prouvé que les premiers fossiles de sporanges et de tiges, vers la fin du Silurien (environ -420 Ma), étaient consommés par les herbivores[14]. Les animaux se sont nourris des spores de plantes du début du Dévonien, et la flore de Rhynie fournit également des preuves que des organismes se nourrissaient de plantes grâce à une technique de « piquer-sucer »[13].
Beaucoup de plantes fossiles de cette époque montrent des énations, pseudo-épines qui peuvent avoir joué un rôle défensif avant d'être cooptées pour se développer en feuilles.
Pendant les 75 millions d'années qui ont suivi, les plantes ont évolué en créant toute une gamme d'organes - des racines aux graines - plus complexes. Il s'est écoulé un laps de temps de 50 à 100 millions d'années entre l'apparition de chaque organe et sa consommation[14].

Coévolution
Les herbivores dépendent des plantes pour leur alimentation, et ont acquis des mécanismes pour obtenir ces aliments malgré l'évolution des diverses formes de défenses des plantes. L'adaptation des herbivores aux défenses des plantes a été comparée aux caractères offensifs et consiste en adaptations qui permettent un accroissement du nourrissage et l'utilisation d'une plante-hôte[15]. Les relations entre les herbivores et leurs plantes-hôtes aboutissent souvent à des changements évolutifs réciproques, appelés « coévolution ». Quand un herbivore mange une plante, il favorise les plantes capables de monter une réponse défensive. Dans les cas où cette relation démontre une spécificité (l'évolution de chaque caractère est due à l'autre), et une réciprocité (les deux traits doivent évoluer), on estime que les espèces ont coévolué[16]. Le mécanisme de coévolution « évitement et rayonnement » présente l'idée que les adaptations chez les herbivores et leur plantes-hôtes sont la force qui sous-tend la spéciation[10],[17] et ont joué un rôle dans la radiation évolutive des espèces d'insectes durant l'ère des angiospermes[18]. Certains herbivores ont acquis par l'évolution des moyens de détourner les défenses des plantes pour leur propre bénéfice, en séquestrant ces substances chimiques et en les utilisant pour se protéger eux-mêmes des prédateurs[10].
D'autres évolutions ont conduit les plantes à détourner les herbivores vers la consommation de parties non essentielles, ou améliorer leur aptitude à se remettre des dommages causés par les herbivores. Certaines plantes font appel à des niveaux trophiques supérieurs, encourageant la présence d'ennemis naturels des herbivores ou de parasitoïdes des ravageurs, qui en retour protègent la plante
Les défenses des plantes contre les herbivores sont généralement incomplètes de sorte que les plantes tendent à évoluer vers une certaine tolérance aux herbivores.
Types de défenses
On peut classer les défenses des plantes en deux catégories : défenses constitutives ou défenses induites. Les premières sont toujours présentes dans la plante, tandis que les secondes sont produites ou mobilisées vers le point où la plante a été blessée. On peut également les classer selon les deux types de stratégies de défense : tolérance (ou compensation)[19] à la phytophagie et évitement (défenses mécaniques, chimiques ; échappement dans le temps et l'espace[20]).
La composition et la concentration des défenses constitutives sont très variables ; elles vont des défenses mécaniques aux toxines et autres facteurs de réduction de la digestibilité. De nombreuses défenses mécaniques externes et les défenses importantes quantitativement sont constitutives, car leur production requiert beaucoup de ressources, difficiles à mobiliser[21]. Diverses approches moléculaires et biochimiques sont utilisées pour déterminer les mécanismes des réponses défensives, constitutives et induites, des plantes contre les herbivores[22],[23],[24],[25].
Les défenses induites comprennent les produits métaboliques secondaires, ainsi que des changements morphologiques et physiologiques[26]. Un avantage des défenses inductibles par rapport aux défenses constitutives est qu'elles ne sont produites que lorsque c'est nécessaire, et sont donc potentiellement moins coûteuses, en particulier face à différents types d'herbivores[26].
Défenses chimiques
L'évolution des défenses chimiques chez les plantes est liée à l'émergence de substances chimiques qui ne sont pas impliquées dans les processus métaboliques et photosynthétiques essentiels. Ces substances, métabolites secondaires, sont des composés organiques qui n'interviennent pas directement dans la croissance normale, le développement ou la reproduction des organismes[27], et sont souvent des sous-produits de la synthèse des métabolites primaires[28]. Ces métabolites secondaires appartiennent à différentes classes de composés organiques : terpénoïdes, stéroïdes, alcaloïdes, composés phénoliques, glucosinolates, glycosides[29]. Bien qu'on ait pensé que ces métabolites secondaires pouvaient jouer un rôle majeur dans les défenses contre les herbivores[10],[27],[30], une méta-analyse d'importantes études récentes a suggéré que leur rôle dans les défenses pouvait être moindre (comparé à celui d'autres métabolites non secondaires) ou plus complexes[31].
Les métabolites secondaires sont souvent caractérisés comme étant qualitatifs ou quantitatifs. Les métabolites qualitatifs sont définis comme des toxines qui interfèrent avec le métabolisme des herbivores, souvent en bloquant des réactions biochimiques spécifiques. Les composés chimiques qualitatifs sont présents dans les plantes à des concentrations relativement faibles (souvent inférieures à 2 % de la matière sèche), et ne sont pas dépendants du dosage. Ce sont généralement de petites molécules solubles dans l'eau, qui peuvent par conséquent être rapidement synthétisées, transportées et stockées à un coût énergétique relativement faible pour la plante. Leur activité s'exerce sous trois formes : action répulsive, biocide (action bactéricide et fongicide sur le microbiote intestinal par inhibition la production des enzymes par les micro-organismes intestinaux, ce qui inhibe la digestion) et toxique[32]. Les allélochimiques qualitatifs sont habituellement efficaces contre les herbivores spécialistes et généralistes non adaptés.
Les composés chimiques quantitatifs sont ceux qui sont présents en forte concentration dans les végétaux (5 - 40 % du poids sec) et sont efficaces contre tous les herbivores, aussi bien les spécialistes que les généralistes. La plupart des métabolites quantitatifs sont des réducteurs de digestibilité qui rendent les parois cellulaires des plantes indigestes pour les animaux. Les effets de métabolites quantitatifs dépendent du dosage, et plus la proportion de ces substances dans l'alimentation des herbivores est élevée, et moins l'ingestion de tissus végétaux peut contribuer à la nutrition des herbivores.
Du fait que ce sont généralement de grandes molécules, ces défenses sont coûteuses en énergie à produire et à entretenir, et nécessitent souvent plus de temps pour les synthétiser et les transporter[33].
Le géranium, par exemple, produit un unique composé chimique dans ses pétales pour se défendre contre le scarabée japonais. Dans un délai de 30 minutes après l'ingestion, cette substance paralyse l'insecte. Alors que le produit chimique s'estompe généralement après quelques heures, le scarabée est souvent lui-même consommé pendant ce temps par ses prédateurs[34].
Types de défenses chimiques
Les végétaux ont développé de nombreux métabolites secondaires impliqués dans la défense des plantes, qui sont collectivement connus comme composés antiherbivores et peuvent être classés en trois sous-groupes[35] :
- composés azotés (y compris les protéines PR, alcaloïdes, glycosides cyanogénétiques, glucosinolates et benzoxazinoïdes),
- terpénoïdes[36],,
- et composés phénoliques.
Les alcaloïdes sont issus de divers acides aminés. On connait plus de 3000 alcaloïdes, parmi lesquels on peut citer le nicotine, la caféine, la morphine, la colchicine, l'ergoline, la strychnine et la quinine[37]. Les alcaloïdes ont des effets pharmacologiques sur les êtres humains et les animaux. Certains alcaloïdes peuvent inhiber ou activer des enzymes, ou altérer le stockage des glucides et des graisses en inhibant la formation de liaisons phosphodiester impliquées dans leur dégradation[38]. Certains alcaloïdes se lient aux acides nucléiques et peuvent inhiber la synthèse des protéines et affecter les mécanismes de réparation de l'ADN. Les alcaloïdes peuvent aussi affecter la membrane cellulaire et la structure du cytosquelette provoquant l'affaiblissement des cellules, leur effondrement ou des fuites. Ils peuvent affecter la transmission nerveuse. Bien que les alcaloïdes agissent sur différents systèmes métaboliques chez l'homme et les animaux, ils apportent presque toujours un goût amer répulsif[39].
Les glycosides cyanogénétiques sont stockés sous des formes inactives dans les vacuoles de la plante. Ils deviennent toxiques lorsque les herbivores, en broutant la plante, brisent les membranes cellulaires, ce qui met les glycosides au contact des enzymes dans le cytoplasme libérant de l'acide cyanhydrique qui bloque la respiration cellulaire[40].
Les glucosinolates sont activés de la même façon que les glucosides cyanogénétiques, et les produits peuvent causer des symptômes tels que gastroentérite, salivation, diarrhée et irritation de la bouche[39]. Les benzoxazinoïdes, métabolites de défense secondaires caractéristiques des graminées (Poaceae), sont également stockés sous forme de glucosides inactifs dans la vacuole végétale[41]. Dès la désorganisation des tissus, ils entrent en contact avec les β-glucosidases des chloroplastes, qui libèrent enzymatiquement les aglycones toxiques. Tandis que certains benzoxazinoïdes sont constitutivement présents, d'autres ne sont synthétisés qu'après l'infestation des herbivores et sont, par conséquent, considérés comme des défenses inductibles contre les herbivores[42].
Les terpénoïdes, parfois appelés « isoprénoïdes », sont des composés organiques semblables au terpène, dérivés d'unités isoprène à cinq atomes de carbone. On connaît plus de 10 000 types de terpènes[43]. La plupart sont des structures multicycliques qui diffèrent les unes des autres dans les deux groupes fonctionnels, et dans leur squelette de carbone de base[44]. Les monoterpénoïdes, à deux unités d'isoprène, sont des huiles essentielles volatiles telles que la citronnelle, le limonène, le menthol, le camphre et le pinène. Les diterpénoïdes, à quatre unités d'isoprène, sont largement distribués dans les latex et les résines, et peuvent être très toxiques. Les diterpènes sont responsables de la toxicité des feuilles de Rhododendron[45]. Les stéroïdes et stérols végétaux sont également issus de précurseurs terpénoïdes, dont la vitamine D, des glycosides (tels que la digitale) et la saponine (qui lyse les globules rouges des herbivores).
Les composés phénoliques, parfois appelés « phénols », sont composés d'un noyau cyclique aromatique à six atomes de carbone lié à un groupe hydroxy. Certains phénols ont des propriétés antifongiques et antibactériennes[46], tandis que d'autres perturbent l'activité endocrinienne. Les composés phénoliques vont de simples tanins à de plus complexes flavonoïdes qui donnent aux plantes beaucoup de leurs pigments rouge, bleu, jaune et blanc. Les composés phénoliques complexes, appelés « polyphénols », sont capables de produire différents types d'effets chez l'homme, y compris des propriétés antioxydantes. La lignine, la silymarine et les cannabinoïdes sont des exemples de composés phénoliques utilisés pour la défense des plantes[47]. Les tanins condensés, polymères composés de 2 à 50 (ou plus) molécules flavonoïdes, peuvent inhiber la digestion chez certains herbivores en se liant aux protéines végétales consommées et en rendant plus difficile leur digestion par les animaux[48], et en interférant avec l'absorption des protéines et les enzymes digestives, ce qui à terme nuit à la croissance des herbivores[49]. Des propriétés hépatotoxiques des tanins condensés ont été suggérées pour expliquer la mortalité anormales de grands koudous dans des ranches en Afrique du Sud[50].
La silice et la lignine, qui sont totalement indigestes pour les animaux, broient les mandibules des insectes (appendices indispensables à leur alimentation).
Outre les trois grands groupes de substances mentionnés ci-dessus, des dérivés d'acides gras, des acides aminés et même des peptides sont utilisés comme défenses[51]. La cicutoxine, toxine cholinergique de la ciguë, est un polyyne dérivé du métabolisme des acides gras[52]. Le β-N-oxalyle-L-α, de l'acide β-diaminopropionique, en tant que comme simple acide aminé, est utilisé par le pois de senteur qui est également responsable d'intoxication chez l'homme[53]. La synthèse du fluoroacétate chez plusieurs plantes est un exemple de l'utilisation de petites molécules pour perturber le métabolisme des herbivores, dans ce cas le cycle de l'acide citrique[54].
Chez les espèces d'algues tropicales des genres Sargassum et Turbinaria, qui sont souvent préférentiellement consommées par les poissons marins et échinides herbivores, le niveau des composés phénoliques et tanins est relativement faible[55].
Des chitinases sont sécrétées par les plantes, comme un moyen de se protéger naturellement des attaques des maladies fongiques et des insectes en attaquant leur paroi ou leur cuticule à base de chitine[56]. Cette défense n'existe pas chez les myrmécophytes qui ont une réduction de l'activité lytique de la chitinase afin de favoriser la symbiose avec les fourmis[57].
Défenses mécaniques

Les plantes ont développé de nombreuses structures défensives externes qui découragent les herbivores[58]. En fonction des caractéristiques physiques des herbivores (comme leur taille et leur armure défensive), les défenses structurelles des tiges et des feuilles peuvent dissuader, blesser ou tuer les brouteurs de plantes. Certains composés défensifs sont produits en interne, mais sont libérés à la surface de la plante ; par exemple, les résines, la lignine, la silice et la cire recouvrent l'épiderme des plantes terrestres et modifient la texture des tissus de la plante. Les feuilles de houx, par exemple, sont très lisses et glissantes, ce qui rend plus difficile leur ingestion par les ravageurs. Certaines plantes produisent des gommes ou de la sève qui piègent les insectes.
Les feuilles et les tiges des plantes peuvent être couvertes de piquants pointus, d'épines ou de trichomes (poils sur les feuilles souvent avec des barbes), contenant parfois des substances irritantes ou des poisons. Certaines structures végétales caractéristiques, comme les épines peuvent réduire l'alimentation des grands herbivores ongulés (comme le koudou, l'impala et les chèvres) en limitant le taux d'alimentation des herbivores, ou en usant leurs molaires[59]. Les raphides sont des aiguilles d'oxalate de calcium ou de carbonate de calcium présentes dans les tissus végétaux, qui rendent douloureuse leur ingestion, pouvant blesser la bouche et l'œsophage des herbivores et facilitant la libération des toxines de la plante. La structure de la plante, sa ramification et la disposition des feuilles, peuvent également évoluer pour réduire l'impact des herbivores. Les arbustes de Nouvelle-Zélande ont évolué vers des ramifications étalées, adaptation qui pourrait être une réponse aux oiseaux grignoteurs, tels que les moas (espèces éteintes)[60]. De même, les acacias africains ont de longues épines dans le bas de la canopée, mais des épines très courtes dans le haut de la canopée, laquelle est relativement à l'abri des herbivores comme les girafes[61],[62].

Des arbres, tels que le cocotier et d'autres palmiers, peuvent protéger leurs fruits de multiples couches de protection. Il faut des outils efficaces pour les briser et atteindre le contenu des graines, et des aptitudes particulières pour grimper sur les troncs hauts et relativement lisses.
Ces adaptations sont plus fréquentes chez les plantes poussant dans des zones tropicales (cuticule cireuse plus épaisse, développement de la spinescence ou de la pilosité) que celles dans les zones tempérées qui ont des feuilles plus souvent molles et comestibles[63].
En complément de cette résistance passive, les plantes peuvent développer une résistance active : épaisseur ou coriacité des feuilles plus importante[64].
Thigmonastie
Les mouvements thigmonastiques, qui se produisent en réponse au toucher, sont utilisés comme moyen de défense chez certaines plantes. Les feuilles de la sensitive (Mimosa pudica), se ferment rapidement en réponse à un contact direct, à des vibrations, ou même à des stimulus électriques et thermiques. La cause immédiate de cette réponse mécanique est une variation abrupte de la pression de turgescence dans les pulvinus à la base des feuilles, qui résulte de phénomènes osmotiques. Cette dépression est ensuite transmise dans toute la plante par des moyens à la fois électriques et chimiques. Il suffit qu'une seule foliole soit perturbée[65].
Cette réponse réduit la surface offerte aux herbivores qui se trouvent sur la face inférieure de chaque foliole, et aboutit à une apparence flétrie. Elle peut aussi déloger physiquement les petits herbivores, comme les insectes[66].
Domaties
300 familles et 2 000 espèces de plantes[67] développent des domaties, structures végétales spécialement adaptées (tiges enflées, stipules, pseudobulbes, poches foliaires, tubercules, etc.) qui attirent des arthropodes (fourmis, acariens), des cyanobactéries du genre Nostoc, organismes qui consomment et débarrassent les plante de divers parasites (punaises, champignons et leurs spores, voire d'autres acariens phytophages)[68].
Mimétisme et camouflage

Certaines plantes miment la présence d'œufs d'insectes sur leurs feuilles, de manière à dissuader certaines espèces d'insectes de pondre leurs œufs. Parce que les papillons femelles sont moins susceptibles de pondre leurs œufs sur des plantes qui portent déjà œufs de papillons, certaines espèces de plantes grimpantes néotropicales du genre Passiflora (fleurs de la passion) présentent sur leurs feuilles des structures physiques qui ressemblent aux œufs jaunes de papillons du genre Heliconius qui découragent la ponte par les papillons[70].
D'autres mimeraient par leurs gousses des chenilles (Lathyrus ochrus, Pisum fulvum, Vicia peregrina), ou par des taches sombres, la présence de colonies de fourmis ou de pucerons, émettant ainsi des signaux répulsifs qui avertissent d'autres herbivores que les végétaux sont déjà infestés (simulant un effet compétiteur pour les ressources ou une induction de défenses anti-herbivores)[69]. Ce mimétisme, peu étudié et non testé expérimentalement, serait commun dans le règne végétal selon un modèle de la théorie évolutive des jeux[71].
Défenses indirectes

Une autre catégorie de défenses des plantes regroupe celles qui protègent indirectement la plante en renforçant la probabilité d'attirer les ennemis naturels des herbivores. Un tel dispositif est appelé mutualisme ; dans ce cas, il s'agit de la variante « ennemi de mon ennemi » Les sémiochimiques, exhalés par les plantes constituent l'une de ces défenses indirectes. Les substances sémiochimiques sont un groupe de composés organiques volatils impliqués dans les interactions entre les organismes. Les substances allélochimiques sont l'un des groupes de sémiochimiques. Ce groupe comprend notamment les allomones, qui jouent un rôle défensif dans la communication inter-espèces et les kairomones qui sont utilisées par les membres des niveaux trophiques supérieurs pour localiser les sources de nourriture. Quand une plante est attaquée, elle libère des allélochimiques contenant un taux anormal de composés volatils[72],[73]. Les prédateurs interprètent ces composés volatils comme des signaux alimentaires, qui les attirent vers les plantes endommagées et vers leurs proies herbivores. La réduction subséquente du nombre des herbivores confère une valeur sélective bénéfique à la plante et démontre les capacités défensives indirectes des sémiochimiques[74]. Les composés volatils induits présentent également des inconvénients ; certaines études ont suggéré que ces volatils attirent également les herbivores[72].
Les plantes fournissent également aux ennemis naturels des herbivores des moyens pour les nourrir et les abriter. Ce sont des « mécanismes de défense biotiques », qui servent à maintenir la présence de ces prédateurs.
Par exemple, les arbres du genre Macaranga ont adapté les parois minces de leurs tiges pour créer le logement idéal d'une espèce de fourmi (genre Crematogaster), qui à son tour protège la plante contre les herbivores[75]. En plus de lui offrir un abri, la plante fournit également aux fourmis leur source de nourriture exclusive, tirée des substances alimentaires produites par la plante. De même, certaines espèces d'arbres du genre Acacia ont développé des épines qui sont renflées à la base, formant une structure creuse qui sert d'abri. Ces acacias produisent aussi sur leurs feuilles, dans des pseudonectaires (extrafloraux), du nectar qui sert de nourriture aux fourmis[76].
La défense des plantes par des champignons endophytes est un phénomène très courant. La plupart des plantes ont des organismes microbiens endophytes, qui vivent en leur sein. Alors que certains provoquent des maladies, d'autres tels que mes mycorhizes protègent les plantes contre les herbivores et les microbes pathogènes. Les endophytes peuvent aider la plante en produisant des toxines nocives pour d'autres organismes qui attaquent la plante, tels les champignons producteurs d'alcaloïdes qui sont communs dans les graminées comme la fétuque élevée (Festuca arundinacea)[65].
« Parmi les mécanismes indirects se retrouvent le renforcement pariétal par incrustation de molécules polysaccharidiques, comme la callose, de métabolites issus du sentier des phénylpropanoïdes, comme la lignine et les composés phénoliques, et des protéines et glycoprotéines structurales, comme les glycoprotéines riches en hydroxyproline (HRGPs). Ce renforcement pariétal se traduit le plus souvent par la formation de nouvelles barrières dénommées papilles ou appositions pariétales[77] qui contribuent fortement à retarder la progression de l’agent pathogène dans les tissus de la plante et à empêcher la diffusion de substances délétères telles des enzymes de dégradation des parois ou des toxines[63] ».
Couleur et chute des feuilles
La chute des feuilles peut être une réponse qui protège les plantes contre les maladies et certains types de ravageurs tels que les mineuses et les insectes cécidogènes[78]. D'autres réponses, telles que la modification de la couleur des feuilles avant leur chute, pourraient être des adaptations destinées à contrer le camouflage des herbivores[79]. La couleur des feuilles en automne peut aussi s'interpréter comme un signal d'avertissement « honnête » d'engagement défensif à l'égard des insectes ravageurs qui migrent vers les arbres en automne[80],[81].
Reconnaissance des agresseurs
La reconnaissance des agresseurs se fait par plusieurs voies de signalisation : induction de résistance par le biais d'éliciteurs, détection des vibrations acoustiques émises par la mastication des prédateurs lorsqu'ils grignotent les feuilles[82].
Coûts et avantages
Les structures et les substances chimiques défensives sont coûteuses car elles nécessitent des ressources qui pourraient être utilisées par les plantes pour maximiser leur croissance et leur reproduction. De nombreux modèles ont été proposés pour découvrir comment et pourquoi certaines plantes font cet investissement dans les défenses contre les herbivores.
Hypothèse de la défense optimale
L'hypothèse de la défense optimale tente d'expliquer comment les moyens de défense qu'une plante donnée pourrait employer reflètent les menaces particulières qu'elle doit affronter[83]. Ce modèle tient compte de trois facteurs principaux, à savoir : le risque d'une attaque, la valeur de la partie menacée de la plante, et le coût de la défense[84],[85].
Le premier facteur déterminant une défense optimale est le risque : quelle est la probabilité que la plante ou certaines de ses parties soient attaquées ? Cela est également lié à l'« hypothèse de l'exposition de la plante », qui stipule qu'une plante investit massivement dans les défenses très efficaces lorsqu'elle se trouve très exposée et donc facile à trouver par les herbivores[86]. Les plantes exposées qui produisent des protections généralisées sont, notamment, les arbres, les arbustes et les graminées vivaces, à longue durée de vie[86]. Les plantes faiblement exposées, comme celles à cycle de vie court des premiers stades d'une succession écologique investissent de préférence dans de petites quantités de toxines qualitatives qui sont efficaces contre la plupart des herbivores les plus spécialisés[86].
Le deuxième facteur est la valeur de la protection : la plante serait-elle moins apte à survivre et à se reproduire après l'amputation d'une partie de sa structure par un herbivore ? Toutes les parties d'une plante n'ont pas la même valeur adaptative, par conséquent ce sont les éléments ayant la plus grande valeur qui contiennent le plus de défenses. Le stade de développement de la plante au moment où elle est consommée par un herbivore influe aussi sur le changement résultant dans sa capacité de résistance ou de tolérance. Expérimentalement, cette capacité est déterminée en retirant la partie concernée de la plante et en observant les conséquences[87]. En général, les parties reproductives ne sont pas aussi faciles à remplacer que les parties végétatives, les feuilles terminales ont plus de valeur que les feuilles basales, et la perte de certaines parties de la plante a un effet négatif plus important sur sa capacité de résistance au milieu de la saison de croissance qu'au début ou à la fin[88],[89]. Les graines, en particulier, ont tendance à être très bien protégées. Par exemple, les graines de différents fruits comestibles contiennent des glycosides cyanogénétiques tels que l'amygdaline. Cela résulte de la nécessité d'équilibrer les efforts nécessaires pour rendre les fruits attrayants pour les animaux qui assurent leur dispersion, tout en assurant que les graines ne soient pas détruites par l'animal[90],[91].
La dernière considération porte sur le coût : combien une stratégie défensive donnée coûtera à la plante en énergie et en matériaux ? Cela est particulièrement important étant donné que l'énergie consacrée à la défense ne peut pas servir à d'autres fonctions vitales, comme la reproduction et la croissance. L'hypothèse de la défense optimale prédit que les plantes allouent plus d'énergie à la défense lorsque les avantages de la protection l'emportent sur les coûts, en particulier dans les situations où les herbivores exercent une forte pression[92].
Hypothèse de l'équilibre carbone / éléments nutritifs
L'hypothèse de l'équilibre carbone / éléments nutritifs, connue aussi comme l'« hypothèse de la contrainte environnementale » ou « modèle de l'équilibre carbone - éléments nutritifs » (CNBM), suppose que les différents types de défenses de la plante sont des réponses à des variations dans les niveaux de nutriments disponibles dans l'environnement[93],[94]. Cette hypothèse suppose que le ratio carbone/azote dans les plantes détermine quels métabolites secondaires seront synthétisés. Par exemple, les plantes qui poussent dans des sols pauvres en azote utilisent des défenses à base de carbone (principalement des réducteurs de digestibilité : cellulose, polyphénols tels que la lignine ou les tannins), tandis que celles qui poussent dans des milieux faibles en carbone (tels que des conditions ombragées) sont plus susceptibles de produire des toxines à base d'azote. L'hypothèse prédit en outre que les plantes peuvent modifier leurs défenses en réponse aux variations des nutriments. Par exemple, si les plantes sont cultivées dans un milieu à faible teneur en azote, elles mettront en œuvre une stratégie défensive faisant appel à des défenses à base de carbone. Si par la suite les niveaux de nutriments augmentent, par exemple par l'ajout d'engrais, ces défenses à base de carbone diminueront.
Hypothèse du taux de croissance
L'hypothèse du taux de croissance, également connue sous le nom d'« hypothèse de la disponibilité des ressources », affirme que les stratégies de défense sont déterminées par le taux de croissance intrinsèque de la plante, qui est à son tour déterminé par les ressources disponibles pour la plante. L'une des hypothèses principales est que les ressources disponibles sont le facteur limitant dans la détermination du taux de croissance maximal d'une espèce de plante. Ce modèle prévoit que le niveau de l'investissement défensif augmente à mesure que le potentiel de croissance diminue[95]. En outre, les plantes croissant dans des zones pauvres en ressources, avec des taux de croissance faibles, ont tendance à avoir des feuilles et des rameaux à longue durée de vie, et la perte de ces organes peut entraîner une perte de nutriments rares et précieux[96].
Ce modèle a été testé en 2004 pour déterminer si des compromis entre taux de croissance et moyens de défense restreignent des espèces à un habitat. Des plantules de vingt espèces d'arbres ont été transplantées de sols argileux (riches en nutriments) vers des sols sableux (pauvres en nutriments) et réciproquement. Les plantules issues de sols sableux (plus pauvres) avaient des niveaux plus élevés de défense à base de carbone constitutifs, mais quand ils ont été transplantées dans des sols argileux (plus riches) ils ont subi une mortalité plus élevée du fait des herbivores. Ces conclusions suggèrent que les stratégies défensives limitent l'habitat de certaines plantes[97].
Hypothèse de l'équilibre croissance-différenciation
L'hypothèse de l'équilibre croissance-différenciation, appelée aussi hypothèse du bilan croissance-différenciation (BCD), suppose que les défenses de la plante sont le résultat d'un compromis entre les « processus liés à la croissance » et les « processus liés à la différenciation » dans des environnements différents[98],[99]. Les processus liés à la différenciation se définissent comme des « processus qui améliorent la structure ou la fonction des cellules existantes (c'est-à-dire maturation et spécialisation) »[83]. Une plante produira des défenses chimiques uniquement lorsqu'elle disposera de l'énergie nécessaire à partir de la photosynthèse et les plantes ayant les plus fortes concentrations de métabolites secondaires sont celles qui ont un niveau intermédiaire de ressources disponibles[98].
L'hypothèse de l'équilibre croissance-différenciation fournit un cadre de travail permettant de prédire les patrons d’allocation des ressources chez les plantes, que ce soit en faveur des mécanismes de défense ou de croissance des tissus. Dans les situations où les ressources (eau et nutriments) limitent la photosynthèse, cette hypothèse prédit que l'approvisionnement en carbone limite à la fois la croissance et les défenses. Au fur et à mesure que la disponibilité des ressources augmente, les conditions nécessaires pour assurer la photosynthèse sont remplies, ce qui permet l'accumulation d'hydrates de carbone dans les tissus. Lorsque les ressources ne sont pas suffisantes pour répondre à la forte demande de la croissance, ces composés de carbone peuvent être répartis plutôt vers la synthèse de métabolites secondaires organiques (composés phénoliques, tannins, etc.). Dans les environnements où les besoins en ressources pour la croissance sont assurés, le carbone est alloué aux méristèmes à division rapide au détriment du métabolisme secondaire. Ainsi les plantes en croissance rapide doivent avoir des niveaux plus faibles de métabolites secondaires et vice versa. En outre, le compromis prédit par l'hypothèse de l'équilibre croissance-différenciation peut changer dans le temps, comme en témoigne une étude de 2007[100] sur Salix spp. Cette hypothèse est très présente dans la littérature scientifique, et certains chercheurs considèrent que c'est l'hypothèse la plus aboutie sur les défenses des plantes.
Applications
Agriculture
Les variations de la sensibilité des plantes aux maladies et ravageurs étaient probablement connues dès les premiers stades de l'agriculture. À l'époque historique, l'observation de ces différences de sensibilité a permis d'apporter des solutions à des problèmes socio-économiques importants. Le phylloxéra de la vigne a été introduit d'Amérique du Nord en France en 1860 et en 25 ans il a provoqué la destruction de près d'un tiers (100 000 km2) du vignoble français. Charles Valentine Riley a remarqué que l'espèce américaine, Vitis labrusca, était résistante au phylloxéra. Riley, en collaboration avec Jules Émile Planchon, contribua à sauver la viticulture en France en suggérant de greffer les cépages sensibles mais de haute qualité sur des plants de Vitis labrusca[101] L'étude formelle de la résistance des plantes aux herbivores a été largement couverte par Reginald (R.H.) Painter, considéré comme le fondateur de ce domaine de recherche, dans son livre publié en 1951, Plant Resistance to Insects (Résistance des plantes aux insectes)[102]. Tandis que cet ouvrage a ouvert la voie à des recherches ultérieures aux États-Unis, le travail de Chesnokov fut la base de nouvelles recherches en Union soviétique[103].
Les jeunes pousses d'herbe ont parfois un taux élevé d'acide prussique et peuvent causer l'empoisonnement du bétail au pâturage. La production de composés cyanogénique dans les herbes est essentiellement une défense contre les herbivores[104],[105].
La cuisson est une innovation humaine qui a été particulièrement utile pour surmonter de nombreuses substances chimiques défensives des plantes. De nombreux inhibiteurs enzymatiques présents chez les céréales et les légumineuses, comme les inhibiteurs de la trypsine fréquents chez les légumineuses cultivées, sont dénaturés par la cuisson, ce qui rend ces produits digestibles[106],[107].
On sait depuis la fin du XVIIe siècle que les plantes contiennent des composés chimiques nocifs qui sont évités par les insectes. Ces composés ont été parmi les premiers insecticides utilisés par l'homme ; en 1690, la nicotine était extraite du tabac et utilisée comme insecticide de contact. En 1773, les plantes infestées d'insectes étaient traités à l'aide de fumigations de nicotine en faisant chauffer du tabac et en soufflant la fumée sur les plantes[108]. Les fleurs des espèces de Chrysanthemum contiennent de la pyréthrine, qui est un puissant insecticide. Dans les dernières années, les applications de la résistance des plantes sont devenues un important domaine de recherche en agriculture et en amélioration des plantes, en particulier parce qu'elles peuvent fournir des alternatives sûres et peu coûteuses à l'utilisation des pesticides[109]. Le rôle important des substances secondaires des plantes dans la défense des plantes a été décrite vers la fin des années 1950 par Vincent Dethier et G.S. Fraenkel[27],[110]. L'emploi de pesticides botaniques est très répandu et parmi les exemples notables on peut citer l'azadirachtine extraite du neem (Azadirachta indica), le d-Limonène des espèces de Citrus, la roténone du Derris, la capsaïcine du piment et le Pyrethrum[111].
Des substances naturelles présentes dans l'environnement peuvent aussi induire des résistances chez les plantes[112]. Le chitosane, dérivé de la chitine, induit chez les plantes une réponse de défense naturelle contre les pathogènes, les maladies et les insectes, y compris les nématodes à kystes. Ces deux molécules ont été approuvées comme biopesticides par l'EPA pour réduire la dépendance à l'égard des pesticides toxiques.
L'amélioration des plantes cultivées implique souvent une sélection contre les stratégies de résistance intrinsèque des plantes. Cela rend les variétés de plantes cultivées particulièrement sensibles aux maladies et ravageurs, au contraire de leurs parentes sauvages. Dans le cadre de la sélection pour la résistance des plantes-hôtes, ce sont souvent les plantes sauvages apparentées qui sont la source de gènes de résistance. Ces gènes sont incorporés par des approches conventionnelles d'hybridation, mais celles-ci ont été amplifiées par des techniques d'ADN recombinant, qui permettent l'introduction de gènes provenant d'organismes totalement non apparentés. L'approche transgénique la plus connue est l'introduction dans le génome des plantes de gènes provenant d'une espèce bactérienne, Bacillus thuringiensis. La bactérie produit des protéines qui tuent les chenilles de lépidoptères qui les ingèrent. Le gène codant ces protéines hautement toxiques, introduit dans le génome de la plante-hôte, confère à celle-ci une résistance contre les chenilles lorsque les mêmes protéines toxiques sont synthétisées dans la plante elle-même. Toutefois, cette approche est controversée à cause de la possibilité d'effets collatéraux d'ordre écologique et toxicologique[113].
Pharmacie

Beaucoup de médicaments courants sont dérivés de métabolites secondaires que les plantes utilisent pour se protéger des herbivores, parmi lesquels l'opium, l'aspirine, la cocaïne et l'atropine[114]. Ces substances chimiques ont évolué pour affecter la biochimie des insectes par des voies très spécifiques. Cependant, beaucoup de ces voies biochimiques ont été conservées chez les vertébrés, y compris les humains, et ces substances agissent sur la biochimie humaine de manière très similaire à leur action sur les insectes. L'étude des interactions plantes-insectes pourrait donc aider à la bioprospection[115].
Il est prouvé que l'homme a commencé à utiliser des alcaloïdes végétaux dans des préparations médicales dès l'an 3000 av. J.-C[38].. Bien que les principes actifs de la plupart des plantes médicinales n'aient été isolés que récemment (depuis le début du XIXe siècle, ces substances ont été utilisées comme médicaments tout au long de l'histoire humaine dans des potions, des médicaments, des thés et aussi comme poisons. Par exemple, pour lutter contre les larves de certaines espèces de lépidoptères, le quinquina produit divers alcaloïdes dont le plus connu est la quinine. Celle-ci est extrêmement amère, ce qui rend l'écorce de l'arbre tout à fait désagréable. C'est aussi un agent antifièvre, connu sous le nom d'herbe des Jésuites, particulièrement utile dans le traitement du paludisme[116].
Tout au long de l'histoire, la mandragore (Mandragora officinarum) a été très prisée pour ses propriétés réputées aphrodisiaques. Cependant, les racines de la mandragore contiennent également de grandes quantités d'un alcaloïde, la scopolamine, qui, à doses élevées, agit comme un dépresseur du système nerveux central, et rend la plante très toxique pour les herbivores. La scopolamine est devenue par la suite le médicament utilisé pour le traitement de la douleur avant et pendant l'accouchement ; à petite dose, on l'emploie pour prévenir la cinétose[117].
L'un des terpènes les plus connus et apprécié en pharmacie est le taxol, médicament anticancéreux, isolé à partir de l'écorce de l'if de l'Ouest,(Taxus brevifolia), au début des années 1960[118].
Notes et références
- (en) Carlos M. Herrera, Pilar Bazaga, « Epigenetic correlates of plant phenotypic plasticity: DNA methylation differs between prickly and nonprickly leaves in heterophyllous Ilex aquifolium (Aquifoliaceae) trees », Botanical Journal of the Linnean Society, vol. 171, no 3, , p. 441–452 (DOI 10.1111/boj.12007).
- Boyd, Jade (2012). "A bit touchy: Plants' insect defenses activated by touch". Rice University. http://news.rice.edu/2012/04/09/a-bit-touchy-plants-insect-defenses-activated-by-touch-2/.
- Changement de modèles de croissance saisonnière.
- (en) S.Y. Strauss, A.A. Agrawal, « The ecology and evolution of plant tolerance to herbivory », Trends in Ecology and Evolution, vol. 14, no 5, , p. 179-185
- (en) Margareta Séquin, The Chemistry of Plants and Insects. Plants, Bugs, and Molecules, Royal Society of Chemistry, (lire en ligne), p. 63
- Pierre Abad, Bruno Favery, « L'arsenal immunitaire des plantes », Pour la science, no 77, , p. 24
- Pierre Abad, Bruno Favery, « L'arsenal immunitaire des plantes », Pour la science, no 77, , p. 26
- (en) S. Venturi, F.M. Donati, A. Venturi et M. Venturi, « Environmental Iodine Deficiency: A Challenge to the Evolution of Terrestrial Life? », Thyroid, vol. 10, no 8, , p. 727–9 (PMID 11014322, DOI 10.1089/10507250050137851).
- (en) Sebastiano Venturi, « Evolutionary Significance of Iodine », Current Chemical Biology-, vol. 5, no 3, , p. 155–162 (ISSN 1872-3136, DOI 10.2174/187231311796765012).
- (en) Paul R. Ehrlich et Peter H. Raven, « Butterflies and plants: a study of coevolution. », Evolution, Society for the Study of Evolution, vol. 18, no 4, , p. 586–608 (DOI 10.2307/2406212, JSTOR 2406212).
- (en) C.C. Labandeira, D.L. Dilcher, D.R. Davis et D.L. Wagner, « Ninety-seven million years of angiosperm-insect association: paleobiological insights into the meaning of coevolution », Proceedings of the National Academy of Science of the United States of America, vol. 91, no 25, , p. 12278–82 (PMID 11607501, PMCID 45420, DOI 10.1073/pnas.91.25.12278, Bibcode 1994PNAS...9112278L, lire en ligne [PDF]).
- Keddy, P.A. 2007. Plants and Vegetation: Origins, Processes, Consequences. Cambridge University Press, Cambridge, UK. 666 p. Chapter 7.
- (en) C.C. Labandeira, « Early History Of Arthropod And Vascular Plant Associations 1 », Annual Reviews in Earth and Planetary Sciences, vol. 26, no 1, , p. 329–377 (DOI 10.1146/annurev.earth.26.1.329, Bibcode 1998AREPS..26..329L).
- (en) C. Labandeira, « The origin of herbivory on land: Initial patterns of plant tissue consumption by arthropods », Insect Science, vol. 14, no 4, , p. 259–275 (DOI 10.1111/j.1744-7917.2007.00152.x).
- (en) Richard Karban et Anurag A. Agrawal, « Herbivore offense », Annual Review of Ecology and Systematics, vol. 33, no 1, , p. 641–664 (DOI 10.1146/annurev.ecolsys.33.010802.150443).
- (en) Douglas J. Futuyma et Montgomery Slatkin, Coevolution, Sunderland, Massachusetts, Sinauer Associates, , 555 p. (ISBN 0-87893-228-3).
- (en) J. Thompson, Herbivores: between plants and predators; the 38th symposium of the British Ecological Society in cooperation with the Netherlands Ecological Society held at the Wageningen Agricultural University, The Netherlands, 1997, Oxford, Blackwell Science, , 639 p. (ISBN 0-632-05155-8), « What we know and do not know about coevolution: insect herbivores and plants as a test case. ».
- (en) Brian D. Farrell et Charles Mitter, « Adaptive Radiation in Insects and Plants: Time and Opportunity », American Zoologist, vol. 34, no 1, , p. 57–69 (DOI 10.1093/icb/34.1.57).
- Meilleure aptitude à la multiplication végétative ou à la fructification.
- Par exemple décalage de la période de floraison ou de fructification, par rapport à la période de parasitisme ; dispersion des graines dans l’espace.
- (en) Brian M. Traw et Todd E. Dawson, « Differential induction of trichomes by three herbivores of black mustard », Oecologia, vol. 131, no 4, , p. 526–532 (DOI 10.1007/s00442-002-0924-6, lire en ligne [PDF], consulté le ).
- Walling, L.L. The myriad plant responses to herbivores. J. Plant Growth Regul. 2000, 19, 195–216.
- Wu, J.; Baldwin, I.T. Herbivory-induced signalling in plants: Perception and action. Plant Cell Environ. 2009, 32, 1161–1174.
- Sarmento, R.A.; Lemos, F.; Dias, C.R.; Kikuchi, W.T.; Rodrigues, J.C.P.; Pallini, A.; Sabelis, M.W.; Janssen, A. A herbivorous mite down-regulates plant defence and produces web to exclude competitors. PLoS One 2011, 6, doi:10.1371/journal.pone.0023757.
- Sangha, J.S.; Yolanda, H. Chen, Jatinder Kaur, Wajahatullah Khan, Zainularifeen Abduljaleel, Mohammed S. Alanazi, Aaron Mills, Candida B. Adalla, John Bennett, Balakrishnan Prithiviraj, Gary C. Jahn, Hei Leung. Proteome Analysis of Rice (Oryza sativa L.) Mutants Reveals Differentially Induced Proteins during Brown Planthopper (Nilaparvata lugens) Infestation. Int. J. Mol. Sci. 2013, 14, 3921-3945; doi:10.3390/ijms14023921.
- (en) Richard Karban, Anurag A. Agrawal et Marc Mangel, « The benefits of induced defenses against herbivores », Ecology, Ecological Society of America, vol. 78, no 5, , p. 1351–1355 (DOI 10.2307/2266130, JSTOR 2266130, lire en ligne [PDF], consulté le ).
- (en) G. Fraenkel, « The raison d'être of secondary plant substances », Science, vol. 129, no 3361, , p. 1466–70 (PMID 13658975, DOI 10.1126/science.129.3361.1466, Bibcode 1959Sci...129.1466F).
- (en) Robert H. Whittaker, « The biochemical ecology of higher plants », dans Ernest Sondheimer et John B. Simeone, Chemical ecology, Boston, Academic Press, (ISBN 0-12-654750-5), p. 43–70.
- (en) A. Mithöfer & W. Boland, « Plant defense against herbivores: chemical aspects », Annual Review of Plant Biology, vol. 63, , p. 431–450 (DOI 10.1146/annurev-arplant-042110-103854).
- (en) Robert H. Whittaker, Communities and ecosystems, New York, Macmillan, (ISBN 0-02-427390-2).
- (en) Diego Carmona, Marc J. Lajeunesse et Marc T.J. Johnson, « Plant traits that predict resistance to herbivores », Functional Ecology, vol. 25, no 2, , p. 358–367 (DOI 10.1111/j.1365-2435.2010.01794.x, lire en ligne [PDF], consulté le ).
- (en) Michael J. Crawley, Plant Ecology, John Wiley & Sons, p. 294-295
- (en) Nina Theis et Manuel Lerdau, « The evolution of function in plant secondary metabolites », International Journal of Plant Science, vol. 164, no 3 Suppl., , S93–S102 (DOI 10.1086/374190, lire en ligne[archive] [PDF], consulté le ).
- (en) « Geraniums and Begonias New Research on Old Garden Favorites », Agricultural reseach Service (USDA), (consulté le ).
- (en) « Biochemical defenses: secondary metabolites: », Plant Defense Systems & Medicinal Botany, McDaniel College (consulté le ).
- (en) Esha Sharma, Garima Anand, Rupam Kapoor, « Terpenoids in plant and arbuscular mycorrhiza-reinforced defence against herbivorous insects », Annals of Botany, vol. 119, no 5, , p. 791–801 (DOI 10.1093/aob/mcw263).
- (en) « Alkaloids: contain a N-containing heterocycle », Plant Defense Systems & Medicinal Botany (consulté le ).
- (en) Margaret F. Roberts et Michael Wink, Alkaloids : biochemistry, ecology, and medicinal applications, New York, Plenum Press, , 486 p. (ISBN 0-306-45465-3, lire en ligne).
- (en) David F Rhoades, Herbivores: Their Interaction with Secondary Plant Metabolites, New York, Academic Press, , 3–54 p. (ISBN 0-12-597180-X), « Evolution of Plant Chemical Defense against Herbivores »
- Toxicon Volume 38, Issue 1, January 2000, Pages 11-36 János Vetter Plant cyanogenic glycosides DOI:10.1016/S0041-0101(99)00128-2
- (en) HM Niemeyer, « Hydroxamic acids derived from 2-hydroxy-2H-1,4-benzoxazin-3(4H)-one: key defense chemicals of cereals », J Agric Food Chem, vol. 57, no 5, , p. 1677–1696 (DOI 10.1021/jf8034034).
- (en) G. Glauser, G. Marti, N. Villard, GA. Doyen, J.-L. Wolfender, TCJ. Turlings et M. Erb, « Induction and detoxification of maize 1,4-benzoxazin-3-ones by insect herbivores », Plant J, vol. 68, no 5, , p. 901–911 (DOI 10.1111/j.1365-313X.2011.04740.x).
- (en) « Terpenoids », Plant Defense Systems & Medicinal Botany (consulté le ).
- (en) Jonathan Gershenzon et Wolfgang Kreis, Biochemistry of plant secondary metabolism, Londres, Sheffield Academic Press, , 222–279 p. (ISBN 0-8493-4085-3), « Biochemistry of terpinoids ».
- (en) Albert T. Sneden, « Terpenes »(Archive • Wikiwix • Archive.is • Google • Que faire ?), Natural Products as Medicinally Useful Agents (consulté le ).
- En règle générale, les composés phénoliques peuvent avoir un effet délétère sur la germination des spores, la croissance mycélienne, la production d'enzymes hydrolytiques comme les pectinases, et la synthèse et l'activité biologique des toxines fongiques (par une détoxification).
- (en) « Phenols », Plant Defense Systems & Medicinal Botany (consulté le ).
- (en) Wouter Van Hoven, « Tannins and digestibility in greater kudu », Canadian Journal of Animal Science, vol. 64 (suppl.), , p. 177–178.
- (en) Peter J. Van Soest, Nutritional ecology of the ruminant: ruminant metabolism, nutritional strategies, the cellulolytic fermentation, and the chemistry of forages and plant fibers, Corvallis (Orégon), O & B Books, (ISBN 0-9601586-0-X).
- (en) Wouter Van Hoven, « Mortalities in kudu (Tragelaphus strepsiceros) populations related to chemical defence in trees », Revue de zoologie africaine, vol. 105, no 2, , p. 141-145.
- (en) John W. Hylin, « Toxic peptides and amino acids in foods and feeds », Journal of Agricultural and Food Chemistry, vol. 17, no 3, , p. 492–496 (DOI 10.1021/jf60163a003).
- (en) E. Anet, B. Lythgoe, M. H. Silk et S. Trippett, « Oenanthotoxin and cicutoxin. Isolation and structures », Journal of the Chemical Society, , p. 309–322 (DOI 10.1039/JR9530000309).
- (en) Mark V. Barrow, Charles F. Simpson et Edward J. Miller, « Lathyrism: A Review », The Quarterly Review of Biology, vol. 49, no 2, , p. 101–128 (PMID 4601279, DOI 10.1086/408017, JSTOR 2820941).
- (en) Donald A. Levin et Dennis R. King, « The Impact of Fluoroacetate-Bearing Vegetation on Native Australian Fauna: A Review », Oikos, Blackwell Publishing, vol. 61, no 3, , p. 412–430 (DOI 10.2307/3545249, JSTOR 3545249).
- (en) Chemical defenses and the susceptibility of tropical marine brown algae to herbivores. Peter D. Steinberg, Oecologia, 1986, volume 69, Number 4, pages 628-630, DOI:10.1007/BF00410374.
- (en) Iseli B, Armand S, Boller T, Neuhaus JM, Henrissat B (1996) Plant chitinases use two different hydrolytic mechanisms. FEBS Lett 382:186–188
- (en) Martin Heil, Brigitte Fiala, K. Eduard Linsenmair, Thomas Boller, « Reduced Chitinase Activities in Ant Plants of the Genus Macaranga », Naturwissenschaften, vol. 86, no 3, , p. 146–149 (DOI 10.1007/s001140050589).
- (en) G.W. Fernandes, « Plant mechanical defenses against insect herbivory », Revista Brasileira de Entomologia, vol. 38, no 2, , p. 421–433 (lire en ligne).
- (en) Susan M. Cooper et Norman Owen-Smith, « Effects of plant spinescence on large mammalian herbivores », Oecologia, vol. 68, no 3, , p. 446–455 (DOI 10.1007/BF01036753).
- (en) W. Bond, W. Lee et J. Craine, « Plant structural defences against browsing birds: a legacy of New Zealand's extinct moas », Oikos, vol. 104, no 3, , p. 500–508 (DOI 10.1111/j.0030-1299.2004.12720.x).
- (en) Truman P. Young, « Increased thorn length in Acacia drepanolobium- an induced response to browsing », Oecologia, vol. 71, no 3, , p. 436–438. (DOI 10.1007/BF00378718).
- (en) Truman P. Young et Bell Okello, « Relaxation of an induced defense after exclusion of herbivores: spines on Acacia drepanolobium », Oecologia, vol. 115, no 4, , p. 508–513. (DOI 10.1007/s004420050548).
- Nicole Benhamou et Patrice Rey, « Stimulateurs des défenses naturelles des plantes : une nouvelle stratégie phytosanitaire dans un contexte d’écoproduction durable », Phytoprotection, vol. 92, no 1, , p. 1-23 (DOI 10.7202/1012399ar)
- (en) Dieter F. Hochuli, « Insect herbivory and ontogeny: How do growth and development influence feeding behaviour, morphology and host use? », Austral Ecology, vol. 26, no 5, , p. 563-570 (DOI 10.1046/j.1442-9993.2001.01135.x).
- (en) Peter H. Raven, Ray F. Evert et Susan E. Eichhorn, Biology of Plants, New York, W. H. Freeman and Company, (ISBN 0-7167-1007-2).
- (en) E. Wassim Chehab Elizabeth Eich Janet Braam, « Thigmomorphogenesis: a complex plant response to mechano-stimulation », Journal of Experimental Botany, vol. 60, no 1, , p. 43–56 (DOI 10.1093/jxb/ern315).
- (en) M. Heil et D. McKey D, Protective ant-plant interactions as model systems in ecological and evolutionary research, Annual Review of Ecology, Evolution, and Systematics, n°34, 2003, p.425-453
- (en) Dennis J O'Dowd, « Associations Between Mites and Leaf Domatia », Trends in Ecology & Evolution, vol. 6, no 6, , p. 179–182 (DOI 10.1016/0169-5347(91)90209-G.)
- (en) Simcha Lev-Yadun, Moshe Inbar, « Defensive ant, aphid and caterpillar mimicry in plants? », Biological Journal of the Linnean Society, vol. 77, no 3, , p. 393–398 (DOI 10.1046/j.1095-8312.2002.00132.x, lire en ligne).
- (en) Kathy S. Williams et Lawrence E. Gilbert, « Insects as selective agents on plant vegetative morphology: egg mimicry reduces egg-laying by butterflies », Science, vol. 212, no 4493, , p. 467–469 (PMID 17802547, DOI 10.1126/science.212.4493.467, Bibcode 1981Sci...212..467W).
- (en) Magnus Augner & Elizabeth A. Bernays, « Plant defence signals and Batesian mimicry », Evolutionary Ecology, vol. 12, , p. 667–679 (DOI 10.1023/A:1006581415114)
- (en) Marcel Dicke et Joop J.A. van Loon, « Multitrophic effects of herbivore-induced plant volatiles in an evolutionary context », Entomologia Experimentalis et Applicata, vol. 97, no 3, , p. 237–249 (DOI 10.1046/j.1570-7458.2000.00736.x).
- DOI:10.1126/science.1191634.
- (en) Meredith C. Schuman, Kathleen Barthel et Ian T. Baldwin, « Herbivory-induced volatiles function as defenses increasing fitness of the native plant Nicotiana attenuata in nature », eLife Sciences, vol. 1, (DOI 10.7554/eLife.00007, lire en ligne [PDF]).
- (en) Martin Heil, Brigitte Fiala, K. Eduard Linsenmair, Gerhard Zotz et Petra Menke, « Food body production in Macaranga triloba (Euphorbiaceae): A plant investment in anti-herbivore defense via symbiotic ant partners », Journal of Ecology, British Ecological Society, vol. 85, no 6, , p. 847–861 (DOI 10.2307/2960606, JSTOR 2960606).
- (en) Truman P. Young, Cynthia H. Stubblefield et Lynne A. Isbell, « Ants on swollen-thorn acacias: species coexistence in a simple system », Oecologia, vol. 109, no 1, , p. 98–107 (DOI 10.1007/s004420050063).
- (en) J.R. Aist, « Papillae and related wound plugs of plant cells », Annual Review of Phytopathology, vol. 14, no 1, , p. 145-163 (DOI 10.1146/annurev.py.14.090176.001045)
- (en) Alan G. Williams et Thomas G. Whitham, « Premature Leaf Abscission: An Induced Plant Defense Against Gall Aphids », Ecology, Ecological Society of America, vol. 67, no 6, , p. 1619–1627 (DOI 10.2307/1939093, JSTOR 1939093).
- (en) Simcha Lev-Yadun, Amots Dafni, Moshe A. Flaishman, Moshe Inbar, Ido Izhaki, Gadi Katzir et Gidi Ne'eman, « Plant coloration undermines herbivorous insect camouflage », BioEssays, vol. 26, no 10, , p. 1126–1130 (PMID 15382135, DOI 10.1002/bies.20112, lire en ligne [PDF], consulté le ).
- (en) M Archetti, M., « The origin of autumn colours by coevolution », J. Theor. Biol., vol. 205, no 4, , p. 625–630 (PMID 10931756, DOI 10.1006/jtbi.2000.2089).
- W. D. Hamilton et S. P. Brown, « Autumn tree colours as a handicap signal », Proc. R. Soc. B, vol. 268, no 1475, , p. 1489–1493 (PMID 11454293, PMCID 1088768, DOI 10.1098/rspb.2001.1672).
- (en) H. M. Appel, R. B. Cocroft, « Plants respond to leaf vibrations caused by insect herbivore chewing », Oecologia, vol. 175, no 4, , p. 1257–1266.
- (en) Nancy Stamp, « Out of the quagmire of plant defense hypotheses », Quarterly Review of Biology, vol. 78, no 1, , p. 23–55 (PMID 12661508, DOI 10.1086/367580).
- D. F. Rhoades et R. G. Cates., Recent advances in phytochemistry: proceedings of the annual meeting of the Phytochemical society of North America, Boston, Academic Press, , 168–213 p. (ISBN 0-12-612408-6), « Towards a general theory of plant antiherbivore chemistry ».
- (en) Peter Wilf, Conrad C. Labandeira, Kirk R. Johnson, Phyllis D. Coley et Asher D. Cutter, « Insect herbivory, plant defense, and early Cenozoic climate change », Proceedings of the National Academy of Sciences, vol. 98, no 11, , p. 6221–6226 (PMID 11353840, PMCID 33449, DOI 10.1073/pnas.111069498, Bibcode 2001PNAS...98.6221W, lire en ligne [PDF], consulté le ).
- (en) P. Feeny, Biochemical interaction between plants and insects: proceedings of the fifteenth annual meeting of the Phytochemical Society of North America, New York, Plenum Press, , 1–40 p. (ISBN 0-306-34710-5), « Plant apparency and chemical defense. ».
- (en) D. McKey, Herbivores, their interaction with secondary plant metabolites, Boston, Academic Press, , 55–133 p. (ISBN 0-12-597180-X), « The distribution of secondary compounds within plants. ».
- (en) V. A. Krischik et R. F. Denno., Variable plants and herbivores in natural and managed systems, Boston, Academic Press, , 463–512 p. (ISBN 0-12-209160-4), « Individual, population, and geographic patterns in plant defense. ».
- (en) Arthur R. Zangerl et Claire E. Rutledge, « The probability of attack and patterns of constitutive and induced defense: A test of optimal defense theory », The American Naturalist, vol. 147, no 4, , p. 599–608 (DOI 10.1086/285868, JSTOR 2463237).
- (en) Elisabeth Swain, Chun Ping Li et Jonathan E. Poulton, « Development of the Potential for Cyanogenesis in Maturing Black Cherry (Prunus serotina Ehrh.) Fruits », Plant Physiology, vol. 98, no 4, , p. 1423–1428 (PMID 16668810, PMCID 1080367, DOI 10.1104/pp.98.4.1423).
- (en) M.C. Witmer, « Ecological and evolutionary implications of energy and protein requirements of avian frugivores eating sugary diets », Physiological Zoology, vol. 71, no 6, , p. 599–610 (PMID 9798248).
- (en) Steven C. Pennings, Erin L. Siska et Mark D. Bertness, « Latitudinal differences in plant palatability in Atlantic coast salt marshes », Ecology, Ecological Society of America, vol. 82, no 5, , p. 1344–1359 (DOI 10.2307/2679994, JSTOR 2679994).
- (en) John P. Bryant, Stuart Chapin et David R. Klein, « Carbon/nutrient balance of boreal plants in relation to vertebrate herbivory », Oikos, Blackwell Publishing, vol. 40, no 3, , p. 357–368 (DOI 10.2307/3544308, JSTOR 3544308).
- (en) P. Niemela, F. S. Chapin, J. P. Bryant et S. Siren, Mechanisms of woody plant defenses against insects: search for pattern, Berlin, Springer-Verlag, , 57–72 p. (ISBN 0-387-96673-0), « Defensive responses of trees in relation to their carbon/nutrient balance. ».
- (en) Phyllis D. Colley, John P. Bryant et F. Stuart Chapin III, « Resource availability and plant antiherbivore defense », Science, vol. 230, no 4728, , p. 895–899 (PMID 17739203, DOI 10.1126/science.230.4728.895, Bibcode 1985Sci...230..895C).
- (en) F. Stuart, III Chapin, « The Mineral Nutrition of Wild Plants », Annual Review of Ecological Systematics, vol. 11, , p. 233–260 (DOI 10.1146/annurev.es.11.110180.001313, JSTOR 2096908).
- (en) Paul V. A. Fine, Italo Mesones et Phyllis D. Coley, « Herbivores promote habitat specialization by trees in Amazonian forests », Science, vol. 305, no 5684, , p. 663–5 (PMID 15286371, DOI 10.1126/science.1098982, Bibcode 2004Sci...305..663F).
- (en) W. E. Loomis, Growth and differentiation in plants, New York, Pergamon Press, , 1–17 p. (ISBN 0-08-026351-8), « Growth and differentiation—an introduction and summary. ».
- (en) Daniel A. Herms et William J. Mattson, « The dilemma of plants: to grow or defend », Quarterly Review of Biology, vol. 67, no 3, , p. 283–335 (DOI 10.1086/417659, JSTOR 2830650).
- (en) Carolyn Glynn, Daniel A. Herms, Colin M. Orians, Robert C. Hansen, Stig Larsson, « Testing the growth–differentiation balance hypothesis: dynamic responses of willows to nutrient availability », New Phytologist, vol. 176, no 3, , p. 623-634 (DOI 10.1111/j.1469-8137.2007.02203.x, lire en ligne).
- (en) Sridhar Polavarapu, « Plant Resistance to insects », Agricultural Entomology & Pest Management, université Rutgers, (consulté le ).
- (en) Reginald Henry Painter, Insect Resistance in Crop Plants, Lawrence, University of Kansas Press, (OCLC 443998).
- (en) Pavel G. Chesnokov, Methods of Investigating Plant Resistance to Pests, Jérusalem, Israel Program for Scientific Translations, (OCLC 3576157).
- (en) Roslyn M. Gleadow et Ian E. Woodrow, « Constraints on effectiveness of cyanogenic glycosides in herbivore defense », Journal of Chemical Ecology, vol. 28, no 7, , p. 1301–13 (PMID 12199497, DOI 10.1023/A:1016298100201).
- (en) Lester R. Vough et E. Kim Cassel, « Prussic Acid Poisoning of Livestock: Causes and Prevention (ExEx 4016) » [PDF], Extension Extra, South Dakota State University Extension Service, .
- (en) George Grant, Linda J. More, Norma H. McKenzie et Arpad Pusztai, « The effect of heating on the haemagglutinating activity and nutritional properties of bean (Phaseolus vulgaris) seeds », Journal of the Science of Food and Agriculture, vol. 33, no 12, , p. 1324–6 (PMID 7166934, DOI 10.1002/jsfa.2740331220).
- (en) Tu, « Natural Toxins in Raw Foods and How Cooking Affects Them », Is Cooked Food Poison?, Beyond Vegetarianism, (consulté le ).
- (en) George W. Ware, The Pesticide Book, Willoughby, MeisterPro, (ISBN 1-892829-11-8).
- (en) C. Michael Smith, Plant Resistance to Arthropods : Molecular and conventional approaches, Berlin, Springer, , 423 p. (ISBN 1-4020-3701-5, lire en ligne)
- (en) V. G. Dethier, « Evolution of feeding preferences in phytophagous insects », Evolution, Society for the Study of Evolution, vol. 8, no 1, , p. 33–54 (DOI 10.2307/2405664, JSTOR 2405664).
- (en) Karen Russ, « Less toxic insecticides », Clemson University Home & Garden Information Center (consulté le ).
- J. Linden, R. Stoner, K. Knutson et C. Gardner-Hughes, « Organic Disease Control Elicitors », Agro Food Industry Hi-Te, octobre 2000), p. 12-15.
- (en) H.F. van Emden, « Transgenic Host Plant Resistance to Insects—Some Reservations », Annals of the Entomological Society of America, vol. 92, no 6, , p. 788–797 (lire en ligne, consulté le ).
- (en) B. Ghosh, « Polyamines and plant alkaloids », Indian Journal of Experimental Biology, vol. 38, no 11, , p. 1086–91 (PMID 11395950).
- (en) Thomas Eisner, « Prospecting for nature's chemical riches », Chemoecology, vol. 1, no 1, , p. 38–40 (DOI 10.1007/BF01240585).
- (en) Albert T. Sneden, « The Quinine Alkaloids » [PDF], Medicinal Chemistry and Drug Design (consulté le ).
- Albert T. Sneden, « The Tropane Alkaloids » [PDF], Medicinal Chemistry and Drug Design (consulté le ).
- (en) Albert T. Sneden, « Taxol (Paclitaxe) » [PDF], Medicinal Chemistry and Drug Design (consulté le ).
Voir aussi
Articles connexes
- Aposématisme
- Biopesticide
- Écologie chimique
- Canavanine
- Druse (botanique)
- Laticifère
- Lectine
- Raphide
- Résistance des plantes aux maladies
- Rencontre plantes-insectes
- Tolérance des plantes aux herbivores
- Pollinisation
- Phytoalexine
- Mouvement végétal rapide
- Granivore
- Histoire évolutive des végétaux
- Adaptation des herbivores aux défenses des plantes
- Défense contre les prédateurs
- Évolution des défenses anti-prédation
- Listes
- Liste de plantes répulsives
- Liste d'adventices bénéfiques
- Liste de plantes compagnes
Bibliographie
- (en) Anurag A. Agrawal, Sadik Tuzun, Elizabeth Bent, Induced Plant Defenses Against Pathogens and Herbivores: Biochemistry, Ecology, and Agriculture, APS Press, 1999
- (en) R. Thomas Palo, Charles T. Robbins, Plant Defenses Against Mammalian Herbivory, CRC Press, 1991
Liens externes
- Portail de l’agriculture et l’agronomie
- Portail de la botanique
- Portail de la protection des cultures
