Tanin
Les tanins ou tannins sont des substances de la famille des polyphénols, le plus souvent hydrosolubles, d’origine végétale et qui possèdent la capacité de précipiter les protéines, alcaloïdes et polysaccharides, à partir de leur solution aqueuse[1],[2],[3]. Après la cellulose (35 à 50 % de la biomasse terrestre), l'hémicellulose (30 à 45 %) et la lignine (15 à 25 %), biopolymères constitutifs de la paroi cellulaire végétale, les tanins forment avec leurs dérivés la quatrième famille de composés par ordre d’abondance dans les plantes et dans les écosystèmes terrestres où domine la biomasse végétale morte ou vive[4]. Il en existe une grande diversité, différents par leurs tailles et leurs structures chimiques. Disposés dans les vacuoles et les parois cellulaires, ils représentent moins de 1 % du poids sec des plantes, mais de 15 à 25 % dans les feuilles, et jusqu'à 40 % dans l’écorce, 50 % dans certaines galles[5].
Pour les articles homonymes, voir tanin (homonymie).
Ces métabolites secondaires sont utilisés par les plantes (arbres, plantes à fleur, etc.) comme moyen de défense chimique contre les microbes pathogènes et les herbivores[3]. On les retrouve dans quasiment tout type de partie végétale exposée à des risques de prolifération microbienne (écorces, racines, feuilles, fruits, etc.), et donc, dans certaines boissons comme le thé, le café, la bière, le cidre et le vin.
Les propriétés particulières de ces composés polyphénoliques leur permettent d'être utilisés à des usages divers notamment dans le tannage des peaux, la fabrication des encres ou en pharmacologie [6]. Sur le plan chimique, ils sont constitués soit de polyol (glucose le plus souvent), ou de catéchine ou de triterpénoïde auxquels sont attachées des unités galloyles (en) (ou leurs dérivés), soit d'oligomères, ou de polymères de flavanols.
Histoire

Les tanins sont connus depuis la plus haute Antiquité. Au Moyen Âge, pour la préparation du cuir, on les extrayait d'écorces de chênes ou de châtaigniers qu'on broyait dans des moulins à tan et qu'on commercialisait sous forme de poudre, le tan qui a donné le nom de tanins[7]. Les peaux étaient trempées dans des fosses à tan pendant au moins un an avant d'être travaillées. À la fin du XIXe siècle, l'industrie substitua le chrome au tan.
Le tannage s'obtient en établissant des liaisons entre les fibres de collagène de la peau ce qui a pour conséquence de transformer des peaux fraîches en cuir imputrescible.
La première description chimique des tanins végétaux est redevable au chimiste allemand Emil Fischer (1852-1919) dans les premières décennies du XXe siècle. En 1920, Karl Freudenberg distinguait les tanins hydrolysables, de ceux non-hydrolysables (ou tanins condensés). L'invention de la chromatographie sur papier durant la Seconde Guerre mondiale permit à Bate-Smith de mener un travail considérable d'identification de polyphénols chez les plantes.
Le rôle des tanins dans la défense des plantes contre les herbivores a fait l'actualité, à grand renfort de communication assurée depuis la fin des années 1980 par Jean-Marie Pelt via notamment L'aventure des plantes, les livres de vulgarisation de Francis Hallé et La Vie secrète des arbres de Peter Wohlleben[8], avec l'anecdote sensationnaliste du koudou et l'acacia[9], histoire sujette à caution car non validée par une revue à comité de lecture[8] : dans les années 1980, des milliers de grands koudous élevés dans des game ranches du Transvaal pour les soustraire à une chasse excessive, meurent. En autopsiant ces animaux, le zoologiste Wouter van Hoven de l'université de Pretoria considère que leur mort est due à leur principale source d'alimentation dans ces ranches lors de la sécheresse hivernale, une espèce d'acacia qui, en réponse à l'herbivorie, augmente la concentration en tanins dans ses feuilles jusqu'à des niveaux létaux[10],[11].
Il y aurait actuellement un millier de tanins naturels dont la structure aurait été déterminée de manière non ambiguë[12]. Le biologiste Marc-André Selosse considère les tannins sensu lato, les rattachant à tous les composés polyphénoliques dont les chimistes ont répertorié plus de 9 000 molécules différentes « mais il en existe sans doute de 10 à 100 fois plus dans la nature »[13].
Classification des tanins
Bate-Smith et Swain (1962) définissaient les tanins végétaux comme des composés phénoliques solubles dans l'eau, ayant une masse moléculaire comprise entre 300 et 3000 Da, et qui présentent à côté des réactions classiques des phénols (coloration vert-bleu au test du chlorure ferrique), la propriété de précipiter les alcaloïdes, la gélatine et d'autres protéines.
Les deux catégories de tanins distinguées depuis Freudenberg et Gross, les tanins hydrolysables (gallotanins et ellagitanins) et les tanins condensés, sont d'origines biosynthétiques différentes. On les trouve dans les plantes mais on n'en trouve pas chez les algues ou les animaux. Il existe cependant des tanins particuliers, ou phlorotanins, qui existent chez les algues brunes et les diatomées.
Cette définition n'est plus maintenant complètement valide[12] pour plusieurs raisons :
- on a trouvé des tanins ayant une masse moléculaire très élevée (jusqu'à 20 000 Da) et non hydrosolubles
- il y a des « ellagitanins non hydrolysables » en raison d'un couplage C-C de leurs résidus polyphénoliques avec l'unité polyol (par exemple, la vescalagine du bois de chêne utilisé en tonnellerie)
- une nouvelle classe de tanins a été décrite en 1985 formée par des acides hexahydroxydiphéniques (HHDP) et une unité catéchine C-C couplée avec la partie glycosidique. Cette classe de « tanins complexes » ou « flavanoellagitanins » est formée de composés partiellement hydrolysables.
Il est donc clair que l'opposition hydrolysable/non hydrolysable est un critère de classification peu satisfaisant.
Khanbabae et van Ree[12] proposent de répartir les tanins en quatre classes suivant leurs structures chimiques :
- Les gallotanins sont des tanins formés d'unités galloyles ou de leurs dérivés meta-dépsidiques liées à diverses unités polyol-, flavanol- ou triterpénoïdes
- Les ellagitanins sont des tanins formés d'au moins deux unités galloyles C-C couplées entre elles et sans liaison glycosidique avec des unités flavanols (catéchines).
- Les tanins complexes sont des tanins formés par une unité gallotanin ou ellagitanin comportant une liaison glycosidique à un flavanol
- Les tanins condensés sont des proanthocyanidols comportant des liaisons entre le C-4 d'une unité flavanol et un C-8 (ou C-6) d'une autre flavanol monomère.
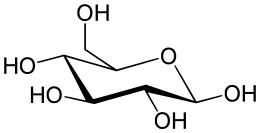 D-glucose |
Les gallotanins ou tanins galliques sont formés autour d'un sucre (glucose ou polyol dérivé du D-glucose) comportant plusieurs liaisons esters avec des acides galliques (ou leurs dérivés) ; les fonctions hydroxy OH des résidus polyoliques sont partiellement ou totalement substitués par des unités galloyles. Les tetra-esters et penta-esters sont les intermédiaires fondamentaux dans la biosynthèse de presque tous les polyphénols hydrolysables naturels. Il peut se constituer des chaînes latérales de plusieurs acides galliques liés selon un mode méta- ou para-dépsidique. |  penta-O-galloyl-D-glucose, précurseurs de nombreux tanins |
 Acide gallique | ||
 HHDP |
Les ellagitanins ou tanins ellagiques sont formés autour d'un sucre (glucose ou polyol dérivé du D-glucose) comportant plusieurs liaisons esters d'acide hexahydroxydiphénique (HHDP) (ou de ses dérivés DHHDP, acide chébulique). Ils sont produits à partir des gallotanins par couplage oxydatif C-2-C-2' d'au moins deux unités galloyles. Avec plus de 500 composés, les ellagitannins forment le groupe le plus important de tanins. Après hydrolyse des liaisons ester, les acides diphéniques libérés se réarrangent spontanément en acide ellagique stable. |  Casuarictine, tiré de l'arbre australien Casuarina stricta |
 (+)-catéchine |
Les tanins complexes sont construits par une unité gallotanin ou ellagitanin comportant une liaison à une catéchine. | 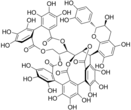 Acutissime |
 numérotation des flavanols numérotation des flavanols |
Les tanins condensés sont des oligomères ou polymères de flavanols. Ils sont constitués d'unités de flavan-3-ols liées entre elles par des liaisons carbone-carbone de type 4→8 ou 4→6. Ils sont non hydrolysables mais traités à chaud par un acide, ils se dégradent en pigments colorés formés d'anthocyanidols. |  Procyanidol B-3, dimère catéchol-(4α→8)-catéchol |
Étymologie et orthographe
Tanin dérive de tan par le suffixe -in*. Le tan est la poudre extraite de l'écorce du chêne qui sert à tanner les peaux. Ce terme de tan est très probablement issu du gaulois *tanno- signifiant « chêne » que l'on peut restituer d'après le breton tann « chêne rouvre » et l'ancien cornique (parlée en Cornouailles jusqu'au XVIIe siècle) tannen « chêne » ou l'ancien irlandais teine « houx »[14]. Cette racine celtique se retrouve dans des toponymes qui évoquent la présence de tanneries ou de chênes : Tanis, Thennes, Thenney, Tannay, Tanay, Theneuil, Theneuille, Thénioux, Tannerre-en-Puisaye, Thenailles et Thenelles mais des confusions sont possibles avec la tanière (tanne) et le mot latin thannus qui désigne un buisson, un tronc d’arbre[15].
En Allemagne, pays un peu moins riche en chênes, tannen désigne les sapins, arbres peu tannifères mais utilisés préférentiellement pour le tannage à partir de la poudre extraite de leur écorce[16].
On dit plutôt du tanin, en parlant du produit utilisable (poudre) et des tanins lorsqu'on évoque la substance organo-chimique générique, car il existe de très nombreux tanins.
Extraction
Les tanins sont solubles dans l'eau sous forme de solutions colloïdales mais leur solubilité diminue lorsque le degré de polymérisation augmente.
L'extraction des tanins[1] est réalisée en général par un mélange d'eau et d'acétone. On élimine ensuite l'acétone par distillation puis les pigments et les lipides par un solvant (comme le dichlorométhane). On extrait de cette solution aqueuse par l'acétate d'éthyle les proanthocyanidols dimères et la plupart des tanins galliques.
Les techniques de chromatographie permettent seules d'obtenir des molécules pures.
L'extraction des tanins se déroule à contre courant d'eau chaude avec un ajout possible d'additif (en faible pourcentage de sulfite, métabisulfite de sodium, bicarbonate de sodium) pour améliorer la solubilité des oligomères.
Ce procédé se déroule en plusieurs étapes[17] :
- Des écorces broyées ou des copeaux de bois riches en tanin sont déposés dans des réservoirs en acier inoxydable, des autoclaves, qui présentent de bonne résistance à la pression.
- De l'eau chaude (entre 70 et 90°C) est projetée à travers les autoclaves.
- On obtient une fine solution aqueuse de tanin.
- Il est possible, en fonction des applications, d'ajouter une étape de sulfitation des tanins. C'est une des réactions les plus anciennes qui permet une viscosité plus faible et une solubilité augmentée et donc une manipulation plus aisée. Il faut cependant noter que cette étape doit être réfléchie en fonction des applications visées. Cette étape rendant le tanin plus sensible à l'humidité, cela peut poser un problème pour des usages dont la tenue à l'eau est nécessaire.
- La solution aqueuse riche en tanin est séchée par atomisation permettant d'atteindre un composé sous forme de poudre possédant une concentration en tanin de l'ordre de 86 % qui est ensuite mis sous sachet.
Le rendement de ce procédé se situe entre 18 et 33 % en fonction des essences des additifs utilisés.
Il est aussi possible d'extraire le tanin à l'aide de solvant mais cette méthode requiert une étape de purification supplémentaire car une multitude d'autres substances sont solubilisées.
Propriétés
Caractéristiques communes
Les molécules de tanins possèdent à des degrés divers[18] :
- une structure de petite taille comportant un ou plusieurs phénols ;
- une odeur, agréable ou non, surtout grâce au cycle aromatique du phénol (coumarine très utilisée en parfumerie, phényléthanol naturellement présent dans les essences de rose, de géranium et dans certains vins comme le gewurztraminer) ;
- une affinité pour les protéines, auxquelles ces molécules se lient réversiblement ou irréversiblement et qu'elles dénaturent (inactivation des protéines de surface des microbes et inhibition de leurs métabolismes par déformation des enzymes, d'où un effet antimicrobien ; inhibition des transcriptases inverses virales, d'où un effet antiviral ; inhibition des enzymes productrices d'espèces réactives de l'oxygène ou stimulation de la synthèse d'enzymes antioxydantes, d'où un effet antioxydant[n 1] ; dénaturation des protéines digestives, d'où un effet laxatif et anti-herbivore[n 2],[19] ; réduction de l'émission d'œufs de parasites dans les fèces, d'où un effet antiparasitaire) ;
- une capacité de s'insérer dans l'ADN (effet mutagène ou antitumoral) ;
- une capacité à absorber la lumière visible et/ou ultraviolette, d'où souvent une couleur (des fruits, des vins) et des rôles photoprotecteurs (marennine, anthocyane) et cryoprotecteurs (antigel contre les gelées tardives)[20],[21] ;
- des réactions d'oxydation ou avec les protéines, à l'origine du brunissement enzymatique ;
- une capacité de s'assembler en macromolécules rigides, imperméables et très résistantes (lignine, un des principaux composants du bois ; sporopollénine, constituant principal de la paroi externe des pollens et des spores ; subérine, substance cireuse ayant un rôle d'imperméabilisant et isolant, sinon ignifugeant).
Propriétés biologiques
Les tanins sont capables de former des complexes avec les macromolécules et particulièrement avec les protéines.
Le collage des vins rouges trop tanniques s'effectue en rajoutant du blanc d'œuf qui en floculant entraîne les particules qui troublent le vin.
Les tanins vacuolaires dans les cellules végétales, en réagissant avec les protéines cytosoliques, expliquent le brunissement enzymatique des fruits[22].
La cuticule joue un rôle protecteur chez les Arthropodes. Elle est durcie par des tanins qui se combinent avec les scléroprotéines de l'exocuticule.
La combinaison avec le collagène de la peau est à l'origine du tannage.
La réaction des tanins des végétaux verts[n 3] et des vins trop jeunes avec les glycoprotéines de la salive est à l'origine de la sensation d'astringence. La faculté de percevoir l'amertume et l'astringence (sensation induite par les tanins qui se complexent avec les protéines salivaires de type mucine et leur font perdre leurs propriétés lubrifiantes) a probablement été sélectionnée au cours de l'évolution pour avertir les herbivores et les omnivores de l’absorption de ces composés potentiellement toxiques, ces sensations pouvant provoquer un rejet de l'aliment par l'animal (anti-appétent), voire l'arc réflexe du vomissement[23]. Les tanins peuvent en effet avoir une toxicité propre mais ils agissent généralement en interférant avec les protéines, soit celles de l'aliment végétal ce qui diminue alors sa digestibilité, soit celles de la salive, soit encore les enzymes digestives (rappel du rôle des tanins des plantes qui interviennent dans leur défense contre les herbivores et les microbes pathogènes) ou les glycoprotéines membranaires au niveau de la muqueuse intestinale qui peuvent être partiellement inhibées[24]. Selon leur concentration (notion de dose efficace et de dose toxique), les tanins ont la capacité à resserrer les tissus et de modifier la perméabilité membranaire par complexation avec leurs chaînes glycoprotéiques, d'où leur usage interne (antidiarrhéique, antitumoral, action anti-inflammatoire, activité antimicrobienne, antifongique et antivirale) et externe (effet hémostatique, cicatrisant)[25],[26],[27].
La complexation[1] peut être réversible quand elle s'effectue par liaison hydrogène et interactions hydrophobes[n 4]. Les tanins condensés (proanthocyanidols) ont une affinité moindre pour les protéines que les esters polygalliques[22].
La complexation peut devenir irréversible lorsque les tanins par autoxydation donnent des O-quinones qui forment des liaisons covalentes[22].
Distribution
Mole[28] (1993) a étudié la distribution des plantes à tanin chez 180 familles des Dicotylédones et 44 familles des Monocotylédones. La majorité des familles de Dicotylédones contiennent des espèces dépourvues de tanin (testé par leur aptitude à précipiter les protéines).
Les familles les plus connues dont toutes les espèces testées contiennent du tanin sont les : Aceraceae, Actinidiaceae, Anarcadiaceae, Bixaceae, Burseraceae, Combretaceae, Dipterocarpaceae, Ericaceae, Grossulariaceae, Myricaceae pour les Dicotylédones et les Najadaceae et Typhaceae pour les Monocotylédones. Pour la famille du chêne, les Fagaceae, 73 % des espèces testées contiennent du tanin. Pour celle des acacias, les Mimosaceae, seul 39 % des espèces testées contiennent du tanin, chez les Solanaceae le taux chute à 6 % et les Compositae à 4 % des espèces. Quelques familles comme les Boraginaceae, Cucurbitaceae, Papaveraceae n'en contiennent aucune.
Plantes à tanin

La plupart des plantes sont diurétiques et cholagogues en raison de leur richesse en petits tannins qui sont assimilés et passent dans le sang puis sont évacués dans la bile produite par le foie et surtout dans l'urine émise par le rein[n 5],[29].
De nombreux végétaux sont riches en tannins : thé vert, plantes à latex (pissenlit, laitue, cannabis)[30].
Écorces à tanin

- Acacia mearnsii De Wild. (Mimosaceae), ou acacia noir[31] est un arbre originaire du sud-est de l'Australie qui a été introduit dans toutes les régions tropicales et subtropicales. Il existe de grandes plantations commerciales en Afrique (Kenya, Afrique du Sud, Zimbabwe). L'acacia noir est devenu la principale source mondiale d'écorce à tanin.
- L'écorce contient de 30 à 40 % de tanin de haute qualité (en matière sèche). Ce sont des proanthocyanidols (tanins condensés) formés d'une quarantaine de composés, principalement des polymères de (+)-catéchine, (-)-robinetinidol et de (+)-gallocatéchine. Ce tanin sert au tannage de gros objets en cuir ou de semelles de cuir pour les chaussures. Il est aussi utilisé pour la préparation de colles de tanin formaldéhyde pour le contreplaqué ou les bois agglomérés ou stratifiés.
Plantes à tanin médicinales
- Chênes, Quercus spp. : le tanin officinal[1] peut être préparé à partir des galles de Quercus infectoria, un chêne méditerranéen. La galle est produite par les tissus de l'arbre en réaction à la ponte d'œufs par une petite guêpe cécidogène Cynips (Hyménoptère). Elle est riche en esters galliques du glucose : m-depsides du pentagalloylglucose, pédanculagine, telligrandine, etc. et des acides galliques et ellagiques libres. Elle est utilisée (par voie externe) contre certaines maladies inflammatoires de la peau et des muqueuses.
- Chênes, hêtres : les jeunes feuilles de hêtre, les écorces et les fruits de ces deux types d'arbres, consommés à doses modérées, étaient utilisés pour leurs propriétés médicinales. Leur richesse en tanins, flavonoïdes et mucilages était censée soulager les bronches, les maux de gorge et des troubles digestifs (notamment les parasites intestinaux chez les ruminants). Cet usage médicinal s'est perdu car les tanins leur confèrent une saveur amère et astringente, les rendant immangeables à moins de les faire bouillir à plusieurs eaux. En revanche à hautes doses (à l'exception des faînes doux des hêtres, dépourvus de tanins, comme les glands doux des chênes méditerranéens), les tanins hydrolysables ingérés sont métabolisés par l'organisme en acide gallique et en pyrogallol responsable d'effets rapidement toxiques : constipation, lésions hépatiques et rénales, troubles neurologiques[32].
Boissons tirées de plantes à tanins
- Vin : on trouve deux types de tanins ayant une origine différente. Les tanins condensés viennent du raisin, les ellagitanins viennent du bois de chêne des fûts ou des tanins commerciaux additionnés aux vins, conformément à la législation. Des tanins extraits de la noix de galle, du quebracho, du chêne et du châtaignier sont additionnés pendant la phase de vinification, alors que des tanins extraits des pépins et pellicules de raisin sont ajoutés pendant la phase d'affinage du vin[33].
Utilisations
On emploie les tanins pour protéger le cuir, car ils transforment les protéines contenues dans le cuir en produits insolubles résistant à la décomposition organique. La principale utilisation du tanin est le tannage (comme son nom l'indique) des peaux. Les tanins confèrent aux cuirs leurs qualités d'imputrescibilité qui ont fait la richesse de la mégisserie à Mazamet en particulier, mais aussi à Graulhet ou Millau.
Autres utilisations :
- encres (par réaction avec des sels ferriques) ;
- teinture d'étoffes ;
- encollage du papier ou de la soie ;
- coagulation du caoutchouc ;
- clarification des vins et des bières ;
- recherchés également pour leurs propriétés antioxydantes (après couplage avec d'autres chaînes carbonées) ;
- développement de résines époxy issues de ressources renouvelables[34].
Pharmacopée
Au niveau biochimique, ce sont des composés phénoliques faisant précipiter les protéines. Lorsqu'il s'agit de celles de la salive, la lubrification de la bouche fait alors défaut, expliquant la sensation d'assèchement.
Certains tanins auraient des propriétés antioxydantes, expliquant certains effets bénéfiques du jus de raisin et du vin sur la santé (protection cardio-vasculaire) à doses modérées. Ils stopperaient également le développement des microbes.
Les phénols interviennent dans les caractères organoleptiques du vin (saveur, astringence, dureté), dans les problèmes d’hygiène alimentaire (effet vitaminique P et effet bactéricide) et dans les transformations du vin (traitements et vieillissement). En particulier, ces substances, qui proviennent de la partie solide de la grappe, sont responsables de toutes les différences entre les vins blancs et les vins rouges.
Les tanins du thé ont des effets sur l'assimilation du fer, la rendant moins efficace.
L'acide tannique est utilisé en médecine externe[précision nécessaire] comme astringent antidiarrhéique.
Notes et références
- Notes
- Cet effet explique l'utilisation d'épices, de gallates obtenus à partir d'un tannin de galle et désormais produits chimiquement (exemples : additifs tels que E310, E311 et E312).
- Cet effet explique que l'homme ait sélectionné des plantes domestiques moins tanniques depuis la révolution néolithique, ce qui a conduit au développement de pesticides pour aider les plantes dont on a réduit les défenses chimiques contre les herbivores. À l'inverse, la culture de plantes dans des conditions de stress biotiques et abiotiques (stress hydrique chez la vigne taillée en trogne, stress de la vie montagnarde — froid, rayonnement solaire — des thés d'altitude, sécheresse pour de nombreuses épices) induit la concentration de tannins aux effets antimicrobiens et antibiotiques. Ces propriétés sont utilisées pour protéger les boissons des microbes contaminants (lupuline de l'houblon de la bière, tannins du raisin ou du tonneau pour le vin, la fermentation de ces boissons contribuant aussi à limiter le développement de ces microbes ; infusions tels que les thés — chai, thé noir — ou les matés plus épicés dans le pays chauds, café arabe à la cardamome).
- À maturité, juste avant la phase de sénescence, les fruits amers deviennent doux car leurs tanins vacuolaires, ont attaqué les protéines cytosoliques à la rupture du tonoplaste.
- Les interactions hydrophobes se produisent par exemple entre électrons π des cycles des tannins et des radicaux hydrophobes des acides aminés. Les interactions hydrophobes (liaison hydrogène) impliquent les groupements hydroxyles des phénols et l’oxygène du lien peptide ou d’amides tertiaires, comme dans la proline).
- « Dans ces deux organes, ils subissent des modifications qui, d'une part, altèrent leur structure (et donc leur toxicité potentielle) et, d'autre part, les rendent plus solubles dans l'eau (par exemple, par des oxydations, par l'ajout d'un autre hydroxyle, d'un sulfate, d'un sucre, voire d'un acide uronique, c'est-à-dire sucre modifié très soluble »
- Références
- Bruneton, J., Pharmacognosie - Phytochimie, plantes médicinales, 4e éd., revue et augmentée, Paris, Tec & Doc - Éditions médicales internationales, , 1288 p. (ISBN 978-2-7430-1188-8).
- (en) T. Ozcan, A. Akpinar-Bayizit, L. Yilmaz-Ersan et B. Delikanli, « Phenolics in Human Health », International Journal of Chemical Engineering and Applications, Vol. 5, No. 5, , p. 2 (lire en ligne [PDF]).
- « Qu'est-ce que le tanin ? », sur blog.laruedesartisans.com (consulté le ).
- (en) Commission of the European Communities, Biomass for energy, UK Section of the International Solar Energy Society, , p. 73.
- (en) J.B. Harborne, Methods in plant biochemistry, Academic Press, , p. 389-419.
- « Tanin, Tannin », sur cnrtl.fr (consulté le ).
- Pierre Avenas, Henriette Walter, La majestueuse histoire du nom des arbres, Robert Laffont, , p. 204.
- Adrien Delattre, « Le koudou et l’acacia : histoire et analyse critique d’une anecdote », sur tela-botanica.org, (consulté le ).
- (en) Edward E. Farmer, Leaf Defence, OUP Oxford, , p. 87.
- (en) Wouter van Hoven, « Trees’ secret warning system against browsers », Custos, vol. 13, no 5, , p. 11‐16.
- (en) Wouter van Hoven, « Mortalities in Kudu (Tragelaphus Strepsiceros) Populations Related to Chemical Defence in Trees », Journal of African Zoology, vol. 105, no 2, , p. 141‐145.
- Karamali Khanbabaee, Teunis van Ree, « Tannins : classification and definition », Nat. Prod. Rep., vol. 18, , p. 641-649 (DOI: 10.1039/b1010611).
- Selosse 2019, p. 28.
- CNRTL.
- Roger Brunet, Trésor du terroir. Les noms de lieux de la France, CNRS éditions, , p. 88
- Marc-André Selosse, Les Goûts et les couleurs du monde. Une histoire naturelle des tannins, de l'écologie à la santé, Actes Sud Nature, , p. 47
- Antonio PIZZI, « Valorisation industrielle des tanins », Technique de l'ingénieur, .
- Selosse 2019, p. 30.
- Selosse 2019, p. 42.
- (en) Wang D, Kasuga J, Kuwabara C, et al. Presence of supercooling-facilitating (anti-ice nucleation) hydrolyzable tannins in deep supercooling xylem parenchyma cells in Cercidiphyllum japonicum. Planta. 2012;235:747–759.10.1007/s00425-011.
- (en) Kuwabara C, Wang D, Endoh K, et al. Analysis of supercooling activity of tannin-related polyphenols. Cryobiology. 2013;67:40–49.10.1016/j.cryobiol.2013.04.008.
- Les tannins [PDF], fiche de Marc-André Selosse, Institut de Systématique, Évolution, Biodiversité du Muséum national d’Histoire naturelle de Paris.
- (en) Georg G. Gross, Richard W. Hemingway, Takashi Yoshida, Plant Polyphenols : Chemistry, Biology, Pharmacology, Ecology, Springer, , p. 877.
- Jean-Jacques Macheix, Annie Fleuriet, Christian Jay-Allemand, Les composés phénoliques des végétaux, PPUR presses polytechniques, , p. 88.
- Mamadou Biaye, Actions pharmacologiques des tanins [PDF], thèse de Pharmacie Université de Dakar, 2002, p.15-28.
- (en) Manuchair Ebadi, Pharmacodynamic Basis of Herbal Medicine, CRC Press, , p. 665-666.
- (en) Kerry Bone et Simon Mills, Principles and Practice of Phytotherapy : E-Book : Modern Herbal Medicine, Elsevier Health Sciences, (lire en ligne), p. 35-38.
- Simon Mole, « The Systematic Distribution of Tannins in the Leaves of Angiosperms: A Tool for Ecological Studies », Biochemical Systematics and Ecology, vol. 21, no 8, , p. 833-846.
- Selosse 2019, p. 102.
- Selosse 2019, p. 88-90.
- Paulos Cornelis Maria Jansen, Dominique Cardon, Colorants et tanins, Fondation PROTA/Backhuys Pub./CTA Wageningen, .
- François Couplan, Eva Styner, Guide des plantes sauvages comestibles et toxiques, Delachaux et Niestlé, , p. 32-33.
- Institut français de la vigne et du vin -- Les tannins ou tanins œnologiques, visite du 17 novembre 2012.
- [(fr) Nouveau Procédé d'élaboration de résines thermodurcissables epoxy, lire en ligne sur Google Patents].
Voir aussi
Bibliographie
- Marc-André Selosse (ill. Arnaud Rafaelian), Les Goûts et les couleurs du monde : Une histoire naturelle des tannins, de l'écologie à la santé, Arles, Actes Sud, coll. « Nature », , 352 p. (ISBN 978-2-330-12677-3 et 2330126778, OCLC 1126402280, présentation en ligne).
Liens externes
- « Les tannins, des molécules aux propriétés insoupçonnées » [audio], Du Vent dans les synapses, sur France Inter, .
- Portail de la chimie
- Portail de la vigne et du vin
- Portail de la pharmacie
- Portail de la médecine
- Portail des couleurs