Dioxyde de silicium
Le dioxyde de silicium, ou silice, est un composé chimique de formule SiO2. Il s'agit d'un solide incolore présent en abondance dans le milieu naturel et chez divers êtres vivants. Il existe à l'état libre sous différentes formes cristallines ou amorphes, et combiné chimiquement avec d'autres oxydes dans les silicates, qui sont les principaux constituants de l'écorce terrestre et du manteau terrestre. Libre ou combiné, il représente 60,6 % de la masse de la croûte continentale[9]. Il est particulièrement abondant sous forme de quartz, notamment dans les granites. Il existe également sous forme de matériau synthétique, comme le verre de quartz, la silice pyrogénée, le gel de silice et les aérogels. Il est utilisé comme matériau structurel, en microélectronique, comme isolant électrique, ainsi que comme ingrédient pour l'industrie pharmaceutique et l'industrie agroalimentaire.
| Dioxyde de silicium | ||
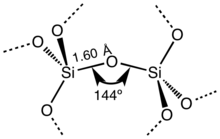 | ||
| Image supérieure : formule de Lewis du dioxyde de silicium. Image inférieure : motif structurel de base de la plupart des polymorphes du dioxyde de silicium qui forme des assemblages de tétraèdres SiO4 liés les uns aux autres par leurs sommets, chaque atome d'oxygène étant commun à deux tétraèdres, d'où la formule générale de SiO2[alpha 1]. |
||
| Identification | ||
|---|---|---|
| Synonymes |
silice |
|
| No CAS | : silice précipitée : silice amorphe : stishovite : coésite : cristobalite : quartz : tridymite : keatite : verre de quartz : gel de silice : fumée de silice : silice pyrogénée |
|
| No ECHA | 100.028.678 | |
| No CE | 231-545-4 : silice amorphe 238-455-4 : cristobalite 238-878-4 : quartz 239-487-1 : tridymite 262-373-8 : verre de quartz 273-761-1 : fumée de silice 601-214-2 : gel de silice 604-037-9 : stishovite 920-837-3 : verre |
|
| No RTECS | VV7325000 : cristobalite VV7330000 : quartz VV7335000 : tridymite |
|
| PubChem | 24261 | |
| ChEBI | 30563 | |
| No E | E551 | |
| SMILES | ||
| InChI | ||
| Apparence | solide incolore cristallisé, parfois amorphe, pratiquement insoluble dans l'eau[1] | |
| Propriétés chimiques | ||
| Formule | O2Si |
|
| Masse molaire[2] | 60,0843 ± 0,0009 g/mol O 53,26 %, Si 46,74 %, |
|
| Propriétés physiques | ||
| T° fusion | 1 730 °C[1] | |
| T° ébullition | 2 230 °C[3] | |
| Solubilité | 10 mg·L-1 à 25 °C (quartz)[4] | |
| Masse volumique | 2,334 g·cm-3[1] | |
| Propriétés optiques | ||
| Indice de réfraction | 1,458 pour λ=589 nm dans la silice amorphe en couche mince[5] | |
| Précautions | ||
| SGH[6] | ||
  |
||
| NFPA 704[6] | ||
| Classification du CIRC | ||
| Groupe 1 : cancérogène pour l'homme[7] (silice cristalline inhalée sous forme de quartz ou de cristobalite de source professionnelle)
Groupe 3 : inclassable quant à sa cancérogénicité pour l'Homme[8] (silice amorphe) |
||
| Unités du SI et CNTP, sauf indication contraire. | ||
L'inhalation de silice cristallisée finement divisée est toxique et peut conduire à des inflammations graves des poumons, à la silicose, à des bronchites, au cancer du poumon et à des maladies auto-immunes comme le lupus érythémateux disséminé et la polyarthrite rhumatoïde. L'absorption de dioxyde de silicium amorphe a été déclarée ne provoquer que de brèves inflammations réversibles[10]., mais les dernières recherches semblent infirmer cette affirmation, et l'ANSES appelle à "un encadrement réglementaire renforcé" de toutes les nanoparticules[11].
Propriétés physiques
Diagramme de phases
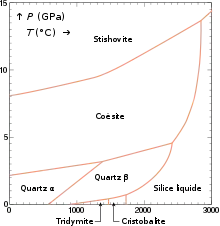
Dans les conditions normales de température et de pression (T = 0 °C, P = 0,1 MPa), le dioxyde de silicium à l'équilibre est sous la forme de quartz α, un matériau cristallin de structure trigonale (Z = 3 motifs SiO2 par maille).
À basse pression (P < 500 MPa) et température T croissante, la phase stable est successivement :
- le quartz α, trigonal (Z = 3) ;
- le quartz β, hexagonal (Z = 4) ;
- la tridymite, triclinique (Z = 320[alpha 2]) ;
- la cristobalite, tétragonale (Z = 4) ;
- la silice liquide (à partir de 1 703 °C à pression atmosphérique) ;
- la vapeur de silice (au-dessus de 2 950 °C à pression atmosphérique).
À basse température (T < 600 °C) et pression P croissante, la phase stable est successivement :
- le quartz α, trigonal (Z = 3) ;
- la coésite, monoclinique (Z = 16) ;
- la stishovite, tétragonale (Z = 2).
Les transitions de phase du diagramme sont du premier ordre, à l'exception de la transition quartz α ↔ quartz β (du deuxième ordre), qui est displacive (elle se fait par simple déplacement des atomes sans rupture de liaisons chimiques) ; pour cette raison elle ne nécessite pas de nucléation, et le quartz β ne peut pas être trempé à basse température.
Dans toutes les phases ci-dessus chaque atome de silicium est au centre d'un tétraèdre [SiO4], à l'exception de la vapeur de silice (molécules SiO2) et de la stishovite, dans laquelle le nombre de coordination du silicium est 6 (octaèdres [SiO6]).
Formes cristallines
Le dioxyde de silicium est un solide incolore relativement dur (7,0 sur l'échelle de Mohs pour le quartz) qui existe aussi bien sous forme cristallisée que sous forme amorphe. Sa masse volumique vaut 2,648 g/cm3 pour le quartz α, mais 2,196 g/cm3 pour le SiO2 amorphe[13]. Il est transparent dans tout le spectre visible, d'où ses applications en optique, avec un indice de réfraction voisin de 1,46. Il est en revanche moins transparent dans l'infrarouge, ce qui explique en partie l'avantage procuré en horticulture par l'emploi de serres[alpha 3]. C'est un bon isolant électrique, avec une résistivité de 1012 à 1016 Ω cm pour les formes cristallisées, et supérieure à 1018 Ω cm pour les formes amorphes[16]. Sa conductivité thermique vaut respectivement 1,3 et 1,4 W m−1 K−1, et son coefficient de Poisson respectivement 0,17 et 0,165 pour les formes cristallines et amorphes.
Dans la majorité des silicates, les atomes de silicium présentent une coordination tétraédrique, avec quatre atomes d'oxygène entourant un atome de silicium central. Les polymorphes du quartz sont des exemples de telles structures, qui forment un réseau tridimensionnel dans lequel chaque atome de silicium est lié par covalence à quatre atomes d'oxygène de manièe tétraédrique.
Par exemple, dans la maille cristalline du quartz α, le tétraèdre central partage ses quatre sommets, formés chacun d'un atome d'oxygène, tandis que les deux tétraèdres à faces centrées partagent deux de leurs quatre sommets, et que les quatre tétraèdres à arêtes centrées ne partagent que l'un de leurs atomes d'oxygène avec des tétraèdres SiO4 voisins. Ce sont ainsi 12 atomes d'oxygène sur les 24 que comptent les 7 tétraèdres de la maille élémentaire du quartz α qui sont partagés entre deux tétraèdres adjacents.
La seule forme stable de dioxyde de silicium aux conditions normales de température et de pression est le quartz α, qui est la forme cristalline la plus commune du SiO2. Les impuretés dans le réseau du cristal peuvent donner à ce dernier différentes couleurs. La transition entre le quartz α et le quartz β se produit à 573 °C de manière abrupte. Comme cette transition s'accompagne d'une augmentation sensible du volume du cristal, elle peut aisément fracturer les roches ou les céramiques contenant du dioxyde de silicium franchissant cette température[17].
Minéraux des hautes températures, la cristobalite et la tridymite ont une masse volumique et un indice de réfraction inférieurs à ceux du quartz α. En revanche, la seifertite, la stishovite et la coésite, qui sont des minéraux des hautes pressions, ont une masse volumique et un indice de réfraction supérieurs à ceux du quartz α[18].
Hormis la stishovite et les fibres de silice, tous les polymorphes du dioxyde de silicium cristallisé sont constitués de tétraèdres SiO4 unis par certains de leurs sommets dans différentes configurations tridimensionnelles. La longueur de la liaison Si–O varie selon les formes cristallines. Dans le quartz α, par exemple, elle vaut 161 pm, tandis qu'elle vaut de 154 à 171 pm dans la tridymite α. L'angle de liaison Si–O–Si varie également de 140° pour la tridymite α à 180° pour la tridymite β, tandis qu'il vaut 144° pour le quartz α[19].
Les fibres de silice présentent une structure semblable à celle du disulfure de silicium SiS2, avec des chaînes de tétraèdres partageant certaines de leurs arêtes. La stishovite, forme stable à haute pression, présente en revanche une structure de type rutile, dans laquelle les atomes de silicium sont hexacoordonnés. La masse volumique de la stishovite est de 4,287 g·cm-3, bien supérieure à celle du quartz α, qui n'est que de 2,648 g·cm-3[20]. Cette différence de masse volumique est à mettre en relation avec la variation de coordinence, car les liaisons Si–O sont plus longues dans la stishovite — quatre liaisons équatoriales de 176 pm et deux liaisons polaires de 181 pm — que dans le quartz α : quatre liaisons tétraédriques de 161 pm[21].
La faujasite est une autre forme de silice cristalline. On l'obtient par désalumination de zéolithes Y ultra stables à basse teneur en sodium à l'aide d'un traitement thermique en présence d'un acide. Le produit résultant contient plus de 99 % de silice ayant une forte cristallinité et une surface spécifique élevée (plus de 800 m2·g-1). C'est un matériau très stable vis-à-vis de la température et des acides. Il conserve notamment se cristallinité et son haut degré d'ordre moléculaire à grande distance après avoir été placé dans de l'acide chlorhydrique concentré bouillant[22].
| Polymorphe | Structure | Système, Pearson, no de groupe d'espace |
ρ g·cm–3 |
Remarques |
|---|---|---|---|---|
| Quartz α | 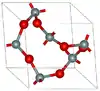 |
Trigonal rhomboédrique hP9, P3121 no 152[23] |
2,648 | Chaînes hélicoïdales rendant les monocristaux optiquement actifs. Le quartz α se transforme en quartz β à 846 K. |
| Quartz β | 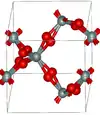 |
Hexagonal hP18, P6222, no 180[24] |
2,533 | Étroitement apparenté au quartz α, avec un angle Si–O–Si de 155° et optiquement actif. Le quartz β se transforme en tridymite β à 1 140 K. |
| Tridymite α | 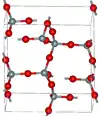 |
Orthorhombique oS24, C2221, no 20[25] |
2,265 | Métastable à pression atmosphérique. |
| Tridymite β | 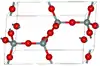 |
Hexagonal hP12, P63/mmc, no 194[25] |
Étroitement apparentée à la tridymite α. La tridymite β se transforme en cristobalite β à 2 010 K. | |
| Cristobalite α | 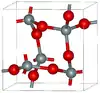 |
Tétragonal tP12, P41212, 92[26] |
2,334 | Métastable à pression atmosphérique. |
| Cristobalite β | 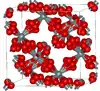 |
Cubique cF104, Fd3m, no 227[27] |
Étroitement apparentée à la cristobalite α. Fond à 1 978 K. | |
| Keatite | 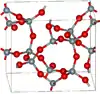 |
Tétragonal tP36, P41212, no 92[28] |
3,011 | Cycles Si5O10, Si4O14 et Si8O16. Produit à partir de verre de quartz et d'alcalis de 600 à 900 K et de 40 à 400 MPa. |
| Moganite | 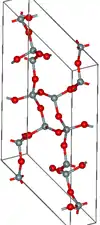 |
Monoclinique mS46, C2/c, no 15[29] |
Cycles Si4O8 et Si6O12. | |
| Coésite | 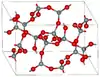 |
Monoclinique mS48, C2/c, no 15[30] |
2,911 | Cycles Si4O8 and Si8O16. Formation à 900 K et de 3 à 3,5 GPa. |
| Stishovite | 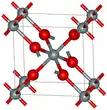 |
Tétragonal tP6, P42/mnm, no 136[31] |
4,287 | L'une des formes de dioxyde de silicium les plus denses, de masse volumique à peine inférieure à celle de la seifertite. Structure cristalline de type rutile avec du silicium hexacoordonné. Formation de 7,5 à 8,5 GPa. |
| Seifertite | 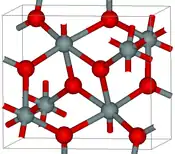 |
Orthorhombique oP, Pbcn[32] |
4,294 | L'une des formes de dioxyde de silicium les plus denses, de masse volumique légèrement supérieure à celle de la stishovite. Elle se forme à des pressions supérieures à 40 GPa[33]. |
| Mélanophlogite |  |
Cubique (cP*, P4232, no 208)[34] ou tétragonal (P42/nbc)[35] | 2,04 | Cycles Si5O10, Si6O12. Présent avec des hydrocarbures dans les espaces interstitiels[36]. |
| Silice fibreuse[20] | 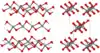 |
Orthorhombique oI12, Ibam, no 72[37] |
1,97 | Structure semblable à celle du disulfure de silicium SiS2 constituée de chaînes de tétraèdres SiO4 unis par certaines de leurs arêtes. Il fond à environ 1 700 K |
| Silice 2D[38] | 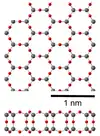 |
Hexagonal | Structure en bicouches de feuillets de silice hexagonale. |
Formes non cristallines ou biologiques
Il existe une grande variété de minéraux constitués d'une fraction plus ou moins importante de SiO2 amorphe. Le principal d'entre eux est l'opale, qui est un hydrate de dioxyde de silicium amorphe dont l'eau représente généralement entre 6 et 10 % de la masse, les valeurs extrêmes allant de 3 à 21 %. La geysérite est une variante d'opale formée autour des sources chaudes et des geysers.
Certaines roches siliceuses sont d'origine biologique, comme les radiolarites et les diatomites, comme le kieselguhr, formées par diagenèse à partir de squelettes de myriades de radiolaires, de frustules de diatomées, d'éponges siliceuses, voire de thèques d'amibes testacées[39]. D'autres, comme le silex et le grès, sont des roches sédimentaires plus ou moins cristallines, le silex étant généralement qualifié de cryptocristallin tant ses cristaux de quartz sont petits et agencés de manière désordonnée.
De la silice amorphe se forme également à partir de silice cristalline fondue et refroidie rapidement. On en trouve ainsi dans diverses roches volcaniques, comme l'obsidienne et la tachylite, ou encore dans les éjectas issus de cratères d'impacts, comme les tectites. Une variété particulière de telles roches se forme à partir de sols siliceux frappés par la foudre : les fulgurites et la lechateliérite.
Les plantes produisent des phytolithes dont certains sont constitués de dioxyde de silicium. Dans la mesure où les phytolithes riches en SiO2, qui favorisent l'usure des dents et des mandibules, se rencontrent notamment dans les herbes consommées comme pâturage (graminées) par divers herbivores allant des insectes aux ongulés, on pense qu'il s'agit d'un mécanisme de défense développé par ces plantes pour limiter leur consommation[40],[41]. On trouve également de la silice dans les cendres de balle de riz, qui peut être utilisée en filtration et dans la fabrication de ciments.
Du SiO2 moléculaire à géométrie moléculaire linéaire O=Si=O est produit lorsque du monoxyde de silicium SiO est condensé dans une matrice d'argon cryogénique refroidie à l'hélium liquide en présence d'atomes d'oxygène libérés par décharge micro-onde. Du dioxyde de silicium dimérique (SiO2)2 a été obtenu en faisant réagir des molécules d'oxygène O2 avec du monoxyde de silicium dimérique (SiO)2. Le dioxyde de silicium dimérique présente deux atomes d'oxygène pontants entre les atomes de silicium avec un angle Si–O–Si de 94° et une longueur de liaison de 164,6 pm, tandis que la liaison Si–O terminale a une longueur de 150,2 pm.
Silice liquide
À l'état liquide, le dioxyde de silicium présente certaines propriétés semblables à celles de l'eau, comme un coefficient de dilatation thermique négatif, un maximum de masse volumique autour de 5 000 °C, ainsi qu'un minimum de capacité thermique[42]. Sa masse volumique décroît de 2,08 g·cm-3 à 1 950 °C jusqu'à 2,03 g·cm-3 à 2 200 °C[43].
Propriétés chimiques
La solubilité du dioxyde de silicium dans l'eau dépend fortement de sa forme cristalline. Elle est bien plus élevée pour la silice amorphe que pour le quartz — 120 et 10 mg·L-1 à 25 °C respectivement[4] — et est maximum à 340 °C avec 1 660 mg·kg-1 à pression de vapeur saturante[44] ; cette propriété est mise à profit pour faire croître des monocristaux de quartz par procédé hydrothermal dans lequel du quartz naturel est dissous dans de l'eau surchauffée dans un récipient pressurisé qui est refroidi par le haut : on peut obtenir des cristaux de 0,5 à 1 kg sur une période de un à deux mois[19]. De tels cristaux de quartz très purs peuvent être utilisés pour des applications électroniques[20]. La solubilité du SiO2 est encore plus élevée dans l'eau supercritique, atteignant 20 % à 500 °C et 1 000 bar.
Le SiO2 dissous dans l'eau forme un acide silicique H4SiO4, qui est un acide faible, avec un maximum de 120 mg·L-1 à 25 °C dans l'eau purifiée. Cette valeur augmente avec la température, la pression, mais aussi le pH, les solutions basiques favorisent en effet la formation d'ions silicate SiO44–. L'acide silicique forme des suspensions colloïdales dans l'eau en lui conférant une certaine opacité. C'est le cas dans l'eau des geysers, comme celui de Geysir en Islande. Pour une concentration donnée en silice colloïdale, la couleur bleue est d'autant plus intense que l'eau est plus froide, la solubilité de l'acide silicique y étant alors plus faible.
Le dioxyde de silicium peut donner du silicium par réaction carbothermique dans des fours à arc à plus de 2 000 °C selon la réaction :
Le fluor F2 réagit avec le dioxyde de silicium pour former du tétrafluorure de silicium SiF4 en libérant de l'oxygène O2, tandis que les autres halogènes (chlore Cl2, brome Br2 et iode I2) ne réagissent pas avec lui[20].
Le dioxyde de silicium est attaqué par l'acide fluorhydrique HF pour donner de l'acide hexafluorosilicique[19] H2SiF6, réaction utilisée notamment dans l'industrie des semi-conducteurs pour graver ou retirer des couches minces de SiO2 :
- SiO2 (s) + 6 HF (aq) ⟶ H2SiF6 (aq) + 2 H2O.
Le dioxyde de silicium est un oxyde acide au sens de Lux-Flood, qui réagit avec les oxyde basiques pour donner des silicates, par exemple sous forme d'ions métasilicate SiO32–, analogues à l'ion carbonate CO32–, et orthosilicate SiO44–. Ainsi, l'oxyde de calcium CaO réagit avec le dioxyde de silicum et donne des silicates de calcium, par exemple de la wollastonite CaSiO3 :
La présence ubiquitaire de silicates parmi les minéraux fait du silicium le deuxième élément chimique le plus abondant de l'écorce terrestre, après l'oxygène.
Le dioxyde de silicium est dissous dans les bases concentrées à chaud ou les hydroxydes de métaux alcalins fondus, comme le montre par exemple cette équation idéalisée :
Le dioxyde de silicium neutralise les oxydes métalliques basiques comme l'oxyde de sodium Na2O, l'oxyde de potassium K2O, l'oxyde de plomb(II) PbO ou l'oxyde de zinc ZnO, formant des silicates et des verres alors que les liaisons Si–O–Si sont progressivement rompues[19]. Ainsi, la réaction de l'oxyde de sodium et du dioxyde de silicium peut produire de l'orthosilicate de sodium Na4SiO4, du silicate de sodium Na2SiO3 et des verres, selon les proportions des réactifs :
Certains de ces verres ont une importance commerciale, par exemple le verre sodocalcique (avec du carbonate de sodium Na2CO3 et de l'oxyde de calcium CaO), le verre borosilicate (avec du carbonate de sodium Na2CO3 et du sesquioxyde de bore B2O3) et le cristal (avec de l'oxyde de plomb(II) PbO).
Le dioxyde de silicium réagit à chaud avec le silicium pour donner du monoxyde de silicium SiO :
Cycle biogéochimique de la silice
Parmi les services écosystémiques fournis par les éponges siliceuses (et les radiolaires), figure leur rôle dans le cycle océanique de la silice. Alors que l'océan reçoit en continu de la silice d'origine terrigène, l'enfouissement des squelettes siliceux (forme particulièrement insoluble de la silice biogénique) joue un rôle majeur dans le cycle géochimique (en) de la silice océanique[45].
On a longtemps cru que le cycle marin du Si était à l'équilibre grâce à l'enfouissement de squelettes siliceux d'algues (diatomées) ou à leur transformation en argile authigénique (phénomène dit d'« altération inverse », mais il a été démontré que les glaciers et eaux souterraines apportent un surplus de silice à l'océan mondial[45]. La digestion chimique d'échantillons de sédiments et leur examen au microscope montrent que le rôle de l'enfouissement de squelettes insolubles d'éponges a été très sous-estimé dans les inventaires biogéochimiques. Les éponges siliceuses sont maintenant considérées comme étant le premier puits de silice marin[45].
Production
Le dioxyde de silicium provient essentiellement de l'exploitation minière, y compris de l'extraction de sable et de la purification du quartz.
Fumée de silice
La fumée de silice est obtenue comme sous-produit de procédés à chaud comme la production de ferrosilicium. Elle est moins pure que la silice pyrogénée et ne doit pas être confondue avec elle, ses propriétés physiques et ses applications étant également différentes.
Silice pyrogénée
La silice pyrogénée est une forme de silice pulvérulente ou colloïdale obtenue en faisant brûler du tétrachlorure de silicium SiCl4 dans une flamme d'hydrogène H2 riche en oxygène[20] O2 :
Silice précipitée
La silice précipitée est une forme amorphe de dioxyde de silicium obtenue par acidification de solutions de silicate de sodium Na2SiO3. Il se forme un précipité gélatineux, ou gel de silice, d'abord lavé puis déshydraté pour donner de la silice microporeuse[20]. L'équation idéalisée faisant intervenir un trisilicate de sodium Na2Si3O7 et l'acide sulfurique H2SO4 peut être résumée ainsi :
De l'ordre d'un million de tonnes de silice ont été produits de cette manière en 1999, destinés essentiellement à l'utilisation dans des matériaux composites (pneus et semelles de chaussures)[46].
Sur circuits intégrés
Des couches minces de dioxyde de silicium se développent spontanément sur les wafers de silicium par oxydation thermique, en donnant une couche très fine d'environ 1 nm d'oxyde natif[47]. Il est possible de faire croître des couches de dioxyde de silicium sur du silicium, par exemple à des températures de 600 à 1 200 °C en utilisant de l'oxygène (oxydation sèche) ou de l'eau (oxydation humide)[48],[49] :
Cette couche d'oxyde natif est utile en microélectronique car elle agit comme isolant électrique avec une grande stabilité chimique. Elle peut protéger le silicium, permettre d'accumuler une charge électrique (condensateur), bloquer le courant électrique, voire réguler l'intensité du courant.
Procédés particuliers ou de laboratoire
De nombreux procédés aboutissant au dioxyde de silicium partent de composés organosiliciés comme l'hexaméthyldisiloxane[50] O[Si(CH3)3]2 (HMDSO) et l'orthosilicate de tétraéthyle Si(OEt)4 (TEOS). Ainsi, le simple chauffage du TEOS de 680 à 730 °C donne du dioxyde de silicium :
De même, le TEOS brûle vers 400 °C :
- Si(OC2H5)4 + 12 O2 ⟶ SiO2 + 10 H2O + 8 CO2.
Le TEOS est hydrolysé par procédé sol-gel. Le déroulement de la réaction et la nature du produit dépendent des catalyseurs, mais l'équation idéalisée peut s'écrire[51] :
Le dioxyde de silicium étant un composé très stable, il apparaît au cours de nombreuses réactions chimiques. Ainsi, la combustion du silane SiH4 donne du dioxyde de silicium de la même manière que la combustion du méthane CH4 donne du dioxyde de carbone CO2 :
Le dépôt chimique en phase vapeur (CVD) de SiO2 à la surface de cristaux à partir de silane a été réalisé dans un flux d'azote N2 à une température de 200 à 500 °C[52].
Applications
Utilisations structurelles
De l'ordre de 95 % du dioxyde de silicium (sable) produit est consommé dans l'industrie du BTP, par exemple pour la production de béton de ciment (ciment Portland)[46]. Le dioxyde de silicium est le principal composant des moulages en sable utilisés pour la réalisation de pièces métalliques en ingénierie et autres applications technologiques. Le point de fusion élevé de la silice est particulièrement utile dans cet usage.
La silice cristallisée est utilisée en fracturation hydraulique de formations géologiques contenant du pétrole de réservoirs étanches et du gaz de schiste.
Production de verre et de silicium
La silice est la principale matière première utilisée pour la production de la plupart des verres. La température de transition vitreuse du dioxyde de silicium pur est d'environ 1 201,85 °C[53]. Lorsque du dioxyde de silicium fondu est refroidi rapidement, il ne cristallise pas mais se solidifie sous forme d'un solide amorphe, en l'occurrence un verre. L'absence d'ordre à grande distance n'implique pas que le matériau soit également désordonné à plus petite échelle, et on observe une organisation ordonnée dans la silice amorphe à des échelles qui dépassent largement la longueur de la liaison Si–O ; c'est par exemple le cas des cycles de six tétraèdres SiO4[54].
La plus grande partie des fibres optiques destinées aux télécommunications sont en dioxyde de silicium. Ce dernier est la matière première de nombreuses céramiques, comme la terre cuite, les grès et la porcelaine.
Le dioxyde de silicium permet d'obtenir du silicium pur, par un procédé faisant intervenir une réaction carbothermique dans un four à arc électrique[55] :
Industrie électronique
Le dioxyde de silicium est également très utilisé dans l'industrie de la microélectronique où il sert comme couche de passivation, d'oxyde (diélectrique) de grille pour transistor MOSFET ou encore comme couche anti-reflet. Ses applications sont semblables à celles d'autres oxydes apparentés, comme le dioxyde de zirconium ZrO2, le dioxyde de titane TiO2 ou encore l'oxyde d'hafnium(IV) HfO2.
Utilisations agroalimentaires
Le dioxyde de silicium est un additif (E 551) couramment utilisé dans l'industrie agroalimentaire, essentiellement comme agent de fluidification pour denrées en poudre ou pour absorber l'humidité dans les applications hygroscopiques. On le trouve comme anti-agglomérant dans les aliments en poudre comme les épices et les crèmes en poudre pour le café.
La silice colloïdale est utilisée comme agent de collage dans la clarification et stabilisation du vin, de la bière et des jus de fruits[46] ; son numéro E est E551.
Autres
Le dioxyde de silicium est utilisé dans la méthode de séparation de l'ADN par adsorption sur silice (en), applicable à l'ADN aussi bien qu'à l'ARN, en raison de la capacité du SiO2 à se lier aux acides nucléiques en présence de chaotropes[56].
Le dioxyde de silicium est le constituant principal du kieselguhr, ou terre de diatomées, dont les propriétés mécaniques particulières sont mises à profit dans de nombreuses applications, allant de l'abrasion dans le dentifrice jusqu'à l'isolation thermique en passant par la stabilisation de la nitroglycérine dans les bâtons de dynamite, la fonction d'absorbant dans les litières pour chats, les insecticides mécaniques (notamment contre les blattes), le support de catalyseurs en catalyse hétérogène, l'activation expérimentale de la coagulation sanguine en laboratoire, etc.
La silice hydrophobe (en) peut être utilisée comme antimoussant, ou peut servir à produire de l'eau sèche, substance se présentant comme une fine poudre blanche formée de gouttelettes d'eau enrobées d'une pellicule de nanoparticules de silice.
Toxicité
Ingestion
L'ingestion de dioxyde de silicium par voie orale a été déclarée non toxique, avec une LD50 de 5 g/kg[46]. Une étude de 2008 avait conclu, après avoir suivi des sujets pendants 15 ans, qu'un niveau de SiO2 plus élevé dans l'eau semble réduire le risque de démence ; un ajout de 10 mg/jour de SiO2 dans l'eau potable était associé à une baisse de 11 % du risque de démence[57].
Or de nouvelles études indiquent des effets potentiellement néfastes sur la santé, "notamment des dysfonctionnements de la division cellulaire et des perturbations du trafic cellulaire[58], ainsi que des effets indésirables sur le foie"[59]. Car nous absorbons en moyenne environ 124 mg de nano-silice (E551) par jour dans notre alimentation [60].
En 2020, les fabricants de silice défendent leur produit en attaquant l'une de ces études parue en 2019[61] ; les chercheurs ont répondu dans la même revue, en démontant point par point les critiques des fabricants de silice[62].
Inhalation
Le dioxyde de silicium n'est pas toxique chimiquement, mais les poussières de silice cristalline (quartz et cristobalite, notamment) sont toxiques en raison de leur petite taille, de leur dureté et de leur inaltérabilité, essentiellement par inhalation[63]. Une exposition même brève peut provoquer une irritation des yeux et de l'appareil respiratoire. Les particules les plus fines peuvent être inhalées et atteindre les parties les plus profondes des poumons (alvéoles). Ces particules ne sont pas éliminées par l'organisme et peuvent entrainer des atteintes pulmonaires graves comme la silicose (pneumoconiose fibrosante). Elles peuvent activer l'inflammasome NLRP3 des macrophages et des cellules dendritiques et conduire ainsi à la production d'interleukine, une cytokine fortement pro-inflammatoire du système immunitaire[64]. Elles favorisent également l'apparition du cancer du poumon. Une exposition unique à de fortes doses peut entrainer des effets durables et irrémédiables, la prévention des risques est donc primordiale (protections individuelles, lutte contre la contamination de l'air, confinement). L'inhalation de telles particules en grande quantité, par exemple sur le lieu de travail, augmente le risque de développer des maladies auto-immunes telles que le lupus érythémateux disséminé et la polyarthrite rhumatoïde[65].
Les poussières de silice amorphes ne présenteraint pas ce degré de toxicité[66] car elles présentent une faible biopersistance (elles sont solubles dans les liquides biologiques).
Risques en milieu professionnel
La silice est un risque professionnel pour les personnes qui réalisent du sablage ou travaillent avec des produits contenant de la silice cristalline en poudre. La silice amorphe, telle que la silice pyrogénée, peut dans certains cas induire des lésions pulmonaires irréversibles, mais n’est pas associée au développement de la silicose. Les enfants, les asthmatiques de tous âges, les personnes allergiques et les personnes âgées, qui présentent toutes une capacité pulmonaire réduite, peuvent être atteintes plus rapidement[67].
La silice cristalline est également un risque professionnel pour ceux qui produisent des plans de travail en pierre, car le processus de découpe et d'installation des plans de travail libère de grandes quantités de silice en suspension dans l'air[68]. La silice cristalline utilisée dans la fracturation hydraulique présente également un risque pour la santé des travailleurs[69].
Notes et références
Notes
- Les valeurs numériques sont celles du quartz α
- Sic. Une valeur aussi élevée du nombre Z de motifs chimiques par maille est exceptionnelle.
- La relative opacité de la silice dans l'infrarouge est partagée par le verre à vitre, riche en SiO2. On a longtemps pensé que ce phénomène était à l'origine de la différence de température moyenne entre l'intérieur et l'extérieur d'une serre, mais il ne compte que pour environ 20 % du réchauffement, le phénomène principal étant le blocage de l'advection[14],[15]. C'est par contre bien la relative opacité de l'atmosphère dans l'infrarouge qui est à l'origine de l'« effet de serre » atmosphérique.
Références
- Entrée « Silicon dioxide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 28 février 2019 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Silicon dioxide nanopowder, 10-20 nm particle size (BET), 99.5% trace metals basis, consultée le 28 février 2019.
- (en) W. Hummel, U. Berner, E. Curti, F. J. Pearson et T. Thoenen, Nagra/Psi Chemical Thermodynamic Data Base 01/01, Universal-Publishers, 2002, p. 311-313. (ISBN 1-58112-620-4)
- (en) Edward Palik, Handbook of Optical Constants of Solids, 1re édition, Academic Press Inc, 1985, p. 760. (ISBN 0-12-544420-6)
- « Fiche du composé Silicon(IV) oxide, powder, 1.0 micron, 99.9% », sur Alfa Aesar (consulté le ).
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 1 : Cancérogènes pour l'homme », sur http://monographs.iarc.fr, CIRC, (consulté le )
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme », sur http://monographs.iarc.fr, CIRC, (consulté le )
- (en) R. L. Rudnick (dir.) et S. Gao, Treatise on Geochemistry, vol. 3 : The Crust, Elsevier, , 702 p. (ISBN 978-0-08-044847-3, présentation en ligne), « Composition of the Continental Crust », p. 48-53
- (en) Carl J. Johnston, Kevin E. Driscoll, Jacob N. Finkelstein, R. Baggs Michael, A. O'Reilly, Janet Carter, Robert Gelein et Günter Oberdörster, « Pulmonary Chemokine and Mutagenic Responses in Rats after Subchronic Inhalation of Amorphous and Crystalline Silica », Toxicological Sciences, vol. 56, no 2, , p. 405-413 (PMID 10911000, DOI 10.1093/toxsci/56.2.405, lire en ligne)
- https://www.anses.fr/fr/content/pointant-la-toxicité-de-certains-nanomatériaux-l’anses-appelle-à-un-encadrement
- Ariel Provost, « États physiques, liaisons chimiques », dans Ariel Provost et Cyril Langlois, Géologie. Roches et géochimie, Paris, Dunod, coll. « Mini-manuels », , 227 p., p. 8.
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, 92e édition, 2011, CRC Press, États-Unis. (ISBN 1439855110)
- Benoît Urgelli, « Note sur la théorie de la serre, par R.W. Wood (1909) », sur ENS Lyon, .
- (en) Brian Shmaefsky, Favorite demonstrations for college science : an NSTA Press journals collection, NSTA Press, , 175 p. (ISBN 978-0-87355-242-4, lire en ligne), p. 57.
- (en) « Properties of Silicon Dioxide », sur https://sciencestruck.com/ (consulté le ).
- (en) Y. H. Cuff, Ceramic Technology for Potters and Sculptors, Philadelphia: University of Pennsylvania, 1996, p. 93–95. (ISBN 9780812213775)
- (en) Christina De La Rocha et Daniel J. Conley, « Mystical Crystals of Silica », Silica Stories, Springer, 2017, p. 50–55. DOI:10.1007/978-3-319-54054-2_4 (ISBN 9783319540542)
- (en) Arnold Frederik Holleman et Egon Wiberg, revu par Nils Wiberg, Inorganic Chemistry, traduit par Mary Eagleson et William Brewer, Academic Press/De Gruyter, San Diego/Berlin, 2001. (ISBN 0-12-352651-5)
- (en) Norman N. Greenwood et Alan Earnshaw, Chemistry of the Elements, Pergamon Press, Oxford, 1984, p. 393–399. (ISBN 0-08-022057-6)
- (en) A. Kirfel, H.-G. Krane, P. Blaha, K. Schwarz et T. Lippmann, « Electron-density distribution in stishovite, SiO2: a new high-energy synchrotron-radiation study », Acta Crystallographica Section A, vol. 57, no 6, , p. 663-677 (PMID 11679696, DOI 10.1107/S0108767301010698, lire en ligne)
- (en) Julius Scherzer, « Dealuminated faujasite-type structures with SiO2 Al2O3 ratios over 100 », Journal of Catalysis, vol. 54, no 2, , p. 285-288 (DOI 10.1016/0021-9517(78)90051-9, lire en ligne)
- (en) G. A. Lager, « Crystal structure and thermal expansion of α‐quartz SiO2 at low temperatures », Journal of Applied Physics, vol. 53, no 10, , p. 6751-6756 (DOI 10.1063/1.330062, Bibcode 1982JAP....53.6751L, lire en ligne)
- (en) A. F. Wright et M. S. Lehmann, « The structure of quartz at 25 and 590°C determined by neutron diffraction », Journal of Solid State Chemistry, vol. 36, no 3, , p. 371-380 (DOI 10.1016/0022-4596(81)90449-7, Bibcode 1981JSSCh..36..371W, lire en ligne)
- (en) Kuniaki Kihara, Takeo Matsumoto et Moritaka Imamura, « Structural change of orthorhombic-I tridymite with temperature: A study based on second-order thermal-vibrational parameters », Zeitschrift für Kristallographie, vol. 177, nos 1-2, , p. 27-38 (DOI 10.1524/zkri.1986.177.1-2.27, Bibcode 1986ZK....177...27K, lire en ligne)
- (en) R. T. Downs et D. C. Palmer, « The pressure behavior of α cristobalite », American Mineralogist, vol. 79, nos 1-2, , p. 9-14 (lire en ligne)
- (en) A. F. Wright et A. J. Leadbetter, « The structures of the β-cristobalite phases of SiO2 and AlPO4 », The Philosophical Magazine, vol. 31, no 6, , p. 1391-1401 (DOI 10.1080/00318087508228690, Bibcode 1975PMag...31.1391W, lire en ligne)
- (en) Joseph Shropshire, Paul P. Keat et Philip A. Vaughan, « The crystal structure of keatite, a new form of silica », Zeitschrift für Kristallographie, vol. 112, nos 1-6, , p. 409-413 (DOI 10.1524/zkri.1959.112.1-6.409, Bibcode 1959ZK....112..409S, lire en ligne)
- (en) Gerhard Miehe et Heribert Graetsch, « Crystal structure of moganite: a new structure type for silica », European Journal of Mineralogy, vol. 4, no 4, , p. 693-706 (DOI 10.1127/ejm/4/4/0693, Bibcode 1992EJMin...4..693M, lire en ligne)
- (en) L. Levien et C. T. Prewitt, « High-pressure crystal structure and compressibility of coesite », American Mineralogist, vol. 66, nos 3-4, , p. 324-333 (lire en ligne)
- (en) Joseph R. Smyth, R. Jeffrey Swope et Alison R. Pawley, « H in rutile-type compounds: II. Crystal chemistry of Al substitution in H-bearing stishovite », American Mineralogist, vol. 80, nos 5-6, , p. 454-456 (DOI 10.2138/am-1995-5-605, Bibcode 1995AmMin..80..454S, lire en ligne)
- (en) Przemyslaw Dera, Charles T. Prewitt, Nabil Z. Boctor et Russell J. Hemley, « Characterization of a high-pressure phase of silica from the Martian meteorite Shergotty », American Mineralogist, vol. 87, no 7, , p. 1018-1023 (DOI 10.2138/am-2002-0728, lire en ligne)
- (en) « Seifertite », sur https://www.mindat.org/ (consulté le ).
- (en) Brian J. Skinner et Daniel E. Appleman, « Melanophilogite, a cubic polymorph of silica », American Mineralogist, vol. 48, nos 7-8, , p. 854-867 (lire en ligne)
- (en) Takeshi Nakagawa, Kuniaki Kihara et Kazuo Harada, « The crystal structure of low melanophlogite », American Mineralogist, vol. 86, nos 11-12, , p. 1506-1512 (DOI 10.2138/am-2001-11-1219, lire en ligne)
- (en) Rosemarie Szostak, Molecular sieves: Principles of Synthesis and Identification, Springer, 1998. (ISBN 978-0-7514-0480-7)
- (de) Alarich Weiss et Armin Weiss, « Über Siliciumchalkogenide. VI. Zur Kenntnis der faserigen Siliciumdioxyd‐Modifikation », Zeitschrift für anorganische und allgemeine Chemie, vol. 276, nos 1-2, , p. 95-112 (DOI 10.1002/zaac.19542760110, lire en ligne)
- (en) Torbjörn Björkman, Simon Kurasch, Ossi Lehtinen, Jani Kotakoski, Oleg V. Yazyev, Anchal Srivastava, Viera Skakalova, Jurgen H. Smet, Ute Kaiser et Arkady V. Krasheninnikov, « Defects in bilayer silica and graphene: common trends in diverse hexagonal two-dimensional systems », Scientific reports, vol. 3, , article no 3482 (PMID 24336488, PMCID 3863822, DOI 10.1038/srep03482, Bibcode 2013NatSR...3E3482B, lire en ligne)
- (en) Leonardo D. Fernández, Enrique Lara et Edward A. D. Mitchell, « Checklist, diversity and distribution of testate amoebae in Chile », European Journal of Protistology, vol. 51, no 5, , p. 409-424 (DOI 10.1016/j.ejop.2015.07.001, lire en ligne)
- (en) Fergus P. Massey, A. Roland Ennos et Sue E. Hartley, « Silica in grasses as a defence against insect herbivores: contrasting effects on folivores and a phloem feeder », Journal of Animal Ecology, vol. 75, no 2, , p. 595-603 (PMID 16638012, DOI 10.1111/j.1365-2656.2006.01082.x, lire en ligne)
- (en) Malcolm G. Keeping et Olivia L. Kvedaras, « Silicon as a plant defence against insect herbivory: response to Massey, Ennos and Hartley », Journal o Animal Ecology, vol. 77, no 3, , p. 631-633 (PMID 18341561, DOI 10.1111/j.1365-2656.2008.01380.x, lire en ligne)
- (en) M. Scott Shell, Pablo G. Debenedetti et Athanassios Z. Panagiotopoulos, « Molecular structural order and anomalies in liquid silica », Physical Review E, vol. 66, no 1, , article no 011202 (PMID 12241346, DOI 10.1103/PhysRevE.66.011202, Bibcode 2002PhRvE..66a1202S, lire en ligne)
- (en) Ilhan A. Aksay, Joseph A. Pask et Robert F. Davis, « Densities of SiO2‐Al2O3 Melts », Journal of the American Ceramic Society, vol. 62, nos 7-8, , p. 332-336 (DOI 10.1111/j.1151-2916.1979.tb19071.x, lire en ligne)
- (en) Robert O. Fournier et Jack R. Rowe, « The solubility of amorphous silica in water at high temperatures and high pressure », American Mineralogist, vol. 62, , p. 1052-1056 (lire en ligne)
- Manuel Maldonado, María López-Acosta, Cèlia Sitjà, Marta García-Puig, Cristina Galobart, Gemma Ercilla & Aude Leynaert (2019) Sponge skeletons as an important sink of silicon in the global oceans ; Nature Geoscience | volume 12, pages815–822
- (en) Otto W. Flörke, Heribert A. Graetsch, Fred Brunk, Leopold Benda, Siegfried Paschen, Horacio E. Bergna, William O. Roberts, William A. Welsh, Cristian Libanati, Manfred Ettlinger, Dieter Kerner, Monika Maier, Walter Meon, Ralf Schmoll, Hermann Gies et Dietmar Schiffmann, « Silica », Ullmann's Encyclopedia of Industrial Chemistry, , p. 455 (DOI 10.1002/14356007.a23_583.pub3, lire en ligne)
- (en) R. Doering et Y. Nishi, Handbook of Semiconductor Manufacturing Technology, CRC Press, 2007. (ISBN 9781574446753)
- (en) S. Lee, Encyclopedia of chemical processing, CRC Press, 2006. (ISBN 9780824755638)
- (en) D. V. Morgan et K. Board, (1991). An Introduction To Semiconductor Microtechnology, 2e édition, John Wiley & Sons, 1991, p. 72. (ISBN 9780471924784)
- (en) Robin S. M. Chrystie, Felix L. Ebertz, Thomas Dreier et Christof Schulz, « Absolute SiO concentration imaging in low-pressure nanoparticle-synthesis flames via laser-induced fluorescence », Applied Physics B, vol. 125, , p. 29 (DOI 10.1007/s00340-019-7137-8, lire en ligne)
- (en) Asep Bayu Dani, Nandiyanto Soon-Gil Kim, Ferry Iskandar et Kikuo Okuyama, « Synthesis of spherical mesoporous silica nanoparticles with nanometer-size controllable pores and outer diameters », Microporous and Mesoporous Materials, vol. 120, no 3, , p. 447-453 (DOI 10.1016/j.micromeso.2008.12.019, lire en ligne)
- (en) D. V. Morgan et K. Board, (1991). An Introduction To Semiconductor Microtechnology, 2e édition, John Wiley & Sons, 1991, p. 27. (ISBN 9780471924784)
- (en) M. I. Ojovan, « Glass formation in amorphous SiO2 as a percolation phase transition in a system of network defects », Journal of Experimental and Theoretical Physics Letters, vol. 79, no 12, , p. 632-634 (DOI 10.1134/1.1790021, Bibcode 2004JETPL..79..632O, lire en ligne)
- (en) S. R. Elliott, « Medium-range structural order in covalent amorphous solids », Nature, vol. 354, no 6353, , p. 445-452 (DOI 10.1038/354445a0, Bibcode 1991Natur.354..445E, lire en ligne)
- (en) P. W. Atkins, T. Overton, J. Rourke, et al. Shriver & Atkins' inorganic chemistry, 5e édition, Oxford: Oxford University Press, 2010, p. 354. (ISBN 9780199236176)
- (en) W. Goodwin, A. Linacre et S. Hadi, An Introduction to Forensic Genetics, Wiley & Sons, 2007, p. 29. (ISBN 9780470010259)
- (en) Virginie Rondeau, Hélène Jacqmin-Gadda, Daniel Commenges, Catherine Helmer et Jean-François Dartigues, « Aluminum and Silica in Drinking Water and the Risk of Alzheimer's Disease or Cognitive Decline: Findings From 15-Year Follow-up of the PAQUID Cohort », American Journal of Epidemiology, vol. 169, no 4, , p. 489-496 (PMID 19064650, PMCID 2809081, DOI 10.1093/aje/kwn348, lire en ligne)
- "In vitro toxicity of amorphous silica nanoparticles in human colon carcinoma cells", Nanotoxicology, 7(3), Mai 2013 "Presence of nanosilica (E551) in commercial food products: TNF-mediated oxidative stress and altered cell cycle progression in human lung fibroblast cells", Cell Biology and Toxicology, février 2014, "Sub-chronic toxicity study in rats orally exposed to nanostructured silica", Particle and Fibre Toxicology, 11:8, 2014
- "Silica nanoparticle-induced toxicity in mouse lung and liver imaged by electron microscopy', Fundamental Toxicological Sciences, 2(1) : 19-23, 2015, "Novel insights into the risk assessment of the nanomaterial synthetic amorphous silica, additive E551, in food", van Kesteren PCE et al., Nanotoxicology, 2014
- "Presence and risks of nanosilica in food products", Dekkers et al., Nanotoxicology, 5(3) : 393-405, 2011
- Boudard D et al. : "Chronic oral exposure to synthetic amorphous silica (NM-200) results in renal and liver lesions in mice", Boudard D et al., Kidney International Reports, 2019.
- site de KI Reports, le 10 mars 2020
- « Silice cristalline - Fiche toxicologique no 232 », INRS, 1997
- (en) Veit Hornung, Franz Bauernfeind, Annett Halle, Eivind O Samstad, Hajime Kono, Kenneth L Rock, Katherine A Fitzgerald et Eicke Latz, « Silica crystals and aluminum salts activate the NALP3 inflammasome through phagosomal destabilization », Nature Immunology, vol. 9, no 8, , p. 847-856 (PMID 18604214, PMCID 2834784, DOI 10.1038/ni.1631, lire en ligne)
- (en) Armando Meyer, Dale P. Sandler, Laura E. Beane Freeman, Jonathan N. Hofmann et Christine G. Parks, « Pesticide Exposure and Risk of Rheumatoid Arthritis among Licensed Male Pesticide Applicators in the Agricultural Health Study », Environmental Health Perspective, vol. 125, no 7, , article no 077010 (PMID 28718769, PMCID 5744649, DOI 10.1289/EHP1013, lire en ligne)
- « Les silices amorphes - Le point des connaissances sur… », INRS, 2007
- (en) P. G. J. Reuzel, J. P. Bruijntjes, V. J. Feron et R. A. Woutersen, « Subchronic inhalation toxicity of amorphous silicas and quartz dust in rats », Food and Chemical Toxicology, vol. 29, no 5, , p. 341-354 (PMID 1648030, DOI 10.1016/0278-6915(91)90205-L, lire en ligne)
- (en) « Worker Exposure to Silica during Countertop Manufacturing, Finishing and Installation » [PDF], sur https://www.cdc.gov/niosh/, National Institute for Occupational Safety and Health, (consulté le ).
- (en) Steven Greenhouse, « New Rules Would Cut Silica Dust Exposure », sur https://www.nytimes.com/, The New York Times, (consulté le ).
