Silane (composé)
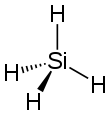
Le silane est un composé chimique de formule SiH4. Il se présente comme un gaz pyrophorique incolore à l'odeur repoussante[6]. Analogue silicié du méthane CH4, c'est le plus simple des hydrures de silicium, et le plus simple des composés de la série des silanes, de formule générale SinH2n+2, qui sont eux-mêmes des analogues siliciés des alcanes CnH2n+2.
Cet article concerne le plus simple de toute une famille de composés. Pour cette famille, voir Silane (famille de composés).
| Silane | |
  |
|
| Structure du silane. | |
| Identification | |
|---|---|
| Nom UICPA | silane |
| Synonymes |
Tétrahydrure de silicium, monosilane, silicane, hydrure de silicium |
| No CAS | |
| No ECHA | 100.029.331 |
| No CE | 232-263-4 |
| No RTECS | VV1400000 |
| PubChem | 23953 |
| ChEBI | 29389 |
| SMILES | |
| InChI | |
| Apparence | gaz pyrophorique incolore à l'odeur désagréable[1] |
| Propriétés chimiques | |
| Formule | SiH4 |
| Masse molaire[2] | 32,1173 ± 0,0006 g/mol H 12,55 %, Si 87,45 %, |
| Propriétés physiques | |
| T° fusion | −185 °C[1] |
| T° ébullition | −112 °C[1] |
| Solubilité | s'hydrolyse rapidement dans l'eau[1] |
| Masse volumique | 1,44 kg/m3 à 0 °C[1] |
| Limites d’explosivité dans l’air | 1,4 % en volume, 19 g/m3[1] |
| Pression de vapeur saturante | 29 bar à −22 °C[1] 40,8 bar à −10 °C[1] 48 bar à −3,5 °C[1] |
| Point critique | 0,242 g/cm3 à −3,5 °C sous 48,4 bar[1] |
| Point triple | −186,4 °C[1] |
| Thermochimie | |
| ΔvapH° | 12,1 kJ·mol-1 (1 atm, −111,9 °C)[3] |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 11,00 ± 0,02 eV (gaz)[4] |
| Précautions | |
| SGH[1] | |
  Danger |
|
| SIMDUT[5] | |
  A, B6, |
|
| Transport[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Par extension, on peut également parler de silanes pour désigner collectivement divers dérivés substitués du silane, comme l'orthosilicate de tétraméthyle Si(OCH3)4, l'orthosilicate de tétraéthyle Si(OCH2CH3)4 ou le trichlorosilane SiHCl3, ou encore des composés organosiliciés comme le diméthylsilanediol Si(OH)2(CH3)2 ou le tétraméthylsilane Si(CH3)4.
Propriétés et réactions
L'hydrogène étant plus électronégatif que le silicium (2,2 contre 1,9 sur l'échelle de Pauling), la polarisation de la liaison Si–H est inverse de celle de la liaison C–H (l'électronégativité du carbone est de 2,55 sur l'échelle de Pauling). Cela a plusieurs conséquences, notamment la propension du silane à former des complexes avec les métaux de transition ou encore le fait qu'il s'enflamme spontanément dans l'air sans devoir être mis à feu (il est pyrophorique)[7]. Les données de combustion du silane sont cependant souvent contradictoires car le silane lui-même est plutôt stable tandis que sa pyrophoricité serait due essentiellement à des impuretés telles que la formation de silanes supérieurs au cours de sa production, par la présence de traces d'humidité et par les effets catalytiques de la surface des récipients qui le contiennent[8],[9].
En l'absence d'oxygène et d'humidité, le silane se décompose au-dessus de 400 °C en silicium et hydrogène[10], ce qui peut être mis à profit pour déposer des couches minces de silicium par dépôt chimique en phase vapeur (CVD).
La réduction du silane par un métal alcalin dissous dans un solvant donne le dérivé silylique alcalin correspondant. Selon le solvant, deux réactions concurrentes peuvent avoir lieu, par exemple la première réaction seule dans l'hexaméthylphosphoramide [(CH3)2N]3PO (HMPA) et les deux simultanément dans le diméthoxyéthane CH3OCH2CH2OCH3, par exemple ici avec du potassium donnant le silanure de potassium KSiH3[11] :
L'énergie de la liaison Si–H vaut environ 384 kJ/mol, ce qui est environ 20 % moindre que celle de la liaison H–H dans la molécule d'hydrogène H2. Il s'ensuit que les composés qui contiennent de telles liaisons Si–H sont plus réactifs que H2. L'énergie de la liaison Si–H est peu affectée par la présence de substituants sur l'atome de silicium : elle vaut ainsi 419 kJ/mol pour le trifluorosilane SiHF3, 382 kJ/mol pour le trichlorosilane SiHCl3 et 398 kJ/mol pour le triméthylsilane SiH(CH3)3[12],[13].
Le silane est un réducteur fort qui brûle dans l'oxygène, explose dans le chlore et s'hydrolyse rapidement dans l'eau basique (pH > 7) selon les réactions :
En revanche, la réaction avec l'eau pure est très lente : elle est facilitée en présence de traces basiques ou d'un acide fort.
Production
Méthodes industrielles
Le silane est synthétisé suivant plusieurs procédés[14]. Il se forme généralement par réaction de chlorure d'hydrogène HCl avec du siliciure de magnésium Mg2Si :
On peut également le produire à partir de silicium métallurgique en deux étapes. Le silicium est tout d'abord traité au chlorure d'hydrogène à environ 300 °C pour produire du trichlorosilane SiHCl3 avec de l'hydrogène H2 :
Le trichlorosilane est ensuite converti en un mélange de silicium et de tétrachlorure de silicium SiCl4 en présence d'un catalyseur :
Les catalyseurs les plus couramment utilisés dans ce procédé sont les halogénures de métaux, notamment le chlorure d'aluminium AlCl3. Il s'agit d'une redistribution, qui peut également être vue comme une dismutation bien que l'état d'oxydation du silicium ne varie pas (il vaut +4 aussi bien pour le silane, le trichlorosilane, que le tétrachlorure de silicium) ; cependant, le chlore étant plus électronégatif que l'hydrogène (3,16 contre 2,2 sur l'échelle de Pauling), l'atome de silicium de SiCl4 présente un état d'oxydation formel plus élevé que celui de SiH4.
Une méthode alternative de production concerne le silane de très grande pureté destiné à la production de silicium de qualité électronique pour l'industrie des semiconducteurs. Ce procédé utilise également du silicium métallurgique ainsi que de l'hydrogène et du tétrachlorure de silicium. Il fait intervenir une série de redistributions, avec des sous-produits qui sont recyclés dans les réactions et des distillations, que l'on peut résumer ainsi :
- Si + 2 H2 + 3 SiCl4 ⟶ 4 SiHCl3 ;
- 2 SiHCl3 ⟶ SiH2Cl2 + SiCl4 ;
- 2 SiH2Cl2 ⟶ SiHCl3 + SiH3Cl ;
- 2 SiH3Cl ⟶ SiH4 + SiH2Cl2.
Le silane ainsi formé peut être décomposé thermiquement pour donner en une seule passe du silicium de haute pureté et de l'hydrogène.
D'autres méthodes de production du silane font intervenir la réduction du tétrafluorure de silicium SiF4 par l'hydrure de sodium NaH ou la réduction du tétrachlorure de silicium SiCl4 par l'aluminohydrure de lithium LiAlH4. Il est également possible de procéder par réduction du dioxyde de silicium SiO2 sous aluminium par de l'hydrogène H2 dans un mélange de chlorure de sodium NaCl et de chlorure d'aluminium AlCl3 à haute pression[15] :
À l'échelle du laboratoire
Les chimistes allemands Heinrich Buff et Friedrich Woehler découvrirent le silane en 1857 parmi d'autres produits formés en faisant réagir de l'acide chlorhydrique HCl sur du siliciure d'aluminium Al4Si3 ; ils nommèrent le composé hydrogène siliciuré[16].
Pour les démonstrations en classe, le silane peut être produit en chauffant un mélange de sable et de poudre de magnésium pour obtenir du siliciure de magnésium Mg2Si, qui peut ensuite être versé dans de l'acide chlorhydrique. Le siliciure de magnésium réagit avec l'acide pour produire du silane SiH4, lequel forme des bulles qui remontent à la surface et s'enflamment spontanément au contact de l'air par pyrophoricité en laissant entendre un crépitement de petites explosions[17]. On peut considérer cette réaction comme une réaction acido-basique hétérogène dans la mesure où l'anion siliciure Si4– de la structure antifluorite de Mg2Si peut servir de base de Brønsted acceptant quatre protons.
D'une manière générale, les métaux alcalino-terreux forment des siliciures ayant les stœchiométries MII2Si, MIISi et MIISi2. Dans tous les cas, ces substances réagissent avec les acides de Brønsted pour produire des hydrures de silicium dont la nature dépend des liaisons de l'anion Si dans le siliciure. Il peut par exemple se former du silane SiH4, des silanes plus lourds de la série homologue de formule générale SinH2n+2, des hydrures de silicium polymériques, ou un acide silicique [SiOx(OH)4−2x]n. Ainsi, MIISi, qui contient une chaîne d'anions Si2– en zigzag sur laquelle chaque Si a deux doublet non liants susceptibles d'accepter des protons, donne l'hydrure polymérique (SiH2)x.
Enfin, une méthode de production de silane à petite échelle consiste à faire réagir un amalgame de sodium avec du dichlorosilane SiH2Cl2, ce qui donne, outre le silane, des hydrures de silicium polymérisés (SiH)x[16].
Applications
---No%252C1_%E3%80%90_Pictures_taken_in_Japan_%E3%80%91.jpg.webp)
Alors que les organosilanes ont des applications variées, le silane proprement dit est utilisé de manière quasi exclusive comme précurseur du silicium pur, notamment pour l'industrie des semiconducteurs. La fabrication de modules solaires photovoltïques bon marché a conduit a une consommation substantielle de silane pour le dépôt de silicium amorphe hydrogéné (a-Si:H) dépôt chimique en phase vapeur assisté par plasma (PECVD) sur divers substrats tels que le verre, des métaux ou des matières plastiques.
Le dépôt de silicium par PECVD est assez peu efficient puisqu'il n'utilise qu'environ 15 % du silane, le reste étant perdu. Diverses méthodes de recyclage ont été développées pour améliorer le rendement du procédé et réduire son empreinte environnementale[18],[19].
Sécurité
Le silane étant pyrophorique, les fuites de ce gaz s'enflamment spontanément, de sorte que de nombreux accidents mortels ont eu lieu dans des usines à la suite de feux et d'explosions[20],[21],[22]. La combustion du silane à faible concentration se déroulerait en deux temps, l'oxydation de l'hydrogène intervenant après la formation du dioxyde de silicium, dont la condensation accélérerait la formation d'eau sous l'effet d'une rétroaction thermique[23]. Le silane dilué dans des gaz inertes comme l'azote ou l'argon est encore davantage susceptible de s'enflammer dans l'air que le silane pur : même un mélange de 1 % de silane dans l'azote pur s'enflamme facilement[24]. La dilution du silane dans de l'hydrogène permet de réduire les risques industriels lors de la production de cellules solaires en silicium amorphe et présente également l'avantage de stabiliser les modules solaires photovoltaïques ainsi produits en limitant l'effet Staebler-Wronski (WSE)[25],[26].
Contrairement au méthane, le silane est assez toxique : la dose létale médiane chez le rat de laboratoire est de 0,96 % (9 600 ppm) sur quatre heures. De plus, le contact avec l'œil peut former des acides siliciques responsables d'irritations oculaires. Le National Institute for Occupational Safety and Health américain recommande de ne pas dépasser une exposition professionnelle au silane de 5 ppm, soit 7 mg/m3, en moyenne pondérée sur huit heures[27].
Notes et références
- Entrée « Monosilane » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 12 janvier 2021 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-4200-9084-0)
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- « Silane » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail)
- (de) Wolfgang Legrum, Riechstoffe, zwischen Gestank und Duft, Vieweg + Teubner Verlag, 2011, p. 68–69. (ISBN 978-3-8348-1245-2)
- (en) H. J. Emeléus et K. Stewart, « 281. The oxidation of the silicon hydrides. Part I », Journal of the Chemical Society (Resumed), , p. 1182-1189 (DOI 10.1039/JR9350001182, lire en ligne).
- (en) Seiichiro Koda, « Kinetic aspects of oxidation and combustion of silane and related compounds », Progress in Energy and Combustion Science, vol. 18, no 6, , p. 513-528 (DOI 10.1016/0360-1285(92)90037-2, lire en ligne).
- (en) Peter L. Timms, « The chemistry of volatile waste from silicon wafer processing », Journal of the Chemical Society, Dalton Transactions, no 6, , p. 815-822 (DOI 10.1039/A806743K, lire en ligne).
- (en) T. R. Hogness, Thomas L. Wilson et Warren C. Johnson, « The Thermal Decomposition of Silane », Journal of the American Chemical Society, vol. 58, no 1, , p. 108-112 (DOI 10.1021/ja01292a036, lire en ligne)
- (en) [PDF] Barry Arkles, « Silanes », p. 39, réimpression de Kirk-Othmer, Encyclopedia of Chemical Technology, 4e édition, vol. 22, John Wiley & Sons, 1997, p. 38-69. (ISBN 0-471-52691-6)
- (en) M. A. Brook, Silicon in Organic, Organometallic, and Polymer Chemistry, 2000, J. Wiley. (ISBN 0-471-19658-4).
- (en) « Standard Bond Energies », sur https://web.archive.org/, université d'État du Michigan, 10 février 1998, archivé le 21 novembre 2016 (consulté le ).
- (en) Walter Simmler, « Silicon Compounds, Inorganic », Ullmann's Encyclopedia of Industrial Chemistry, (DOI 10.1002/14356007.a24_001, lire en ligne).
- (en) Peter Atkins, Shriver & Atkins' Inorganic Chemistry, 5e éd., W. H. Freeman, New York, 2010, p. 358. (ISBN 978-0199599608)
- (en) J. W. Mellor, A Comprehensive Treatise on Inorganic and Theoretical Chemistry, vol. VI, Longmans, Green and Co., 1947, p. 216.
- (en) « Making Silicon from Sand », Popular Science, octobre 2005, archivé le (lire en ligne, consulté le ).
- (en) Pierre Briend, Bruno Alban, Henri Chevrel et Denis Jahan pour L'Air Liquide SA pour l'Étude et l'Exploitation des Procédés Georges Claude, Brevet U.S. 20110011129A1 : Method for recycling silane (CH4)., déposé le 18 février 2009, publié le 20 janvier 2011, sur Google Patents.
- (en) M. A. Kreiger, D. R. Shonnard et J. M. Pearce, « Life cycle analysis of silane recycling in amorphous silicon-based solar photovoltaic manufacturing », Resources, Conservation and Recycling, vol. 70, , p. 44-49 (DOI 10.1016/j.resconrec.2012.10.002, lire en ligne [PDF]).
- (en) Jenq Renn Chen, « Characteristics of fire and explosion in semiconductor fabrication processes », Process Safety Progress, vol. 21, no 1, , p. 19-25 (DOI 10.1002/prs.680210106, lire en ligne).
- (en) Jenq‐Renn Chen, Hsiao‐Yun Tsai, Shang‐Kay Chen, Huan‐Ren Pan, Shuai‐Ching Hu, Chun‐Cheng Shen, Chia‐Ming Kuan, Yu‐Chen Lee et Chih‐Chin Wu, « Analysis of a silane explosion in a photovoltaic fabrication plant », Process Safety Progress, vol. 25, no 3, , p. 237-244 (DOI 10.1002/prs.10136, lire en ligne).
- (en) Yo‐Yu Chang, Deng‐Jr Peng, Hong‐Chun Wu, Charng‐Cheng Tsaur, Chun‐Cheng Shen, Hsiao‐Yun Tsai et Jenq‐Renn Chen, « Revisiting of a silane explosion in a photovoltaic fabrication plant », Process Safety Progress, vol. 26, no 2, , p. 155-158 (DOI 10.1002/prs.10194, lire en ligne).
- (en) V. I. Babushok, W. Tsang, D. R. Burgess Jr. et M. R. Zachariah, « Numerical study of low- and high-temperature silane combustion », Symposium (International) on Combustion, vol. 27, no 2, , p. 2431-2439 (DOI 10.1016/S0082-0784(98)80095-7, lire en ligne).
- (en) Shigeo Kondo, Kazuaki Tokuhashi, Hidekazu Nagai, Masaji Iwasaka et Masahiro Kaise, « Spontaneous ignition limits of silane and phosphine », Combustion and Flame, vol. 101, nos 1-2, , p. 170-174 (DOI 10.1016/0010-2180(94)00175-R, lire en ligne).
- (en) Christopher J.Petti, Mohamed M. Hilali et Gopalkrishna Prabhu, « 10 - Thin Films in Photovoltaics », Handbook of Thin Film Deposition (Third Edition), , p. 313-359 (DOI 10.1016/B978-1-4377-7873-1.00010-3, lire en ligne).
- (en) Wilfried G. J. H. M. Van Sark, « Methods of Deposition of Hydrogenated Amorphous Silicon for Device Applications », Thin Films and Nanostructures, vol. 30, , p. 1-215 (DOI 10.1016/S1079-4050(02)80004-7, lire en ligne).
- (en) « Silicon tetrahydride », sur https://www.cdc.gov/niosh/, CDC (consulté le ).
- Portail de la chimie
