Maladie de Parkinson
La maladie de Parkinson, décrite par James Parkinson en 1817, est une maladie neurologique chronique dégénérative (perte progressive des neurones) affectant le système nerveux central responsable de troubles progressifs : mouvements ralentis, tremblements, rigidité puis troubles cognitifs. C'est le second trouble neurodégénératif le plus fréquent[1].

| Spécialité | Neurologie |
|---|---|
| Symptôme | Tremblement, Spasticité, hypokinésie (en) et anomalie de la démarche (en) |
| CISP-2 | N87 |
|---|---|
| CIM-10 | G20, F02.3 |
| CIM-9 | 332 |
| OMIM | 168600 556500 |
| DiseasesDB | 9651 |
| MedlinePlus | 000755 |
| eMedicine | 1831191 |
| eMedicine | neurologique/304 |
| MeSH | et D010300 D010300 et D010300 |
| GeneReviews | Parkinson Disease Overview |
![]()
Ses causes sont mal connues. Le tableau clinique est la conséquence de la perte de neurones du locus niger (ou « substance noire ») et d'une atteinte des faisceaux nigro-striés (en). La maladie débute habituellement entre 45 et 70 ans. C'est la deuxième maladie neurodégénérative la plus fréquente, après la maladie d'Alzheimer. La maladie de Parkinson se distingue des syndromes parkinsoniens qui sont généralement d'origines diverses, plus sévères et répondent peu aux traitements.
Physiopathologie
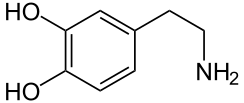
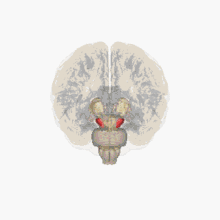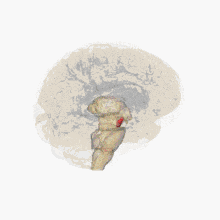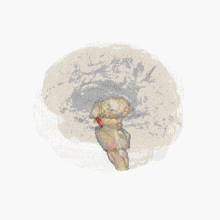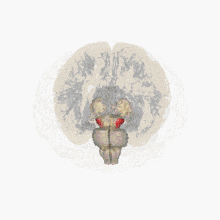
Un déficit de dopamine apparaît dans certaines structures du cerveau (la dopamine est un neurotransmetteur, une molécule servant de messager chimique entre deux neurones, synthétisée dans une terminaison axonale ; elle est libérée dans la fente synaptique en réponse à un influx nerveux).
Les altérations cérébrales ne se limitent pas seulement à la sphère dopaminergique ; de nombreux systèmes de neurotransmetteurs (sérotoninergiques, cholinergiques, glutamatergiques, adénosinergiques, noradrenalgiques[2] ou encore adrénergiques) sont également atteints. Le dérèglement du système dopaminergique par dégénérescence des neurones dopaminergiques dans la pars compacta du locus niger est néanmoins caractéristique de cette maladie ; c'est elle qui induit les principaux symptômes de la maladie de Parkinson[1].
La physiopathologie de la maladie a été récemment éclairée par la découverte de nombreux gènes impliqués dans des formes rares de la maladie.
Les processus biologiques suspectés d'entraîner la perte neuronale sont multiples : dysfonctionnement mitochondrial, apoptose, accumulation de protéines neurotoxiques, stress oxydatif (affectant la réparation de l'ADN neuronal lors de stress physicochimiques du neurone) ; l'hyperactivation inappropriée de la protéine Cdk5 (kinase cycline-dépendante 5 (en)) normalement présente dans les neurones, supprime l'enzyme APE1 (voir Endonucléase) nécessaire à la réparation de l'ADN, ce qui peut conduire à la destruction de neurones.
Il a récemment été montré que la voie Cdk5-APE1 était perturbée chez des patients victimes de la maladie de Parkinson ou d'Alzheimer[3],[4],[5]. De même une protéine mal conformée, l'α-synucléine, s'accumule anormalement dans les corps de Lewy et les neurites[1]. Cette protéine a un comportement infectieux de type prion[6].
La maladie de Parkinson n'est pas liée à la maladie d'Alzheimer[2].
Causes
Les causes, processus ou facteurs de risque de cette maladie sont encore mal connus. La maladie de Parkinson est une maladie idiopathique aux causes multiples qui entraînent la mort des neurones. Ils pourraient être la conséquence de l'interaction entre une prédisposition génétique (surtout chez des sujets de moins de 50 ans[7]) et des cofacteurs environnementaux. Depuis de nombreuses années, des toxiques environnementaux, métaux lourds et pesticides sont suspectés[2].
Maladie du vieillissement
Le premier facteur de risque reste avant tout l'âge même si il y a des patients jeunes pour les formes génétiques de la maladie, ce qui fait de la maladie de Parkinson une maladie du vieillissement[8].
Facteurs de risque génétiques
Une petite partie des malades de Parkinson, environ 15%, ont des formes génétiques de la maladie[2]. Environ 15 % des personnes ayant la maladie de Parkinson ont un proche atteint[9]. Au moins 5 % des patients sont reconnus comme ayant une forme de la maladie liée à une mutation de gènes spécifiques[10]. Plusieurs gènes actifs ont été identifiés dans des familles de parkinsoniens :
- des mutations du gène LRRK-2 (leucine-rich repeat kinase 2) : la découverte récente du gène LRRK2 qui code la dardarine, a révolutionné la génétique de la maladie de Parkinson puisqu’une seule mutation, G2019S, explique à elle seule une proportion importante des formes autosomiques dominantes de la maladie de Parkinson et aussi, de façon très intéressante, des formes communes idiopathiques, dans certains sous-groupes de patients parkinsoniens. La fréquence de la mutation G2019S varie considérablement selon l’origine géographique et ethnique des populations étudiées. Très rare en Asie (<0,1 %) et en Afrique sub-saharienne, elle peut atteindre 40 % en Afrique du Nord dans les formes familiales et sporadiques de la maladie de Parkinson. La mutation G2019S joue aussi un rôle important chez les patients d’origine juive ashkénaze et sépharade (10-15 % des cas isolés), et dans une moindre mesure chez les patients originaires de la péninsule Ibérique (3-6 % des cas isolés). Elle est très rare en Europe du Nord. La plupart des patients d'Afrique du Nord, Juifs et Européens partagent le même haplotype indiquant l’existence d’un effet fondateur unique[11],[12] ;
- l'atteinte d'autres gènes a été décrite mais est sensiblement plus rare (c'est le cas, en particulier, de la maladie de Gaucher, des mutations sur le gène PINK1, PRKN, SNCA...) ;
- le gène Pyridoxal kinase est anormalement activé chez les malades[13],[14] ; une mutation de ce gène modifierait la quantité ou l'activité des enzymes Pyridoxal kinase (PDXK) qui transforme la vitamine B6 en sa forme active indispensable à production de dopamine. Or, un vieillissement prématuré, puis la mort des cellules produisant la dopamine, est toujours associé à la maladie de Parkinson. Dans ce cas, des thérapies individualisées sont espérées à l'avenir.[réf. nécessaire]
Inflammation intestinale
Certaines preuves solides suggèrent qu'une inflammation intestinale pourrait être responsable de la maladie pour au moins une partie des patients. Les patients atteints de la maladie de Crohn et de rectocolite hémorragique ont 28% plus de risques de développer la maladie de Parkinson, suggérant des liens génétiques entre ces affections[15]. Les protéines alpha-synucléines s'agglutinent et forment des fibres qui endommagent les neurones. Les patients présentent ces fibres dans leur cerveau mais aussi dans leur intestin[16]. Les alpha-synucléines pourraient transiter vers le cerveau au travers du nerf vague[15],[17]. Les personnes ayant le nerf vague sectionné ont moins de chances de développer la maladie de Parkinson[15].
La plupart des patients atteints de la maladie de Parkinson se plaignent de constipation jusqu'à une dizaine d'années avant que d'autres symptômes n'apparaissent[18]. Les scientifiques pensent que les bactéries intestinales pourraient libérer des produits chimiques qui suractiveraient les parties du cerveau entraînant des dommages[19]. Des chercheurs du California Institute of Technology ont mis en évidence un lien biologique entre le microbiome intestinal et la maladie de Parkinson chez la souris[20].
Facteurs environnementaux de risque
La MPTP est une neurotoxine synthétique utilisée pour étudier la maladie chez le singe[21]. Elle provoque les symptômes permanents de la maladie de Parkinson en détruisant certains neurones dopaminergiques dans la substantia nigra du cerveau. Ce mode d'action a permis l'émergence de théories considérant que l'exposition à certaines toxines environnementales pourrait augmenter le risque de survenue d'une MP[22].

Exposition aux pesticides

L'exposition aux pesticides augmenterait le risque de près de 70 % : 5 % des personnes exposées aux pesticides risqueraient de développer la maladie contre 3 % pour la population générale[24]. Cette maladie est effectivement plus fréquente en milieu rural qu'urbain. Un modèle animal confirme la responsabilité d'un pesticide dans la constitution d'un syndrome parkinsonien[25]. Les organochlorés - interdits dans les pays développés, mais persistants dans l'environnement - seraient les premiers responsables (risque jusqu'à 2,4 fois plus élevé que la normale). Le risque est multiplié par trois si certains pesticides sont associés[26]. Le risque pourrait doubler en cas d'exposition à certains pesticides, tels que la roténone (un pesticide utilisé en production biologique) ou le paraquat (interdit dans l'UE), et herbicides, tel que l'agent orange[22],[27],[23]. Une étude sur l'agent orange a mis en évidence que certains facteurs d'exposition indirecte aux pesticides, par exemple la vie en milieu rural, augmentaient également le risque[23].
En France, la Sécurité sociale a reconnu en 2006 un cas de maladie de Parkinson comme maladie professionnelle pour un ancien salarié agricole[28]. Depuis le 7 mai 2012, le lien entre la maladie de Parkinson et les pesticides est officiellement reconnu par l'État français avec l'entrée en vigueur du décret n° 2012-665[29],[30],[31].
Les pesticides augmentant le risque de maladie de Parkinson comportent le Roténone, le Paraquat, le Carbamate, l'Organochlorine (composant du DDT), le Pyréthroide, l'Heptachlore[32].
Exposition aux solvants
L'exposition aux solvants est un facteur de risque pour la maladie de Parkinson[33]. La sévérité de la maladie est directement corrélée au degré d'exposition aux solvants organiques[34]. Un lien significatif entre l’exposition au trichloréthylène et au tétrachlorométhane avec le risque de survenue de la maladie de Parkinson est établi[35].
Autres produits chimiques
L’Autorité européenne de sécurité alimentaire (EFSA) a identifié différents produits chimiques associés très probablement à l’apparition de la maladie de Parkinson[32] :
- Methyl-4-Phenyl-1,2,3,6-Tetrahydropyridine (MPTP)
- 6-hydroxydopamine (6-OHDA)
- Manganèse (voir aussi Manganèse (maladie professionnelle))
- Amphétamine
- Isoquinoline
- Organophosphate
- 1-trichloromethyl-1,2,3,4-tetrahydro-betacarboline
- Carbolinium
- Particules de la pollution atmosphérique
- Polychlorobiphényle (PCB)
- Fungal
- Haloperidol (antipsychotique)
Autres facteurs environnementaux
L'exposition à des métaux (éléments-traces métalliques tels que l'aluminium, ou les métaux lourds) a été fortement suspectée dans les années 1970, via une accumulation de ces métaux dans la substantia nigra, mais les études n'ont pas pu confirmer de lien de cause à effet[22] et sont actuellement remises en cause ; et la maladie est dans ce cadre perçue comme sporadique sauf pour une proportion minoritaire[36].
Les traumatismes crâniens ont été associés à la maladie de Parkinson mais ne constituent pas un facteur de risque prouvé, l'augmentation des admissions de malades parkinsoniens en hôpital pour traumatisme crâniens semblant une conséquence de l'évolution des troubles moteurs liés à la maladie et non une cause[37].
La bactérie Helicobacter pylori pourrait contribuer à la survenue de la maladie de Parkinson[38].
Corossol
L'utilisation dans l'alimentation et la médecine traditionnelle notamment dans les Antilles françaises d'annonacine extraite du corossol est responsable de l'apparition de syndromes parkinsoniens atypiques à des fréquences anormalement élevées[39].
Facteurs environnementaux protecteurs
Exercice physique
La pratique régulière du sport permet de diminuer significativement le risque de développer la maladie de Parkinson[6].
Tabac
Le tabagisme entraînerait une réduction du risque de développer une maladie de Parkinson[40], dans ce cas, le risque des fumeurs pourrait être réduit d'un tiers par rapport aux non-fumeurs[22]. Le mécanisme de cette protection reste inconnu, mais pourrait être dû à l'effet stimulant de la nicotine sur la dopamine[22]. La fumée du tabac contient des composés qui agissent comme inhibiteurs de la monoamine oxydase et qui pourraient également contribuer à cet effet[41]. Des essais d'utilisation de nicotine en patch sont en cours[42],[43].
Café
De même, la consommation de café, et notamment de caféine, pourrait avoir un rôle protecteur[44],[45].
Vitamine B6
La vitamine B6 semble notamment jouer un rôle important (facteur de risque, facteur d'efficacité du traitement)[11].
Antioxydants
Certains ont avancé que les antioxydants, comme les vitamines C et D, pourraient protéger de la maladie, mais les résultats des études ont été contradictoires et aucun effet positif n'a finalement été démontré[22].
Lipides
Les évidences accumulées jusqu'à présent démontrent un lien entre les habitudes alimentaires et l'incidence de la maladie. En effet, une étude prospective basée sur un questionnaire alimentaire répondu par 131 368 participants démontre que le régime méditerranéen diminue l'incidence de la maladie de Parkinson. Cette étude n'identifie pas de facteur protecteur en particulier.
Cependant la consommation de poisson à la base de ce régime est riche en oméga-3 qui pourrait être en lien avec la diminution du risque. De plus, une autre étude de 5000 sujets suivis sur une période de 6 ans démontre qu'une forte consommation d'oméga-3 est associée avec une diminution du risque de la maladie de Parkinson.
Des études supplémentaires sont nécessaires pour déterminer si les oméga-3 peuvent exercer un effet neuroprotecteur et par quel mécanisme ceux-ci agissent[46].
Œstrogènes
Un possible rôle protecteur des œstrogènes et des anti-inflammatoires non-stéroïdiens a été suspecté mais reste à démontrer[22]. Le rôle protecteur des œstrogènes expliquerait le plus grand nombre d'hommes touchés par la MP[2] (45% de femmes contre 55% d'hommes)[47].
Vagotomie
La vagotomie semble protectrice et pourrait diminuer l'incidence de la maladie par rapport à la population générale[48]. Certains avancent l'hypothèse que la déconnexion de l'intestin du cerveau bloque le point d'entrée de l'α-synucléine[49], protéine pouvant se comporter comme un prion et dont on soupçonne un rôle dans l'origine de la maladie de Parkinson[50].
Poivron / aubergine
Une consommation importante de poivrons et d'aubergines et des légumes de la famille des solanacées pourrait en raison de leur teneur naturelle en nicotine prévenir en partie la maladie[51].
Diagnostic
L'âge moyen au moment du diagnostic est de 58 ans[52].
Clinique
La 1re ligne contient les mots “Catherine Metzger” et la seconde “13 octobre 1869”.

Le diagnostic est basé sur le constat de symptômes spécifiques des syndromes parkinsoniens[54]
- hypertonie musculaire extrapyramidale appelée « plastique » par opposition à l'hypertonie spastique, c’est-à-dire qu'elle cède à l'appui, qu'on a la sensation de « tuyau de plomb » lors de la mobilisation passive du membre (symptôme chez 85 % des parkinsoniens). Cette rigidité peut céder par à-coups (aspect de roue dentée). L'attitude générale est en flexion (Cyphose dorsale, membres semi-fléchis) et donne un aspect penché en avant. Elle est augmentée par la manœuvre de Froment, persiste en décubitus (signe de l'oreiller) ;
- tremblement de repos des extrémités, notamment du pouce (symptôme chez 64 % des parkinsoniens) : le patient semble compter sa monnaie, ou rouler de la mie de pain. Il est lent et régulier, pouvant plus rarement persister dans l'attitude. Classiquement, il disparaît lors des mouvements volontaires et du sommeil, est augmenté par les efforts de concentration tels que le calcul mental, et respecte le cou et le chef (la tête) mais peut toucher le menton ;
- akinésie : elle consiste en une rareté et une lenteur des mouvements (bradykinésie). Elle se manifeste aussi par une perturbation de la mimique et des mouvements automatiques comme ceux de la marche. C'est le signe le plus important de la maladie (symptôme chez 88 % des parkinsoniens). Le patient a un visage impassible, la bouche entrouverte, clignant rarement des yeux. La marche est lente à petits pas, parfois entrecoupée d'arrêts avec piétinement. Elle est parfois rapide (festination). Le malade penché en avant paraît courir après son centre de gravité. Il y a toujours une perte du ballant des bras. Les mouvements alternatifs rapides des membres (épreuve des marionnettes) sont mal réalisés.
Les symptômes inauguraux les plus fréquents sont la dépression, l'altération de l'odorat (symptôme difficile à évaluer[55]) puis le tremblement, la micrographie, la difficulté de marcher (maladie asymétrique, elle touche plus sévèrement un côté du corps), signes généralement associés à des douleurs. Après cette phase, on enregistre souvent des symptômes autres que moteurs. D'autres symptômes peuvent être rencontrés plus ou moins tardivement : chutes, hypersalivation, réflexe oculo-palpébral inépuisable, une micrographie (la calligraphie diminue en amplitude), une dysarthrie (troubles de la parole), troubles de la déglutition, troubles du comportement en sommeil paradoxal, hypotension orthostatique, troubles urinaires, etc. Des troubles cognitifs voire une démence peuvent survenir chez le patient âgé[56].
Examens complémentaires
Le diagnostic de maladie de Parkinson est habituellement clinique. En théorie, la certitude du diagnostic n'est obtenue que par l'étude histologique du cerveau mais les critères diagnostiques actuellement définis permettent de faire le diagnostic sans trop de difficultés.
- Le scanner cérébral et l'imagerie par résonance magnétique sont normaux mais permettent d'éliminer d'autres maladies pouvant avoir des signes proches.
- Une scintigraphie cérébrale (DATscan) permettrait de montrer l'atteinte du striatum[57].
Diagnostic différentiel
Syndrome parkinsonien
- Syndromes parkinsoniens iatrogènes (lié aux médicaments) postneuroleptiques (butyrophénones, phénothiazines) mais aussi neuroleptiques atypiques et neuroleptiques cachés (ex. : Primpéran : métoclopramide). Il a également été décrit après l'emploi de certaines herbes (dont le kava[58]).
- Maladie de Wilson : diagnostic à évoquer chez un sujet jeune avec des antécédents familiaux, une atteinte du foie.
- Paralysie supranucléaire progressive (PSP) ou maladie de Steele-Richardson-Olszewski.
- Atrophie multi-systématisée : signes extrapyramidaux associés plus ou moins à des signes pyramidaux, dysautonomiques (hypotension orthostatique, impuissance) ou cérébelleux (troubles de l'équilibre).
- Dégénérescence cortico-basale : affection rare se traduisant par une apraxie, des signes extrapyramidaux unilatéraux.
- Démence à corps de Lewy : syndrome parkinsonien débutant chez le sujet âgé rapidement associé à des troubles cognitifs, des troubles attentionnels, du sommeil et des hallucinations visuelles.
- Parkinson vasculaire : accidents vasculaires touchant les noyaux gris centraux. La distinction entre un syndrome parkinsonien d'origine vasculaire et une maladie de Parkinson peut être difficile ; des tests olfactifs peuvent montrer de meilleures réponses lorsque la cause est vasculaire[59].
- Hydrocéphalie à pression normale : pas typiquement de syndrome parkinsonien mais des troubles de la marche sont évocateurs.
- Intoxications :
- exposition aux pesticides (fréquent), MPTP (toxicomanie)
- manganisme : intoxication chronique au manganèse par inhalation dans certaines professions (soudeurs, etc.) ou ingestion (teneur de manganèse trop importante de l'eau) pouvant provoquer un syndrome parkinsonien[60].
Tremblements non parkinsoniens
Il existe plus d'une vingtaine d'autres causes de tremblements, notamment la plus fréquente, le tremblement essentiel, qui est un tremblement lors des mouvements (ou dans le maintien d'attitude : tremblement postural), et non de repos, comme le tremblement parkinsonien. Seul un diagnostic posé par un neurologue permet de confirmer l'existence d'une pathologie précise.
Autres symptômes associés
Les symptômes non spécifiques pouvant donner l'aspect d'une dépression ou avoir une allure rhumatismale.
Évolution
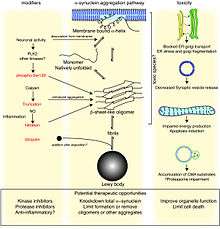
Depuis 1998 la maladie de Parkinson est classée, comme certaines maladies dégénératives plus rares, dans le groupe des synucléinopathies : dans ces pathologies, la protéine α-synucléine s'accumule et « empoisonne » les cellules. Il s'agit du principal composant des corps de Lewy, les indicateurs pathophysiologiques de la MP et du second composant en importance dans les plaques séniles distinctives de la maladie d'Alzheimer[62].
Premiers troubles
Les premiers symptômes de la maladies peuvent inclure des troubles du sommeil, de la digestion, de l'olfaction et de la vision des couleurs et des contrastes[6].
Les troubles du sommeil paradoxal entraînant des mouvements violents et, dans certains cas, des blessures chez le conjoint, apparaissent en moyenne treize ans avant les premiers symptômes moteurs. L'anosmie (déficit d'olfaction) étant présente, selon certaines études, chez 100 % des patients atteints de MP, son apparition, fréquemment considérée comme un aspect normal du vieillissement, pourrait être un symptôme avant-coureur plus alarmant. Selon une étude hollandaise, l'anosmie prédirait cinq ans à l'avance la maladie dans 12,5 % des cas — une performance cependant trop modeste pour appliquer le test d'anosmie isolément à toute la population[63]. La fatigue, un autre symptôme omniprésent chez les parkinsoniens, pourrait découler d'un processus ayant pour origine une dégénérescence de l'innervation du cœur. La présence de corps de Lewy dans cet organe et dans les nerfs sympathiques qui l'excitent, chez des patients atteints de MP, appuient cette hypothèse. Les nerfs du cœur pourraient bien être atteints avant le système sympathique.
La constipation, un symptôme encore non élucidé observé par James Parkinson, pourrait résulter d'une dégénérescence semblable, puisque des corps de Lewy tapissent diverses régions du tube digestif chez plusieurs, sinon tous les parkinsoniens. Une vaste étude prospective a montré que les personnes souffrant de constipation à l'âge adulte avaient quatre fois plus de risque que les autres d'être atteintes de MP plus tard. Les corps de Lewy dans le tube digestif et la constipation qui en résulte, selon l'hypothèse, pourraient être les premiers signes avant-coureurs de maladie, puisqu'ils apparaîtraient plus de quinze ans avant le diagnostic[64].
Symptômes moteurs
Les symptômes moteurs n'apparaissent que lorsque 50[2] à 70 % des neurones de la substance noire ont été détruits[65]. Les tubercules olfactifs et le locus cœruleus sont affectés précocement, ce qui entraîne des troubles de l'olfaction et du sommeil (agitation nocturne et cauchemars) initiaux[64],[66].
Ultérieurement, des structures impliquées dans la régulation motrice (substance noire) situées dans la partie haute du tronc cérébral vont être atteintes et entraîner les signes moteurs caractéristiques de la maladie. Enfin, après plusieurs décennies d'évolution, des structures corticales peuvent être touchées.
Une « personnalité parkinsonienne » a été décrite : elle serait caractérisée par une forme de rigidité psychologique qui annoncerait la rigidité motrice, un souci de contrôle et un perfectionnisme qui correspondent, en outre, à la description de l'état hypodopaminergique, qui est caractérisé principalement par un déficit dans la recherche de nouveauté (novelty seeking)[67].
Impact sur l'entourage de la personne malade
En France, le conjoint d'une personne atteinte de la maladie de Parkinson lui consacre en moyenne huit heures par jour. 52 % des conjoints de personnes souffrant de la maladie de Parkinson limitent les sorties du domicile sans le patient. 47 % des conjoints parkinsoniens font chambre à part ou utilisent des lits jumeaux, 46 % ont recours à une aide à domicile[68].
Au Québec, Chloé Sainte-Marie et Gilles Carle ont fondé le Réseau des aidants pour« sortir de l’isolement, être reconnus et pouvoir compter sur de l’aide[69],[70] ».
Épidémiologie
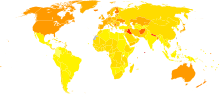
- Aucune donnée
- < 5
- 5–12.5
- 12.5–20
- 20–27.5
- 27.5–35
- 35–42.5
- 42.5–50
- 50–57.5
- 57.5–65
- 65–72.5
- 72.5–80
- > 80
La maladie de Parkinson est la seconde maladie neurodégénérative la plus fréquente après la maladie d'Alzheimer[22].
Sa prévalence (proportion dans une population à un instant donné) dans les pays occidentaux est d'environ 0,3 % dans la population générale. Elle augmente avec l’âge, atteignant 1 % chez les plus de 60 ans, et jusqu'à 4 % chez les plus de 80 ans[22]. Cependant, les études épidémiologiques dans cette tranche d'âge ne distinguent pas la maladie de Parkinson des syndromes parkinsoniens. L'âge moyen d'apparition de la maladie est d'environ 60 ans, même si 5 à 10 % des cas, classés comme précoces, commencent entre 20 et 50 ans[9]. La maladie de Parkinson pourrait être moins fréquente chez les personnes d'ascendance africaine et asiatique, ce qui reste contesté[22]. Les hommes seraient plus souvent atteints que les femmes mais les études ne sont pas unanimes sur ce point[71].
L'incidence de la maladie de Parkinson est comprise entre 8 et 18 pour 100 000 années-personnes[22] (nombre de nouveaux cas pour 100 000 personnes par an).
C'est la deuxième cause de handicap moteur majeur chez les sujets âgés après les accidents vasculaires cérébraux[72].
En France, en 2015, 160 000 personnes sont traitées pour la maladie de Parkinson et 26 000 nouveaux cas apparaissent par an[54].
En dehors des formes rares clairement d'origine purement génétique qui touchent des patients parfois dès 20 - 30 ans, la répartition de l'incidence de la maladie au sein des groupes de populations semble relativement homogène. Cette répartition semblait plus prévalente chez les populations noires d'origine africaine mais finalement de nouvelles études semblent indiquer qu'il n'y a pas de prévalence plus importante selon les ethnies. Les données ne sont pas cependant pas complémentent fiables suivant les pays[6].
Le nombre de patients en France a été multiplié par 2 entre 1993 et 2018 et une augmentation de 50 % d'ici à 2030 est attendue. Cette augmentation est due principalement à l'augmentation de l’espérance de vie, à un meilleur dépistage de la maladie ainsi qu'à d'autres facteurs environnementaux non clairement définis[6].
La maladie touche particulièrement les agriculteurs et les riverains des exploitations en particulier viticoles en raison de l'exposition aux pesticides[6].
Pronostic
La maladie de Parkinson ne réduit pas l'espérance de vie des malades[2]. Le risque de mortalité est à peu près doublé par rapport à une population non parkinsonienne, la cause la plus fréquente étant probablement les infections pulmonaires[73]. Les chutes sont une complication fréquente de la maladie[73].
Traitements

Médicaments
Il n'existe pas à l'heure actuelle de traitement curatif de la maladie chez l'humain. Les traitements médicamenteux restent donc aujourd'hui encore purement symptomatiques (agissant sur les symptômes). Les traitements sont aujourd'hui en 2018 assez puissants pour améliorer les symptômes principaux mais ne permettent pas de stopper la progression de la maladie[2].
Les symptômes sont rangés en deux catégories : moteurs et non-moteurs[74].
Sous l'influence des traitements et la progression de la maladie, les symptômes vont se modifier. Des mouvements anormaux (dyskinésies) apparaissent pouvant être parfois très impressionnants. Ce sont des mouvements parasites très variés des mouvements volontaires (ouverture-fermeture des yeux, grimace, mouvements de langue, de rotation de la tête, d'ascension d'une épaule, d'enroulement du bras ou de la jambe…)
Symptômes moteurs
DOPA
La L-DOPA est le traitement le plus utilisé car le plus actif. Ce médicament va être transformé en dopamine et utilisé par l’organisme. La transformation se passe dans le système nerveux central mais aussi dans tout l’organisme par la DOPA décarboxylase au niveau sanguin. Pour cette raison, ce traitement est couplé à un inhibiteur de la décarboxylase périphérique ou de la catéchol-O-méthyl transférase (COMT) qui permet de diminuer la transformation périphérique et ainsi de diminuer les effets secondaires tout en multipliant par 10 la disponibilité au niveau du système nerveux central. Les effets secondaires comme des nausées ou des vomissements sont devenus rares lorsque les doses sont progressivement augmentées.
La L-DOPA a une demi vie (temps au bout duquel la molécule est à moitié éliminée de l'organisme) comprise entre 1 h 30 et 3 h. Les prises du médicament seront donc répétées et régulières tout au long de la journée afin de maintenir un taux sanguin stable, et donc un effet clinique permanent. L'effet des médicaments va se modifier au cours du temps en raison d'une augmentation de la sensibilité des récepteurs cérébraux à la L-DOPA et de la diminution de la durée d'action de chaque prise de médicaments. Ces deux particularités vont respectivement entraîner des fluctuations d'effet et des dyskinésies (mouvements involontaires). Les fluctuations motrices peuvent être précoces. Le malade présente des états de blocage au cours de la journée imposant des modifications d'horaires et l'utilisation de formes à libération prolongée. Les dyskinésies surviennent le plus souvent au moment où les taux de L-DOPA sont le plus importants dans le sang. Elles peuvent être retardées par la prise d'agonistes dopaminergiques. Lorsque celles-ci surviennent, il est recommandé de diminuer la dose de la prise unitaire de L-DOPA.
- Diminution des effets secondaires
Les effets secondaires de la DOPA sont dus en bonne partie à son effet sur d'autres neurotransmetteurs et sur le métabolisme et le transport d'autres acides aminés. Il était donc souhaitable de veiller à ce que tyrosine, tryptophane, 5-hydroxytryptophane, sérotonine, cystéine, cystine et méthionine soient à des concentrations optimales, d'autant plus que la maladie de Parkinson diminue également les concentrations de sérotonine et de noradrénaline. En 2011, une étude sur 254 patients atteints de la maladie à divers degrés (certains avaient épuisé toutes les options couramment utilisées) a confirmé que les parkinsoniens avaient effectivement un besoin accru de plusieurs de ces molécules et que leur administration diminuait ou supprimait totalement les effets secondaires de la DOPA tout en préservant ses effets thérapeutiques, si bien qu'il a été possible de hausser librement la dose de DOPA pour atteindre les meilleurs résultats possibles. Ce protocole, baptisé OCT, est centré sur l'importante primordiale du transporteur de cations OCT. Les mesures de sérotonine et de dopamine urinaires permettent d'assurer un suivi rapproché de l'efficacité et de l'innocuité d'un traitement traditionnel longtemps perçu comme ayant de grands bienfaits contrebalancés par des hauts risques[75].
L'utilisation d'antagoniste des récepteurs A2A (Istradefylline)[76], molécule analogue de la caféine, en combinaison avec le traitement de L-DOPA permettrait d'améliorer le phénomène on/off relié à la L-DOPA. Celui-ci est disponible au Japon depuis mars 2013[77].
Agonistes de la dopamine
La deuxième grande catégorie de traitement médicamenteux est la classe des agonistes dopaminergiques : bromocriptine, cabergoline, pramipexole, ropinirole, pirebidil, lisurdide, apomorphine. Ces substances agissent directement sur les récepteurs postsynaptiques de la voie nigro-striée. Elles sont moins efficaces sur les symptômes moteurs que la L-DOPA. Elles sont néanmoins utilisées en premier intention chez le sujet jeune car elles retardent l'utilisation de la L-DOPA, qui favorise l'apparition de dyskinésies. Ces médicaments peuvent entraîner des effets indésirables à type de nausées, vomissements, œdèmes, hallucinations et troubles du contrôle des pulsions. La dernière classe thérapeutique agit en inhibant la monoamine oxidase, enzyme qui catabolise la dopamine. Les deux molécules utilisées dans ce but sont la sélégiline et la rasagiline. Ceux-ci peuvent remplacer pendant une courte durée la L-dopa au début de la maladie. Ils sont utilisés parfois en première intention surtout chez les patients les plus jeunes afin d'économiser la L-dopa.
Facteurs neurotrophes
Les facteurs neurotrophes forment une famille disparate de messagers cellulaires ayant pour rôle ou pour effet de stimuler le développement des neurones et leur survie une fois qu'ils sont à maturité. Ils sont également impliqués dans le processus de plasticité cérébrale qui est mis en mouvement à la suite d'une atteinte au cerveau. Parmi ceux-ci, le facteur neurotrophe dérivé de la glie (GDNF) s'avère particulièrement prometteur dans la maladie de Parkinson. Un dispositif d'injection est installé chirurgicalement à la base du cerveau pour que le GDNF soit administré directement dans le putamen. Le facteur neurotrophe est injecté quotidiennement et des améliorations sont observées variant autour de 40 % sur les échelles de gravité de la maladie (échelle UPDRS). La procédure comporte des dangers d'infections, comme toute intervention nécessitant un port permanent; le port doit alors être enlevé.
La Fondation Michael J. Fox subventionne la recherche sur une voie d'administration moins coûteuse et risquée, la voie intranasale, qui permet d'outrepasser la barrière hématoencéphalique.
Antioxydants
L'acide urique, mieux connu pour son rôle dans la goutte, est aussi un antioxydant présent chez l'homme et les grands singes dont les concentrations sont inversement proportionnelles à la gravité des symptômes dans la maladie de Parkinson[79]. La susceptibilité de la substance noire à l'oxydation est due à sa teneur en fer, qui accélère le taux de production de « rouille » cellulaire. Même la DOPA et la dopamine peuvent devenir toxiques au contact de métaux de transition comme le fer et le cuivre. L'acide urique est particulièrement intéressant dans la MP en raison de sa capacité à lier ces métaux, en plus de ses capacités antioxydantes intrinsèques[79]. L'acide urique et les autres antioxydants peuvent être mesurés dans des laboratoires spécialisés par l'entremise des hôpitaux et des spécialistes prenant en charge le patient[80].
Autres
D'autres traitements médicamenteux existent en particulier pour optimiser l'efficacité de la L-DOPA : tolcapone peut être proposée[73], entacapone.
L'importance de l'effet placebo est à noter dans cette maladie, avec une amélioration de près de 15 % des cas[81].
Symptômes non-moteurs
Les symptômes non moteurs peuvent apparaître avant les symptômes moteurs. Ceux-ci incluent la dysautonomie, l'insomnie, la somnolence diurne, la fatigue, la douleur et des symptômes neuropsychiatriques[74].
Traitements non médicamenteux
Mesures diététiques
Une alimentation riche en protéines pourrait réduire l'efficacité de la levodopa par compétition au niveau de son absorption intestinale. Mais les études n'ont pas confirmé l'intérêt d'une diète en protéines. La prise du médicament en début de repas est parfois conseillée[réf. nécessaire].
Exercices physiques
La pratique régulière d'exercices (éventuellement dans le cadre d'activités physiques adaptées) est essentielle pour maintenir mobilité, flexibilité, équilibre et pour combattre les effets et symptômes secondaires. De plus, la pratique régulière d'un sport permet d'augmenter la sécrétion naturelle de dopamine[82]. Les résultats concrets des effets de la réadaptation physique sur la maladie de Parkinson montrent une amélioration fonctionnelle notable[83].
À l'initiative de la Mutualité française par exemple, des groupes de musicothérapie active utilisent le chant pour atténuer les effets de la maladie[84][réf. insuffisante].
La pratique d'exercices physiques intenses permettrait également de ralentir la progression de la maladie et ainsi retarder la prise de médicaments selon une étude menée à l'Université Northwestern[85],[86]. Il existe des preuves expérimentales chez l'animal qu'un effort intense et une alimentation pauvre ralentisse la progression de la maladie[2].
Stimulation rythmique auditive
La stimulation rythmique auditive (SRA) est une technique de rééducation neurologique consistant à compenser une perte de régulation motrice, survenant dans le cadre d’atteintes neurologiques à conséquence sur le plan moteur, par une stimulation sensorielle externe, médiée par le son. Le patient va synchroniser ses pas sur la stimulation perçue et pourra développer une marche plus fluide et rythmée.
Cette technique est utilisée en rééducation par les kinésithérapeutes afin de soutenir des exercices impliquant un travail du rythme.
De nombreuses études démontrant une amélioration de la longueur de foulée et de la vitesse de marche lors de l’utilisation de la SRA dans le cadre de la maladie de Parkinson[87].
Des dispositifs mettant en œuvre cette technique sont aujourd’hui proposés, dans une optique de rendre accessible l’auto-rééducation à domicile et de permettre aux patients de conserver une activité physique régulière[88].
Rééducation orthophonique
Pour les troubles de la parole, la déglutition et la micrographie. La rééducation du langage vise à lutter contre la parésie des muscles de la face. Elle est souvent trop tardivement prescrite par les médecins.
Sous l'impulsion de Joseph Sohet, patient, et de Claude Frémont, orthophoniste, un recueil de textes aux phonèmes spécialisés est édité[89].
Stimulation cérébrale profonde

La stimulation cérébrale profonde (SCP) est un traitement chirurgical efficace sur les trois symptômes moteur de la maladie de Parkinson : tremblements, raideur et akinésie. Elle a été pratiquée pour la première fois chez l'être humain en 1993 par l'équipe de Alim-Louis Benabid et Pierre Pollak à Grenoble, après des études menées chez le primate non-humain par Abdelhamid Benazzouz à Bordeaux[90]. La SCP est aujourd'hui réalisée sur des patients dans plusieurs hôpitaux français, et à travers le monde. Le centre Clinatec en réalise à l'aide de dispositifs nanométriques élaborés sur place.
L'opération consiste à implanter deux électrodes dans une région cérébrale précise. Généralement, il s'agit du noyau sous-thalamique. Ces régions d'implantation sont déterminées grâce à une IRM préopératoire. Les électrodes sont ensuite reliées à un neurostimulateur. Ce dernier est implanté sous la peau au niveau de la région sous-claviculaire ou abdominale. Le neurostimulateur générera par la suite de faibles impulsions électriques. Ces impulsions vont interrompre le signal émis par le cerveau responsables des symptômes moteur de la maladie. Les mécanismes qui atténuent ainsi ces signaux sont encore mal connus. Cette information devrait demander une certaine prudence dans l'utilisation de la SCP.
La stimulation cérébrale profonde (SCP) permet d'obtenir les mêmes résultats que les traitements médicamenteux (L-DOPA), les effets secondaires en moins. Ainsi, il est possible dans la plupart des cas d'alléger le traitement médicamenteux des patients, jusqu'à une diminution des doses de 50 %. Cependant, les deux options thérapeutiques sont complémentaires. Le traitement chirurgical n'est, en aucun cas, une alternative au traitement médicamenteux.
La SCP nécessitant des opérations chirurgicales, elle présente les mêmes risques que toute autre chirurgie. Ces risques sont principalement de nature hémorragique et infectieuse. De plus, le fait que le dispositif implanté traverse des parties du cerveau peut potentiellement engendrer des complications neurologiques. Cependant, la mortalité chirurgicale, difficile à évaluer, est très faible.
La SCP nécessite une intervention lourde, c'est pourquoi les candidats à l'opération doivent répondre à des critères bien précis. Le patient doit développer la maladie depuis au moins 5 ans et ne présenter ni trouble cognitif sévère, ni troubles psychiatriques. Une bonne sensibilité à la L-DOPA est un critère essentiel de sélection, car elle est prédictive de l'efficacité de la SCP. Enfin, l'âge en soi n'est pas un critère discriminant, mais certaines maladies dont la fréquence augmente avec l'âge le sont. Les patients aptes à subir l'opération ne représentent que 10 % de la population malade. En France, les critères pour être éligible à une stimulation électrique profonde sont ne pas présenter de troubles cognitifs, avoir de moins de 70 ans et présenter les signes caractéristiques susceptibles d'être amélioré par la stimulation électrique profonde[2].
Stimulation magnétique transcrânienne
La stimulation magnétique transcrânienne (SMT) est, comme la stimulation cérébrale profonde, un traitement par stimulation électrique du cerveau. Cette technique est à l'étude depuis 2004 et continue d'être évaluée, notamment par le Dr David Benninger au sein du CHUV, en Suisse[91]. Des patients volontaires reçoivent actuellement de brèves impulsions magnétiques délivrées par une bobine placée sur leur cuir chevelu. Ces impulsions ne provoquent aucune douleur. Elles sont censées moduler l'activité des neurones du cortex moteur. Cette région du cerveau est en effet à l'origine des mouvements des muscles.
Cette technique non-invasive est bien moins lourde que la SCP. Elle pourrait donc concerner un plus grand nombre de patients et constitue ainsi un espoir pour les chercheurs.
Recherche de nouveaux traitements
Thérapie génique
Cette technique consiste à injecter dans certains zones du système nerveux central des vecteurs viraux porteurs de certains gènes. Ces gènes vont être intégrés dans le génome des cellules hôtes et sécréter des substances neuroprotectrices ou des enzymes intervenant dans la synthèse de neuromédiateurs. Des études préliminaires ont montré des premiers résultats positifs en ce qui concerne la tolérance chez l'être humain, mais l'efficacité clinique reste à démontrer[92].
Cellules souches
Il s'agit d'une piste thérapeutique majeure qui consiste à transplanter des cellules souches dans le striatum. Ces cellules sont totipotentes et peuvent en théorie se transformer en cellules neurales. Il existe encore de nombreux obstacles, en particulier liés au risque de cancérisation, avant d'envisager une utilisation thérapeutique chez l'être humain. Les résultats restent inconstants, avec une amélioration plus visible chez les jeunes patients[93] et qui persiste à très long terme[94].
La difficulté d'obtention des cellules, la lourdeur de la méthode et la nécessité d'immunosuppression ont limité le développement de cette technique.
Stimulation électrique de la moelle épinière
Un traitement par stimulation électrique de la moelle épinière est également à l'étude et donne en mars 2009 des résultats très prometteurs lors des premiers tests sur des souris et des rats[95],[96].
Immunothérapie
Un traitement prometteur à base d’anticorps monoclonaux ciblant les dépôts de protéines α-synucléines pour les détruire[97] est en mai 2018 entré dans la phase II de l’étude clinique avec de 300 patients[47]. Le but du traitement est de ralentir le processus dégénératif, voire de le stopper[97]. Les patients reçoivent une perfusion par mois.
Injection de venin d'abeille
En 2013, à la suite d'une observation clinique à San Francisco[98], des chercheurs ont découvert que l'apamine, un des composants actifs du venin d'abeille, semblait capable de freiner la dégénérescence des neurones dopaminergiques. Ils ont ensuite réalisé des tests sur des souris et ont constaté l'efficacité de cette technique. Chez certaines souris, des effets secondaires ont toutefois également été observés à la suite de l'administration du venin d'abeille. Les chercheurs restent donc prudents, conscients du risque de réactions allergiques potentiellement fatales, mais ont tout de même formulé l'hypothèse que les allergènes contribuaient peut-être à l’effet protecteur des neurones dopaminergiques[99].
Chélateur de fer
En 2014, en se basant sur l'hypothèse que dans les maladies neurodégénératives, notamment la maladie de Parkinson, il existe une accumulation du taux de fer dans certaines régions du cerveau[100], un essai a été réalisé avec un chélateur de fer, une molécule capable de capturer le fer pour en permettre l'élimination. La défériprone, déjà commercialisée dans le traitement de la bêta-thalassémie, a montré à 12 mois de traitement une amélioration des symptômes[101],[102]. Néanmoins, cette étude concernait un petit échantillon de patients et doit être confirmée sur une plus grande population. Un essai européen a débuté en 2015[103].
Voie sérotoninergique
La maladie de Parkinson implique la dégénérescence de la voie dopaminergique ainsi que de multiples voies non dopaminergiques telles que la voie sérotoninergique.
Voie cholinergique
La plupart des systèmes cholinergiques, muscariniques et nicotiniques sont affectés par la maladie de Parkinson. Les médicaments anticholinergiques ont été les premiers utilisés en maladie de Parkinson, mais avec une efficacité limitée.
Des études ont aussi démontré un effet protecteur de la nicotine sur la dégénérescence liée à la maladie. En effet, une corrélation inverse entre la consommation de cigarette et l'apparition de la maladie[104].
Inhibiteur de neurotoxicité de l'α-synucléine
Le CLR01, un inhibiteur de la neurotoxicité de l'α-synucléine, a aboli l'agrégation et la toxicité de cette molécule, in vitro, et a amélioré significativement le phénotype et la survie d'un nouveau modèle animal d'α-synucléinopathie (un poisson zèbre mutant ; dans le groupe contrôle, tous les mutants sont morts après deux à trois jours)[105].
Maladie professionnelle
En France, la maladie de Parkinson est reconnue maladie professionnelle par la mutualité sociale agricole depuis 2012. Les agriculteurs ayant manipulé des pesticides pendant au moins 10 ans sont susceptibles d'être pris en charge à 100% et être indemnisés[32].
Histoire et société
Historique

Plusieurs sources anciennes, incluant un papyrus de l'ancienne Égypte, un traité de médecine ayurvédique, la Bible ou des textes de Galien, décrivent des symptômes semblables à ceux observés dans la maladie de Parkinson[106].
Après Galien (IIe siècle), on ne retrouve pas de descriptions décrivant un tableau de Parkinson jusqu'au XVIIe siècle[106]. Aux XVIIe et XVIIIe siècles, plusieurs auteurs écrivent sur le sujet, notamment Sylvius, Gaubius, Hunter et Chomel[106],[107],[108].
En 1817, un médecin anglais, James Parkinson, publie une description claire et détaillée de six patients présentant les symptômes de la maladie qui porte maintenant son nom, et qu'il dénomme alors paralysis agitans[109]. An Essay on the Shaking Palsy décrit le tremblement de repos caractéristique, la posture et la démarche anormales, la paralysie et la diminution de la force musculaire, ainsi que l'évolution de la maladie au fil du temps[109],[110]. Les premiers neurologues à avoir étudié la maladie sont Armand Trousseau, Gowers, Kinnier Wilson et Wilhelm Erb. Et particulièrement Jean-Martin Charcot, dont les études effectuées entre 1868 et 1881 constituent une étape majeure dans la compréhension de la maladie[109]. Il fit entre autres la distinction entre la rigidité, la faiblesse et la bradykinésie et défendit le renommage de la maladie en l'honneur de James Parkinson[109].
En 1911, Frederic Lewy décrit les particules microscopiques présentes dans les cerveaux atteints, plus tard appelées « corps de Lewy[109] ». En 1919, Konstantin Tretiakoff rapporte que la substantia nigra est la principale structure cérébrale touchée, fait qui ne sera reconnu que tardivement, après d'autres études publiées par Rolf Hassler en 1938[109]. Les modifications biochimiques au niveau cérébral furent identifiées dans les années 1950, surtout grâce aux travaux de Arvid Carlsson sur la dopamine, un neurotransmetteur sécrétée par le locus niger et dont la diminution joue une rôle majeur dans la maladie de Parkinson[111]. La démonstration d'une diminution cérébrale en dopamine dans la maladie de Parkinson a été publié en 1960 par Ehringer et Hornykiewicz[112]. En 1997, il est découvert que l'α-synucléine est le composant principal des corps de Lewy[113].
Les anticholinergiques et la chirurgie (par lésion du faisceau pyramidal ou des ganglions de la base) étaient les seuls traitements disponibles jusqu'à l'arrivée de la levodopa, qui réduisit considérablement leur utilisation[107],[114]. La Levodopa fut synthétisée pour la première fois en 1911 par Casimir Funk, mais on[Qui ?] s'y intéressa peu jusqu'au milieu du XXe siècle[111]. Elle est entrée dans la pratique clinique en 1967 et a apporté une véritable révolution dans la prise en charge thérapeutique de la maladie de Parkinson[111],[115]. À la fin des années 1980, la stimulation cérébrale profonde devint un nouveau traitement possible[116].
Société et médias
Personnalités
Cette section ne cite pas suffisamment ses sources (octobre 2010). Pour l'améliorer, ajoutez des références vérifiables [comment faire ?] ou le modèle {{Référence nécessaire}} sur les passages nécessitant une source. |
Personnes célèbres atteintes d'une maladie de Parkinson :
- le chef cuisinier Paul Bocuse ;
- le pape Jean-Paul II ;
- le cardinal français à la curie romaine Jean-Louis Tauran ;
- le prédicateur évangéliste Billy Graham[117] ;
- l'acteur américano-canadien Michael J. Fox ;
- le romancier, poète et illustrateur anglais, Mervyn Peake ;
- le boxeur américain Mohamed Ali ;
- le basketteur américain Brian Grant ;
- le metteur en scène québécois Gilles Carle ;
- le pilote automobile américain Phil Hill ;
- le chanteur américain Maurice White, membre du groupe Earth, Wind and Fire ;
- l'homme d'État Yasser Arafat ;
- le général Franco ;
- probablement Adolf Hitler[118] ;
- l'actrice et humoriste française Sylvie Joly[119] ;
- le chanteur et musicien français Pierre Vassiliu[120] ;
- l'acteur Bob Hoskins[121] ;
- la soprano française Mady Mesplé[122], qui a écrit La voix du corps, un livre sur le sujet ;
- l'écrivain et dessinateur humoristique français François Cavanna[123].
- l'acteur américain Robin Williams[124].
- la chanteuse de country américaine Linda Ronstadt[125]
- la couturière Sonia Rykiel
- l'actrice britannique Deborah Kerr[126]
Notes et références
- (en) X. Mao, M. Tianhao Ou, S.S. Karuppagounder et al., « Pathological α-synuclein transmission initiated by binding lymphocyte-activation gene 3 », Science, vol. 353, no 6307, (DOI 10.1126/science.aah3374, résumé)
- « Parkinson : où en est la recherche ? », France Inter, (lire en ligne)
- (en) P.D. Smith, S.J. Crocker, V. Jackson-Lewis et al., « Cyclin-dependent kinase 5 is a mediator of dopaminergic neuron loss in a mouse model of Parkinson's disease », PNAS, vol. 100, no 23, , p. 13650-13655 (DOI 10.1073/pnas.2232515100, lire en ligne [PDF])
- (en) Dianbo Qu et al., « Role of Cdk5-Mediated Phosphorylation of Prx2 in MPTP Toxicity and Parkinson's Disease », Neuron, vol. 55, no 1, , p. 37-52 (DOI 10.1016/j.neuron.2007.05.033, lire en ligne [PDF])
- (en) Serge Przedborski, « Peroxiredoxin-2 links Cdk5 to neurodegeneration », Nat. Med., vol. 13, , p. 907-909 (DOI 10.1038/nm0807-907)
- Marie Vidailhet, Etienne Hirsch, « Maladie de Parkinson : fera-t-elle toujours trembler la recherche ? », La méthode scientifique, (lire en ligne)
- (en) C.M. Tanner, R. Ottman, S.M. Goldman, J. Ellenberg, P. Chan, R. Mayeux et J.W. Langston, « Parkinson Disease in Twins : An Etiologic Study », JAMA, vol. 281, (lire en ligne)
- (en) « Ageing and Parkinson's disease: Why is advancing age the biggest risk factor? », Ageing Research Reviews, vol. 14, , p. 19–30 (ISSN 1568-1637, DOI 10.1016/j.arr.2014.01.004, lire en ligne)
- (en) Samii A, Nutt JG, Ransom BR, « Parkinson's disease », Lancet, vol. 363, no 9423, , p. 1783–93 (PMID 15172778, DOI 10.1016/S0140-6736(04)16305-8)
- (en) Lesage S, Brice A, « Parkinson's disease: from monogenic forms to genetic susceptibility factors », Hum Mol Genet., vol. 18, no R1, , R48–59 (PMID 19297401, DOI 10.1093/hmg/ddp012)
- (en) Healy DG, Falchi M, O-Sullivan SS et al. « Phenotype, genotype, and worldwide genetic penetrance of LRRK2-associated Parkinson's disease: a case-control study » Lancet Neurol. 2008;7: 583-590
- Suzanne Lesage, « LRRK2, gène majeur de la maladie de Parkinson dans les pays du Maghreb » Med Sci. (Paris)2006;22(5):470-471.
- Article du centre Helmholtz de Munich (11/01/2010)
- (de) « Erblicher Risikofaktor für Parkinson identifiziert : Genvariante wirkt sich auf Vitamin B6-Stoffwechsel aus », LMU,
- (en) Diana Kwon, « Does Parkinson's Begin in the Gut? », Scientific American, (lire en ligne)
- (en) « Gastric α-synuclein immunoreactive inclusions in Meissner's and Auerbach's plexuses in cases staged for Parkinson's disease-related brain pathology », Neuroscience Letters, vol. 396, no 1, , p. 67–72 (ISSN 0304-3940, DOI 10.1016/j.neulet.2005.11.012, lire en ligne)
- (en) Staffan Holmqvist, Oldriska Chutna, Luc Bousset et Patrick Aldrin-Kirk, « Direct evidence of Parkinson pathology spread from the gastrointestinal tract to the brain in rats », Acta Neuropathologica, vol. 128, no 6, , p. 805–820 (ISSN 0001-6322 et 1432-0533, DOI 10.1007/s00401-014-1343-6, lire en ligne)
- (en-GB) Fiona MacDonald, « New Evidence Suggests Parkinson's Might Start in The Gut, Not The Brain », ScienceAlert, (lire en ligne)
- (en) Timothy R. Sampson, Justine W. Debelius, Taren Thron et Stefan Janssen, « Gut Microbiota Regulate Motor Deficits and Neuroinflammation in a Model of Parkinson’s Disease », Cell, vol. 167, no 6, , p. 1469–1480.e12 (ISSN 0092-8674, DOI 10.1016/j.cell.2016.11.018, lire en ligne)
- (en) « Gut microbes promote motor deficits in a mouse model of Parkinson's disease », ScienceDaily, (lire en ligne)
- (en) Blanchet PJ, Calon F, Morisette M, Tahar AH, Bélanger N, Samadi Pershia, Grondin R, Grégoire L, Meltzer L et & al, « Relevance of the MPTP primate model in the study of dyskinesia priming mechanisms », Parkinsonism & Rekated Disorders, vol. 10, , p. 297-304 (ISSN 1353-8020, lire en ligne)
- (en) de Lau LM, Breteler MM, « Epidemiology of Parkinson's disease », Lancet Neurol., vol. 5, no 6, , p. 525–35 (PMID 16713924, DOI 10.1016/S1474-4422(06)70471-9)
- (en) Veterans and Agent Orange: Update 2008, Washington, The National Academies press, (ISBN 0-309-13884-1, lire en ligne), « Neurologic disorders », p. 510–45
- (en) A Ascherio, H Chen, M Weisskopf, E O'Reilly, M McCullough, E Calle, M Schwarzschild, M Thun, Pesticide exposure and risk for Parkinson's disease, Annals of Neurology, 2006;60;197-203
- (en) Giasson BI, Lee VMY, A new link between pesticides and Parkinson's disease, Nature Neuroscience, 2000;3:1227-1228
- (en) Wang A, Costello S, Cockburn M et al. Parkinson’s disease risk from ambient exposure to pesticides, Europ J Epidemiol, 2011 DOI:10.1007/s10654-011-9574-5
- (en) Tanner CM, Kamel F, Ross GW, et al., « Rotenone, Paraquat and Parkinson's Disease », Environ Health Perspect., (PMID 21269927, DOI 10.1289/ehp.1002839)
- avec AFP, « Parkinson : les pesticides doublent le risque chez les agriculteurs », Le Monde.fr, (lire en ligne)
- Angela Bolis, « Le lien entre la maladie de Parkinson et les pesticides officiellement reconnu », Le Monde.fr, (lire en ligne)
- « Le lien entre la maladie de Parkinson et les pesticides enfin reconnu », L'Humanité.fr, (lire en ligne)
- Décret n° 2012-665 du 4 mai 2012 révisant et complétant les tableaux des maladies professionnelles en agriculture annexés au livre VII du code rural et de la pêche maritime, (lire en ligne)
- « Certains pesticides et solvants augmentent le risque de Parkinson - Neuromedia », Neuromedia, (lire en ligne)
- (en) G. Pezzoli et E. Cereda, « Exposure to pesticides or solvents and risk of Parkinson disease », Neurology, vol. 80, no 22, , p. 2035–2041 (ISSN 0028-3878 et 1526-632X, DOI 10.1212/WNL.0b013e318294b3c8, lire en ligne)
- « Maladie de Parkinson : les solvants organiques sont liés à des symptômes plus sévères », Caducee.net, (lire en ligne)
- (en) Samuel M. Goldman, Patricia J. Quinlan, G. Webster Ross et Connie Marras, « Solvent exposures and parkinson disease risk in twins », Annals of Neurology, vol. 71, no 6, , p. 776–784 (ISSN 0364-5134, PMID 22083847, PMCID PMC3366287, DOI 10.1002/ana.22629, lire en ligne)
- Collège des enseignants de neurologie, référentiel national, (lire en ligne)
- (en) Rugbjerg K, Ritz B, Korbo L, Martinussen N, Olsen JH, Risk of Parkinson’s disease after hospital contact for head injury: population based case-control study, BMJ, 2008;337:a2494
- (en) Dr Testerman Traci, « Bacteria 'linked' to Parkinson's disease », BBC Online, consulté le 23 mai 2011.
- Agence française de sécurité sanitaire des aliments, « Avis de l’Agence française de sécurité sanitaire des aliments relatif aux risques liés à la consommation de corossol et de ses préparations », saisine n° 2008-SA-0171, , p. 2 (lire en ligne)
- (en) Allam MF, Campbell MJ, Hofman A, Del Castillo AS, Navajas R Fernández-Crehuet, Smoking and Parkinson's disease: systematic review of prospective studies, Mov Disord, 2004;19:614-621
- (en) Castagnoli K, Murugesan T, « Tobacco leaf, smoke and smoking, MAO inhibitors, Parkinson's disease and neuroprotection; are there links? », Neurotoxicology, vol. 25, nos 1–2, , p. 279–91 (PMID 14697903, DOI 10.1016/S0161-813X(03)00107-4)
- (en) http://clinicaltrials.gov/ct2/show/NCT00873392?term=nicotine+parkinson&rank=1
- Présentation de l'essai clinique Nicopark2 sur le site de l'OMS.
- (en) Costa J, Lunet N, Santos C, Santos J, Vaz-Carneiro A, « Caffeine exposure and the risk of Parkinson's disease: a systematic review and meta-analysis of observational studies », J. Alzheimers Dis., vol. 20, no Suppl 1, , S221–38 (PMID 20182023, DOI 10.3233/JAD-2010-091525)
- (en) Hernán MA, Takkouche B, Caamaño-Isoma F et al. A meta-analysis of coffee drinking, cigarette smoking, and risk of Parkinson’s disease, Ann Neurol, 2002;52:276–84
- (en) Bousquet M, Calon F et Cicchetti F, « Impact of omega-3 fatty acids in Parkinson's disease », Ageing Research Reviews, , p. 453-463 (ISSN 1568-1637, lire en ligne)
- « L’immunothérapie, enfin une avancée pour les malades de Parkinson », leparisien.fr, (lire en ligne)
- Elisabeth Svensson, Erzsébet Horváth-Puhó, Reimar W. Thomsen et Jens Christian Djurhuus, « Vagotomy and subsequent risk of Parkinson's disease », Annals of Neurology, vol. 78, , p. 522-529 (ISSN 1531-8249, PMID 26031848, DOI 10.1002/ana.24448, lire en ligne)
- Horacio Kaufmann, « Cutting the vagal highway blocks one point of entry for prion-like alpha-synuclein », Annals of Neurology, vol. 78, , p. 520-521 (ISSN 1531-8249, PMID 26224086, DOI 10.1002/ana.24492, lire en ligne)
- Ting Wang et Jesse C. Hay, « Alpha-synuclein Toxicity in the Early Secretory Pathway: How It Drives Neurodegeneration in Parkinsons Disease », Frontiers in Neuroscience, vol. 9, (ISSN 1662-4548, PMID 26617485, PMCID 4641903, DOI 10.3389/fnins.2015.00433, lire en ligne)
- « Prévenir la maladie de Parkinson en mangeant des poivrons ? », CARE STORE / PASOLO.com, (lire en ligne)
- « Parkinson: la gymnastique, un effort salvateur pour freiner la maladie », Médecine, santé, forme et bien-être - ra-sante, (lire en ligne)
- Internet Archive. org : Présentation et accès au livre ; Charcot, J. M. (Jean Martin), 1825-1893; Bourneville, b. 1840 Volume: 2 Subject: Nervous system -- Diseases Ed : A. Delahaye, Paris)
- Santé publique France, « Fréquence de la maladie de Parkinson en France en 2015 et évolution jusqu’en 2030 », Bull Epidémiol Hebd, , p. 128-40 (lire en ligne)
- (en) Doty RL, Bromley SM, Stern MB. « Olfactory testing as an aid in the diagnosis of Parkinson's disease: development of optimal discrimination criteria » Neurodegeneration 1995;4:93-97
- (en) M. Pandya, C. S. Kubu et M. L. Giroux, « Parkinson disease : Not just a movement disorder », Cleveland Clinic Journal of Medicine, vol. 75, no 12, , p. 856-864 (DOI 10.3949/ccjm.75a.07005)
- (en) Kimberly D. Seifert et Jonathan I. Wiener, « The impact of DaTscan on the diagnosis and management of movement disorders: A retrospective study », Am J Neurodegener Dis., vol. 2, no 1, , p. 29–34 (PMCID PMC3601468, lire en ligne [html])
- (en) Meseguer E, Taboara R, Sánchez V, Mena MA, Campos V, De Yébenes J García « Life-threatening Parkinsonism induced by kava kava » Mov Disord. 2002;17:193-196
- (en) L'olfaction permet de différencier un syndrome parkinsonien d'origine vasculaire d'une maladie de Parkinson
- Document sur le manganisme publié par l'Institut de recherche Robert-Sauvé en Santé et en Sécurité du Travail [PDF]
- (en) Cookson MR, « alpha-Synuclein and neuronal cell death », Mol Neurodegener., vol. 4, , p. 9 (PMID 19193223, PMCID 2646729, DOI 10.1186/1750-1326-4-9, lire en ligne)
- (en) Krüger R, Müller T, Riess O, « Involvement of alpha-synuclein in Parkinson's disease and other neurodegenerative disorders », J Neural Transm., vol. 107, no 1, , p. 31–40 (PMID 10809401)
- (en) Berendse HW, Ponsen MM, « Diagnosing premotor Parkinson's disease using a two-step approach combining olfactory testing and DAT SPECT imaging », Parkinsonism Relat Disord., vol. 15 Suppl 3, , S26–30 (PMID 20083001, DOI 10.1016/S1353-8020(09)70774-6)
- (en) Langston JW, « The Parkinson's complex: parkinsonism is just the tip of the iceberg », Ann Neurol., vol. 59, no 4, , p. 591–6 (PMID 16566021, DOI 10.1002/ana.20834)
- (en) « Parkinson's Progress »
- (en) Siderowf A, Stern MB, « Premotor Parkinson's disease: clinical features, detection, and prospects for treatment », Ann Neurol., vol. 64 Suppl 2, , S139–47 (PMID 19127581, DOI 10.1002/ana.21462)
- (en) Ronald F. Pfeiffer, Iván Bódis-Wollner. Parkinson's disease and nonmotor dysfunction
- « Étude Compas »(Archive • Wikiwix • Archive.is • Google • Que faire ?)
- « Communiqué de presse - lancement du Réseau des aidants »(Archive • Wikiwix • Archive.is • Google • Que faire ?) (consulté le 30 mars 2013)
- reseaudesaidants.org, le site Internet du réseau
- (en) Twelves D, Perkins KS, Counsell C. Systematic review of incidence studies of Parkinson's disease, Mov Disord. 2003;18:19-31
- « Épidémiologie de la maladie de Parkinson » La lettre du neurologue janvier 2004; p. 13-15
- (en) Lees AJ, Hardy J, Revesz T, Parkinson's disease, Lancet, 2009;373:2055-2066
- (en) Tysnes OB, Müller B, Larsen JP, « Are dysautonomic and sensory symptoms present in early Parkinson's disease? », Acta Neurol Scand., Suppl., no 190, , p. 72–7 (PMID 20586740, DOI 10.1111/j.1600-0404.2010.01380.x)
- (en) Hinz M, Stein A, Uncini T, « Amino acid management of Parkinson's disease: a case study », Int J Gen Med., vol. 4, , p. 165–74 (PMID 21475622, DOI 10.2147/IJGM.S16621, lire en ligne)
- (en) Morelli M, Di Paolo T, Wardas J, Calon F, Xiao D et Schwarzschild M.A, « Role of adenosine A2A receptors in parkinsonian motor impairment and L-DOPA-induced motor complications », Progress in Neurobiology, vol. 83, , p. 293-309 (ISSN 0301-0082, lire en ligne)
- (en) Dungo R et Deeks E.D, « Istradefylline : First Global Approval », Drugs, vol. 73, , p. 875-882 (ISSN 1179-1950, lire en ligne)
- (en) Hashim H, Azmin S, Razlan H, Yahya NW, Tan HJ, Manaf MR, Ibrahim NM, « Eradication of Helicobacter pylori infection improves levodopa action, clinical symptoms and quality of life in patients with Parkinson's disease », PLoS One, vol. 9, no 11, , e112330. (PMID 25411976, PMCID PMC4239049, DOI 10.1371/journal.pone.0112330, lire en ligne [html])
- (en) Ascherio A, LeWitt PA, Xu K. et al., « Urate as a predictor of the rate of clinical decline in Parkinson disease », Arch Neurol., vol. 66, no 12, , p. 1460–8 (PMID 19822770, PMCID 2795011, DOI 10.1001/archneurol.2009.247)
- (en) Schipper HM, « Redox neurology: visions of an emerging subspecialty », Ann N. Y. Acad Sci., vol. 1012, , p. 342–55 (PMID 15105277)
- (en) Goetz CG, Wuu J, McDermott MP et al. Placebo response in Parkinson's disease: comparisons among 11 trials covering medical and surgical interventions, Mov Disord, 2008;23:690-699
- Rôle du sport sur le circuit de la récompense
- (en) Keus SH, Bloem BR, Hendriks EJ et al. Evidence-based analysis of physical therapy in Parkinson's disease with recommendations for practice and research, Mov Disord. 2007;22:451-460
- Des groupes de musicothérapie active utilisant le chant font l'objet d'essais
- « L'exercice intensif peut aider les malades de Parkinson - L'actu GDD », sur blog.pharma-gdd.com (consulté le 14 décembre 2017)
- (en) Margaret Schenkman, Charity G. Moore, Wendy M. Kohrt et Deborah A. Hall, « Effect of High-Intensity Treadmill Exercise on Motor Symptoms in Patients With De Novo Parkinson Disease », JAMA Neurology, (DOI 10.1001/jamaneurol.2017.3517, lire en ligne)
- Sandi J. Spaulding, Brittany Barber, Morgan Colby et Bronwyn Cormack, « Cueing and gait improvement among people with Parkinson's disease: a meta-analysis », Archives of Physical Medicine and Rehabilitation, vol. 94, no 3, , p. 562–570 (ISSN 1532-821X, PMID 23127307, DOI 10.1016/j.apmr.2012.10.026, lire en ligne)
- « WalkMe by Resilient : retrouvez le plaisir de la marche », sur www.walkmebyresilient.com (consulté le 29 décembre 2017)
- Pot-pourri parkinsonien, ouvrage. Nouméa, éd. C. Frémont, 2007, 69 p. (OCLC 470728325)
- (en) Benazzouz A, Gross C, Féger J, Boraud T, Bioulac B. « Reversal of rigidity and improvement in motor performance by subthalamic high-frequency stimulation in MPTP-treated monkeys » Eur J Neurosci. 1993;5(4):382-9.
- (en) Benninger DH, Berman BD, Houdayer E, Pal N, Luckenbaugh DA, Schneider L, Miranda S, Hallett M., « Intermittent theta-burst transcranial magnetic stimulation for treatment of Parkinson disease », Neurology., vol. 76, no 7, , p. 601-9. (PMID 21321333, PMCID PMC3053339, DOI 10.1212/WNL.0b013e31820ce6bb, lire en ligne [html])
- (en) Marks WJ, Ostrem JL, Verhagen L et al. « Safety and tolerability of intraputaminal delivery of CERE-120 (adeno-associated virus serotype 2-neurturin) to patients with idiopathic Parkinson's disease: an open-label, phase I trial » Lancet Neurol. 2008;7:400-408
- (en) Freed CR, Greene PE, Breeze RE et al. « Transplantation of embryonic dopamine neurons for severe Parkinson's disease » N Engl J Med. 2001;344:710-719
- Bega D, Krainc D, Long-term clinical outcomes after fetal cell transplantation in Parkinson disease, implications for the future of cell therapy, JAMA, 2014;311:617-618
- (en) Fuentes R, Petersson P, Siesser WB, Caron MG, Nicolelis MA, « Spinal cord stimulation restores locomotion in animal models of Parkinson's disease » Science 2009;323:1578-1582 sciencemag.org]
- « Un simulateur de la moelle épinière offre un nouvel espoir contre Parkinson » Le Point.
- « L’immunothérapie, «un nouvel espoir pour les malades de Parkinson» », leparisien.fr, (lire en ligne)
- « Bee Venom and Its Component Apamin as Neuroprotective Agents in a Parkinson Disease Mouse Model » MyScienceWork
- « Le venin d'abeille contre la maladie de Parkinson » MyScienceWork
- E. C. Hirsch, J. P. Brandel, P. Galle et F. Javoy-Agid, « Iron and aluminum increase in the substantia nigra of patients with Parkinson's disease: an X-ray microanalysis », Journal of Neurochemistry, vol. 56, , p. 446-451 (ISSN 0022-3042, PMID 1988548, lire en ligne)
- David Devos, Caroline Moreau, Jean Christophe Devedjian et Jérome Kluza, « Targeting Chelatable Iron as a Therapeutic Modality in Parkinson's Disease », Antioxidants & Redox Signaling, vol. 21, , p. 195-210 (ISSN 1523-0864, PMID 24251381, PMCID 4060813, DOI 10.1089/ars.2013.5593, lire en ligne)
- « Association France Parkinson », sur www.franceparkinson.fr (consulté le 4 décembre 2015)
- « European Commission : CORDIS : Projects & Results Service : Conservative iron chelation as a disease-modifying strategy in Parkinson’s disease: a multicentric, parallel-group, placebo-controlled, randomized clinical trial of deferiprone », sur cordis.europa.eu (consulté le 4 décembre 2015)
- (en) Schapia AHV, Bezard E, Brotchie J, Calon F, Collingridge GL, Ferger B, Hengerer B, Hirsh E et & all, « Novel pharmacological targets for the treatment of Parkinson's disease », Nature, vol. 5, , p. 845-854 (ISSN 1474-1776, lire en ligne)
- (en) S. Prabhudesai, S. Sinha, A. Attar, A. Kotagiri, AG. Fitzmaurice, R. Lakshmanan, MI. Ivanova, JA. Loo et FG. Klärner, « A Novel Molecular Tweezer Inhibitor of α-Synuclein Neurotoxicity in Vitro and in Vivo », Neurotherapeutics, (PMID 22373667, DOI 10.1007/s13311-012-0105-1)
- (es) García Ruiz PJ, « Prehistoria de la enfermedad de Parkinson », Neurologia, vol. 19, no 10, , p. 735–7 (PMID 15568171)
- (en) Lanska DJ, « Chapter 33: the history of movement disorders », Handb Clin Neurol., vol. 95, , p. 501–46 (PMID 19892136, DOI 10.1016/S0072-9752(08)02133-7)
- (en) Koehler PJ, Keyser A, « Tremor in Latin texts of Dutch physicians: 16th–18th centuries », Mov Disord., vol. 12, no 5, , p. 798–806 (PMID 9380070, DOI 10.1002/mds.870120531)
- (en) Lees AJ, « Unresolved issues relating to the shaking palsy on the celebration of James Parkinson's 250th birthday », Mov Disord., vol. 22, no Suppl 17, , S327–34 (PMID 18175393, DOI 10.1002/mds.21684)
- (en) Louis ED, « The shaking palsy, the first forty-five years: a journey through the British literature », Mov Disord., vol. 12, no 6, , p. 1068–72 (PMID 9399240, DOI 10.1002/mds.870120638)
- (en) Fahn S, « The history of dopamine and levodopa in the treatment of Parkinson's disease », Mov Disord., vol. 23, no Suppl 3, , S497–508 (PMID 18781671, DOI 10.1002/mds.22028)
- (de) Ehringer, H. & Hornykiewicz, O., « Verteilung von noradrenalin und dopamin (3-hydroxytyramin) in gerhirn des menshenen und ihr verhalten bei erkankungen des extrapyramidalen systems », Klin Wochenschr., vol. 38, , p. 1236-9
- (en) Schulz-Schaeffer WJ, « The synaptic pathology of alpha-synuclein aggregation in dementia with Lewy bodies, Parkinson's disease and Parkinson's disease dementia », Acta Neuropathol., vol. 120, no 2, , p. 131–43 (PMID 20563819, PMCID 2892607, DOI 10.1007/s00401-010-0711-0)
- (en) Guridi J, Lozano AM, « A brief history of pallidotomy », Neurosurgery, vol. 41, no 5, , p. 1169–80; discussion 1180–3 (PMID 9361073, DOI 10.1097/00006123-199711000-00029)
- (en) Hornykiewicz O, « L-DOPA: from a biologically inactive amino acid to a successful therapeutic agent », Amino Acids, vol. 23, nos 1–3, , p. 65–70 (PMID 12373520, DOI 10.1007/s00726-001-0111-9)
- (en) Coffey RJ, « Deep brain stimulation devices: a brief technical history and review », Artif Organs, vol. 33, no 3, , p. 208–20 (PMID 18684199, DOI 10.1111/j.1525-1594.2008.00620.x)
- (en) « CBC News Indepth: Billy Graham »
- (en) Adolf Hitler's Parkinson's disease and an attempt to analyse his personality structure, Franz Gerstenbrand, Elisabeth Karamat, Ludwig Boltzmann lnstitut für Restaurafive Neurologie, Neurologisches Krankenhaus Maria Theresien Schlössl, Hofzeile 18–20, A-1190 Wien, Austria b A-2020 Oberfellabrunn 72, Austria
- Sylvie Joly souffre de la maladie de Parkinson, Libération, 8 octobre 2010
- Pure People, 29 juillet 2011
- Bob Hoskins prend sa retraite à cause de la maladie de Parkinson, Première, 8 août 2012
- Mesplé M, J’ai appris que j'avais la maladie de Parkinson Paris-Match, 18 janvier 2011
- « Quand François Cavanna racontait sa lutte contre la maladie de Parkinson », sur francetvinfo.fr, (consulté le 17 février 2014)
- « Robin Williams souffrait également d'un début de Parkinson », sur Le Monde,
- Linda Ronstadt
- « L'actrice Deborah Kerr est décédée à l'âge de 86 ans », Le Monde.fr, (ISSN 1950-6244, lire en ligne)
Voir aussi
Bibliographie
- Chantal Hausser-Hauw (préf. Didier Robillard), La maladie de Parkinson, Paris, PUF, coll. « Que sais-je ? », , 128 p. (ISBN 978-2-13-079568-1, ISSN 0768-0066)
Articles connexes
- Clinatec
- Corossol (neurotoxicité des fruits de la famille des annonacées)
- Syndrome de dysrégulation dopaminergique
- DJ-1
Liens externes
- Recommandations de la Haute Autorité de Santé
- Site de l'Association France Parkinson
- Site de l'Association belge Parkinson
- Site de l'Association suisse Parkinson
- Documentaire : Dis monsieur, pourquoi tu trembles?
- Portail de la médecine
- Portail des neurosciences
- Portail du handicap
- Portail de la psychologie