Paraquat
Le paraquat est un produit phytosanitaire (pesticide) ayant un effet herbicide produit à des fins commerciales dès 1961 par ICI (devenu Syngenta). Il appartient à la famille chimique des pyridines qui comprend d'autres produits phytosanitaires possédant des propriétés similaires le diquat, le cyperquat... C'est un produit toxique et écotoxique, notamment source d'atteinte hépato-rénale[4],[5], pulmonaire et du système nerveux.[réf. nécessaire] En 2017, la France et la Suisse furent épinglées pour leur autorisation à l'exportation de ce pesticide interdit sur leurs territoires vers des tiers[6].
| No CAS | Nom commun | Nom chimique |
|---|---|---|
| Paraquat | 1,1’-Diméthyl-4,4’-bipyridinium | |
| Paraquat chlorure | Dichlorure de 1,1’-Diméthyl-4,4’-bipyridinium | |
| Paraquat méthylsulfate | di(méthylsulfate) de 1,1’-Diméthyl-4,4’-bipyridinium |
| Paraquat | ||
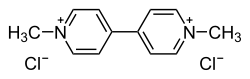 | ||
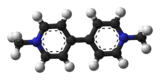 | ||
| Représentation 3D de la molécule | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 1,1’–diméthyl-4,4’-bipyridinium | |
| Synonymes |
Gramoxone |
|
| No CAS | ||
| No ECHA | 100.016.015 | |
| No EC | 225-141-7 | |
| SMILES | ||
| InChI | ||
| Apparence | poudre blanche | |
| Propriétés chimiques | ||
| Formule brute | C12H14N2 [Isomères] |
|
| Masse molaire[1] | 186,253 ± 0,011 g/mol C 77,38 %, H 7,58 %, N 15,04 %, |
|
| Propriétés physiques | ||
| T° fusion | 175 à 180 °C | |
| T° ébullition | décomposition >300 °C | |
| Solubilité | soluble dans l'eau | |
| Masse volumique | 1,25 liquide | |
| Pression de vapeur saturante | 700 g·L-1 à 20 °C | |
| Précautions | ||
| Directive 67/548/EEC | ||
 T  N Phrases R : 24/25, 36/37/38, Phrases S : 22, 36/37/39, 45, |
||
| Inhalation | Irritation des muqueuses respiratoires. Fibrose pulmonaire aiguë. |
|
| Peau | Irritation | |
| Yeux | Irritation des muqueuses oculaires |
|
| Ingestion | Brûlures du système digestif. Dommages aux reins. |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
| Dichlorure de paraquat | |
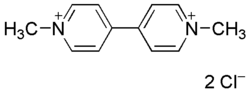 | |
| Identification | |
|---|---|
| Nom UICPA | Dichlorure de 1,1’-Diméthyl-4,4’-bipyridinium |
| No CAS | |
| No ECHA | 100.016.015 |
| No EC | 217-615-7 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule brute | C12H14Cl2N2 |
| Masse molaire[2] | 257,159 ± 0,015 g/mol C 56,05 %, H 5,49 %, Cl 27,57 %, N 10,89 %, |
| Précautions | |
| Directive 67/548/EEC | |
 T+  N Phrases R : 24/25, 26, 36/37/38, 48/25, 50/53, Phrases S : (1/2), 22, 28, 36/37/39, 45, 60, 61, |
|
| Unités du SI et CNTP, sauf indication contraire. | |
| Paraquat méthylsulfate | |
| Identification | |
|---|---|
| Nom UICPA | di(méthylsulfate) de 1,1’-Diméthyl-4,4’-bipyridinium |
| No CAS | |
| No ECHA | 100.016.015 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule brute | C14H20N2O8S2 |
| Masse molaire[3] | 408,447 ± 0,025 g/mol C 41,17 %, H 4,94 %, N 6,86 %, O 31,34 %, S 15,7 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Usages
Le paraquat est l’un des herbicides les plus utilisés au monde, vendu dans plus de 120 pays (selon son fabricant).[réf. nécessaire] Bien que très toxique, pour son faible coût et sa facilité d'utilisation, il sert en agriculture, floriculture et dans certains boisements à désherber ou préparer le sol pour une centaine de cultures de céréales (maïs, blé, orge, seigle, riz...), de soja, pomme de terre, fruits (pomme, orange, banane), de plantes destinées à la fabrication de boissons (café, thé, cacao) et des cultures traitées (coton, huile de palme, canne à sucre et caoutchouc). Il vise à protéger les semis contre la concurrence d'un large éventail de plantes pluriannuelles, les adventices, qui réduisent le rendement et la qualité de la récolte par compétition pour l'espace, l'eau, les nutriments, et la lumière. Il est aussi de plus en plus utilisé pour préparer le semis direct, notamment là où les adventices sont devenues résistantes au glyphosate (mais avec le risque de générer de nouvelles résistances au paraquat, cette fois).[réf. nécessaire]
L'usage du paraquat fut employé comme défoliant militaire contre les champs de cannabis mexicains en 1976 ordonné par le président intérimaire Gérald Ford.[réf. nécessaire]
Réglementation
Historique de l'interdiction dans l'Union européenne
L’Union européenne avait (à la demande notamment de la France qui l'utilisait dans les bananeraies et sur luzerne, et du Royaume-Uni où il est fabriqué) autorisé le paraquat en 2003 en l'inscrivant à l’annexe I de la directive 91/414/CEE par la directive 2003/112/CE. Cette autorisation de mise sur le marché a été décidée en dépit de sa toxicité pour l'Homme et l'environnement.
La Suède, soutenue par le Danemark, l’Autriche, et la Finlande, a alors saisi la commission européenne. Après trois ans d'investigations complémentaires, le verdict devait être annoncé au printemps 2007. Ce n'est que le 11 juillet 2007 que le Tribunal de première instance des Communautés européennes, par l'arrêt arrêt T-229/04, a finalement annulé[7] la directive 2003/112/CE autorisant l'usage du paraquat dans les États-membres, considérant qu’il n’avait pas suffisamment été tenu compte du lien entre le paraquat et la maladie de Parkinson, ainsi que d'autres effets de la substance sur la santé des travailleurs et des animaux sauvages. Un nouvel effet délétère de faibles doses a été publié en 2007, sur les cellules souches du système nerveux central (de même que de faibles doses de plomb, de mercure)[8].
Statut réglementaire actuel
Sur le plan de la réglementation des produits phytopharmaceutiques :
- pour l’Union européenne : cette substance active est interdite à la suite de l'arrêt T-229/04 du 11 juillet 2007 du Tribunal de première instance des Communautés européennes[7] ;
- pour la France : cette substance active n'est pas autorisée dans la composition de préparations bénéficiant d’une autorisation de mise sur le marché. L'avis paru au Journal officiel du 4 août 2007 retire les autorisations de mise sur le marché des produits phytopharmaceutiques contenant du paraquat (R BIX (AMM no 8700169)), pour tous les usages agricoles et non agricoles, sans délai d'écoulement des stocks que ce soit pour la distribution ou l'utilisation des stocks existants.
Demande d'indemnisation
Les députés Hélène Vainqueur-Christophe et Victorin Lurel ont demandé le 1er février 2018 que le paraquat et le chlordécone soient intégrés dans la proposition de loi portant création d'un fonds d'indemnisation des victimes des produits phytopharmaceutiques. La commission des finances a refusé les amendements dans une réponse que cela entraînerait une aggravation des charges publiques[9].
Caractéristiques physico-chimiques
Le paraquat-chlorure se présente sous la forme de cristaux incolores et inodores. Il n’est pas volatil.
Très soluble dans l’eau, il l'est légèrement dans l’éthanol et l’acétone, il est insoluble dans les hydrocarbures.
Les sels de paraquat et leurs solutions aqueuses ne sont pas inflammables.
Il se décompose au-dessus de 300 °C produisant des fumées toxiques.
Il attaque les métaux, notamment le fer.
Caractéristiques de l'action herbicide
Quelques caractéristiques le distinguent d'autres substances actives d'herbicides de contact :
- Non-sélectivité (il détruit un large éventail de plantes) ;
- Action rapide ;
- La pluie survenant quelques minutes après application ne diminue pas son efficacité ;
- Il est réputé devenir biologiquement inactif pour les plantes au contact du sol car il y est rapidement et très fortement adsorbé, mais on ignore ses éventuels effets sur les invertébrés du sol, et son devenir lorsqu'il est emporté par l'érosion hydrique.
Les préparations légales les plus utilisées en France étaient des solutions aqueuses contenant au maximum 40 g·L-1 de paraquat sous forme de dichlorure. Des spécialités contenant en plus du paraquat d’autres matières actives (simazine, diuron ou diquat) existaient aussi.
Ces préparations étaient colorées en bleu et dénaturées par adjonction d’une substance odorante, répulsive et émétique.
Le produit était pulvérisé après dilution dans l’eau.
Effets sur la santé humaine
Toxicité aiguë
Le paraquat est dangereux par sa forte toxicité aiguë par ingestion, même à faible dose . Il est à l'origine de controverses notamment aux Antilles.
- Atteinte digestive caustique, avec diarrhée pouvant conduire à des risques de déshydratation en cas d’ingestion importante.
- Atteinte rénale de type insuffisance rénale fonctionnelle (réversible).
- Si ce premier cap difficile est surmonté, une fibrose pulmonaire irréversible s’installe, aboutissant à une mort douloureuse par hypoxie en quelques jours ou semaines (aucun antidote connu).
- L’absorption cutanée après des contacts prolongés avec des solutions concentrées peut suffire à provoquer la mort par fibrose pulmonaire.
Selon l'ONG Nicaraguayenne Fundacion Nica Global, le paraquat serait une des origines d'une épidémie d'insuffisance rénale chronique concernant notamment les planteurs de canne à sucre et atteignant directement plus de 2 500 travailleurs[10].
Toxicité chronique
- Essentiellement effet irritant de la peau, des muqueuses oculaires et respiratoires.
Expérimentalement :
La toxicité induite par le paraquat chez les rats a été également mise en évidence avec des lésions dégénératives du système nerveux analogues à celles de la maladie de Parkinson.
Une étude montre que le paraquat, comme d'autres neurotoxiques tels que le plomb ou le mercure, peuvent même à faible dose inhiber le développement et le fonctionnement du cerveau et de la moelle épinière en bloquant la division de cellules souches du système nerveux central.
La valeur limite d'exposition professionnelle (VLE) est fixée à 0,1 mg·m-3.
Rôle du MPTP et des autres dérivés de la pyridine, cyperquat, paraquat
Le MPPP est un opioïde de synthèse utilisé par les toxicomanes comme drogue récréative et qui a des effets similaires à ceux de l’héroïne et de la morphine. Le MPTP (1 - méthyle 4 - phényl 1,2,3,6-tétrahydro pyridine) est un neurotoxique qui peut être produit au cours de la fabrication illicite de MPPP, et c'est de cette façon que ses effets inducteurs de la maladie de Parkinson ont d'abord été découverts. Sa neurotoxicité a été suspectée en 1976 lorsque Barry Kidston, un étudiant en chimie du Maryland âgé de 23 ans, s’est injecté du MPPP qu’il avait synthétisé de manière incorrecte. Il a été contaminé par le MPTP, et à l’issue d’un délai de trois jours, il a commencé à développer les symptômes de la maladie de Parkinson qui a été traitée avec succès avec la levodopa, mais il est décédé 18 mois plus tard d'une overdose de cocaïne. Lors de l'autopsie, on a découvert une destruction des neurones dopaminergiques de la substance noire[11].
Le MPTP lui-même n'est pas toxique mais comme tout composé liposoluble, il peut traverser la barrière hémato-encéphalique. Une fois à l'intérieur du cerveau, le MPTP est métabolisé en une substance toxique le 1-méthyl-4-phenylpyridinium (MPP +) par l'enzyme MAO-B des cellules gliales. Le MPP + détruit essentiellement les neurones dopaminergiques dans une partie du cerveau appelée la substantia nigra. Le MPP + interfère avec le complexe I de la chaîne respiratoire, un élément du métabolisme des mitochondries, ce qui conduit à la mort cellulaire et provoque l'accumulation de radicaux libres, des molécules toxiques qui contribuent ultérieurement à la destruction des cellules.
Le MPTP est utilisé dans l'industrie comme intermédiaire de synthèse, le chlorure du métabolite toxique MPP + a été transformé en herbicide pour produire le Cyperquat, substance proche du Paraquat qui est donc suspecté d’avoir la même toxicité, bien qu’aucune étude épidémiologique n’en ait apporté la preuve[12].
Contribution du MPTP à la recherche sur la maladie de Parkinson
Langston et al.(1984) ont constaté que l'injection de MPTP chez le singe Saïmiri a entraîné un syndrome parkinsonien, symptômes qui ont par la suite été réduits par la lévodopa, qui est un précurseur d’un neurotransmetteur (dopamine) et qui est actuellement le médicament de choix dans le traitement de la maladie de Parkinson. Les symptômes et les structures cérébrales dans la maladie de Parkinson induite par le MPTP sont pratiquement identiques à ceux de la véritable maladie de Parkinson au point que le MPTP peut être utilisé pour simuler la maladie en vue d'étudier en laboratoire la physiologie du Parkinson et d’expérimenter des traitements potentiels. Les études sur la souris ont montré que la sensibilité au MPTP augmente avec l'âge.
La connaissance du MPTP et son utilisation pour recréer un modèle expérimental fiable de la maladie de Parkinson a incité les scientifiques à étudier les possibilités d'une intervention chirurgicale remplaçant la perte des neurones par des implants de tissus fœtaux et de cellule souche ou la stimulation électrique cérébrale sous-thalamique, recherches[13], qui toutes initialement ont fait preuve d’une réussite provisoire.
Il a été postulé que la maladie de Parkinson pourrait être provoquée par l’accumulation de faibles quantités de MPP + composées d’un apport exogène par ingestion ou par le biais d'expositions répétées, et que ces substances sont en concentration trop minime pour être détectées de manière significative par des études épidémiologiques[14].
En 2000, un autre modèle animal de la maladie de Parkinson a été découvert. Il a été démontré que la roténone, un insecticide, provoquait la maladie de Parkinson chez le rat, détruisant des neurones dopaminergiques dans la substance noire. Comme le MPP +, la roténone interfère également avec le complexe I de la chaîne respiratoire des mitochondries[15].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- nih.gov: "Predictors of acute kidney injury after paraquat intoxication", 2017 May 18. doi: 10.18632/oncotarget.17975
- nih.gov: "Toxic renal injury at a glance", 2012 Jan 1. doi: 10.12861/jrip.2012.07
- Lise Loumé, « La France exporte un pesticide interdit sur son sol vers des pays en développement », Sciences et Avenir, (lire en ligne)
- Communiqué du Tribunal de première instance des Communautés européennes
- Li Z, Dong T, Proschel C, Noble M. 2007. Chemically diverse toxicants converge on Fyn and c-Cbl to disrupt precursor cell function. PLoS Biol 5(2):e35.
- actu.orange.fr: "Antilles: inquiétude sur l'indemnisation des victimes du chlordécone", (AFP) publié le jeudi 01 février 2018
- ONG Sucre éthique www.sucre-ethique.org
- Fahn, Stanley. The Case of the Frozen Addicts : How the Solution of an Extraordinary Medical Mystery Spawned a Revolution in the Understanding and Treatment of Parkinson's Disease. The New England Journal of Medicine. Dec 26, 1996. Vol. 335, Iss. 26; p. 2002
- P. J. Vinken, G. W. Bruyn. Intoxications of the Nervous System., p. 369. Elsevier Health Sciences, 1994. (ISBN 0-444-81284-9)
- Nouvelles perspectives dans le traitement de la maladie de Parkinson
- Pesticides and Parkinson's Disease - A critical review. Institute of Environment and Health, Cranfield University, October 2005.
- Summary of the article by Dr. Greenamyre on pesticides and Parkinson's Disease, National Institute of Neurological Disorders and Stroke, 9 February 2005.
Voir aussi
Liens externes
Bibliographie
- Agarwal R, Srinivas R, Aggarwal AN, Gupta D. Immunosuppressive therapy in lung injury due to paraquat poisoning: a meta-analysis. Singapore Med J. 2007; 48(11): 1000–1005
- Allègre J. Les adsorbants dans le traitement de l’intoxication au paraquat. Médecine d’Urgence Hospitalière.2004; 1-14
- Castello P, Drechsel D, Patel M. Mitochondria are a major source of paraquat-induced reactive oxygen species production in the brain. J Biol Chem.2007; 282: 14186-14193.
- CIP. Centre d’Information sur le Paraquat de Syngenta crop protection AG. (2016) Fiche technique paraquat. URL:http://paraquat.com/francais/banque-deconnaissances/
- Ernouf D, Boussa N, Legras A, Lanotte R Intoxication aiguë au paraquat associée à une forte consommation d’alcool. J Pharm Clin.1997; 16(2):90-96.
- Garnier R, Saviuc P, Tuppin P et Cochet A . Etude rétrospective des observations notifiées au système français de toxicovigilance (2004-2006). Rapport CCTV. Intoxication par le paraquat, 2007 : 1-183.
- Gil HW, Hong JR2, Jang SH3, Hong SY. Diagnostic and therapeutic approach for acute paraquat intoxication. J Korean Med Sci.2014;29(11):1441-9.
- Grunbaum AM, Gosselin S. Intoxication aigüe au paraquat : Description d’un cas. Bull Inform Toxicol.2012; 28(1):1-13.
- Hausburg MA, Gregory K, De Krey K, Salmen L, Michelle R,. Gardiner K Effects of paraquat on development of preimplantation embryos in vivo and in vitro. Reproductive Toxicology, 2005; 20: 239–246.
- Houze P, Baud FJ, Mouy R, Bismuth C, Bourdon R, Scherrmann JM (). Toxicokinetics of paraquat in humans. Hum Exp Toxicol. 1990; 9: 5-12.
- INRS, (2016) .Fiche toxicologique de paraquat N°182, les effets de paraquat sur la reproduction. www.inrs.fr/fichetox
- Kervégant M, Merigot L, Glaizal M, Schmitt C, Tichadou L, de Haro L. Paraquat Poisonings in France during the European Ban: Experience of the Poison Control Center in Marseille. J Med Toxicol. 2013; 23: 144–147.
- Kuter K, Nowak P, Gołembiowska K, Ossowska K. Increased reactive oxygen species production in the brain after repeated low-dose pesticide paraquat exposure in rats. Neurochem Res. 2010; 35(8):1121-30.
- Ossowska K, Wardas J, Kuter K, Nowak P, Dabrowska J. Influence of paraquat on dopaminergic transporter in the rat brain. Pharmacol Rep. 2005; 57: 330-335.
- Ossowska K, Wardas J, Smialowska M, Kuter K, Lenda T. A slowly developing dysfunction of dopaminergic nigrostriatal neurons induced by long term paraquat administration in rats. Eur J Neurosci. 2005; 22: 1294-1304.
- Petit-Paitel A. Toxicité de l’herbicide paraquat. Bulletin de veille scientifique.2004; N°25 :71-74 .
- Rappold P, M, Cui, M, Chesser, A. S, Tibbett, J, Grima, J. C, Duan, L, Sen, N, Javitch, J. A, Tieu, K. Paraquat neurotoxicity is mediated by the dopamine transporter and organic cation transporter-3. Proceedings of the national academy of sciences, 2011; 108(51): 20766-20771.
- Umesh G L; Anish A. Survival after massive intentional overdose of paraquat. Afr. med. J.2008; 98 (5):370-371.
- Yeh ST, Guo HR, Su YS, Lin HJ, Hou CC, Chen HM, Chang MC, Wang YJ. Protective effects of N-acetylcysteine treatment post-acute paraquat intoxication in rats and in human lung epithelial cells. Toxicology. 2006; 223 (3):181-90.
- Portail de la chimie
- Portail de la protection des cultures