Chlordécone
Le chlordécone (nom commercial Kepone aux États-Unis[5]) est un insecticide organochloré toxique, écotoxique et persistant.
| Chlordécone | |||
 | |||
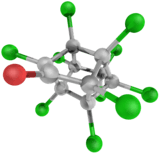 | |||
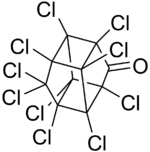
| Structure et représentation de la chlordécone | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | décachloropentacyclo[5.3.0.02.6.03.9.04.8]décan-5-one[1] | ||
| Synonymes |
Képone |
||
| No CAS | |||
| No ECHA | 100.005.093 | ||
| No EC | 205-601-3 | ||
| No RTECS | PC8575000 | ||
| PubChem | 299 | ||
| SMILES | |||
| InChI | |||
| Apparence | cristaux blancs ou blanc cassé[3]. | ||
| Propriétés chimiques | |||
| Formule brute | C10Cl10O [Isomères] |
||
| Masse molaire[4] | 490,636 ± 0,028 g/mol C 24,48 %, Cl 72,26 %, O 3,26 %, |
||
| Propriétés physiques | |||
| T° ébullition | Point de sublimation : 350 °C (décomposition)[3] | ||
| Solubilité | 2,7 mg/l dans l'eau (25 °C)[5] | ||
| Masse volumique | 1,64 g/cm3 (25 °C)[5] | ||
| Pression de vapeur saturante | 3 × 10−7 mmHg (25 °C)[5] | ||
| Thermochimie | |||
| S0gaz, 1 bar | 764 J/(K.mol) (25 °C)[6] | ||
| ΔfH0gaz | −225,9 kJ/mol (25 °C) | ||
| Précautions | |||
| SGH[7] | |||
   Danger |
|||
| Transport | |||
| Classification du CIRC | |||
| Groupe 2B : peut-être cancérogène pour l'homme[8] | |||
| Inhalation | toxique | ||
| Peau | toxique | ||
| Yeux | toxique | ||
| Ingestion | toxique | ||
| Écotoxicologie | |||
| LogP | 3,45[3] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
Présentation
Le chlordécone[alpha 1] est connu pour avoir été utilisé comme substitut au lindane contre le charançon du bananier (Cosmopolites sordidus) dans le monde Atlantique francophone[9] (de 1972 à 1993 dans les Antilles françaises), et contre d'autres insectes attaquant les bananiers. Il a aussi été utilisé pour de nombreuses autres cultures[10], dont sur le tabac, les arbustes ornementaux, les cultures d'agrumes, et dans les pièges à fourmis et à cafards (c'était notamment la matière active de l'insecticide kelevan[11]). Il a été utilisé comme larvicide contre des diptères, et pour un tout autre usage, comme fongicide contre le mildiou[12].
C'est aussi le produit spontané de dégradation d'autres insecticides organochlorés. Ainsi le kelevan comme le mirex se dégradent en quelques semaines en chlordécone (qui est beaucoup plus stable qu'eux). On sait depuis 1976 au moins que le mirex se dégrade en chlordécone[13].
Considéré comme non biodégradable, le chlordécone a dans l'environnement une demi-vie évaluée, suivant les conditions, entre 3,8 et plus de 46 ans, voire bien plus longue[14] dans les sols. Cette persistance, associée à une toxicité élevée, ainsi que des pollutions et intoxications l'ont fait interdire dans de nombreux pays (dès 1976 aux États-Unis) puis définitivement dans le monde (2011), mais après que plusieurs millions de kilogrammes de ce composé aient été produits et dispersés[15].
Les conséquences de son utilisation jusqu'en 1993 aux Antilles françaises font périodiquement la une des médias français depuis septembre 2007. Selon les données disponibles, il faudra de plusieurs décennies à plusieurs siècles pour en épurer les sols antillais les plus touchés[16].
Le mirex[alpha 2] et le chlordécone sont deux insecticides chimiquement très proches, issus de l'hexachlorocyclopentadiène (en). Aucune de ces molécules n'existe naturellement dans l'environnement. Ils n'ont plus été fabriqués ni utilisés aux États-Unis depuis 1978.
Autres dénominations
Le chlordécone a été nommé Kepone et Merex dans les pays anglophones et vendu en France comme spécialités[Quoi ?] sous les noms de Képone de 1968 à 1981 puis de Curlone à partir de 1981[17].
Aspects physicochimiques
[style à revoir] Le mirex est un solide cristallin blanc, alors que le chlordécone est blanc cassé ; tous deux sont inodores.
Sa structure moléculaire est dite bis-homocubane perchlorée (comme celle du mirex et du kelevan (vendu sous le nom de Despirol)[18],[19],[alpha 3],[9], deux molécules chimiquement proche du mirex et du dichlorodiphényltrichloroéthane (DDT), classé polluant organique persistant (POP) par la convention de Stockholm, qui interdit sa production et son utilisation dans les pays parties de la Convention[17].
Peu soluble dans l’eau à pH acide et neutre (1-2 mg/l), le chlordécone est néanmoins très fortement hygroscopique (évoluant spontanément vers une forme hydratée, dite chlordécone-hydrate qui lui donne une fonction gem-diol. C'est la forme qu'il prend rapidement dans l'environnement. Et — en raison d'un pKa de 9 à 10 —, il voit sa solubilité s'accroitre quand le pH augmente (68,8 mg/l à pH 10)[20].
Avec une pression de vapeur de 3 × 10−7 mmHg à 25 °C, il est peu volatil[21] ; il ne s'oxyde pas ou très lentement tant qu'il n'est pas chauffé à 450-500 °C, ce qui rend son incinération difficile et coûteuse en énergie. Il peut en outre produire des dioxines et furanes en brûlant, impliquant donc des installations agréées pour l'incinération de déchets dangereux à des températures dépassant 1 000 °C comme l'ont montré les tests d'incinération cités par Bell et Whitmore de l'EPA en 1978[22].
Synthèse
Selon les données disponibles en 1978 pour les évaluations de ce produit, la réaction de l’hexachlorocyclopentadiène (précurseur de nombreux autres pesticides organochlorés) avec l’anhydride sulfurique, à chaud et sous pression, catalysée par le pentachlorure d'antimoine, donne un produit qui est hydrolysé en milieu basique puis neutralisé à l’acide : le chlordécone, récupéré par centrifugation ou filtrage puis séché à l’air chaud[23].
Historique
Années 1950
En 1951, les chimistes Gilbert et Giolito synthétisent la chlordécone. Deux brevets[24] sont déposés l'année suivante ; tous deux assignés à l'entreprise Allied Chemical and Dye Corporation[11]. Le pesticide est mis sur le marché en 1958 par Allied Chemical, au moins sous deux noms commerciaux : Kepone et GC-1189[23],[25].
Années 1960
Dès 1963, Huber démontre la toxicité du chlordécone, chez la souris de laboratoire[26] et en 1965 il est signalé comme étant aussi reprotoxique chez la souris (« cousin » mammalien de l'humain), et chez la poule[11].
En 1966, sa production commerciale progresse néanmoins, aux États-Unis[11] par Allied Chemical Company et LifeSciences Product Company (LSPC) à Hopewell, en Virginie[27],[28]. En raison du laxisme de la direction de l'entreprise LSPC, une centaine d'ouvriers sont gravement intoxiqués par le chlordécone, scandale qui commence à être connu en 1975[28],[29], aggravé par le fait que durant les années 1960 et 1970 l'usine a aussi gravement pollué l'eau, les sédiments et la faune la James River. Dans l’air le taux de chlordécone y dépassait 3 mg/m3 dans certaines zones de l'usine (trois mille fois le seuil légal de 1 μg/m3)[16]. Ce scandale a attiré l'attention du pays et de l'OMS sur ses effets toxiques pour les humains et la faune '(aquatique notamment)[15]. Ce sera l'origine de l'interdiction du produit aux États-Unis.
En 1968, le 14 juin (alors que la France est agitée par les évènements de mai 1968), le Comité d'études des produits antiparasitaires à usage agricole étudie deux demandes déposées par la société SOPHA basée à Fort-de-France (Martinique), concernant d'une part le mirex (contre la fourmi-manioc) et d'autre part le Képone (alors défini comme « une spécialité à base de « chlordécone » (decachloro-octahydro-1,3,4-metheno-2H-cyclobuta (cd) pentalene-2-one) » et présenté comme visant à détruire les « insectes du bananier »[9] ; le compte-rendu archivé de cette réunion mentionne pour le mirex et le Képone qu'« il s’agit d’une substance nouvelle qui doit être, au préalable, examinée par la Commission des toxiques. Au surplus, pour le mirex des renseignements sur l’intérêt de cette matière active seront demandés au Service de la protection des végétaux de la circonscription Antilles-Guyane ». Aucune autorisation de vente n'est alors délivrée, mais ces deux molécules sont mises à l'étude, l'IFAC ayant d'ailleurs dès mai 1968 mis en place un essai en Martinique alors que des études étaient déjà en cours au Cameroun par l’IFAC depuis 4 ans (depuis 1964)[9]. Le 27 juin, la Commission des toxiques examine le « chlordécone » (défini comme « decachloro-octahydro-1,2,4-metheno-2H cyclobuta (cd) pentalène-2-one ») mais sur la base d'un résumé constitué de trois pages non signées, jugé incomplet ce qui justifie un ajournement de l'étude et de l'avis de la commission[9]. Le 4 octobre puis le 6 décembre 1968, une nouvelle demande d'homologation est déposée pour le « Kepone G » et le « Kepone P », cette fois par la Seppic (Société d'exploitation de produits pour les industries chimiques), à nouveau considérées comme « demandes non en règle » par le Comité d’études des produits antiparasitaires à usage agricole qui répète que le chlordécone en tant que substance nouvelle doit d'abord être soumise à l’examen de la Commission des toxiques[9].
Années 1970
En 1972 (18 septembre), Jacques Chirac (alors ministre de l’Agriculture et de l’Aménagement rural) délivre une Autorisation de Mise sur le Marché (AMM) provisoire pour le chlordécone sous la dénomination commerciale de Képone[30]. Avant 1981, il n'y a jamais eu d'homologation du produit en France ; au profit d'autorisation provisoires (mais plusieurs fois renouvelées) de mise sur le marché, tenant plus ou moins compte des avis de la Commission de l'emploi des toxiques en agriculture, remplacée en 1974 par le Comité d'homologation des produits antiparasitaires à usage agricole et des produits assimilés (subdivisée en deux sections : « Productions végétales » et « Productions animales »), par contre le mirex a lui été homologué[9].
Années 1980
Aux Antilles, une aggravation de la prévalence du parasitisme des bananeraies est attribuée au cyclone David (1980), alors qu'aux États-Unis, le chlordécone cause de lourdes pertes à de nombreux établissements, restaurants et entreprises qui dépendaient de l'eau du fleuve James River ; car depuis 1975 et pendant treize ans, le gouverneur Mills E. Godwin, Jr. y interdit toute pêche sur une distance de cent milles : de l'usine de Richmond (Virginie) à la mer (baie de Chesapeake). Interdiction qui ne sera levée qu'en 1988 quand les efforts de dépollution du fleuve et de ses sédiments finissent par porter leurs fruits[31].
L'ouragan Allen (1980) est suivi aux Antilles d'un fort développement de parasites des bananiers[16]. C'est l'un des arguments ayant justifié des dérogations d'usage pour les bananeraies de Martinique et de Guadeloupe. De ses premiers usages autorisés (1972) à la date de son interdiction aux Antilles (1993), 300 t de ce pesticide seront pulvérisées (30 g de produit par pied, soit 3 kg/ha et par an)[16].
En 1981, le groupe punk Dead Kennedys reprend une chanson Kepone Factory, satire de la controverse entourant Allied Signal et leur négligence concernant la sécurité de ses employés. C'est l'une des chansons de l'album In God We Trust, Inc. Écrite en 1978, la chanson était initialement intitulé Kepone Kids (Les Enfants du Képone).
Cette même année en France, la ministre de l’Agriculture Édith Cresson délivre à la société Laurent de Laguarigue une seconde AMM pour le chlordécone sous la dénomination commerciale « Curlone ». La formulation du produit est faite à Béziers, à partir de la molécule synthétisée au Brésil, avec une commercialisation et importation massive aux Antilles françaises[30], en dépit d'effets pseudo-œstrogéniques scientifiquement déjà clairement démontrés chez les oiseaux et mammifères[32].
En 1982, l'ouvrage Who's Poisoning America?: Corporate Polluters and Their Victims in the Chemical Age passe en revue l'histoire des incidents et accidents liés au Kepone.
En 1986, l'EPA publie Final report on the evaluation of four toxic chemicals in an In Vivo/In Vitro toxicological screen--acrylamide, chlordecone, cyclophosphamide, and diethylstilbestrol, confirmant la toxicité de ce produit[33].
Années 1990
La France en 1990 (1er février) retire l’AMM du chlordécone pour tout le territoire français[30]. Mais le 23 avril, parait une question écrite de Guy Lordinot (alors Député de la Martinique) au ministre de l'Agriculture, relayant de gros planteurs de bananes, en faveur d’une prolongation de la commercialisation du chlordécone[30]. Cette demande fut appuyée par une autre lettre au ministre, datée du 30 avril[30]. Le 5 juin, Henri Nallet, alors ministre de l’Agriculture, publie une dérogation de deux ans, uniquement valable pour les DOM[30].
En 1992 (mars) Louis Mermaz, nouveau ministre de l’Agriculture et des Forêts, proroge d’un an la dérogation pour l’utilisation du Curlone[30].
En 1993 (février), Jean-Pierre Soisson, ministre de l’Agriculture et du Développement rural, répond favorablement à une demande de la SICABAM demandant à pouvoir utiliser le reliquat de stocks de chlordécone[30]. Le 30 septembre, ce pesticide est officiellement interdit à la vente aux Antilles françaises[30].
Années 2000
En 2000 en Guadeloupe, la production d'eau embouteillée de l'usine de Capès-Dolé, après des tests d'échantillons faits le 28 mars, est stoppée (7 avril) en raison des taux de HCHb trouvés dans l'eau à hauteur de 0,5 µg/l (cinq fois la norme) et de chlordécone (0,7 à 1,1 µg/l, soit de sept à onze fois la norme) en plus de traces de dieldrine (0,1 µg/l dans un cas). La société Capès Dolé s'est rapidement (fin avril) équipée de filtres à charbon actif et d'un système d'ultrafiltration sur membranes (5 µm) destinées à retenir les relargages du charbon actif. Les chaînes de conditionnement sont aussi équipées d’une filtration « stérilisante » (membranes à 0,2 µm). Après réglages du processus de filtration, les analyses effectuées par la DDASS le 22 mai confirment l’absence de pesticides dans l’eau. La commercialisation de l’eau embouteillée reprend le 30 mai avec un contrôle hebdomadaire. La société Capès Dolé utilisait le terme eau de source, mais constat fait que la réglementation en matière d'étiquetage n'était pas respectée, elle doit dorénavant employer l'expression eau rendue potable par traitement ; la société concurrente Matouba était dans la même situation. Une recherche mensuelle de pesticides organochlorés est imposée à la charge de Capès Dolé sur une durée minimale de six mois[34].
En 2006 (décembre), un fonctionnaire chargé de mission interrégionale, Éric Godard et nommé pour coordonner l'action de l'État dans les îles antillaises[35]. Il reste en poste au-delà de 2015[36].
En 2009, le chlordécone est inscrit dans la convention de Stockholm sur les polluants organiques persistants, ce qui interdit sa production et son utilisation dans le monde entier[37].
Toxicité

Le chlordécone est une substance biomimétique dans les organismes mammaliens. Il se dissimule facilement dans la voie de la biosynthèse des acides biliaires primaires, et aussi dans celle de la biosynthèse des hormones stéroïdes[5]. D'après la littérature disponible en 1984, l'accumulation se produit principalement dans le foie[11].
Les études de toxicité apportées par l'industrie lors des premières demandes d'homologation étaient très incomplètes, comme l'ont montré les effets de toxicité aigüe et chronique déduits des examens médicaux faits sur le personnel de la première usine fabriquant le chlordécone (à Hopewell, aux États-Unis), ainsi que d'expérience sur les rongeurs et des bovins[23],[38].
Avant 1979 en laboratoire, le modèle animal avait montré une néphrotoxicité (atteinte rénale) et une suppression de la spermatogenèse (reprotoxicité) induite par le chlordécone[11],[39], qui était aussi déjà reconnu comme fœtotoxique[11].
Des ouvriers exposés de manière chronique à ce produit (dont par contact) dans une usine de production des États-Unis, ont été victimes de problèmes neurologiques (irritabilité, tremblements, troubles de la vision, céphalées). Des effets toxiques sur le foie ont été observés, ainsi qu'une action de délétion de la spermatogenèse[40].
Effets synergiques
Une étude écrite en 1989 par H.M. Mehendale[41] indique que le chlordécone amplifie gravement (67 fois) les effets hépatotoxiques des composés comme le tétrachlorure de carbone, le chloroforme et le dichlorométhane.
Cancérogénicité (avec prévalence très élevée de cancer de la prostate)
Étant donné le délai de latence d'apparition des cancers chez l'homme, le caractère cancérigène du chlordécone n'est apparu qu'après quelques décennies ou via le modèle animal avec :
- des cancers du foie, observés chez l'animal[11] avant qu'en 1987, le Centre international de recherche sur le cancer classe le chlordécone comme « cancérogène possible pour l’homme »[42],[43] ;
- des myélomes multiples, révélés en 2009 en Martinique par une analyse du risque de cancer (par zones), commandée par l'InVS. Cette étude a montré une « surincidence statistiquement significative du myélome multiple »[44] chez l'homme adulte résidant dans la zone où le chlordecone a été le plus utilisé et serait encore le plus présent dans les sols (selon le BRGM) ;
- un risque fortement accru de cancer de la prostate, confirmé par une étude de l'INSERM et du CHU de Pointe-à-Pitre[45].
En 2010, une élévation significative du risque de cancer de la prostate est démontré[46] chez les hommes de Guadeloupe ayant été, selon des analyses de sang faites de 2004 à 2007 très exposés au chlordécone ; ceux ayant le taux sanguin le plus élevé avaient un risque plus de 2,5 fois plus élevé que les moins exposés. Dans les Antilles françaises, des taux sanguins de plus d'un microgramme par litre (μg/l) sont trouvés chez plus de 20 % de la population étudiée[46]. Le chlordécone était présent dans le sang de 68,7 % des malades et de 66,8 % des témoins à des concentrations médianes respectives de 0,44 et 0,40 μg/l. Posséder certains caractères génétiques qui diminuent la capacité d'éliminer le chlordécone de l'organisme est associé à un risque accru de cancer de la prostate. Le caractère de perturbateur endocrinien (féminisant, car mimant les œstrogènes, et capable d'agir sur le fœtus) de ce produit est connu depuis la fin des années 1970[47], et l'on sait que de manière générale, les œstrogènes sont sources de risques accrus de ce cancer[46]). Un risque accru (et encore non expliqué) concerne chez les hommes ayant vécu plusieurs années en métropole ou dans un pays occidental (risque multiplié par cinq pour des hommes ayant été exposés, ayant un antécédent familial de cancer de la prostate et ayant vécu dans un pays occidental)[46].
Prévalence record du cancer de la prostate (et de mortalité induite) dans les Antilles françaises
L’Institut national du cancer constate en Martinique pour la période 2001-2005 une augmentation spectaculaire du taux d’incidence annuel (standardisé monde, moyenne mondiale 30), qui est passé de 137,0 pour 100 000 en 2000 à 177,0 pour 100 000 en 2005. En 2012, le World Cancer Research Fund International publie un taux d’incidence annuel (standardisé monde) de 227,2 pour 100 000, le taux le plus élevé au monde loin devant le 2e, la Norvège avec 129 pour 100 000[42].
En 2012, les statistiques du GLOBOCAN révèlent que le taux de mortalité est de 32 pour 100 000 en Martinique et 30 pour 100 000 en Guadeloupe pour ce cancer (contre 7 pour 100 000 en moyenne dans le monde)[48].
Détection et évaluation de l'exposition humaine
Les scientifiques et institutions de France sont aujourd'hui à l'avant-garde pour la détection de cette molécule car très concernés (records mondiaux de pollution et de cancer de la prostate), et parce que les Américains ont laissés ce champ libre après leur interdiction précoce et totale du chlordécone (1976).
Deux moyens principaux existent : le dosage direct dans les matrices biologiques (sang, lait, oeuf, viande, poisson et graisses), et indirectement le calcul de l’apport alimentaire en chlordécone, via les données de consommation et de contamination des aliments[49].
La base de données PubChem, alimentée par la NIH américaine à partir de revues scientifiques, liste plusieurs méthodes de détection pour le chlordécone[5], dont :
- chromatographie en phase liquide à haute performance[50] ;
- chromatographie en phase gazeuse aidée par un détecteur à capture d'électrons (en)[51] ;
- chromatographie en phase gazeuse aidée par spectrométrie de masse[52] ;
- chromatographie en phase gazeuse aidée par spectrométrie de masse carbone 13[53] ;
- désorption-ionisation laser assistée par matrice[54] ;
- chromatographie en phase gazeuse aidée par séquençage par spectrométrie de masse[55].
Cinétique, élimination, stabilité
Cette molécule a une forme de cage (« cage bis-homocubane ») solidement et principalement entourée d'atomes de chlore ; elle ne se comporte pas comme les polychlorobiphényles (PCB).
Dans le corps humain
Concernant l'humain adulte, les premières donnés viennent des ouvriers accidentellement exposés à ce produit lors de sa fabrication (le chlordécone était présent en fortes concentrations dans des échantillons de sang, de foie et de graisse de ces travailleurs).
Vers 2015, alors que le produit est interdit dans les Antilles, le sang d'environ 70 % des Guadeloupéennes contient encore du chlordécone. Il vient principalement des aliments et notamment des poissons, fruits de mer et légumes/racines contaminés[56],[57]. Les poissons d'eau douce et côtiers, les mollusques et les crustacés sont les aliments les plus contaminés[58],[59],[60],[61]. Une limite maximale de résidus (LMR) de 20 μg de chlordécone (CLD) par kilogramme de poids humide a été fixée en France pour les aliments d'origine végétale et animale (en 2008)[62], impliquant de sévères restrictions dans la pêche et la consommation de poisson.
On recherche des produits dits « chélateurs » qui pourraient extraire cette molécules du corps et aider à son élimination via les urines, les excréments ou la sueur. La cholestyramine a été inventée et utilisée aux États-Unis pour combattre l'empoisonnement par le chlordécone, suite à une négligence industrielle dans l'usine qui le fabriquait[63],[27] ; une centaine de travailleurs y ont été exposés (par contact et inhalation) durant plusieurs mois, ce qui fut pour eux une source d'intoxication (les manifestations toxiques touchaient principalement le système nerveux, le foie et les testicules).
Une expérience de plasmaphorèse a montré que le chlordécone est rapidement transféré des tissus au sang mais l'hémoperfusion ne réussi pas à éliminer le chlordécone de l'organisme, car le chlordécone est fortement lié aux protéines plasmatiques.
Constatant que les selles ne contiennent qu'une petite part des quantités de chlordécone excrété dans la bile, le chercheur a administré par voie orale de la cholestyramine, une résine non résorbable qui lie le chlordécone in vitro. La cholestyramine a augmenté l'excrétion fécale de chlordécone et a accéléré le taux de disparition du pesticide du corps. Cela s'est accompagné d'une amélioration des manifestations cliniques de toxicité, indiquant que les effets toxiques subaiguës du chlordécone sont réversibles. Le chercheur a conclu que la thérapie avec des agents de liaison pris par voie orale fournit un moyen sûr et efficace pour le traitement des humains empoisonnés avec du chlordécone et, éventuellement, avec d'autres pesticides organochlorés[63].
Chez l'animal (mammifères)
Selon le modèle animal, à la différence des PCB (qui sont essentiellement stockés dans les tissus adipeux), le chlordécone est chez les mammifères principalement stocké dans le foie et dans les muscles. Chez la chèvre, il est moins durablement retenu par l'organisme que les PCB (demi-vie plus courte).
Le chlordécone et les PCB NDL semblent présenter des dynamiques de décontamination de l'organisme très différentes[64].
Une expérience récente[Quand ?] a consisté à exposer oralement durant trois semaines des chèvres à 0,05 mg/kg de poids corporel et par jour de chlordécone et 0,30 μg/kg de poids corporel et par jour de biphényle polychloré non dioxine[65]. Une partie a été abattue et l'autre soumise à 21 jours d'un régime alimentaire non contaminé, et certains animaux relevaient en outre des pastilles additionnées de 10 % de charbon actif ou de 8 % d'huile de paraffine (PO). Tous ont vu leurs taux de chlordécone fortement diminuer (-60 %) dans le foie, le sang, les muscles et graisses (beaucoup plus que pour les PCB) après que les apports aient cessés, mais la supplémentation alimentaire en charbon activé ou en huile de paraphine n'a pas affecté de manière significative la dynamique de décontamination pour le chlordécone[64].
Chez les coraux
Le chlordécone a — sans surprise — été détecté dans divers organismes marins des Caraïbes (poissons, crustacés, oiseaux, etc.), mais aussi de façon plus inattendue en Polynésie française.
Or on a récemment[Quand ?] montré que comme l'acidification, la salinisation, l'excès de potassium et certains désherbants, le chlordécone peut aussi négativement affecter les polypes d'un corail. Il y suractive des gènes (de la sous-famille P450-1A et P450-3A) connus pour être impliqués dans la détoxification. Le chlordécone suscite aussi un processus de suicide cellulaire et de dégradation des protéines de la matrice cellulaire des polypes coralliens, via l'apoptose et l'activation de cathepsines. Ceci conduit le corail à mourir ou perdre sa forme coloniale. Ceci a été récemment[Quand ?] démontré chez le corail Pocillopora damicornis, avec des analyses transcriptomiques et morphologiques de sa réponse au chlordécone[66].
Chez les poissons
En 1984, des chercheurs montrent que chez le poisson-chat Ictalurus punctatus la demi-vie du chlordécone est de 8,7 jours ; qu'il est le plus concentré dans le sang et le cerveau du poisson ; et le moins concentré dans le tissu adipeux mésentérique et le squelette ; il semble principalement éliminé par la bile (après avoir été réduit en alcool de chlordécone) via les fèces, mais aussi au travers des branchies et via le mucus épidermique alors que l'excrétion urinaire est négligeable[67].
Chez les crustacés
La crevette d'eau douce géante Macrobrachium rosenbergii est élevée en Guadeloupe dans des eaux où le chlordécone est détecté. Ces élevages sont économiquement importants pour l'île et plusieurs ont du être fermé (de plus le chlordécone peut intoxiquer les crevettes et perturber leur système hormonal[68]. Ces crevettes ont été exposée en laboratoire (durant un mois) et in situ (huit mois) au chlordécone. Certaines ont ensuite été transférées en eau non contaminée puis observées[69]. L'étude (2018) a montré que les organes du céphalothorax (hépatopancréas en particulier) étaient les plus contaminés et que le chlordécone s'accumulait dans la cuticule (jusqu'à 40 % de la charge corporelle). Chaque mue (abandon d'une exuvie contribue donc à la détoxication de l'animal[69]. La bioconcentration du chlordécone dans les crevettes dépendait à la fois du temps et du degré d'exposition. Les femelles semblent de plus se « décontaminer » plus vite que les mâles sans doute grâce aux pontes successives durant les quelles du chlordécone est exporté via leurs œufs[69].
Dans les végétaux
La cinétique du chlordécone dans les plantes sauvages (arbres y compris) n'a pas été très étudiée, mais plusieurs études, notamment basées sur le carbone radiomarqué, ont montré que des légumes/racines pouvaient fortement se contaminer sur un sol pollué par ce pesticide (ex. : radis, utilisé comme plante-modèle des racines comestibles[70]), via :
- une voie systémique par absorption racinaire puis translocation vers les tiges et feuilles (qui peuvent aussi être consommées) d'autant plus rapide que le légume évaporanspire ;
- et une voie « non systémique » d'absorption percutanée (au travers du périderme, plus ou moins selon son épaisseur) de la racine, cette absorption étant ensuite suivie d'une diffusion radiale dans la chair du tubercule (l'épluchage ne protège pas le consommateur du chlordécone). Le flux moyen de diffusion du sol vers la chair du radis, au travers le périderme, a été estimé à environ 5,71×1014 g cm−2 s−1. Il est probable que la présence plus ou moins importante de lipides dans certaines plantes modifie la cinétique de cette molécule très liposoluble, l'épaisseur et la perméabilité du périderme des tubercules (et des tissus internes) joue aussi un rôle qui n'est pas encore mesuré pour toutes les espèces consommées[70].
Une étude récente[Quand ?] a confirmé que même chez des plantes en C4 à rhizome, il entre dans la sève et est retrouvé dans toute la plante : chez deux espèces de Miscanthus (M. sinensis et M. giganteus, toutes deux plantes en C4 adaptées au climat tropical et éventuellement utilisable pour la phytoremédiation) exposées à des concentrations environnementales (1 mg/kg), un bilan à deux et six mois après la transplantation montre que le chlordécone est absorbé et en grande partie stocké dans le rhizome pérenne de ces plantes. Mais on le retrouve aussi dans les racines, les tiges, les feuilles et même les épis floraux. Les racines en contenaient le plus (5 398 ± 1 636 ng/g pour M. giganteus et 14 842 ± 3 210 ng/g de poids sec pour M. sinensis) et les jeunes pousses le moins (152 ± 28 ng/g chez M. giganteus et 266 ± 70 ng/g de poids sec chez M. sinensis).
Dans le sol
Le sol (avec les sédiments) est le principal réservoir de chlordécone. Il y persiste longtemps et de là il peut contaminer des plantes via les racines, et l'eau d'où il passe dans les animaux (gibier et d'élevage), par ingestion essentiellement. Les nitisols et ferralsols (fréquentes en zones tropicale) le fixent moins bien, il contamine alors plus facilement les milieux aquatiques et l'eau[71],[60].
La consommation de denrées issues d'animaux ayant vécu sur des sols contaminés peut significativement contribuer à l'exposition des humains.
En 2017, une étude conclut que la présence charbon actif dans un sol contaminé y réduit fortement la biodisponibilité du chlordécone, mais avec une efficacité dépendant du type de charbon actif utilisé[72] et on ignore encore ce que deviendra la molécule à long terme une fois piégée dans cette matrice.
Une expérience publiée en 2018 a consisté à élever 44 porcelets mâles castrés (âgés de quarante jours) durant dix jours sur des sols artificiels modifiés selon leur groupe. Le sol était contaminé à hauteur de 50 μg de chlordécone par gramme de sol sec et enrichi (ou non) en charbon de bois ou en biochar[73]. Ce biochar était issu selon les cas de pyrolyse à 500 °C ou 700 °C de quatre types de bois distinct et il était utilisés comme amendement du sol à raison de 5 %. Résultats : le biochar n'a pas été significativement efficace ; par rapport à un groupe témoin, seuls les porcelets élevés en présence de charbon actif présentaient significativement moins de chlordécone dans leurs tissus gras et le foie. Le biochar n'a permis qu'une légère diminution, non statistiquement significative[73]. Les meilleurs résultats ont été obtenus avec un charbon actif fabriqué à partir de coquille de noix de coco (biodisponibilité relative inférieure à 3,2 % pour le foie et les graisses)[73].
En laboratoire
Dans les conditions naturelles, cette molécule en forme de cage est résistante et n'est que très superficiellement biodégradable. Mais au Genoscope du CEA, des chercheurs ont récemment[Quand ?] identifié des familles de bactéries susceptibles — dans de bonnes conditions, anaérobies notamment — de mieux dégrader cette molécule. Ils ont isolé une bactérie (du genre Citrobacter) pouvant à certaines conditions initier (en quelques semaines) la dégradation du chlordécone, en produisant cependant des sous-produits : (métabolites chlorés) dont trois hydrochlordécones et deux polychloroindènes (PCI) ; d'autres métabolites pourraient être des acides polychloroindènecarboxyliques (APCIC)[16]. « Une étude électrochimique a montré la nécessité de conditions réductrices puissantes et la présence d’un catalyseur tel que la vitamine B12 pour créer les conditions favorables à la formation des PCI et APCIC »[16]. Ces métabolites qui peuvent potentiellement aussi être toxiques ou écotoxiques sont encore à évaluer[16].
Règlementation européenne
La Communauté européenne a proposé et défendu l'inclusion dans la troisième annexe de la convention de Stockholm. Le chlordécone figurait déjà sans dérogation aux annexes I et/ou II du protocole relatif aux POP de la convention CEE-ONU ; sa production et son utilisation sont à ce titre totalement interdites dans l’Union européenne depuis l’entrée en vigueur du règlement POP adopté le 29 avril 2004[74].
Les teneurs maximales dans les produits végétaux et animaux ont été fixées par les règlements No 149/2008 du 29 janvier 2008[75] et No 839/2008 du 31 juillet 2008[76], documents consultables sur le site de la Direction générale de la santé et des consommateurs[77],[78],[79].
Notes et références
Notes
- Nom féminin pour désigner la molécule, nom masculin pour le produit.
- Le mirex était utilisé pour contrôler les fourmis de feu, ainsi que comme ignifugeant et retardateur de flamme (alors vendu sous le nom commercial « Dechlorane ») dans les plastiques, le caoutchouc synthétique, la peinture, certains papiers et appareils électriques de 1959 à 1972.
- Le kelevan est vendu par le producteur américain du Képone (Allied Chemical) au groupe allemand Spieß und Sohn qui l'importait en Europe pour le transformer en kelevan[pas clair], la matière active utilisée contre le doryphore de la pomme de terre, très utilisé en Allemagne de l'Ouest et dans plusieurs pays de l'ex-URSS.
Références
- IUPAC Agrochemical information, lire en ligne
- Nom en nomenclature CAS : 1,1a,3,3a,4,5,5,5a,5b,6-décachlorooctahydro-1,3,4-méthéno-2H-cyclobuta[cd]pentalen-2-one.
- CHLORDECONE, fiche(s) de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée(s) le 9 mai 2009
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Kepone », PubChem.
- Dolfing J., Novak I., Archelas A., Macarie H. (2012), Gibbs free energy of formation of chlordecone and potential degradation products: implications for remediation strategies and environmental fate, Environ. Sci. Technol., 46, 8131-8139, DOI:10.1021/es301165p
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Évaluations Globales de la Cancérogénicité pour l'Homme, Groupe 2B : peut-être cancérogène pour l'homme », sur monographs.iarc.fr, CIRC, (consulté le 22 août 2009)
- Matthieu Fintz (2010) L’autorisation du chlordécone en France, 1968-1981 : Éléments historiques sur l’arrivée du chlordécone en France, ANSES <hal-00584031>
- Dolfing, J., Novak, I., Archelas, A., MacArie, H. (2012), Gibbs free energy of formation of chlordecone and potential degradation products: implications for remediation strategies and environmental fate, Environ. Sci. Technol., 46, 8131–8139, DOI:10.1021/es301165p.
- International Agency for Research on Cancer (IARC) - Summaries & Evaluations: Chlordecone, sur inchem.org, vol. 20, 1979, p. 67
- Cabidoche YM et Lesueur-Jannoyer M (2012), Contamination of Harvested Organs in Root Crops Grown on Chlordecone-Polluted Soils, Pedosphere, 22, 562-571
- Carlson D. A., Konyha K. D., Wheeler W. B., Marshall G. P., Zaylskie R. G. (1976), « Mirex in the Environment: its Degradation to Kepone and Related Compounds », Science, 194(4268), p. 939-41
- (en) Summary profiles of chemicals sur le site Environnement de la Communauté européenne
- Robert L. Metcalf, Insect Contro in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Wienheim, 2002, DOI:10.1002/14356007.a14_263
- Chevallier Marion (2017), Étude de la dégradation biologique et chimique d'un pesticide persistant : la chlordécone, thèse de doctorat en Sciences de la vie et de la santé – Chimie analytique, université de Paris Saclay, résumé
- Jack Weinberg (en), Un guide pour les ONG sur les Polluants Organiques Persistants, sur ipen.org, 30 octobre 2008.
- Figge K et Rehm H (1977), On the behaviour of the insectide « kelevan » and its metabolites in the ecological system « potato field », Journal of Plant Disease and Protection, 84, 385-409.
- Maier-Bode H., The insecticide « Kelevan », Residue Rev., 1976, 63, 45-76, .
- Dawson G.W., Weimer W.C. et Shupe S.J. (1979), Kepone - A case study of a persistant material, The American Institute of Chemical Engineers, 190, 366-374.
- Harris R.L, Huggett R.J et Slone H.D (1980), Determination of dissolved Kepone by direct addition of XAD-2 resin to water, Anal. Chem., 52(4), 779-780.
- Bell B.A et Whitmore F.C (1978), Kepone incineration test program, United States Environmental Protection Agency, 1-148.
- Epstein S.S (1978), Kepone--hazard evaluation, Sci. Total Environ., 9(1), 1-62.
- US Patent 2.616.825 et US Patent 2.616.928.
- Huff J.E et Gerstner H.B (1978), Kepone: a literature summary, J. Environ. Pathol. Toxicol., 1(4), 377- 395.
- Huber J.J (1963), Some physiological effects of the insecticide Kepone in the laboratory mouse. The Ohio State University.
- Treatment of chlordecone (Kepone) toxicity with cholestyramine. Results of a controlled clinical trial, sur ncbi.nlm.nih.gov, N. Engl. J. Med., 1978;298(5):243-8
- Philip S Guzelian, Treatment of Chlordecone (Kepone) Poisoning with Cholestyramine, dans Plans for Clinical and Epidemiologic Follow-up After Area-wide Chemical Contamination: Proceedings of an International Workshop, Washington, D.C., 17-19 mars 1980 (National Academies: Luigi Dardanoni, Robert W. Miller, éds.)
- Proctor and Hughes' Chemical Hazards of the Workplace, John Wiley & Sons, 2004, p. 133
- Chlordécone : Chronologie d'un empoisonnement, sur latribunedesantilles.net
- Jack Cooksey, What's in the Water?, Richmond Magazine, juin 2007
- Estrogenic activity of the insecticide chlordecone in the reproductive tract of birds and mammals, sur ncbi.nlm.nih.gov.
- Lewtas, Joellen, Final report on the evaluation of four toxic chemicals in an In Vivo/In Vitro toxicological screen--acrylamide, chlordecone, cyclophosphamide, and diethylstilbestrol, EPA, 1986
- Rapport sur la présence de pesticides dans les eaux de consommation humaine en Guadeloupe (par le Dr Henri Bonan, Inspection générale des affaires sociales (IGAS) et Jean-Louis Prime, Inspection générale de l'environnement (IGE) ; IGAS-IGE, rendu le 5 juillet 2001 à Mme Dominique Voynet, ministre de l'Environnement au sein du gouvernement Jospin II, et à Mme Dominique Gillot, secrétaire d’État à la Santé. Le résumé est : « Ce rapport est le fruit d'une mission diligentée en Guadeloupe à la suite de la découverte d'une pollution phytosanitaire importante dans certaines eaux de consommation humaine dans le sud de Basse-Terre. Dans la première partie, le rapport présente la situation géographique et démographique de la Guadeloupe, les cultures qui prédominent, les ressources en eau et leurs usages. Dans la seconde partie, il explique que la pollution de l'eau est une préoccupation ancienne, mise en évidence en 1999-2000. La troisième partie expose les mesures prises pour gérer la crise, tant à court terme qu'à moyen et long terme (fermetures de captages, élaboration d'un plan phytosanitaire, code de bonne conduite des pratiques agricoles, etc.). »
- Impacts de l'utilisation de la chlordécone et des pesticides aux Antilles : bilan et perspectives d'évolution, sur senat.fr, voir rapport Procaccia (2008)
- Didier Torny, « Managing an everlastingly polluted world: food policies and community health actions in the French West Indies », dans Nathalie Jas, Soraya Boudia, Toxicants, Health and Regulation Since 1945, Routledge, (ISBN 1317319699, lire en ligne)
- Stockholm Convention, Listing of POPs in the Stockholm Convention: Annex A (Elimination), 2011, disponible sur What are POPs?
- Mahieu M (2014), Gestion du parasitisme gastro-intestinal des petits ruminants en zone tropicale humide, sur theses.fr, theses.fr
- International Programme on Chemical Safety - Enviromental Health Criteria 43 - Chlordecone, sur inchem.org
- Note AFSSA : Le chlordécone en Martinique et Guadeloupe, Questions/Réponses, septembre 2007
- (en) Mehendale HM, Mechanism of the lethal interaction of chlordecone and CCl4 at non-toxic doses, Toxicol Lett., 1989 déc., 49 (2-3): 215-41.
- Gabriel Henry, « Pourquoi la Martinique détient le record du monde des cas de cancer de la prostate par habitant ? », sur médiaphore.com,
- Principi attivi usati in agricoltura val IARC, sur usl3.toscana.it
- Dieye M., Quénel P., Goria S., Blateau A., Colonna M. et al., Étude de la répartition spatiale des cancers possiblement liés à la pollution des sols par les pesticides organochlorés, en Martinique [PDF], Saint-Maurice, France, Institut de veille sanitaire, août 2009, 27 p. (disponible sur le site de l'InVS)
- Claire Peltier, « Le chlordécone, ex-insecticide des bananeraies, serait bien cancérigène », sur Futura Santé.fr, (consulté le 23 juin 2010)
- Luc Multigner, Jean Rodrigue Ndong, Arnaud Giusti, Marc Romana, Helene Delacroix-Maillard, Sylvaine Cordier, Bernard Jégou, Jean-Pierre Thome, Pascal Blanchet, Chlordecone Exposure and Risk of Prostate Cancer, dans le cadre de l'étude Karuprostate, article publié (DOI:10.1200/JCO.2009.27.2153) le 21 juin 2010 dans le Journal of Clinical Oncology. Voir aussi sur le même sujet les résumés de presse INSERM : Chlordecone exposure and risk of prostate cancer, 22 juin 2010, et Communiqué INSERM, 22 juin 2010
- Hammond B., Katzenellenbogen B.S., Krauthammer N. et McConnell J. (1979), Estrogenic activity of the insecticide chlordecone (Kepone) and interaction with uterine estrogen receptors, Proceedings of the National Academy of Sciences, 76(12), 6641-6645
- GLOBOCAN 2012: Estimated cancer incidence, mortality and prevalance worldwide in 2012, sur globocan.iarc.fr
- Exposition de la population antillaise au chlordécone. Numéro thématique. Chlordécone aux Antilles : bilan actualisé des risques sanitaires, sur opac.invs.sante.fr, 8 février 2011
- George SE et al., Chromatographia, 22 (1-6), 165-7, 1986
- Chlordecone exposure and risk of prostate cancer
- Validation of chlordecone analysis for native and remediated French West Indies soils with high organic matter content
- Detection and quantification of chlordecone in contaminated soils from the French West Indies by GC-MS using the 13C10-chlordecone stable isotope as a tracer
- Localisation et quantification absolue in situ du chlordécone dans le foie de souris par imagerie MALDI
- Ultra-trace quantification method for chlordecone in human fluids and tissues
- Dubuisson, C., Héraud, F., Leblanc, J.-C., Gallotti, S., Flamand, C., Blateau, A., Quenel, P., Volatier, J.-L. (2007), Impact of subsistence production on the management options to reduce the food exposure of the Martinican population to Chlordecone, Regul. Toxicol. Pharmacol., 49, 5–16, DOI:10.1016/j.yrtph.2007
- Guldner, L., Multigner, L., Héraud, F., Monfort, C., Pierre Thomé, J., Giusti, A., Kad- hel, P., Cordier, S. (2010), Pesticide exposure of pregnant women in Guadeloupe: ability of a food frequency questionnaire to estimate blood concentration of chlordecone, Environ. Res., 110, 146–151, DOI:10.1016/j.envres.2009.
- Bertrand, J., Bodiguel, X., Abarnou, A., Reynal, L., Bocquene, G. (2010), Chlordecone in the marine environment around the French West Indies: from measurement to pollution management decisions. In: ICES Conf. Meet., p. 1–9.
- Cabidoche, Y.-M., Lesueur-Jannoyer, M., Vannière, H. (2006), Conclusions du groupe d’étude et de prospective « Pollution par les organochlorés aux Antilles : aspects agronomiques », Contrib. CIRAD INRA.
- Coat, S., Monti, D., Legendre, P., Bouchon, C., Massat, F., Lepoint, G. (2011), Organochlorine pollution in tropical rivers (Guadeloupe): role of ecological factors in food web bioaccumulation, Environ. Pollut., 159, 1692–1701, DOI:10.1016/j.envpol.2011.02.036.
- Dromard, C.R., Bodiguel, X., Lemoine, S., Bouchon-Navaro, Y., Reynal, L., Thouard, E., Bouchon, C. (2016), Assessment of the contamination of marine fauna by chlordecone in Guadeloupe and Martinique (Lesser Antilles), Environ. Sci. Pollut. Res., 23, 73–80, DOI:10.1007/s11356-015-4732-z.
- DGS (2008), Plan d’actions chlordécone en Martinique et en Guadeloupe 2008-2010, 16 p., 63798?token=aa65f5b7b786198cd89d253f56c23541 lire en ligne
- New approaches for treatment of humans exposed to a slowly excreted environmental chemical (chlordecone), sur researchgate.net
- Lastel, M. L., Fournier, A., Jurjanz, S., Thomé, J. P., Joaquim-Justo, C., Archimède, H., … et Rychen, G. (2018), Comparison of chlordecone and NDL-PCB decontamination dynamics in growing male kids after cessation of oral exposure: Is there a potential to decrease the body levels of these pollutants by dietary supplementation of activated carbon or paraffin oil?, Chemosphere, 193, 100-107, résumé.
- PCB-NDL, congénères 28, 52, 101, 138, 153 et 180.
- Wecker, P., Lecellier, G., Guibert, I., Zhou, Y., Bonnard, I. et Berteaux-Lecellier, V. (2018), Exposure to the environmentally-persistent insecticide chlordecone induces detoxification genes and causes polyp bail-out in the coral P. damicornis, Chemosphere, 195, 190-200 (résumé).
- Van Veld, P. A., Bender, M. E. et Roberts Jr., M. H. (1984), Uptake, distribution, metabolism and clearance of chlordecone by channel catfish (Ictalurus punctatus), Aquatic Toxicology, 5(1), 33-49, résumé.
- Lafontaine, A., Hanikenne, M., Boulangé-Lecomte, C., Forget-Leray, J., Thomé, J.-P., Gismondi, E., (2016), Vitellogenin and vitellogenin receptor gene expression and 20-hydroxyecdysone concentration in Macrobrachium rosenbergii exposed to chlordecone, Environ. Sci. Pollut. Res., 1–11, DOI:10.1007/s11356-016-7273-1
- Lafontaine, A., Gismondi, E., Dodet, N., Joaquim-Justo, C., Boulangé-Lecomte, C., Caupos, F., … et Thomé, J. P. (2017), Bioaccumulation, distribution and elimination of chlordecone in the giant freshwater prawn Macrobrachium rosenbergii: Field and laboratory studies, Chemosphere, 185, 888-898.
- Létondor, C., Pascal-Lorber, S. et Laurent, F. (2015), Uptake and distribution of chlordecone in radish: different contamination routes in edible roots, Chemosphere, 118, 20-28, résumé.
- Coat, S., Bocquené, G., Godard, É., (2006), Contamination of some aquatic species with the organochlorine pesticide chlordecone in Martinique. Aquat. Living Resour. 19, 181–187, DOI:10.1051/alr:2006016.
- Sarah Yehya, Matthieu Delannoy, Agnès Fournier, Moomen Baroudi, Guido Rychen et Cyril Feidt, Activated carbon, a useful medium to bind chlordecone in soil and limit its transfer to growing goat kids, sur ncbi.nlm.nih.gov, PLoS One, 19 juillet 2017, 12(7):e0179548, DOI:10.1371/journal.pone.0179548
- Delannoy, M., Yehya, S., Techer, D., Razafitianamaharavo, A., Richard, A., Caria, G., … et Rychen, G. (2018), Amendment of soil by biochars and activated carbons to reduce chlordecone bioavailability in piglets, Chemosphere (résumé).
- Document 52009PC0027 - Proposition de décision du Conseil définissant la position à adopter au nom de la Communauté européenne, en ce qui concerne les propositions de modification des annexes A, B et C de la convention de Stockholm, lors de la quatrième conférence des parties (4 – 8 mai 2009), sur eur-lex.europa.eu.
- No 149/2008 du 29 janvier 2008
- No 839/2008 du 31 juillet 2008
- EU Pesticide Database, base de donnée européenne tenue par la DG Sanco, répertoriant les limites maximales de résidus (EU pesticides database)
- Commission Regulation (EC) No 839/2008 of 31 July 2008 amending Regulation (EC) No 396/2005 of the European Parliament and of the Council as regards Annexes II, III and IV on maximum residue levels of pesticides in or on certain products (Text with EEA relevance)
- Commission Regulation (EC) No 149/2008 of 29 January 2008 amending Regulation (EC) No 396/2005 of the European Parliament and of the Council by establishing Annexes II, III and IV setting maximum residue levels for products covered by Annex I thereto (Text with EEA relevance)
Voir aussi
- Limite maximale de résidus
Liens externes
- Dossier chlordécone - Veille informatique : Différents sites concernant les conséquences de l'utilisation de chlordécone aux Antilles (Martinique et Guadeloupe). En fin de page, des rapports BRGM, DIREN et GREPHY, sur pedagogie.ac-guadeloupe.fr.
- Article de RFO : .
- Fiche toxico écotoxico chimique [PDF] de l'Association Toxicologie-CNAM.
- Soazig Lemoine - Thèmes de recherche : Biologie des organismes et écosystèmes aquatiques, sur borea.mnhn.fr.
- Exemple de réduction du taux de chlordécone dans les poissons, après son interdiction aux États-Unis (Chesapeake Bay Program).
- CHLORDECONE, fiche(s) de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée(s) le 9 mai 2009.
- Gérard Borvon, Une pollution grave de l’eau et des sols dans les Antilles. Outre-mer : les oubliés des lois sur l’eau, 2 décembre 2011.
- L’État laisse-t-il volontairement la Martinique s’empoisonner au chlordécone ?, sur consoglobe.com, janvier 2014.
- Philippe Verdol, Le Chlordécone aux Antilles françaises et en Europe : du principe de précaution fort à celui d’inégalité devant la loi.
- « Chlordécone, le poison des Antilles » [audio], émission Interception de France Inter, .
Bibliographie
- Benachour N, Moslemi S, Sipahutar H et Seralini GE (2007), Cytotoxic effects and aromatase inhibition by xenobiotic endocrine disrupters alone and in combination, Toxicology and Applied Pharmacology, 222:129- 140.
- Boucher O, Simard MN, Muckle G, Rouget F, Kadhel P, Bataille H, Chajes V, Dallaire R, Monfort C, Thome JP, Multigner L et Cordier S (2013), Exposure to an organochlorine pesticide (chlordecone) and development of 18-month-old infants, Neurotoxicology, 35:162-168, DOI:10.1016/j.neuro.2013.01.007.
- Boutrin L et Confiant R (2007), Chronique d'un empoisonnement annoncé : le scandale du Chlordécone aux Antilles françaises (1972- 2002), Paris, L'Harmattan.
- Bouveret C, Rychen G, Lerch S, Jondreville C, Feidt, C. (2013), Relative Bioavailability of Tropical Volcanic Soil-Bound Chlordecone in Piglets, Journal of Agricultural and Food Chemistry, 61:9269-9274.
- Bucher S, Le Vee M, Jouan E, Fardel O. (2014), Regulation of Hepatic Drug Transporter Activity and Expression by Organochlorine Pesticides, Journal of Biochemical and Molecular Toxicology, 28:119-128.
- Clostre F, Letourmy P et Lesueur-Jannoyer M (2017), Soil thresholds and a decision tool to manage food safety of crops grown in chlordecone polluted soil in the French West Indies, Environmental Pollution, 223, 357-366.
- Dallaire R, Muckle G, Rouget F, Kadhel P, Bataille H, Guldner L, Seurin S, Chajes V, Monfort C, Boucher O, Thome JP, Jacobson SW, Multigner L, Cordier S (2012), Cognitive, visual, and motor development of 7- month-old Guadeloupean infants exposed to chlordecone, Environmental Research, 118:79-85, DOI:10.1016/j.envres.2012.07.006.
- Dieye M, Banydeen R, Macni J, Michel S, Veronique-Baudin J, Sasco A, Escarmant P, Joachim C (2014), Geographic variations and temporal trends in prostate cancer in Martinique over a 25-year period, BMC research notes, 7:262, DOI:10.1186/1756-0500-7-262.
- Guldner L, Multigner L, Heraud F, Monfort C, Thome JP, Giusti A, Kadhel P, Cordier S (2010), Pesticide exposure of pregnant women in Guadeloupe: ability of a food frequency questionnaire to estimate blood concentration of chlordecone, Environmental Research, 110 (2):146-151, DOI:10.1016/j.envres.2009.10.015.
- Kadhel P, Monfort C, Costet N, Rouget F, Thome JP, Multigner L, Cordier S (2014), Chlordecone exposure, length of gestation, and risk of preterm birth, American Journal of Epidemiology, 179 (5):536-544, DOI:10.1093/aje/kwt313.
- Lee J, Scheri RC, Curtis LR (2008), Chlordecone altered hepatic disposition of [C-14]cholesterol and plasma cholesterol distribution but not SR-BI or ABCG8 proteins in livers of C57BL/6 mice, Toxicology and Applied Pharmacology, 229: 265-272.
- Lee J, Scheri RC, Zhang Y, Curtis LR, (2008), Chlordecone, a mixed pregnane X receptor (PXR) and estrogen receptor alpha (ER alpha) agonist, alters cholesterol homeostasis and lipoprotein metabolism in C57BL/6 mice, Toxicology and Applied Pharmacology, 233: 193-202.
- Morvan K, Multigner L, Blanchet P et Luce D (2014), 0280 Occupational risk factors for prostate cancer: a case-control study in Guadeloupe (French West Indies), Occupational and Environmental Medicine, 71 Suppl 1:A100, DOI:10.1136/oemed-2014-102362.312.
- Multigner L, Ndong JR, Giusti A, Romana M, Delacroix-Maillard H, Cordier S, Jegou B, Thome JP, Blanchet P (2010), Chlordecone exposure and risk of prostate cancer, Journal of Clinical Oncology (official journal of the American Society of Clinical Oncology), 28 (21):3457-3462, DOI:10.1200/JCO.2009.27.2153.
- Jondreville C, Bouveret C, Lesueur-Jannoyer M, Rychen G, Feidt C. (2013), Relative bioavailability of tropical volcanic soil-bound chlordecone in laying hens (Gallus domesticus), Environmental Science and Pollution Research, 20:292-299.
- De Luca D, Tagliatti V, Conotte R et Colet J. (2011), Chlordecone potentiation of carbon tetrachloride toxicity: A metabonomic-based mechanistic study, Toxicology Letters, 205:S181-S182. Annexe II : Liste des études épidémiologiques et toxicologiques prises en compte dans le cadre de l'expertise sur les VTR relatives à la chlordécone, p. 26, 42 avis de l’Anses, saisines no 2014-SA-0109 et 2017-SA-0029.
- National Toxicology Program (2011), Kepone. Report on carcinogens : carcinogen profiles, U.S. Dept. of Health and Human Services, Public Health Service, National Toxicology Program, vol. 12, p. 250.
- Scheri RC, Lee J, Barofsky DF et Curtis LR, (2009), Chlordecone increased subcellular distribution of scavenger receptor class B type II to murine hepatic microsomes without altering cytosolic cholesterol binding proteins, Toxicology Letters, 191:20-25.
- Seurin S, Rouget F, Reninger JC, Gillot N, Loynet C, Cordier S, Multigner L, Leblanc JC, Volatier JL et Heraud F (2012), Dietary exposure of 18-month-old Guadeloupian toddlers to chlordecone, Regulatory Toxicology and Pharmacology, 63 (3):471-479, DOI:10.1016/j.yrtph.2012.05.009.
- Saunders L, Kadhel P, Costet N, Rouget F, Monfort C, Thome JP, Guldner L, Cordier S, Multigner L (2014), Hypertensive disorders of pregnancy and gestational diabetes mellitus among French Caribbean women chronically exposed to chlordecone, Environment International, 68:171-176, DOI:10.1016/j.envint.2014.03.024.
- Tabet, É. (2015), Impact d'un pesticide, le chlordécone, sur l'évolution de l'hépatite aïgue et chronique chez la souris (Doctoral dissertation, Rennes 1).
- Tan YM, Clewell H, Campbell J, Andersen M. (2011), Evaluating Pharmacokinetic and Pharmacodynamic Interactions with Computational Models in Supporting Cumulative Risk Assessment, International Journal of Environmental Research and Public Health, 8:1613-1630.
- Verdol P (2007), Le Chlordécone en Guadeloupe : Environnement, santé, société, Pointe-à-Pitre, Éditions Jasor.
- Wang F, Sobel ES, Butfiloski EJ, Roberts SM, (2008), Comparison of chlordecone and estradiol effects on splenic T-cells in (NZB x NZW)F-1 mice, Toxicology Letters, 183: 1- 9.
- Wang F, Roberts SM, Butfiloski EJ, Sobel ES, (2007), Diminished prolactin from chlordecone treatment in ovariectomized (NZB x NZW)F-1 mice, International Immunopharmacology, 7:1808-1812.
- Wang F, Roberts SM, Butfiloski EJ, Morel L, Sobel ES, (2007), Acceleration of autoimmunity by organochlorine pesticides: A comparison of splenic B-cell effects of chlordecone and estradiol in (NZBxNZW)F-1 mice, Toxicological Sciences, 99:141-152.
- Portail de la chimie
- Portail de la protection des cultures
- Portail de l’entomologie
- Portail de l'écotoxicologie