Chlorobenzaldéhyde
Le chlorobenzaldéhyde est un composé aromatique de formule C7H5ClO. Il est constitué d'un noyau benzénique substitué par un groupe aldéhyde (-CHO) et un atome de chlore (Cl). Comme tous les benzènes disubstitués, il existe sous la forme de trois isomères structuraux, les composés ortho, méta et para, selon la position relative des deux substituants sur le cycle.
Par abus de langage, le chlorure de benzoyle est parfois aussi appelé « alpha-chlorobenzaldéhyde », sans pour autant être un aldéhyde mais un chlorure d'acyle, le chlore se substituant à l'atome d'hydrogène de l'aldéhyde. La suite de cet article ne concernera que les « vrais » isomères du chlorobenzaldéhyde.
Propriétés
| Chlorobenzaldéhyde | ||||
| Nom | 2-chlorobenzaldéhyde | 3-chlorbenzaldéhyde | 4-chlorobenzaldéhyde | |
| autre nom | orthochlorobenzaldéhyde o-chlorobenzaldéhyde | métachlorobenzaldéhyde m-chlorobenzaldéhyde | parachlorobenzaldéhyde p-chlorobenzaldéhyde | |
| Structure |  |
 |
 | |
| Numéro CAS | ||||
| PubChem | 6996 | 11477 | 7726 | |
| formule brute | C7H5ClO | |||
| masse molaire | 140,57 g·mol−1 | |||
| apparence (CNTP) | liquide | poudre | ||
| point de fusion | 9-11 °C[1] | 9-12 °C[2] | 45-50 °C[3] | |
| point d'ébullition | 209-215 °C[1] | 213–214 °C[2] | 213–214 °C[3] | |
| Icône SGH | 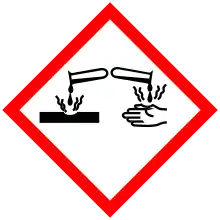 Danger[1] |
 Attention[2] |
 Attention[3] | |
| Phrase H et P | H314 |
H315, H319 et H335 |
H302, H315, H319 et H335 | |
| P280, P310 et P305+P351+P338 |
P261 et P305+P351+P338 |
P261 | ||
Le 4-chlorobenzaldéhyde qui a la symétrie la plus élevée a le plus haut point de fusion. C'est le seul qui est solide à température ambiante.
Synthèse
La synthèse du 4-chlorobenzaldéhyde peut être faite à partir de 4-chlorotoluène, qui est mis à réagir d'abord avec du pentachlorure de phosphore et du chlore sous irradiation UV. L'hydrolyse de l'intermédiaire avec le groupe méthyle doublement chloré, le 4-chloro-(dichlorométhyl)benzène ainsi obtenu, avec de l'acide sulfurique concentré conduit au 4-chlorobenzaldéhyde[4].
Utilisation
Les chlorobenzaldehydes sont utilisés dans la synthèse de colorants triphénylméthane et de médicaments[5]. Le 4-chlorobenzaldéhyde est une matière première pour la synthèse de pesticides chlorobenzilate, coumachlore, paclobutrazol, triticonazole et uniconazole. Partant du 2-chlorobenzaldéhyde, le clomazone est obtenu[6].
Le 4-chlorobenzaldéhyde peut également être utilisé pour la préparation du 4-fluorobenzaldéhyde[7].
Notes et références
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Chlorbenzaldehyde » (voir la liste des auteurs).
- Fiche Sigma-Aldrich du composé 2-Chlorobenzaldehyde, consultée le 10/05/2017. + (pdf) Fiche MSDS
- Fiche Sigma-Aldrich du composé 3-Chlorobenzaldehyde, consultée le 10/05/2017. + (pdf) Fiche MSDS
- Fiche Sigma-Aldrich du composé 4-Chlorobenzaldehyde, consultée le 10/05/2017. + (pdf) Fiche MSDS
- W. L. McEwen, p-Chlorbenzaldehyde, Org. Synth. 12, coll. « vol. 2 », , 12 p., p. 133 DOI:10.15227/orgsyn.012.0012.
- (de) Entrée Chlorbenzaldehyde sur Römpp Online. Georg Thieme Verlag, consultée le 3 mai 2014.
- (en) Thomas A. Unger, Pesticide Synthesis Handbook, William Andrew, (ISBN 0-8155-1853-6, lire en ligne), p. 1028
- http://www.prepchem.com/synthesis-of-4-fluorobenzaldehyde/
| –F | –Cl | –Br | –I | |
|---|---|---|---|---|
| Benzène | Fluorobenzène | Chlorobenzène | Bromobenzène | Iodobenzène |
| Phénol (–OH) | Fluorophénol | Chlorophénol | Bromophénol | Iodophénol |
| Aniline (–NH2) | Fluoroaniline | Chloroaniline | Bromoaniline | Iodoaniline |
| Anisole (–OCH3) | Fluoroanisole | Chloroanisole | Bromoanisole | Iodoanisole |
| Toluène (–CH3) | Fluorotoluène | Chlorotoluène | Bromotoluène | Iodotoluène |
| Nitrobenzène (–NO2) | Fluoronitrobenzène | Chloronitrobenzène | Bromonitrobenzène | Iodonitrobenzène |
| Alcool benzylique (–CH2OH) | Alcool fluorobenzylique | Alcool chlorobenzylique | Alcool bromobenzylique | Alcool iodobenzylique |
| Benzaldéhyde (–CHO) | Fluorobenzaldéhyde | Chlorobenzaldéhyde | Bromobenzaldéhyde | Iodobenzaldéhyde |
| Acide benzoïque (–COOH) | Acide fluorobenzoïque | Acide chlorobenzoïque | Acide bromobenzoïque | Acide iodobenzoïque |
- Portail de la chimie