Silure glane
Silurus glanis

Répartition géographique
LC : Préoccupation mineure
Le silure glane (Silurus glanis) est une espèce de poissons d'eau douce du genre Silurus, originaire du Paléarctique occidental. C'est le plus grand poisson d'eau douce d'Eurasie et le troisième plus grand au monde, pouvant atteindre plus de 2,7 m de longueur et 130 kg[1],[2].


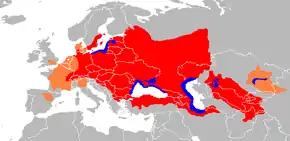
Cette espèce est présente de manière indigène dans une grande partie de l'Europe entre le bassin du Rhin à l'ouest, le bassin du Danube et les fleuves côtiers de Grèce au sud, le bassin de la Volga et de l'Oural à l'est, et le bassin de la mer Baltique au nord, ainsi qu'en Asie centrale dans les bassins de l'Amou-Daria et du Syr-Daria, et dans les cours d'eau des rives sud de la mer Noire et de la mer Caspienne au nord du Moyen-Orient. Il est cité dans l'Histoire naturelle de Buffon éditée au XVIIIe siècle. Son aire de répartition s'est récemment étendue à la suite d'introductions par l'Homme pour la pêche de loisir, lui permettant de conquérir de nombreux réseaux hydrographiques dans presque toute l'Europe de l'Ouest.
Morphologie
Son corps est allongé. Sa peau, très glissante, est vert-brun à blanc-noir, plus claire (jaune ou blanchâtre) sur le ventre.
Des spécimens dits « mandarins » (jaune à orangé) présentent une peau plus ou moins dépigmentée. D'autres sont franchement albinos. Les animaux albinos, au sein d'un groupe pigmenté, ont une couleur qui pourrait les rendre plus vulnérables aux prédateurs[3]. De plus les spécimens albinos pourraient avoir une vue plus dégradée (par manque de cellules photoréceptrices)[3] ; or l'albinisme semble assez fréquent chez le silure[3] et Slavík, Horký & Maciak en 2015 ont décrit un phénomène d'exclusion du groupe de spécimens plus clairs, peut-être parce qu'un poisson dépigmenté pourrait être une cible préférentielle pour certains prédateurs (Landeau & Terborgh, 1986 ; Theodorakis, 1989) ; ce pourrait être une raison pour l'exclusion des albinos dans un groupe de silures[3].
Sa tête massive, large et aplatie peut représenter jusqu'à 30 % de son poids total. La bouche très large est pourvue de lignes de dents petites et nombreuses, semblables à de fines pointes très tranchantes. Elle lui permet d'engloutir de grosses proies et de les maintenir fermement. Elle porte six barbillons : deux longs, et mobiles, sur la mâchoire supérieure, et quatre courts sur la partie inférieure de la tête. Ceux-ci sont pourvus de « bourgeons gustatifs » (organes sensoriels servant à localiser les proies ou toute nourriture potentielle, même cachées dans la vase ou le gravier), sont situés principalement sur leur portion distale. D'autres organes lui servent aussi à détecter tout mouvement proche (la nage d'une écrevisse jusqu'à 10 mètres). Comme la plupart des poissons d'eau douce, le silure glane possède également une ligne latérale très efficace lui permettant de ressentir les mouvements de ses proies potentielles.
Ses yeux minuscules lui seraient peu utiles pour la détection, mais ils lui servent sans doute à distinguer les couleurs[réf. nécessaire], la direction de la lumière et sont importants pour la régulation de ses rythmes biologiques
Les nageoires sont au nombre de sept : deux pectorales très larges, deux ventrales légèrement moins larges, une nageoire dorsale minuscule (de texture adipeuse), une nageoire ventrale très longue partant de l'orifice anal jusque la nageoire caudale. Il peut créer un tourbillon à l'aide de celle-ci dans le but de désorienter, ou assommer sa victime qu'il peut ensuite avaler.
La taille varie d’un à deux mètres le plus souvent, mais le silure peut atteindre jusqu'à 2,75 m, pour un poids de plus de 130 kg. Le plus gros silure péché et homologué a été capturé dans le Tarn en et mesurait 274 cm[4]. Il a été pris en float-tube avec une grappe de vers. En , un silure de 275 cm[4] a été pris dans la rivière Pô en Italie mais le record n'a pas été homologué officiellement même s'il ne fait pas de doute sur la taille incroyable de ce spécimen. L'ichtyologiste britannique Francis Willughby mentionne au XVIIe siècle des silures dépassant les 5 mètres pour un poids de 330 kg, ce qui en faisait vraisemblablement la plus grande espèce de poisson d'eau douce au monde[5].
Habitats
Depuis les années 2000, des études de télémétrie[6] puis d'analyse stomacale[7] ont permis de mieux connaitre les habitats qu'il explore ou utilise pour s'alimenter. Elles montrent que ce poisson s'adapte facilement à tout type d'habitat pourvu que l'eau y soit assez chaude en période de reproduction (condition atteinte en Europe du Nord grâce au soleil de minuit en été) et assez riche en nourriture.
Il vit généralement près du fond, sous les troncs et branches d'arbres tombés à l'eau ou près des berges où il se cache dans l'attente d'une proie.
Origines et expansion
Le groupe des siluriformes est très ancien, daté d'avant la séparation de l'Amérique du Sud et de l'Afrique il y a environ 110 millions d'années, ce qui explique la présence de nombreuses espèces d'eau douce de toutes tailles sur plusieurs continents[8].
Les fossiles européens les plus anciens de poissons du genre des silures (Silurus sp.) estimés vieux de 8 à 5 millions d'années environ, c'est-à-dire du Miocène supérieur durant l'ère Tertiaire, ont été trouvés dans le bassin du Danube (près de Vienne en Autriche), associés à des Cyprinidés (genres Scardinius, Rutilus, Palaeocarassius proche de Carassius, Tinca, Barbus, etc.) et des Percidés selon Gaudant (1994)[9], soit une association de poissons très semblable à l'actuelle en Europe moyenne. Des données paléontologiques montrent la présence de Silurus glanis dans le bassin du Rhône avant les trois dernières glaciations[8]. Par exemple, un fossile provient de l'Ardèche (rivière)[10]. Près de Perpignan ont été trouvés quelques éléments (rayons) de nageoires pectorales aujourd’hui conservés par le département des Sciences de la Terre de l'Université Claude Bernard de Lyon[11]. Ils pourraient appartenir à un poisson du genre Silurus ou Parasilurus, et sont datés du Pliocène (entre −6 et −3 Millions d'années). Aucun fossile du silure aussi ancien n'a été trouvée pour le moment dans le bassin du Rhin, bien qu'une présence ancienne ait été possible du fait que le haut cours du Rhin était tributaire du Danube avant les glaciations. Le silure glane, comme beaucoup d'autres poissons d'eau douce (carpe, sandres, etc) ont ensuite progressivement disparues des bassins fluviaux d'Europe de l'Ouest au fil des glaciations successives du Pléistocène. Mais il a subsisté en Europe de l'Est, dans les bassins de la mer Noire et de la mer Caspienne, qui formaient un vaste ensemble lacustre d'eau douce interconnecté, et les fleuves tributaires de cet hydrosystème. L'Europe de l'Est a conservé une ichtyofaune plus riche que l'Europe de l'Ouest.
Selon les données phylogénétiques disponibles, les populations actuelles de silures ont pour origine un noyau d'Europe de l'Est provenant il y a environ 10 000 ans (fin de la dernière glaciation) d'un unique refuge glaciaire. Dix loci microsatellites ont servi à reconstitue l'histoire des populations actuelles : sa diversité génétique est beaucoup plus élevés que les premières analyses d'ADN mitochondrial ne le laissaient penser[12] mais les niveaux relatifs de variabilité entre les populations étaient en accord avec les études antérieures. Les populations des grands bassins (Volga et Danube) sont génétiquement les plus polymorphes, et les populations de silures des petits fleuves grecs, plus enclines au goulet d'étranglement génétique, sont touchées par de faibles niveaux de diversité génétique. En dépit de grandes différenciations génétiques aucun modèle cohérent de structuration géographique n'a été révélé pour cette espèce (à la différence de ce qui a été le cas pour diverses études précédentes sur les espèces européennes de poissons d'eau douce). L'isolement géographique par la distance semble être le modèle le plus probable, avec une dispersion récente à partir d'un seul refuge glaciaire probablement situé dans la région Ponto-Caspienne.
À partir de ce refuge ponto-caspien, Silurus glanis a pu recoloniser naturellement, au début de l'Holocène, lorsque le climat s'est fortement réchauffé il y a environ 10 000 ans, de nombreux cours d'eau, dont le bassin du Danube et celui de la Volga, et, par une connexion naturelle ancienne, l'ensemble du bassin de la mer Baltique (la mer Baltique a été un temps un lac lié à la Volga au début de l'Holocène), en profitant de l'optimum climatique de l'Holocène, ainsi que le bassin de la mer d'Aral (qui était connecté à la mer Caspienne). Il en résulte une répartition naturelle de l’espèce très semblable à celle de beaucoup d'autres poissons d'Europe centrale et orientale qui ont suivi le même réseau hydrographique, mais qui n'ont pas pu recoloniser naturellement de nombreux bassins fluviaux non connectés d'Europe de l'Ouest durant l'Holocène.
On a aussi des traces archéologiques qui démontrent qu'il avait recolonisé naturellement les bassins du Rhin de la Meuse et de l'Escaut dès le début de l'Holocène. En effet le delta du Rhin a pu être temporairement connecté au bassin de l'Elbe et au bassin de la mer Baltique (qui était le lac Ancylus) au début de l'Holocène lorsque les glaciers fondaient au nord, le réseau hydrographique de la région étant alors instable. Mais il semble avoir connu un fort déclin dans ces bassins à partir de la fin du Moyen Âge, probablement à cause des effets conjugués du Petit Âge glaciaire et d'une surpêche. Puis au XVIIIe siècle, il semble être totalement disparu à nouveau dans ces bassins. De même dans le bassin de la mer Baltique, seules des populations relictuelles ont survécu jusqu'à nos jours[8].
En France, il est cité deux fois par des auteurs anciens dans le bassin du Rhin :
- par un poème d'Ausone daté de la fin du IVe siècle de notre ère dédié à la Moselle mais le mot silurus qu'il utilise peut n'être qu'une forme poétique décrivant un poisson de grande taille (il pourrait éventuellement s'agir d'un esturgeon (A. sturio), dont la présence est avérée à cette époque dans le bassin de la Moselle et une grande partie de la France)
- puis par un texte illustré de Baldner publié en 1666, relatif à la faune d'Alsace. Mais l'auteur précise qu'il a vu ce poisson sur les étals du marché de Strasbourg. L'illustration bien que réalisée par un naturaliste confirmé montre une queue bifide (pouvant laisser penser que ce silure était dans un mauvais état, ou qu'il était si rarement vu en France que le dessinateur a cru bon de lui dessiner une nageoire caudale. Cuvier et Valenciennes en 1839, repris par d'autres auteurs écrivent que cet animal aurait été capturé dans l'Ill qui rejoint le Rhin à Strasbourg, ce qui est rétrospectivement difficile à vérifier.
Ce n'est ensuite qu'aux XIXe et XXe siècles, via des réintroductions par l'homme pour la pisciculture et la pêche, qu'il a recolonisé les fleuves d'Europe de l'Ouest. Une pisciculture de ce poisson était active à Huningue dans le sud de l'Alsace dès 1857 à partir de spécimens importés du Danube (de l'autre côté de la Forêt Noire). Il recolonise le Rhin, puis il apparait en France dans le Doubs à partir de 1890, sans qu'on ne sache s'il y a été introduit directement par des pêcheurs où s'il est éventuellement passé de lui même par le canal du Rhône au Rhin. Il colonise ensuite la Saône en 1966 à partir des étangs de pisciculture de la Dombes. Il est élevé en Camargue quelques années plus tard d'où il passe dans le bas Rhône. Il est pêché dans la Seine et dans la Loire à partir de 1975, puis dans la Garonne à partir de 1989. En passant par les cours d'eau et les canaux, il a pu coloniser rapidement la plupart des eaux libres accessibles des bassins fluviaux où il a été introduit. Il a aussi été introduit dans de nombreuses pièces d'eau, carrières, lacs et étangs isolés. Il est également introduit dans le Pô en Italie dès le XIXe siècle, dans l'Èbre en Espagne en 1990 et localement en Angleterre. Dans les années 1990 il fait l'objet de réintroductions dans les plans d'eau du bassin de l'Elbe en Allemagne, où il avait décliné, pour y contrôler la surpopulation de brèmes communes dont il est le principal régulateur naturel[8]. L'histoire du silure en Europe est donc comparable à celle d'autres poissons qui ont la même origine géographique : la carpe, le sandre, l'ide ou plus récemment l'aspe.
Ce poisson constitue aussi une exception notable : alors que partout les autres grands poissons prédateurs (qui ont des fonctions écologiques reconnues comme importantes voire vitales pour l'écosystème) régressent ou disparaissent d'une grande partie de leur aire de répartition[13],[14], que ce soit dans les milieux marins[15],[16],[17] ou dans les eaux douces[18],[2],[19] ; le silure conquiert au contraire de nouveaux milieux là où il a été introduit, avec des populations en forte croissance en quelques décennies[20] et des groupes d'individus qui commencent à atteindre de grandes tailles.
Alimentation
Régime alimentaire
Dès les années 1980 on s'intéresse au régime alimentaire du silure et à sa place dans le réseau trophique[21]. Son alimentation principale est le plus souvent représentée par les cyprinidés les plus abondants dans son environnement tels que brèmes, carassins, carpes, tanches, rotengles, chevesnes, barbeaux, hotus, etc.
C'est un poisson carnassier typiquement généraliste et opportuniste. Il peut consommer une grande variété d'espèces de poissons et parfois d'autres animaux vivant dans l'eau ou au bord de l'eau, pourvu qu'il soit capable de l'avaler. Il consomme essentiellement des poissons, mais aussi des mollusques, des crustacés, ainsi que des oiseaux d’eau et des mammifères aquatiques. Le silure peut être un grand consommateur d'écrevisses si elles sont bien présentes[22]. Il consomme aussi des insectes comme des larves de libellules (plutôt pour les petits silures) et occasionnellement des amphibiens. Le silure peut être considéré comme un superprédateur se nourrissant parfois d'autres prédateurs (sandre, brochet, etc) pouvant mesurer jusqu'au tiers de sa propre taille, bien que ceux-ci ne constituent qu'une faible part de son alimentation[7]. De gros sujets peuvent ingérer des poissons de plus de 5 kg. Son caractère au moins localement envahissant pourrait être lié à sa grande adaptabilité alimentaire[22].
L’opportunisme et l’adaptabilité de cette espèce s'illustre par exemple au bord du Tarn, où l'alimentation de certains silures est composée à 80 % de pigeons qui viennent s'abreuver sur les berges[23],[24]. Ailleurs, il attaque occasionnellement des oiseaux tels que des poules d'eau, foulques, grèbes, laridés, cormorans, canards, etc, et parfois des jeunes ragondins et autres mammifères aquatiques[25],[22],[7]. Dans la Loire et la Garonne, où les poissons migrateurs comme la lamproie marine et le saumon atlantique sont présents et faciles à attraper au niveau des obstacles avec passes à poissons où ils se concentrent, ceux-ci peuvent constituer une part importante de son alimentation[22].
Fréquemment, en été, lors de fortes chaleurs et peut-être par manque d’oxygène, les mollusques du genre Corbicula meurent, sortent de leur coquille et remontent en surface, ils deviennent un mets de choix pour le silure, qui apprécie aussi d'autres moules d'eau douce comme les mulettes (anodontes) et autres organismes filtreurs[22].
En 2017 des études de contenu stomacal combinées avec analyse isotopique, effectuées dans deux lacs tchèques, montrent que le silure glane occupe une niche écologique bien plus large que celle des autres prédateurs d'eau douce (brochet, sandre, perche...) et que selon les cas et ressources alimentaires présentes il se comporte tantôt en généraliste et tantôt en spécialiste. Il est très adaptable et doué de capacité d'apprentissage. Il est capable de consommer les autres prédateurs présents dans son environnement, mais son impact concerne l'ensemble de l'écosystème aquatique, avec les poissons herbivores et omnivores comme groupe écologique le plus consommé. Il ne remplace pas le brochet, le deuxième plus grand prédateur présent dans son écosystème, car les deux espèces tendent à avoir des niches écologiques différenciées.[7]. D'après une étude similaire de 2015 dans le Lot cependant, le régime du silure est au contraire assez voisin de celui du brochet, mais les deux espèces semblent se faire peu de concurrence grâce à la productivité du milieu, ainsi que par des zones ou horaires de chasse probablement différentes[26].
Consommation et croissance

Comme tous les poissons le silure est un animal ectotherme (à sang froid). De plus cette espèce est peu active et consomme donc peu d'énergie. Malgré sa taille il n'a donc pas besoin de consommer beaucoup de nourriture chaque année pour croître convenablement, comparé aux animaux à sang chaud (oiseaux et mammifères). Les silures peuvent donc cohabiter en nombre dans un habitat malgré une ressource qui peut paraitre faible vis-à-vis de leur taille. Selon le grand aquarium de Touraine un silure de 2 mètres mange en moyenne 1 kg de poisson tous les trois jours en été lorsque la température de l'eau se situe aux alentours de 22 °C. Cette quantité diminue nettement quand l'eau se refroidit : comme beaucoup d'animaux à sang froid, en hiver le silure s'alimente peu.
Entre deux prises alimentaires, le silures passe un certain temps l'estomac vide, mais plus ou moins fréquemment selon le milieu. Par exemple dans le Lac de Most en Tchéquie, 72 % des 232 silures examinés avaient l'estomac vide, 10 % contenaient seulement l'un des appâts disposés par les scientifiques et 18 % contenaient un animal du régime alimentaire normal (65 aliments comptabilisés dans ce milieu, dont sept espèces de poissons, cinq de sauvagine, une de mammifères aquatiques, deux amphibiens et des œufs), alors que dans le lac Milada (lac artificiel rectangulaire de 250 ha et 16 m de profondeur moyenne issu de la submersion d'une mine de charbon à ciel ouvert en Tchéquie) seuls 40 % des estomacs de 93 silures examinés étaient vides, et 6 % contenaient l'appât contre 54 % des aliments normaux, et dans ce cas 117 aliments ont été retrouvés dans les estomacs (8 espèces de poissons, 2 espèces d'oiseaux d'eau, un mammifère aquatique, 2 espèces d'invertébrés, des œufs et quelques macrophytes non identifiés)[7].
L'alevin se nourrit d'abord de plancton et de micro-invertébrés. La taille de ses proies grandit à mesure de sa croissance. À la fin de la première année, il devient un prédateur opportuniste. Sa croissance est alors très rapide : taille de trente-cinq centimètres à un an, cinquante à deux ans et poids atteignant de 2,5 à 3 kilogrammes la troisième année. Un silure de 25 ans pèse environ 65 kilogrammes. Ce poids varie selon la quantité de nourriture disponible et la température de l'eau. Les silures glanes grandissent plus vite dans un environnement riche où leur capacité de prédation est alors accrue, ce qui est souvent le cas dans les cours d'eau où il a récemment été introduit.
Prédation sur les poissons migrateurs
En France, mis à part dans de rares cas, l'introduction du silure ne semble pas avoir d'impact négatif important sur les populations de poissons d'eau douce, ni en biomasse, ni en densité, ni en richesse spécifique. La question se pose en revanche au niveau des poissons migrateurs qui constituent une part non négligeable de son régime dans les cours d'eau français[26].
On constate que là où ils sont encore présents, le silure apprécie particulièrement les poissons migrateurs anadromes[27],[28]. Dans les années 2000, l'écologie fonctionnelle commence à mieux mesurer les effets écologiques de prédateurs introduits dans les écosystèmes dulçaquicoles[29] et du régime alimentaire du silure[1], que certains jugent en France préoccupants pour la biodiversité[30]. En 2016 une étude pilotée par le Muséum d'Orléans et conduite de 2011 à 2014 dans le Val de Loire conclut (à partir de l'examen du contenu stomacal de 60 spécimens de toutes tailles, pêchés au filet avec l'aide de pêcheurs professionnels)[31] que le régime alimentaire du silure est très éclectique (23 espèces-proies). Dans le Val de Loire, les poissons et les cyclostomes (lamproies) sont l'essentiel de ses proies (en nombre et biomasse). En termes d'occurrences relatives ce sont les cyprinidés qui sont les plus consommés (29,5 %), devant les cyclostomes (23 %) et les écrevisses (10 %) mais en termes d’abondance d’individus de chaque espèce consommés (pour 110 proies identifiées) c'est la Lamproie marine qui est, en nombre, la proie la plus consommée (28 % du total). Par ailleurs, deux saumons atlantiques de 78 cm et 80 cm pesant respectivement 5,2 kg et 5,5 kg ont été retrouvés dans les estomacs[22].
Le silure semble particulièrement friand d'espèces migratrices (47 % du contenu stomacal en Val de Loire alors que ces espèces n'y sont pas dominantes et même « notoirement moins abondantes » et qu'elles ne sont présentes qu’à certains moments de l’année. Toujours en Val de Loire en termes de biomasse ingérée, c'est encore la lamproie marine qui domine parmi les proies, mais le saumon atlantique représente ensuite 19 % de la biomasse ingérée par le silure (en raison de son poids, malgré seulement deux spécimens retrouvés). L'anguille européenne figure aussi à son menu[32]. Des hydrobiologistes et écologues comme Guillerault et al. (2015), Libois & al. (2016) jugent préoccupant que le silure consomme dans le sud-ouest de la France de manière nettement préférentielle[22] des espèces qui sont toutes depuis la fin du XXe siècle « à l’exception du Mulet porc » concernées par « un statut de conservation très précaire »[33]. Toutes sont classées comme menacées à divers niveaux[34],[35].
Le problème est aggravé pour les migrateurs en phase de reproduction, car dans le cas de la Lamproie marine, toutes les femelles récupérées en Val de Loire dans les estomacs de silures « étaient adultes, en phase de frai et contenaient des œufs ». Pour le silure qui se montre capable de développer des stratégies de chasse complexes et efficaces, les migrateurs qui se concentrent temporairement au pied de chaque seuil et barrage sont a priori des proies particulièrement vulnérables[22]. Les écrevisses autochtones, dont le silure fait une grande consommation sont aussi des espèces menacées[36]
Selon une étude de 2015 dans le Lot, la consommation de poissons anadromes par le silure serait le fait de l'opportunisme. Les plus gros silures consomment plus souvent ces poissons parce que ces derniers sont plus gros. D'après l'analyse isotopique, les silures testés au niveau d'un barrage et ceux trouvés plus loin dans un site témoin sans barrage consommeraient à peu près autant de poissons d'origine marine en moyenne. Ce barrage n'aurait donc a priori pas d'impact sur le comportement alimentaire du silure[26]. Mais selon une autre étude effectuée dans la Garonne et publiée en 2018, il y a bien une spécialisation d'un certain nombre de silures pour la prédation sur les poissons migrateurs, au niveau des barrages et notamment dans leurs passes à poissons, du fait de la grande facilité de capture des proies à cet endroit. Le saumon est normalement un poisson difficile à capturer pour un silure, et il présente des mœurs très différentes, il devrait donc constituer une proie inhabituelle, mais il devient au contraire facile à capturer dans ce type de passe où les poissons sont très confinés. Durant la saison de migration de 2016, les silures venant nombreux chasser à l'intérieur de la passe à poissons de Golfech ont prélevé 14 des 39 saumons qui ont emprunté cette passe, soit 35%. De nombreux silures ont aussi tenté d'attaquer les saumons à la sortie de la passe mais sans succès à cet endroit, les saumons sachant repérer et éviter efficacement ces prédateurs lorsqu'ils ont assez de place. La période de migration coïncide avec un changement de température de l'eau et avec l'arrivée des silures au niveau du barrage. Ainsi l'étude suggère un probable impact important de la présence du silure sur les poissons anadromes actuellement rares comme le saumon, dans le contexte des cours d'eau anthropisés avec des barrages et des passes à poissons[37].
Comportement
%252C_%D0%A1%D1%8B%D1%80%D0%B4%D0%B0%D1%80%D0%B8%D1%8F%252C_%D0%91%D0%B0%D0%B9%D2%9B%D0%BE%D2%A3%D1%8B%D1%80.jpg.webp)
Le silure est grégaire et territorial. Les jeunes silures se déplacent souvent en groupes de trois à quatre individus (et d'autant plus que le nombre d'individus est élevé sur un site). L'adulte est agressif envers les intrus s'il se sent en danger et il est très protecteur envers sa progéniture, il attaque tout intrus s'approchant trop près de son nid en période de reproduction, y compris les baigneurs. Ce réflexe est surtout destiné à protéger ses œufs et non à se nourrir.
Il apprécie les eaux profondes et abritées des courants, de préférence encombrées et tièdes en surface. Il affectionne les fonds vaseux, principalement en plaine. Il passe la majeure partie de la journée en groupe, indolent près du fond, ou protégé sous les arbres ou branches.
Il s'active plutôt au coucher du soleil, à la recherche de toute nourriture jusqu'au crépuscule. L'adulte chasse alors pour lui seul, mais la chasse peut être faite en groupe. Il peut aussi chasser en journée si son attention est attirée par un poisson ou un oiseau imprudent ou montrant des signes de faiblesse sur son territoire.
Des légendes médiévales présentaient le silure comme un mangeur d'homme. Selon les données disponibles, il peut attaquer l'homme, s'il se sent menacé, ou en période de reproduction où il défend sa progéniture, mais cela reste très rare et surtout peu dangereux, avec au maximum une blessure localisée. Cette agressivité vise alors à éloigner l'intrus, quel qu'il soit.
Le silure s'adapte aux conditions du milieu et peut radicalement changer ses habitudes de prédation. Ainsi des spécimens vivant dans le Tarn se sont spécialisés dans la chasse aux pigeons, qui se baignent dans les eaux peu profondes des rives, en employant une technique d'attaque en échouage similaire à celles employées par les orques du Chili et les crocodiles[38],[23].
Reproduction
Le frai a lieu de mi-mai à la mi-juin. Sa date dépend de la température de l'eau.
La ponte a lieu le soir ou à l'aube dans une température de 18 à 21 °C. Le silure fraye en couple, les œufs sont déposés dans un nid préparé à l'avance, que le mâle défendra farouchement contre tout intrus durant l'incubation. Le nombre d'œufs est fonction du poids de la femelle, on compte de 20 000 à 26 000 œufs par kilogramme. Une femelle de cent kilogrammes peut pondre jusqu'à 2 600 000 œufs.
Les mâles arrivent à leur maturité sexuelle dans leur 3e ou 4e année. Les femelles sont plus tardives et ce n’est que vers leur 5e ou 6e année qu'elles arrivent à leur maturité sexuelle.
La reproduction artificielle a fait l'objet de nombreuses expérimentations de la part des aquaculteurs, allant de la reproduction in situ[39] à la cryopréservation de ses spermatozoïdes [40] et des embryons[41] à l'élevage des larves en passant par l'ovulation artificiellement contrôlée [42], la survie des ovocytes exposés à des solutions salines et d'urine[43] et l'insémination artificielle, dont en Tchéquie et en France[44], en vue de l'aquaculture de l'espèce[45],[46]. Pour obtenir une reproduction (et ensuite une croissance maximale) à n'importe quelle saison, l'importance de la température de l'eau pour la maturation des gonades[47] puis pour une croissance optimale des jeunes et des adultes a aussi été étudiée[48].
En 1986, une étude a porté sur la production d'une triploïdie par exposition de l'ovule fraichement fécondé à un choc thermique (4 °C durant 30 à 40 min dans les 5 min suivant la fertilisation, opération qui tue 70 à 75 % des œufs fécondés)[49],[50],[51].
Traitement médiatique et controverses
Très apprécié d'une nouvelle catégorie de pêcheurs pour sa force et les « combats » qu'il engendre lors de sa pêche, il fait l'objet depuis son apparition en France d'un intérêt et d'un traitement médiatique particulier[52] oscillant « entre fascination et angoisse » (ainsi après qu'il eut été aperçu et signalé à proximité de rejets de centrales nucléaires, et avant qu'on l'étudie près d'une centrale nucléaire (Golfech)[53], qu'on fasse savoir qu'il affectionne ces lieux en tant qu'espèce thermophile[54], on évoque un poisson-chat dont la taille pourrait résulter de « variations génétiques »[55]). Son introduction fait encore l'objet de controverses[56], même dans le monde de la pêche où deux catégories de pêcheurs s'affrontent concernant sa place dans les eaux d'Europe de l'Ouest et notamment de France : les anti-silures et les pro-silures (qui acceptent ou encouragent sa présence dans des régions où il était naturellement absent).
De nombreuses images et vidéo diffusées sur Internet et via des articles de revues de pêche le présentent comme une prise spectaculaire pour le pêcheur, et parfois comme un animal dangereux alors que d'autres le montrent (hors contexte de pêche) comme un animal facile à approcher et au comportement plutôt placide et débonnaire[57] (quand il n'est pas en chasse).
Outre-hexagone[pas clair], le silure dès 1945 est suspecté par la presse de dévorer des enfants voire des adultes « quand bien même seules des parties de corps ont été retrouvées dans les estomacs des poissons »(Gudger, 1945).
En 2012 des chercheurs toulousains publient dans la revue Plos One un article sur le comportement d'échouage volontaire par des silures s'attaquant à des pigeons (Cucherousset et al., 2012), qui, repris par des vidéos fera un « buzz médiatique »[58].
Divers articles de presse abordent son aspect d'espèce invasive ou le jugent indésirable car susceptible de perturber les équilibres écologiques aquatiques en s'attaquant aux poissons autochtones et/ou en perturbant les frayères ou le espèces migratrices[59] par exemple.
Valadou (membre du Conseil Supérieur de la Pêche) en 2007[60] et Proteau et al. en 2008[54] nuancent ce risque. En 2017, à partir d'une analyse lexicale, une étude a cherché à analyser la controverse telle que présentée par la presse française de 2003 à 2015, montrant « que des représentations négatives continuaient d’être véhiculées par les récits médiatiques » durant toute cette période principalement en raison du caractère allochtone de l'espèce, à partir d'un élément fondateur qui a été son introduction, souvent volontaire, suivie en France de son expansion dans les années 1980-1990, et peut être en raison du fait qu'il soit inhabituellement grand (pour un poisson d'eau douce), souvent considéré comme laid et de mauvaise réputation. Cette étude a aussi montré que c'est localement que la presse s'est montrée intéressée par le silure (pour 2202 articles analysés, seuls 88 articles (4 %) proviennent de quotidiens nationaux). L'introduction est « considérée au mieux comme un accident, et au pire, comme un acte malveillant »[56] susceptible de nuire aux espèces autochtones, par exemple au « traditionnel goujon » ou encore à la « "traditionnelle pêche professionnelle » ; selon cette étude « régulièrement accompagné d’un jugement péjoratif : « de façon malveillante », « de façon illégale », « clandestinement », « pour le seul plaisir de la pêche », « croyant bien faire, [il] a introduit de redoutables prédateurs », « de façon malencontreuse », « petits malins qui ont introduit le silure », « introduit maladroitement », « de mauvais plaisants les y ont mis », etc. »[56]. La presse l'affuble de surnom et descriptions métaphoriques qui entretiennent l'attention du lecteur, et donnent à ce poisson une dimension quasi-mythique « « requin d’eau douce », « (notre) monstre du Loch Ness », « Goliath du fleuve », « baleine des eaux douces », « monstre sanguinaire », « monstre des rivières », « nouveau colosse de nos cours d’eau », « monstre dévoreur d’enfants ou de jeunes filles », « “la bête” », etc. ». Ceci est exacerbé par la diffusion de « « légendes » (43 fois sur 2202), « rumeurs » (27 fois), « soupçons » (14 fois) et « bruits qui courent » à son sujet. Il aurait attaqué des baigneurs, mangé des chiens, des enfants et même des veaux entiers. Dans le Lot, un pêcheur muni d’un écho-sondeur en aurait repéré un de quatre mètres (Sud-Ouest, 7 mai 2004) ».
Jean-Noël Kapferer (1987) souligne que le thème de l’animal malveillant est l'une des spécificités des rumeurs en tant que phénomène social, facilement soutenu par le rouage rhétorique et qui porte la rumeur : « il n’y a pas de fumée sans feu » (tautologie)[56]. Via la presse, certains pêcheurs « s’indignent du « délit de sale gueule » (6 fois) » dont souffre cet animal[56]. À partir de 2006, l'espèce semble moins mystérieuse et l'animal semble mieux perçu par les médias (pour la période 2003-2015, par rapport aux années 1980, mais on continue à craindre un comportement invasif et des problèmes à l'image de ceux posés par les « écrevisses américaines/de Louisiane/de Californie, tortue de Floride, grenouille-taureau, insecte, végétal, frelon asiatique, poisson-chat, vison, ragondin, etc. » »[56]; Ainsi en 2015, selon la presse, des représentants de la pêche amateur et professionnelle fustigent « le rôle du silure dans la diminution des stocks de poisson migrateurs : « “La seule menace qui pèse sur les lamproies est le silure. Ils sont de plus en plus nombreux dans la Garonne” » selon le secrétaire de l'Adapaef, association de pêcheurs du Sud-Ouest[56] (une étude de 2016 a retrouvé de nombreuses lamproies dans les estomacs de silures ; ce sont là ses principales proies, avec l'anguille et les crustacés, devant le Barbeau et de nombreuses autres espèces[22]).
En 2017, Rees & al ont étudié au Royaume-uni les aspects socio-économiques communs aux amateurs de silures[61].
Valeur alimentaire
Sa chair est comestible mais pas considérée comme de grande valeur.
En outre, comme pour tous les prédateurs, et parce qu'il se nourrit aussi de sédiments et d'animaux filtreurs, sa chair peut être polluée par des pesticides, des organochlorés tels que les PCB et divers éléments traces métalliques toxiques (cadmium, plomb, mercure, arsenic et chrome[62] voire des radionucléides[63],[64].
D'après une étude faite dans le bassin du Pô (Italie du Nord) de 2007 à 2009 chez cette espèce, le mercure (Hg) est souvent le contaminant le plus problématique[65] ; il est surtout retrouvé dans la chair (muscles) et le foie, le cadmium (Cd) dans le rein, le plomb (Pb) à la fois dans les branchies, le foie et la chair, alors que le chrome est plus spécifiquement fixé dans les branchies et le foie[65]. Dans ces cas le mercure dépassait les niveaux maximaux (ML) de 0,5 ppm dans 18 % des échantillons, alors que le Pb et le Cd ne dépassaient pas les normes européenne[66] dans les tissus musculaires[65]. Les taux les plus élevés de mercure (Hg) étaient dans ces cas corrélées à la proximité d'activités industrielles[65]. Les auteurs considèrent que cette espèce ne répond pas dans ce contexte aux normes et recommandations de consommation humaine et que de manière générale « une surveillance étroite de la pollution par les métaux est fortement recommandée, en particulier dans les poissons piscivores, à cause leur capacité de bioaccumulation »[65],[64], d'autant que les niveaux d'alerte sont également souvent dépassés pour des toxiques de type PCB[67]. Des résultats similaires ont été obtenus dans le bassin du Danube[68]. Plus le silure est grand et âgé, plus il est susceptible d'avoir accumulé des polluants persistants[64].
Une étude récente (2017) a porté sur la composition biochimique de ses œufs, concluant qu'ils pourraient avoir (en raison de leur teneur en phospholipides et en acides gras polyinsaturés ω3) une certaine valeur nutritionnelle comme possible complément alimentaire, qui serait à confirmer par des analyses plus poussées [69], notamment car ses œufs pourraient être contaminés par des polluants organiques persistants liposolubles ou d'autres polluants.
Notes et références
- Copp G.H., Britton J.R., Cucherousset J., Garcia-Berthou E., Kirk R., Pecler E., Stakénas S., (2009) Voracious invader on benign feline ? A review of the environmental biology of European catfish, Silurus glanis, in its native and introduced anges. Fish and Fisheries , 10 (3) : 252-282
- Dudgeon D & al. (2006) Freshwater biodiversity: importance, threats, status and conservation challenges. Biol. Rev. 81, 163–18
- Slavík O, Horký P & Wackermannová M (2016) How does agonistic behaviour differ in albino and pigmented fish ?. PeerJ, 4, e1937.
- « Silure record du monde : découvrez la taille du plus gros silure du monde », sur www.1max2peche.com (consulté le )
- Jean-Pierre Proteau, Olivier Schlumberger, Pierre Élie, Le silure glane : biologie, écologie, élevage, Éditions Quae, , p. 3 et 21
- Carol J, Zamora L & García-Berthou E (2007) Preliminary telemetry data on the movement patterns and habitat use of European catfish (Silurus glanis) in a reservoir of the River Ebro, Spain. Ecol. Freshw. Fish. 16, 450–456 .
- Eloranta A.P, Vejříková I, Peterka J, Kočvara L, Vejřík L, Šmejkal M, ... & Sajdlová Z (2017) European catfish (Silurus glanis) as a freshwater apex predator drives ecosystem via its diet adaptability. Scientific Reports, 7, 15970 | URL:https://www.nature.com/articles/s41598-017-16169-9 | publié en licence ouverte cc-by-sa 4.0
- Schlumberger O, Sagliocco M & Proteau J.P (2001) Biogéographie du silure glane (Silurus glanis) : Causes hydrographiques, climatiques et anthropiques. Bulletin Français de la Pêche et de la Pisciculture, (357-360), 533-547. résumé
- Gaudant P.J (1994), L'ichtyofaune du Pannonien supérieur de Goetzendorf an der Leitha (Basse Autriche). Ann. Naturhist. Mus. Wien , 96 a : 117-131.
- Mein P, Méon H, Romaggi J.P, Saùuel E (1983). La vie en Ardèche au Miocène supérieur d'après les documents trouvés dans la carrière de la montagne d'Andance. Nouv. Arch. Mus. Hist. nat. Lyon , fasc. 1 : 37-44
- Brana J.Y & Rigaud G (1997). L'influence de l'Homme sur l'expansion du silure en Europe (Silurus glanis ). Mémoire Univ. Lyon (France). 23 p. + annexes
- F. Krieg, A. Triantafyllidis, R. Guyomard Published (March 2000), Mitochondrial DNA variation in European populations of Silurus glanis
- Sergio, F., Newton, I., Marchesi, L. & Pedrini, P. Ecologically justified charisma: preservation of top predators delivers biodiversity conservation. J. Appl. Ecol. 43, 1049–1055 (2006).
- Ripple, W. J. et al. Status and ecological effects of the world’s largest carnivores. Science 343, 1241484 (2014).
- Myers R.A, Baum J.K, Shepherd T.D, Powers S.P & Peterson C.H (2007) Cascading effects of the loss of apex predatory sharks from a coastal ocean. Science 315, 1846–1850
- Veit, R. R., Mcgowan, J. A., Ainley, D. G., Wahl, T. R. & Pyle, P. Apex marine predator declines ninety percent in association with changing oceanic chmate. Glob. Change Biol. 3, 23–28 (1997).
- Ferretti, F., Worm, B., Britten, G. L., Heithaus, M. R. & Lotze, H. K. Patterns and ecosystem consequences of shark declines in the ocean. Ecol. Lett. 13, 1055–1071 (2010).
- Rosenblatt A.E & al. (2015) Factors affecting individual foraging specialization and temporal diet stability across the range of a large “generalist” apex predator. Oecologia 178, 5–16
- Stone R (2007) The last of the leviathans Science 316, 1684–1688
- Copp H.G & al. (2009) Voracious invader or benign feline ? A review of the environmental biology of European catfish Silurus glanis in its native and introduced ranges. Fish. Fish. 10, 252–282
- Pouyet C (1987) Étude des relations trophiques entre poissons carnassiers dans une rivière de seconde catégorie, référence particulière au silure glane (Silurus glanis, Siluridae). Rapport technique de D.E.A. Université de Lyon I, Villeurbanne, 25 p.
- Libois R, Rosoux R & Gabris B (2016) Approche du régime alimentaire chez le Silure glane. Recherches Naturalistes en Région Centre, 3, 32-38
- Dans le Tarn, d’étonnants poissons se mettent à chasser… le pigeon, par Pierre Barthélémy, « Passeur des sciences », billet du 6 décembre 2012.
- « “Freshwater Killer Whales”: Beaching Behavior of an Alien Fish to Hunt Land Birds », sur PLUS ONE, (consulté le )
- Jacques Blondel et Jonathan Lhoir, Oiseaux et changement global. Menace ou aubaine ?, Éditions Quae, , p. 130
- Nicolas Guillerault, Sébastien Delmotte, Nicolas Poulet, Frédéric Santoul, Etudes des interactions du Silure glane (Silurus glanis) avec l’ichtyofaune métropolitaine, 2015, .
- Syväranta J, Cucherousset J, Kopp D, Martino A., Cereghino R., Santoul F (2009) Contribution of anadromous fish to the diet of European catfish in a large river system. Naturwissenschaften , 96 : 631-635
- Syväranta J., Cucherousset J., Kopp D, Crivelli A., Cereghino R., Santoul F., (2010) Dietary breadth and trophic position of introduced European catfish, Silurus glanis, in the Tarn river (Garonne river basin), southwest France. Aquatic Biology , 8 : 137-149.
- Martino A (2012) Écologie trophique des poissons top-prédateurs - interactions entre espèces natives et introduites au sein d’écosystèmes dulçaquicoles. Thèse Univ. Toulouse, Écologie fonctionnelle, 124 p.
- Poulet N., Santoul F (2015) Does the non-native European catfish Silurus glanis threathen French river fish populations ? Freshwater biology , doi : 10.1111/fwb.12545
- Chevalier J., (2004) Le silure en Saône aval : perspectives pour la pêche professionnelle. Utilité de la pêche professionnelle pour le suivi des populations. Min. Agric. Aliment. Pêche, affaires rurales. BTS « Gestion de la faune sauvage aquatique », Chevroux, 30 p.
- Martino A, Syväranta J, Crivelli A., Cereghino R., Santoul F (2011) Is European catfish a threat to eels in southern France ? Aquatic Conservation , 21 (3) : 276 – 281
- UICN (2012) La liste rouge des espèces menacées en France. Poissons d’eau douce de France métropolitaine. Rapport UICN, Paris, 12 p.
- Keith P. Allardi J, Moutou B, (1992) Livre Rouge des espèces menacées de poissons d’eau douce de France et bilan des introductions. SFF-MNHN, CSP. Cemagref, Ministère de l’Environnement. 110 p.
- Keith P, Persat H, Feunteun E, Allardi J (2011) Les poissons d’eau douce de France. Biotopes-Museum national d’Histoire naturelle, Mèze-Paris, 552 p.
- Lemarchand C (2012) L’écrevisse à pattes blanches. Histoire d’une sauvegarde. Catiche Production, Nohanent, 32 p.
- Stéphanie Boulêtreau, Adeline Gaillagot, Laurent Carry, Stéphane Tétard, Eric De Oliveira, Frédéric Santoul, Adult Atlantic salmon have a new freshwater predator, avril 2018, .
- Cucherousset J, Boulêtreau S, A zemar F, Compin A, Guillaume M & Santoul S (2012) ‘‘Freshwater Killer Whales’ : beaching behavior of an alien fish to hunt land birds. PLoS ONE 7(12) : e50840.doi : 10.1371/jounal.pone.0050840
- Horvath, L. (1977). Improvement of the method for propagation, larval and postlarval rearing of the wels (Silurus glanis L.). Aquaculture, 10(2), 161-167.
- Linhart, O., Billard, R., & Proteau, J. P. (1993). Cryopreservation of European catfish (Silurus glanis L.) spermatozoa. Aquaculture, 115(3-4), 347-359 (résumé)
- Linhart, O., Rodina, M., Flajshans, M., Gela, D., & Kocour, M. (2005). Cryopreservation of European catfish Silurus glanis sperm: sperm motility, viability, and hatching success of embryos. Cryobiology, 51(3), 250-261 (résumé).
- Brzuska, E., & Adamek, J. (1999). Artificial spawning of European catfish, Silurus glanis L.: stimulation of ovulation using LHRH‐a, Ovaprim and carp pituitary extract. Aquaculture Research, 30(1), 59-64 (résumé)
- Linhart, O., & Billard, R. (1995). Survival of ovulated oocytes of the European catfish (Silurus glanis) after in vivo and in vitro storage or exposure to saline solutions and urine. Aquatic Living Resources, 8(4), 317-322.
- Linhart, O., Gela, D., Rodina, M., & Kocour, M. (2004). of artificial propagation in European catfish, Silurus glanis L. ; Aquaculture, 235(1), 619-632.
- Linhart, O., Šĕtch, L., Švarc, J., Rodina, M., Audebert, J. P., Grecu, J., & Billard, R. (2002). The culture of the European catfish, Silurus glanis, in the Czech Republic and in France. Aquatic Living Resources, 15(2), 139-144.
- Brzuska, E. (2001). Artificial spawning of European catfish Silurus glanis L.: differences between propagation results after stimulation of ovulation with carp pituitary and Ovopel. Aquaculture Research, 32(1), 11-19.
- Proteau, J. P., Schlumberger, O., & Albiges, C. (1994). Influence de la température sur la maturation gonadique finale du silure glane (Silurus glanis L.): application a la reproduction hors saison naturelle.
- Hilge, V. (1985). The influence of temperature on the growth of the European catfish (Silurus glanis L.). Journal of Applied Ichthyology, 1(1), 27-31.
- Krasznai, Z., & Marian, T. (1986). Shock‐induced triploidy and its effect on growth and gonad development of the European catfish, Silurus glanis L. Journal of fish biology, 29(5), 519-527.
- Linhart, O., & Flajšhans, M. (1995). Triploidization of European catfish, Silurus glanis L., by heat shock. Aquaculture Research, 26(5), 367-370.
- Linhart, O., Haffray, P., Ozouf‐Costaz, C., Flajšhans, M., & Vandeputte, M. (2001). Comparison of methods for hatchery‐scale triploidization of European catfish (Silurus glanis L.). Journal of Applied Ichthyology, 17(6), 247-255.
- Bodt, J. M., Santoul, F., & Lefebvre, M. (2017). Analyse du traitement médiatique du silure glane (Silurus glanis), une espèce au centre de controverses. VertigO-la revue électronique en sciences de l'environnement, 17(1). http://vertigo.revues.org/18425
- Carry, L. et A. Goudard (2010). Suivi de la reproduction de la grande alose sur la Garonne en 2009. Suivi du comportement du silure au droit de l’usine hydroélectrique Edf de Golfech, Synthèse 2006-2009.
- Proteau J.P, Schlumberger O et Élie P (2008), Le silure glane : biologie, écologie, élevage. Paris : Éditions Quae.
- Armani G. (2011), Silure et PCB : deux intrus dans l’espace fluvial pour penser l’ordre naturel, VertigO - la revue électronique en sciences de l’environnement, Hors-série 10, URL : http://vertigo.revues.org/11305 ; DOI : 10.4000/vertigo.11305
- Bodt, J. M., Santoul, F., & Lefebvre, M. (2017). Analyse du traitement médiatique du silure glane (Silurus glanis), une espèce au centre de controverses. VertigO-la revue électronique en sciences de l'environnement, 17(1).
- Silures dans la Loire, mis en ligne par Pierre-Alain Gillet le 6 novembre 2015
- Boure R & Lefebvre M (2013), Circulation, altération et appropriation d’une information scientifique, Questions de communication, n 24, p. 169-198. DOI : 10.4000/questionsdecommunication.8690
- (Laharanne, Parouty et Carry, 2007 ; Guillerault, Delmotte, Poulet et Santoul, 2015).
- Valadou B (2007), Le silure glane (Silurus glanis, L.) en France. Évolution de son aire de répartition et prédiction de son extension. Conseil Supérieur de la Pêche, Fontenay-sous-Bois, France.
- Rees E.A, Edmonds-Brown V.R, Alam M.F, Wright R.M, Britton J.R, Davies G.D & Cowx I.G (2017) Socio-economic drivers of specialist anglers targeting the non-native European catfish (Silurus glanis) in the UK. PloS one, 12(6), e0178805 | résumé (publié sous licence ouverte)
- Squadrone S, Prearo M, Brizio P, Gavinelli S, Pellegrino M et al., (2013) Heavy metals distribution in muscle, liver, kidney and gill of European catfish Silurus glanis from Italian Rivers. Chemosphere 90 :358–365
- Alomar, H., Lemarchand, C., Rosoux, R., Vey, D., & Berny, P. (2016). Concentrations of organochlorine compounds (pesticides and PCBs), trace elements (Pb, Cd, Cu, and Hg), 134Cs, and 137Cs in the livers of the European otter (Lutra lutra), great cormorant (Phalacrocorax carbo), and European catfish (Silurus glanis), collected from the Loire River (France). European journal of wildlife research, 62(6), 653-661.
- Has-Schön E, Bogut I, Vuković R, Galović D, Bogut A, Horvatić (2015), Distribution and age-related bioaccumulation of lead (Pb), mercury (Hg), cadmium (Cd), and arsenic (As) in tissues of common carp (Cyprinus carpio) and European catfish (Sylurus glanis) from the Buško Blato reservoir (Bosnia and Herzegovina). ; J. Chemosphere. septembre 2015 ; 135:289-96. Epub 2015 May 15 (résumé).
- Squadrone S, Benedetto A, Brizio P, Prearo M, Abete MC (2015), Mercury and selenium in European catfish (Silurus glanis) from Northern Italian Rivers: can molar ratio be a predictive factor for mercury toxicity in a top predator ? ; Chemosphere. Janvier 2015 ; 119:24-30. Epub 2014 Jun 19.
- (1881/2006/CE et 629/2008/CE), normes qui pourraient être amenées à évoluer pour le mercure et le plomb notamment
- Squadrone, S., Favaro, L., Prearo, M., Vivaldi, B., Brizio, P., & Abete, M. C. (2013). NDL-PCBs in muscle of the European catfish (Silurus glanis): an alert from Italian rivers. Chemosphere, 93(3), 521-525.
- Jovicic, K., Nikolic, D. M., Visnjic-jeftic, E., Ikanovic, V., Skoric, S., Stefanovic, S. M.... & Jaric, I. (2015). Mapping differential elemental accumulation in fish tissues: assessment of metal and trace element concentrations in wels catfish (Silurus glanis) from the Danube River by ICP-MS. Environmental science and pollution research international, 22(5), 3820.
- Saliu F, Leoni B & Della Pergola R (2017) Lipid classes and fatty acids composition of the roe of wild Silurus glanis from subalpine freshwater ; Earth and Environmental Science Department, University of Milano Bicocca, Piazza della Scienza 1, Milano 20126, Italy, avril 2017 ; https://doi.org/10.1016/j.foodchem.2017.04.009
Annexes
Articles connexes
Bibliographie
- Jean-Pierre Proteau, Olivier Schlumberger et Pierre Elie, Le silure glane : biologie, écologie, élevage, Versailles, Quae, , 224 p. (ISBN 978-2-7592-0069-6, lire en ligne)
- Triantafyllidis, A., Krieg, F., Cottin, C., Abatzopoulos, T. J., Triantaphyllidis, C., & Guyomard, R. (2002). Genetic structure and phylogeography of European catfish (Silurus glanis) populations. Molecular Ecology, 11(6), 1039-1055.
Vidéographie
- Silures dans la loire, mis en ligne par Pierre-Alain Gillet le
Références taxinomiques
- (en) Référence Fauna Europaea : Silurus glanis Linnaeus, 1758
- (fr) Référence INPN : Silurus glanis L., 1758
- (fr+en) Référence FishBase :
- (fr+en) Référence ITIS : Silurus glanis L., 1758
- (en) Référence Animal Diversity Web : Silurus glanis
- (en) Référence NCBI : Silurus glanis (taxons inclus)
- (en) Référence UICN : espèce Silurus glanis Linnaeus, 1758 (consulté le )
- (fr) Référence DORIS : espèce Silurus glanis
- (en) Référence Catalogue of Life : Silurus glanis Linnaeus, 1758 (consulté le )
Liens externes
- Portail de l’ichtyologie
- Portail des lacs et cours d’eau
_(13532617795).jpg.webp)
