Cirrhose
La cirrhose (du grec ancien : κιρρός / kirrhós « roux ») est une maladie grave du foie, résultant d’agressions biochimiques répétées, le plus souvent par la consommation chronique d’alcool ou par des virus hépatotropes mais pouvant aussi résulter de l’accumulation de graisses dans le foie, de maladies auto-immunes, de déficits enzymatiques ou autres. Elle est définie selon des critères morphologiques de fibrose et de transformation de l’architecture normale du foie en nodules structurellement anormaux dont la couleur roussâtre a inspiré le nom actuel de la maladie à René Laennec[1]. Ces anomalies structurelles s’accompagnent de surcroît de bouleversements de la fonction hépatique.

| Spécialité | Gastro-entérologie et hépatologie |
|---|
| CIM-10 | K70.3, K71.7, K74 |
|---|---|
| CIM-9 | 571 |
| OMIM | 215600 |
| DiseasesDB | 2729 |
| MedlinePlus | 000255 |
| eMedicine | 185856 et 366426 |
| eMedicine | med/3183 radio/175 |
| MeSH | D008103 |
| Causes | Alcoolisme, hépatite, cirrhose infantile indienne (en), hépatite auto-immune, Cholangite sclérosante primitive et hémochromatose classique |
| Traitement | Transplantation hépatique |
| Médicament | Bumetanide, furosémide, ethacrynic acid (en), torsemide (en), ethacrynate sodium (d), rifaximin (en), ledipasvir/sofosbuvir (en), acide obéticholique, sofosbuvir, peginterféron alfa-2b, boceprevir, tolvaptan, daclatasvir, ribavirine, adefovir, peginterféron alfa-2a, siméprévir et entécavir monohydraté (d) |
| Patient UK | Cirrhosis-pro |
![]() Mise en garde médicale
Mise en garde médicale
Les modifications provoquées par la fibrose entraînent en outre une élévation de la pression sanguine dans la veine-porte avec, dans les stades avancés de la cirrhose, un épanchement de liquide dans l’abdomen susceptible de s’infecter. Par ailleurs, la circulation sanguine tente de contourner l’obstacle en se redirigeant vers les veines abdominales et œsophagiennes. Ces dernières peuvent devenir des varices œsophagiennes dont la rupture est cause d’hémorragies potentiellement mortelles.
La perte des fonctions hépatiques peut quant à elle se manifester tant au niveau de la synthèse de molécules indispensables au bon fonctionnement du corps, avec hypoglycémie, baisse des niveaux sanguins d’albumine et tendance aux saignements, que de l’élimination de substances toxiques avec accumulation de celles-ci (en particulier l’ammonium produit par la flore intestinale) entraînant l’encéphalopathie hépatique qui peut aller jusqu’au coma et à la mort.
Généralement considérée comme irréversible, la cirrhose peut toutefois régresser lorsque l’agent causal a été éliminé mais le foie ne revient pas nécessairement à son activité antérieure. Le traitement a le plus souvent pour but de freiner la progression de la maladie et d’alléger ses complications. Dans les stades avancés, la principale, sinon la seule, option demeure la transplantation hépatique.
Pathogenèse
La cirrhose est l’aboutissement d’un processus d’inflammation chronique du foie par divers agents et toxiques. Elle a classiquement été associée à la consommation chronique d’alcool[2] mais si cela semble encore le cas en France, la cause la plus fréquente est, aux États-Unis et dans le tiers monde, l’hépatite C, suivie de la synergie entre hépatite C et alcool, de la stéatose hépatique non alcoolique, de l’hépatite B (avec éventuelle coinfection par le virus de l’hépatite D) et de causes diverses : hépatite auto-immune, cholangite biliaire primitive (anciennement : cirrhose biliaire primaire), cholangite sclérosante primitive, maladies de stockages dont l’hémochromatose et la maladie de Wilson, déficit en alpha 1-antitrypsine, granulomatoses, effets secondaires de diverses médications, maladies veineuses, cirrhose cardiaque, etc.
La cirrhose due à l’alcool est causée par le principal dérivé métabolique de ce dernier, l’éthanal (ou acétaldéhyde), ainsi que par les stress oxydatif et inflammatoire que sa consommation chronique engendre. Il peut en outre aggraver des maladies préexistantes dont la stéatose hépatique non alcoolique, l’hépatite C ou l’hémochromatose.
Une cirrhose se développe également chez environ 15 à 25 % des sujets infectés par le virus de l’hépatite C et 1 % des sujets infectés par le virus de l’hépatite B. Les dommages sont vraisemblablement causés par les défenses immunitaires, ces virus ne causant pas de tort aux cellules hépatiques par eux-mêmes.
Les mécanismes menant à la cirrhose secondaire à la stéatose hépatique non alcoolique ne sont pas connus avec certitude mais il semble établi qu’elle explique la plupart des cas de « cirrhose cryptogénique ».
Les cirrhoses peuvent encore être dues à une rétention de la bile.
Dans la majorité des cas et indépendamment de la cause, le processus menant à la cirrhose passe d’abord par des stades plus ou moins longs d’accumulation anormale de graisses (stéatose) puis d’hépatite. Les lésions sont alors totalement réversibles lorsque l’agent causal est éliminé ou neutralisé. S’il ne l’est pas, elles progressent et donnent lieu à la production de tissu fibreux. Celle-ci se fait selon deux mécanismes, la fibrose péri-cellulaire et la formation de travées fibreuses. Ces deux mécanismes ne sont pas identiques, bien qu’étroitement apparentés.
Fibrose péri-cellulaire

La production de tissu fibreux par diverses populations de cellules dont les plus importantes (mais non les seules) semblent être les cellules stellaires présentes dans l’espace de Disse. Ces cellules, responsables dans le foie sain, du stockage de la vitamine A et de graisses, sont activées en réponse à des lésions cellulaires et réagissent de façon à limiter ces lésions. Elles acquièrent pour ce faire des propriétés sécrétoires et contractiles, favorisant la prolifération des cellules fibrogéniques, leur contractilité et la production de tissu fibreux ; d’autre part, elles s’opposent à la dégradation du tissu fibreux nouvellement formé par la production d’inhibiteurs des métalloprotéinases[3]. Il a été démontré dans un modèle animal que ce phénomène est auto-régulé car les cellules stellaires activées entrent dans un processus de vieillissement cellulaire, produisent moins de tissu fibreux et sont plus facilement reconnues par les cellules tueuses naturelles[4].
Par ailleurs, elles obstruent le flux sanguin (chez l’individu sain, le sang provenant du tube digestif est emmené au foie par la veine porte jusqu'aux cellules hépatiques ; le sang revient dans la circulation générale par les veines sus-hépatiques qui se déversent dans la veine cave inférieure). Comme le sang ne peut plus circuler, il stagne dans le système porte, ce qui entraîne une augmentation de la pression dans ce dernier[5].
Formation de travées fibreuses

La perte localisée du parenchyme hépatique, à la suite de l’obstruction en cet endroit de la circulation se jetant dans la veine hépatique et dans la veine-porte. Si l’occlusion de l’un des deux vaisseaux ne provoque qu’une atrophie, une double obstruction entraîne une diminution de l’apport sanguin et aboutit à la formation de cloisons fibreuses se développant sur le trajet des vaisseaux obstrués. Ces cloisons comprennent, outre le tissu fibreux, des débris cellulaires, de petites fistules artérioveineuses et des vaisseaux sanguins nouvellement formés. Il s’agit donc d’un tissu cicatriciel se développant le long de vaisseaux sanguins ayant cessé d’alimenter la portion de tissu hépatique qu’ils desservaient.
Dans la cirrhose alcoolique, ces deux mécanismes se font l’un à la suite de l’autre. Dans la plupart des autres causes de cirrhose, ils se produisent simultanément sur un tissu préalablement sain (ou à tout le moins non fibrosé)[6].
La fibrose empêchant la reconstitution de lobules hépatiques normaux, la régénération des hépatocytes s’effectue de manière anarchique et aboutit à la constitution de « nodules de régénération » ayant perdu les connexions vasculaires et biliaires, avec stagnation de la bile dans les canaux biliaires intrahépatiques. Par ailleurs, l’hypertension portale résultant de la fibrose induit la formation de dérivations que constitue la circulation veineuse collatérale abdominale et les varices œsophagiennes. Enfin, la perte des cellules hépatiques entraîne une diminution des différentes fonctions de cet organe et se traduit par une insuffisance hépato-cellulaire. Cet état d’insuffisance persiste tant que les cellules ne se sont pas correctement renouvelées et réorganisées, et ce même si la cirrhose régresse[6].
Hypertension portale
L’hypertension portale est définie par une différence de pressions hydrostatiques de plus de 5 mmHg entre circulation infrahépatique et suprahépatique (bien que cette mesure ne soit jamais réalisée en pratique clinique avant la pose de TIPS). Elle résulte, dans le cas de la cirrhose (à quelques rares exceptions dont la cirrhose cardiaque et le syndrome de Budd-Chiari), de l’obstruction des sinusoïdes hépatiques et de l’engorgement sanguin dans les vaisseaux provenant des organes dépendant pour leur drainage de la veine porte (soit l’estomac, les intestins, la rate, le pancréas et la vésicule biliaire) à la suite de la vasodilatation artérielle.
Elle est donc intrahépatique et a pour conséquence la dérivation du flux sanguin vers des vaisseaux collatéraux de plus faible pression afin de permettre le désengorgement.
Le développement de la circulation collatérale qui se produit dans l’ensemble de l’arbre circulatoire dépendant de la veine-porte donne classiquement lieu au signe clinique de la caput medusae (« tête de Méduse ») par réactivation de la circulation périombilicale.
Il s’accompagne en outre d’un étirement des veines et d’un amincissement de leurs parois jusqu’à la formation de varices œsophagiennes, gastriques, duodénales ou rectales, lesquelles peuvent facilement se rompre et entraîner des hémorragies plus ou moins importantes, depuis le saignement asymptomatique détecté par ses séquelles lors de l’exploration du tube digestif par endoscopie jusqu’à l’urgence vitale voire le décès. La formation de varices œsophagiennes se produit chez environ 5-15 % de cirrhotiques par an.
L’hypertension portale entraîne également de façon fréquente une congestion de la rate qui se manifeste par une augmentation de son volume (avec, éventuellement, une gêne voire une douleur abdominales) ainsi qu’une séquestration des globules blancs et, surtout, des plaquettes.
Diagnostic
La cirrhose du foie est une maladie fréquente dont l'incidence est probablement sous-estimée, car elle peut ne présenter aucun signe à ses débuts et les premières plaintes sont généralement peu spécifiques : fatigue, nausées, vagues douleurs dans l'hypocondre droit, perte d’appétit, amaigrissement, etc. Il a été estimé en 2008 qu’elle serait responsable de plus de 25 000 décès par an aux États-Unis et que sa prévalence serait proche de 1 % de la population générale[2].
La suspicion d'une cirrhose est fondée sur l'ensemble des arguments cliniques et biologiques retrouvés chez un patient. Le diagnostic de certitude est fait par l'analyse anatomopathologique du tissu hépatique. Le matériel à analyser est le plus souvent fourni par la biopsie hépatique. La biopsie hépatique est utile pour affirmer le diagnostic de cirrhose et contribue à la recherche de la cause de celle-ci.
Les signes positifs de cirrhose sont :
- cliniques : consistance dure et bord tranchant du bord inférieur du foie et signes cliniques d'insuffisance hépato-cellulaire (angiomes stellaires, etc.) ;
- biologiques : chute des facteurs de coagulation (taux de prothrombine, facteur V) et hypoalbuminémie, bloc béta-gamma à l'électrophorèse des protéines sériques. Le bloc est généré par l'accumulation sérique d'immunoglobulines A polyclonales [7],[8], à cause notamment du défaut de leur catabolisme lors de la cirrhose. En effet, normalement, les immunoglobulines A sont catabolisées principalement par le foie[9].
En France, la Haute autorité de santé (HAS) recommande, dans certaines circonstances, l'utilisation des tests diagnostiques non invasifs pour le diagnostic de fibrose hépatique dont la cirrhose en 1re intention : examen physique (Fibroscan) et tests sanguins (FibroTest, FibroMètre, Hepascore). Ces examens sont remboursés depuis juin 2011 (JO 19/5/11[10]) dans l'hépatite C sans comorbidité et dans la limite d'un test par an et par patient. Il existe aussi un test sanguin spécifique à la cirrhose (CirrhoMètre), mais il n'est ni validé, ni remboursé.
Anamnèse
Les causes principales de cirrhose se trouvant actuellement être les hépatites virales, l’hépatopathie alcoolique et la stéatose hépatique non-alcoolique (plus couramment appelée NASH du fait de son acronyme anglo-saxon), la prise de renseignements médicaux se focalise plus précisément sur les comportements à risque associés à ces maladies : séjours en zones endémiques, rapports sexuels multiples et/ou non protégés, usage de drogues intraveineuses ou intranasales, réalisation de tatouages ou de piercings, travail en milieu hospitalier ou apparenté, antécédents de transfusions sanguines (à l’époque où le virus de l’hépatite C n’était pas connu), consommation d’alcool, son éventuel degré et son éventuelle durée, habitudes alimentaires, antécédents d’obésité, de diabète etc. Sont également investigués les antécédents personnels de maladies métaboliques et familiaux de maladies du foie.
Signes cliniques
Les signes et symptômes de la cirrhose ou de ses complications sont nombreux et variés. Nombre d’entre eux ne sont pas spécifiques et peuvent se produire en l’absence de cirrhose. Réciproquement, leur absence ne permet pas d’exclure définitivement le diagnostic.
Pendant une période plus ou moins longue, dite non compliquée, seul un examen clinique ou biologique peut mettre en évidence les stigmates. À un stade plus avancé, les signes révélateurs peuvent être une asthénie et amaigrissement, une ascite (présence de liquide à l'intérieur de la cavité péritonéale), un ictère (coloration jaune de la peau et des muqueuses). La cirrhose peut également se révéler par une complication : hémorragie digestive (le plus souvent par rupture de varices œsophagiennes), encéphalopathie avec troubles de conscience et flapping, dont le mécanisme est multifactoriel (notamment par le biais d'une augmentation de l'ammoniaque sanguine : hyperammoniémie).
Signes généraux
Altération de l'état général avec perte d’appétit, amaigrissement et fatigue. Aux stades avancés de la maladie, la cachexie se manifeste par une fonte des muscles temporaux et un jaunissement de la sclérotique.
- Le développement rapide ou soudain d’un état de choc avec hypotension, pâleur, accélération du rythme cardiaque traduit une perte de sang rapide, le plus souvent due dans la cirrhose à une rupture de varices œsophagiennes.
Signes liés à l’hypertension portale
- Ascite, c’est-à-dire accumulation de fluide dans la cavité péritonéale, donnant lieu, lorsqu’elle atteint un volume de 1 500 mL, au signe typique de matité des flancs lors de la percussion abdominale.
- Fetor hepaticus - odeur typique et nauséabonde due à des thiols (en particulier le diméthyl sulfide) dans l’haleine, à la suite de leur passage dans les poumons via les communications entre le système porte et la circulation systémique. Ce signe, survenant tard dans l’évolution de la maladie, est généralement associé à l’encéphalopathie hépatique.
- Hépatomégalie (augmentation du volume du foie) survenant dans les stades précoces de la cirrhose ; dans les stades plus avancés, le remodelage cicatriciel du foie diminue son volume qui revient à la « norme » voire devient « plus petit ». L’hépatomégalie est recherchée sur un(e) patient(e) allongé sur le dos, abdomen relâché et jambes repliées ; en inspiration, le bord inférieur du foie peut apparaître à la palpation comme une masse dure et régulière dans l’hypocondre droit voire dans l’épigastre. Son bord supérieur peut être repéré par percussion de la cage thoracique (le bord supérieur du lobe droit du foie, identifié par le son mat que produit sa percussion, se trouve chez le sujet sain à hauteur de la cinquième côte, en dedans d’une ligne descendant perpendiculairement depuis le milieu de la clavicule)[11].
- Hypogonadisme se manifestant par l’impuissance sexuelle, l’infertilité, la perte de libido. Il a pour causes principales la suppression de l’axe hypothalamo-hypophysaire et la baisse des niveaux d’IGF-1 (qui se produisent concurremment à la cirrhose mais indépendamment d’elle) mais les communications entre le système-porte et la circulation générale pourraient également jouer un rôle, vu qu’elles entraînent dans les modèles animaux une atrophie testiculaire ainsi qu’une production accrue d’œstrogènes[12].
- Souffle de Cruveilhier-Baumgarten, éventuellement audible à l’auscultation de la région épigastrique du fait des collatérales entre le système porte et les veines péri-ombilicales.
- Splénomégalie (augmentation du volume de la rate dont le bord inférieur peut devenir palpable) causée par reflux du sang dans la pulpe rouge de la rate[11]. Elle entraîne à son tour une séquestration accrue des plaquettes avec thrombocytopénie et, éventuellement, des globules blancs avec leucopénie ainsi qu’une destruction des globules rouges avec anémie[13].
Liés à une réduction de l’élimination hépatique
- Angiomes stellaires (présents dans un cas sur trois), érythème palmaire et féminisation avec augmentation de la taille de la poitrine (jusqu’à deux cas sur trois), liés à un taux anormalement élevés d’œstrogènes dans le sang.
- Astérixis - tremblement de la main lorsqu’elle est étendue, évoquant un battement d’ailes. Le signe, secondaire à une élévation du taux d’ammoniaques dans le sang et le cerveau, est typique de l’encéphalopathie hépatique.
- Ictère (« jaunisse ») de la peau, du blanc des yeux et des muqueuses, lié à un taux anormalement élevé de bilirubine dans la circulation (au moins 2–3 mg·dL-1), faisant suite à des troubles d’évacuation de la bile causés par la distorsion architecturale des voies biliaires intra-hépatiques. L’urine peut également apparaître foncée.
- Démangeaisons liées aux troubles d’évacuation des sels biliaires.
Liés à une réduction de la synthèse hépatique
- Hypoaldostéronisme hyporéninémique causé par la diminution de production d’angiotensine II. En résultent une diminution d’excrétion du potassium dans les urines avec hyperkaliémie, et une diminution de récupération du sodium dans les urines avec hyponatrémie, hypovolémie et hypotension artérielle.
- Modifications des ongles avec blanchiment ou élévation de leur lit, leukonychia striata (stries de Muehrcke) ou disparition de la lunule (ongles de Terry), dues à la diminution du taux d’albumine dans le sang. L’hypoalbuminémie a pour autre conséquence une perte de la pression oncotique dans les vaisseaux avec extravasation importante de liquides menant à des œdèmes des membres inférieurs prenant typiquement le godet (le doigt y marque et y laisse une empreinte), des épanchements pleuraux (présence de liquide dans la cavité pleurale)…
- Tendance aux blessures et saignements liée au déficit de synthèse des facteurs de coagulation normalement produits par le foie.
Autres
- Contractures de Dupuytren résultant d’un épaississement et raccourcissement du fascia palmaire avec déformations en flexion des doigts. Conséquence probable de la prolifération des fibroblastes avec déposition anarchique de collagène, elle semble davantage associée à la consommation excessive d’alcool qu’à la cirrhose proprement dite[14].
Signes biologiques
On constate une diminution du taux de prothrombine (par diminution de certains facteurs de coagulation, notamment le facteur V), une hypoalbuminemie, éventuellement une augmentation modérée des transaminases ainsi que des signes de cholestase (augmentation des phosphatases alcalines et des γ-GT, parfois de la bilirubine conjuguée).
Imagerie

Elle est peu spécifique et sert essentiellement à détecter certaines causes rares ou des complications (cancer du foie).
L'échographie abdominale montre un parenchyme hépatique hétérogène et nodulaire, contours bosselés, avec une hypertrophie du segment I ou lobe caudé, des signes d'hypertension portale avec augmentation de la taille de la rate (splénomégalie)…
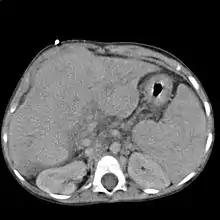
Le scanner et l'IRM sont meilleurs que l'échographie pour détecter un cancer du foie[2]. L'IRM est également fiable pour détecter certaines causes, notamment l'hémochromatose, par la mesure de la concentration en fer des tissus[15]. La fibroscopie œsogastrique peut retrouver des varices œsophagiennes, signe d'hypertension portale.
Méthodes de biopsie hépatique
La biopsie est la méthode de référence pour le diagnostic de cirrhose. Elle n'est toutefois pas indispensable si la maladie est évidente ainsi que sa cause.
Elle peut être faite par voie trans-jugulaire : le cathéter est introduit dans la veine jugulaire interne au niveau du cou, descendue sous contrôle d'une radioscopie dans la veine cave supérieure, puis l'oreillette droite du cœur, la veine cave inférieure jusque dans les veines sus-hépatiques.
La voie trans-pariétale (intercostale) est également utilisée. Elle peut être également faite au cours d'une intervention chirurgicale (biopsie laparoscopique).
Ces techniques présentent des difficultés et des avantages propres à chacune. La principale complication reste les saignements, survenant le plus souvent avant la vingt-quatrième heure et pouvant conduire exceptionnellement à un décès[16].
Les prélèvements subissent plusieurs colorations : éosine-safran, trichrome de Masson, de Perls et le PAS. Une mesure du poids en fer et la recherche d'antigènes viraux peuvent être faites.
Anatomopathologie
L'histologie de la cirrhose montre une fibrose en pont délimitant des nodules de régénération, fait de travées bicellulaires d'hépatocytes parfois dysplasiques.
Le foie peut être atrophié (diminué de volume) ou inversement hypertrophié (augmenté de volume) en fonction de la prédominance de lésions de destructions ou de régénérations.
D'autres lésions sont visibles, elles sont caractéristiques des mécanismes à l'origine de la cirrhose. Lors d'une cirrhose alcoolique, il existe une stéatose macrovésiculaire hépatique, des signes d'inflammation avec une infiltration de lymphocytes et de macrophages, la présence de corps de Mallory, une nécrose des cellules hépatiques, des mitochondries géantes, une hépatosidérose. La maladie de Wilson se caractérise par un dépôts de cuivre dans les hépatocytes, l'hémochromatose par des dépôts d'hémosidérine, la cirrhose biliaire primitive par une modification des travées des canaux biliaires.
Recherche de la cause
Un bilan à la recherche d'une cause est fait de manière systématique :
- recherche d'une notion d'intoxication éthylique chronique, signes cliniques d'intoxication éthylique chronique et signes biologiques (thrombopénie), macrocytose, élévation inconstante et aspécifique des γ-GT
- sérologies virales (hépatite B et C)
- recherche d'auto-anticorps (hépatite auto-immune, cirrhose biliaire primitive)
- dosage de l'alpha 1-antitrypsine (exceptionnelles cirrhoses par déficit en alpha 1-antitrypsine) et dosage de la céruléoplasmine (à la recherche d'une maladie de Wilson)
- Bilan martial à la recherche d'une hémochromatose : Fer, ferritine, coefficient de saturation de la transferrine.
- Bilian lipidique et glucique à la recherche d'un NASH syndrome (stéatose hépatique non alcoolique), d'un syndrome métabolique. : Cholestérol, triglycérides, glycémie.
Scores de gravité
On utilise les scores de Child et Child-Pugh pour permettre la classification en 3 groupes de gravité croissante selon le degré d'insuffisance hépato-cellulaire[17]. Le pronostic est fortement lié à la poursuite de l'intoxication.
Score de Child-Pugh
| un point | deux points | trois points | |
|---|---|---|---|
| TP (%) | >50 | 40-50 | <40 |
| Albumine (g/l) | >35 | 28-35 | <28 |
| Bilirubine (micromol/l) | <35 | 35-50 | >50 |
| Ascite | Absente | Facile à contrôler | Sévère |
| Encéphalopathie (classification de Trey) | Absente | Moyenne (I et II) | Sévère (III et IV) |
Points attribués :
- Classe A: 5 à 6
- Classe B: 7 à 9
- Classe C: 10 à 15.
Complications et répercussions
La cirrhose est une maladie grave qui diminue significativement la durée de vie[18].
Le stade de cirrhose est classiquement irréversible, même si des cas exceptionnels de régression ont pu être décrits[19].
Le risque de saignement est plus élevé (c'est le foie qui synthétise les facteurs de coagulation).
Il peut survenir une insuffisance hépatique, signant une évolution importante de la maladie : le taux de décès est alors proche de 85 % à 5 ans si le patient n'est pas transplanté[2].
Des hémorragies digestives, surtout par rupture de varices œsophagiennes, compliquent le cours de la maladie.
Le cancer du foie (hépatocarcinome) est une complication classique et grave et survient avec un taux de 2 à 7 % par an[2]. Il est particulièrement fréquent dans les cirrhoses post-hépatites virales.
Dans un cinquième des cas, on observe un syndrome hépato-pulmonaire avec une baisse d'oxygénation du sang (hypoxémie) en raison d'ouvertures de mini-shunt dans la circulation pulmonaire par hypersensibilité des récepteurs à l'endothéline[20].
Causes
Cirrhose alcoolique
La cirrhose associée à l’alcoolisme est typiquement qualifiée de « micronodulaire » car les nodules font moins de trois millimètres. Ces nodules peuvent fusionner lors de périodes d’abstinence et résulter en une cirrhose mixte, comprenant des macro- et des micronodules. L'alcoolisme est la première cause en fréquence en France, particulièrement pour les hommes (la situation est différente pour des pays comme les États-Unis où les cirrhoses alcooliques sont minoritaires pour les malades des deux sexes). La quantité et la durée de l'intoxication par l'alcool déterminent la survenue de la cirrhose. Il existe des variations de susceptibilité individuelle face à la consommation d'alcool, cette quantité moyenne étant seulement indicative.
Autres causes
Les autres causes sont les hépatites virales surtout B et C, dans leur forme chronique.
La cholestase extra hépatique prolongée peut entraîner une véritable cirrhose dite cirrhose biliaire secondaire.
L'insuffisance cardiaque prolongée entraînant un foie cardiaque peut également se compliquer, mais rarement, de cirrhose cardiaque.
Parmi les causes rares, on peut citer :
- l'obstruction des veines sus-hépatiques (syndrome de Budd-Chiari) ;
- certaines maladies génétiques (hémochromatose, maladie de Wilson, déficit héréditaire en alpha-1 antitrypsine…) ;
- certaines maladies auto-immunes ;
- la galactosémie ;
- les maladies de surcharge en glycogène ;
- la combinaison de certains médicaments avec l'alcool (par exemple le méthotrexate).
Épidémiologie
En 2015 en France, la consommation d'alcool représente 88 % des cas de cirrhose nécessitant une hospitalisation et tue 8 000 personnes par an[22].
Traitement
Le pronostic étant sombre lorsque les premiers signes surviennent, il est important de prendre en charge le cirrhotique le plus tôt possible.
Traitement de la cause
L'arrêt total de l'alcool est indispensable, mais le risque de mort reste présent.
Lors d'une cirrhose post-hépatite C, un traitement par interféron permet de freiner l'évolution[23].
En cas d'hépatite B, la lamivudine est également efficace[24].
Autres traitements
Le traitement est symptomatique : diurétiques, ponctions d'ascite, prévention de la rupture de varices œsophagiennes par des bêta-bloquants non cardiosélectifs[25], qui permet également de diminuer le risque de survenue d'une ascite[26], ou ligatures endoscopiques selon les cas (il n'y a pas de bénéfice prouvé d'associer les deux).
Une greffe de foie peut être envisagée dans des indications sélectionnées et en l'absence de contre-indication.
Le dépistage du cancer du foie (carcinome hépatocellulaire) par échographie et dosage de l'alpha-fœtoprotéine doit être systématique.
Il faut être prudent dans l'administration de médicaments, un grand nombre étant métabolisés par le foie, avec un risque de surdosage si ce dernier est malade.
Recherche
Des agents anti-fibrosants[réf. nécessaire], susceptibles de faire régresser la cirrhose, seraient à l'étude, comme le zinc[réf. nécessaire], la vitamine E associé à la pentoxifylline[réf. nécessaire].
Notes et références
- Définitions lexicographiques et étymologiques de « cirrhose » dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales
- (en) Schuppan D, Afdhal NH, « Liver cirrhosis » Lancet 2008;371:838-851.
- (en) Iredale JP, « Cirrhosis: new research provides a basis for rational and targeted treatments », BMJ, vol. 327, no 7407, , p. 143–7 (PMID 12869458, PMCID 1126509, DOI 10.1136/bmj.327.7407.143, lire en ligne)
- (en) Krizhanovsky V et al., « Senescence of Activated Stellate Cells Limits Liver Fibrosis », Cell, vol. 134, no 4, , p. 657-67 (DOI 10.1016/j.cell.2008.06.049, lire en ligne)
- (en) Rockey D., « The cellular pathogenesis of portal hypertension: Stellate cell contractility, endothelin, and nitric oxide », Hepatology, vol. 25, no 1, , p. 2-5 (PMID 8985256, DOI 10.1002/hep.510250102, lire en ligne)
- (en) Wanless I. R., « Pathogenesis of cirrhosis », Journal of Gastroenterology and Hepatology, vol. 19, no s7, , S369-S371 (DOI 10.1111/j.1440-1746.2004.03705.x, lire en ligne), voir aussi (en) Wanless I.R., « The role of vascular occlusion in the pathogenesis of cirrhosis » (consulté le )
- « LES FICHES PRATIQUES : Cirrhose et complications de la cirrhose », sur hepatoweb.com (consulté le )
- Collégiale des Universitaires en Hépato-Gastro-Entérologie (CDU-HGE), « Cours », sur campus.cerimes.fr (consulté le )
- Z. Moldoveanu, I. Moro, J. Radl et S. R. Thorpe, « Site of catabolism of autologous and heterologous IgA in non-human primates », Scandinavian Journal of Immunology, vol. 32, , p. 577–583 (ISSN 0300-9475, PMID 2270437, lire en ligne, consulté le )
- Décret du
- Dr Pascal Sève & Pr Christiane Broussolle, « Sémiologie hépatique », sur faculté de médecine Lyon-Sud, (consulté le )
- (en) Mezey E., « Insulin Growth Factor I and Hypogonadism in Cirrhosis », Hepatology, vol. 31, no 3, , p. 783–4 (PMID 10706573, lire en ligne)
- (en) Gonzalez-Casas R. et al., « Spectrum of anemia associated with chronic liver disease », World J Gastroenterol, vol. 15, no 37, , p. 4653–4658 (PMID 19787828, PMCID PMC2754513, DOI 10.3748/wjg.15.4653, lire en ligne)
- (en) Herazy TR, « Dupuytren’s Contracture and Cirrhosis: Chronic Liver Disease » (consulté le )
- (en) Bonkovsky HL, Rubin RB, Câble EE et al. « Hepatic iron concentration: Noninvasive estimation by means of MR imaging techniques » Radiology 1999;212:227-234
- (en) Bravo AA, Sheth SG, Chopra S, « Liver biopsy » N Engl J Med. 2001;344:495-500
- (en) C G Child et J G Turcotte, « Surgery and portal hypertension », Major problems in clinical surgery, vol. 1, , p. 1-85 (ISSN 0025-1062, PMID 4950264)
- D'Amico G, Garcia-Tsao G, Pagliaro L, Natural history and prognostic indicators of survival in cirrhosis: a systematic review of 118 studies, J Hepatol, 2006;44: 217-231
- (en) Desmet VJ, Roskams T, « Cirrhosis reversal: a duel between dogma and myth » J Hepatol, 2004;40:860-867
- (en) Blendis L, Wong F, « Portopulmonary hypertension: an increasingly important complication of cirrhosis » Gastroenterology 2003;125:622-4.
- http://www.has-sante.fr/portail/upload/docs/application/pdf/fs_cirrhose_web.pdf
- « Prévenir la cirrhose alcoolique, une priorité » (consulté le )
- (en) Everson GT, « Management of cirrhosis due to chronic hepatitis C » J Hepatol. 2005;42(suppl):S65-S74
- (en) Liaw YF, Sung JJ, Chow WC et al. « Cirrhosis Asian Lamivudine Multicentre Study Group. Lamivudine for patients with chronic hepatitis B and advanced liver disease » N Engl J Med, 2004;351:1521-1531
- Garcia-Tsao G, Abraldes JG, Berzigotti A, Bosch J, Portal hypertensive bleeding in cirrhosis: Risk stratification, diagnosis and management: 2016 practice guidance by the American Association for the Study of Liver Diseases, Hepatology, 2017;65:310-335
- Villanueva C, Albillos A, Genescà J et al. β blockers to prevent decompensation of cirrhosis in patients with clinically significant portal hypertension (PREDESCI): a randomised, double-blind, placebo-controlled multicentre trial, Lancet, 2019;393:1597-1608
Voir aussi
Liens externes
- Scott L. Friedman, Mechanisms of Hepatic Fibrogenesis, Gastroenterology. 2008 May; 134(6): 1655–1669, doi: 10.1053/j.gastro.2008.03.003
- MedInfos, cirrhose alcoolique, décembre 2006
- Illustrations : Atlas of Pathology
Bibliographie
- Traité de médecine, dirigé par Jean Hamburger, Flammarion, (ISBN 2-257-10286-X)
- Alain Cercle, L’alcoolisme, Paris : Flammarion, 1998, 127 p.
- Sully Ledermann, Alcool, alcoolisme, alcoolisation, Paris : PUF, 1956, 613 p.
- Jean-Charles Sournia, Histoire de l’alcoolisme, Paris : Flammarion, 1986, 324 p.
- Portail de la médecine
- Alimentation et gastronomie