Hépatite virale
Une hépatite virale est une infection provoquée par des virus se développant aux dépens du tissu hépatique. Les virus, une fois inoculés à l'organisme, infectent alors préférentiellement (hépatites virales alphabétiques) ou non (hépatites virales non alphabétiques) les cellules du foie aussi appelées hépatocytes. Les cellules infectées se voient alors obligées de participer au métabolisme viral, à savoir fabriquer sans fin des copies du virus en question. L'hépatocyte, gonflé par une production non régulée de virus, finit par exploser, caractérisant ainsi la cytolyse hépatique, avec les perturbations de bilan hépatique habituelles.
Pour les hépatites non virales, voir Hépatite.
Pour les maladies professionnelles, voir Hépatites virales (maladie professionnelle).
| Spécialité | Infectiologie et gastro-entérologie |
|---|
| CISP-2 | D72 |
|---|---|
| CIM-10 | B15-B19 |
| CIM-9 | 070 |
| eMedicine | 775507 |
| MeSH | D006525 |
| Patient UK | Viral-hepatitis-particularly-d-and-e |
![]() Mise en garde médicale
Mise en garde médicale
Hépatites virales alphabétiques
Bien que les hépatites A, B et C soient toutes regroupées sous le terme d’hépatite infectieuses parce qu'elles causent toutes trois des lésions du foie, les virus sont bien différents, ainsi que leurs modalités de transmission, la gravité de la maladie et son potentiel évolutif. Toutes ces affections constituent un risque professionnel pour les professions de santé.
Les virus des hépatites n’ont été isolés que tardivement à la fin du XXe siècle. On décrit les cinq hépatites virales suivantes : A, B, C, D, E. L’existence des virus F et G est encore largement hypothétique et la liste n’est peut-être pas close.
La journée mondiale des hépatites[1], historiquement fixée le 1er octobre ("hepatitis Awareness Day"), déplacée au 19 mai; a lieu depuis 2011 le 28 juillet (source OMS)[2].
Histoire
La jaunisse est un symptôme connu depuis l’antiquité et des épidémies d’ictère associées à un syndrome fébrile d’aspect grippal ont été rapportées par les grecs (Hippocrate) mais le diagnostic rétrospectif est incertain, il pourrait s’agir de paludisme, de leptospirose ou d’hépatite non infectieuse.
Les épidémies d’ictères ont de tous temps accompagné les armées en déplacement dans les campements avec des conditions d’hygiène précaires (jaunisse des camps). Son aspect épidémique fut décrit pour la première fois par Martin Lange en 1791 dans son historia icterorum epidemicorum. Au cours de la guerre de Sécession aux États-Unis de 1861 à 1865, 52 000 cas d’hépatites furent dénombrés, ce qui constitua une des principales causes de morbidité avec la fièvre typhoïde. C’est pendant la Première Guerre mondiale qu’apparut la notion, maintenant formellement établie que l’hépatite épidémique est liée au péril fécal. Les premières descriptions cliniques précises datent du début du XXe siècle.
L’anatomie pathologique des hépatites virales fut décrite en 1843 par Karel Rokitansky, un pathologiste tchèque enseignant à Vienne qui découvrit l’atrophie jaune aiguë du foie de l’hépatite fulminante. Mais les vrais progrès ont été faits au milieu du XXe siècle avec la ponction biopsie hépatique à l’aiguille de Menghini (1958) qui a permis d’établir la séquence des lésions conduisant de l’hépatite persistante à l’hépatite chronique agressive puis à la cirrhose et au cancer primitif du foie.
À la même époque est apparu le dosage des transaminases, reflet de la cytolyse.
Au lendemain de la Première Guerre mondiale, on commença à penser que les hépatites infectieuses pouvaient être d’origine virale, même si les essais de transmission à l’animal furent négatifs.
La première preuve fut apportée par la transmission expérimentale à des volontaires en Allemagne en 1942 puis en Angleterre en 1944. Mais on savait déjà qu’il existait probablement deux virus responsables du même tableau clinique depuis la première épidémie d’hépatite enregistrée comme provoquée par un virus transmis par voie sanguine observée par Lurman en 1885[3]. Un foyer de variole a été signalé à Brême en 1883 et 1 289 employés des chantiers navals ont été vaccinés avec la lymphe d'autres personnes (vaccination antivariolique pratiquée de bras à bras). Après plusieurs semaines, et jusqu'à huit mois plus tard, 191 des travailleurs vaccinés sont tombés malades et ont présenté un ictère et on a alors diagnostiqué une hépatite sérique. Les autres employés qui avaient été inoculés avec des lots de lymphe différents sont restés en bonne santé. La publication de Lurman, aujourd'hui considérée comme un exemple classique d'étude épidémiologique, a prouvé que la contamination lymphatique était à l'origine de l’épidémie. Plus tard, de nombreux cas similaires ont été signalés à la suite de l'introduction, en 1909, des aiguilles hypodermiques insuffisamment décontaminées et réutilisées de nombreuses fois pour l'administration de Salvarsan pour le traitement de la syphilis. Un cas fut signalé en 1937 à Oxford après une vaccination contre la fièvre jaune (le vaccin contenait du sérum humain pour atténuer les réactions au vaccin). La maladie prit de l’importance à partir de la Seconde Guerre mondiale avec le développement de la transfusion. Bien que l’existence d’un virus ait été soupçonnée en 1947 depuis les travaux de MacCallum[4] qui proposa d’appeler hépatite A, l’hépatite épidémique à incubation courte et hépatite B l’hépatite sérique à incubation longue (hépatite des 100 jours). Pour caractériser les deux virus, la première étape fut réalisée par Krugmann qui avaient remarqué dans une institution d’enfants handicapés mentaux (essentiellement des trisomiques) une fréquence élevée d’hépatites infectieuses et avait constaté que beaucoup d’enfants faisaient deux atteintes successives. Entre 1964 et 1967 ils transmirent expérimentalement (avec l’accord des parents) par inoculation ou ingestion de plasma les deux maladies à un enfant à partir du sérum de deux malades. Grâce à la découverte de l’antigène Australia (maintenant appelé antigène HBs) par Baruch Blumberg en 1963[5] on disposa enfin d’un marqueur pour distinguer l’hépatite A et B. En 1970 le virus de l’hépatite B a été vu au microscope électronique par Dane[6].
Il restait alors à isoler le virus de l’hépatite A pour mettre un point final à la traque des virus de l’hépatite, mais l’absence d’antigène HBs dans les cas d’hépatite A à incubation devait faciliter l’identification de ce nouveau virus désormais bien caractérisé par sa durée d'incubation et son mode de transmission. Dès 1967, Deinhardt à Chicago avait réussi à transmettre aux marmousets (ouistitis) une hépatite histologiquement analogue à l’hépatite A. En 1977, Feinstone au NIH, travaillant sous le contrôle de Kapikian (qui avait développé la technique d’immunomicroscopie électronique pour la recherche des rotavirus dans les selles) parvient à identifier le VHA grâce à des prélèvements bien ciblés.
Géographie
Au sein de l'Union européenne, les pays sont inégaux: l'Italie compte 32 morts par millions et la Finlande 0,4[7].
Virus de l'hépatite A
Le virus de l'hépatite A (VHA) est un virus à ARN appartenant à la famille des picornaviridae. C'est un virus nu (non enveloppé), donc très résistant dans le milieu extérieur et aux agressions physico-chimiques.
Il se transmet par voie digestive féco-orale soit directe (manuportée) soit indirectement par l'eau souillée, contaminée par des selles infectées par le virus d'où une plus forte incidence dans les pays où les réseaux d'eau potable et les stations d'épuration sont de qualité insuffisante.

- Haute : prévalence supérieure à 8 %
- Moyenne : entre 2 et 7 %
- Basse : inférieure à 2 %
La surveillance de l'évolution de l'incidence en France est effectuée par le réseau Sentinelles de l'Inserm, ainsi que par la déclaration obligatoire depuis 2005. Sa distribution varie en fonction des conditions socioéconomiques. La prévalence est inversement proportionnelle au contexte socioéconomique et proportionnelle à l'âge : plus le niveau de vie est élevé, moins il y a de personnes infectées. Plus les gens sont âgés, plus ils ont de risque d'avoir été contaminés (de façon apparente ou non) au cours de leur vie. On assiste à une forte baisse de la prévalence chez les sujets jeunes, en raison de l'amélioration des conditions d'hygiène générale et de la qualité sanitaire des eaux potables.
La durée d'incubation de la maladie est courte (hépatite épidémique), 4 à 6 semaines, ce qui la différencie de l'hépatite B.
L'hépatite A peut rester asymptomatique dans plus de la moitié des cas et la seule trace de l'infection est la présence d'anticorps anti-HAV détectables dans le sang. Dans l'autre moitié des cas elle se manifeste par une hépatite aiguë avec un état fébrile, et une cytolyse hépatique confirmée par l'élévation des transaminases et se traduisant classiquement par un ictère (mais les formes anictériques sont fréquentes). Les lésions hépatiques ne sont pas dues directement au virus mais aux lymphocytes T qui vont détruire les cellules infectées du foie.
Les symptômes peuvent durer deux mois mais l'évolution est constamment bénigne. Contrairement à l'hépatite B et à l'hépatite C, on n'observe pas d'évolution vers des formes chroniques ou la cirrhose. En cas de doute sur l'origine virale de la maladie, le diagnostic peut être confirmé par l'élévation des ImmunoGlobulines M (IgM) anti VHA dès le 25e jour.
L'hépatite A, une fois déclarée, n'a pas de traitement spécifique.
En cas d'épidémie, la sérothérapie par administration de gamma globulines polyvalentes peut permettre d'éviter la survenue de la maladie chez une personne contaminée. Elle n'est efficace que jusqu'à deux semaines après la date présumée de la contamination[8].
En dehors des mesures d'hygiène classiques (lavage des mains après être allé aux toilettes et avant de préparer un repas), la maladie peut également être prévenue par la vaccination : il existe plusieurs vaccins, contenant tous des souches inactivées du virus. Elle a été introduite en 1995 aux États-Unis où elle est recommandée pour tout enfant de moins de 2 ans, ce qui a abouti à une chute importante du nombre de cas recensés[8]. La vaccination est indiquée dans le cas de voyages en zone endémique. Elle constitue également une alternative aux immunoglobulines lorsque la date de contamination est proche[9].
Virus de l'hépatite B
Le virus de l'hépatite B (VHB) est un virus à ADN appartenant à la famille des hepadnaviridae. Ce virus est très contagieux, 100 fois plus que celui du sida et très résistant, ce qui explique la transmission par des seringues mal stérilisées.
Selon l'Organisation mondiale de la santé il y aurait 350 millions de porteurs du virus dans le monde. Sa répartition dans le monde s'explique par son mode de transmission et l'efficacité de la réduction des risques variable suivant le niveau socioéconomique du pays.
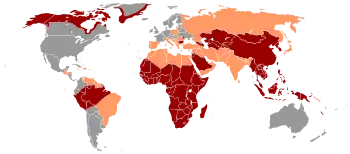
- Haute : prévalence supérieure à 8 %
- Moyenne : entre 2 et 7 %
- Basse : inférieure à 2 %
- transmission par transfusions de sang ou de produits sanguins : rare dans les pays développés depuis l'exclusion des donneurs AgHBs + et Ac anti-HBc +.
- transmission iatrogène par matériel non stérilisé (chirurgie, exploration invasive, acupuncture, mésothérapie, soins dentaires) : L'évolution des règles de stérilisation et la généralisation de l'utilisation de matériel à usage unique permettent de l'éviter. Mais il existe des pays où, faute de moyens, on réutilise le matériel à usage unique après une stérilisation sommaire.
- piqûre accidentelle
- transmission par toxicomanie intraveineuse, tatouage, piercing. Dans certains pays la prévalence élevée du virus s'explique en partie par des pratiques (scarifications) réalisées dans des conditions d'hygiène approximatives[Quoi ?].
- transmission par contact interindividuel hétérosexuel, homosexuel ou non sexuel : intérêt de l'utilisation de préservatifs. Les zones de forte prévalence coïncident souvent avec celles de forte endémie du sida.
- transmission verticale lors de la période néonatale : le dépistage de l'Ag HBs durant la grossesse permet la sérovaccination du nouveau-né (dans les premières 48 heures). Là encore la réduction de ce risque suppose l'existence de structures sanitaires bien organisées.
La période d'incubation est longue (hépatite sérique) 45 à 180 jours, mais la moyenne est de 60 à 90 jours, ce qui la différencie de l'hépatite A.
L'hépatite B guérit spontanément dans 90 % des cas. Dans 1 % des cas se produit une hépatite fulminante. 10 % des patients voient leur hépatite B évoluer en forme chronique[10] (90 % chez les nourrissons). Ces formes chroniques peuvent provoquer des lésions de cirrhose, conduisant au cancer hépatocellulaire (15 % à 25 % des porteurs chroniques meurent des complications par cirrhose ou cancer du foie).
Jusqu'à la fin du XXe siècle, le taux de guérison était de 30 % (à vérifier, META référence) avec des traitements très lourds (interféron). Cette maladie causait annuellement plus d’un million de décès prématurés.
Certains patients porteurs du virus ne présentent pas d'atteinte hépatique ; ils sont appelés porteurs sains.
Traitement curatif :
Son objectif est de prévenir l'évolution vers la cirrhose et le cancer, chez le patient ayant une hépatite B chronique avec réplication virale et lésions hépatiques histologiques. Son évaluation repose sur des critères biologiques (Ag HBe, ADN viral, Ac antiHBe, témoins de la réplication virale) et histologiques[11].
Le traitement antiviral de première intention repose sur le peginterféron alfa-2a pendant 24 à 48 semaines[11], qui a l'avantage d'une seule injection hebdomadaire au lieu de 3 pour l’interféron alfa. L'efficacité du peginterféron alfa-2a est comparable à celle de l’interféron alfa qui entraîne une disparition prolongée de l'AgHBe dans 20 à 40 % des cas[11].
D'autres antiviraux sont utilisés en seconde intention : adéfovir dipivoxil et lamivudine lorsque le traitement initial est insuffisamment efficace ou en raison de ses effets indésirables. En cas d'atteinte hépatique décompensée, la transplantation hépatique est le seul traitement efficace de manière durable.
Traitement préventif :
Vaccination : Après l'invention du premier vaccin à partir de l'antigène Hbs extrait du plasma des porteurs sains par Philippe Maupas à la suite des travaux de Baruch Blumberg, le vaccin a été fabriqué par génie génétique à partir de cellules animales pour la première fois dans l'histoire de la vaccination. Ce vaccin a été mis au point par l'équipe de Pierre Tiollais en 1985. Il a permis la disparition quasi totale de la maladie chez les soignants pour qui elle constituait un risque majeur. Dans les pays de forte endémie où elle a été largement pratiquée comme Taïwan elle a entraîné une diminution significative du nombre de cancers hépatocellulaires.
Chez le nouveau-né de mère Ag Hbs positive : Immunoglobulines spécifiques et vaccination à la naissance. Dans ce protocole, la réduction du risque de transmission à l'enfant est de 92 %[12].
Histoire de l’hépatite C
La découverte des virus de l'hépatite A et de l'hépatite B ne mit pas fin, comme on l'avait cru tout d'abord à la traque des virus de l'hépatite. Au milieu des années 1970, Harvey J. Alter, responsable de la section des maladies infectieuses au département de médecine transfusionnelle du National Institutes of Health, a démontré avec son équipe que la plupart des cas d'hépatite post-transfusionnelles n'étaient dus ni au virus de l'hépatite A ni à celui de l'hépatite B.
La durée d'incubation de cette maladie nouvellement découverte paraissait variable, mais intermédiaire entre celle de l'hépatite A et celle de l'hépatite B, d'où son nom initial d’hépatite non A non B (NANBH en anglais). La transmission au chimpanzé fut réussie par plusieurs équipes et des études faites à partir de lots de facteur VIII et de facteur IX permirent de préciser certaines des caractéristiques du virus. On découvrit notamment en microscopie électronique dans les hépatocytes des chimpanzés infectés des structures tubulaires de réticulum endoplasmique orientant vers un virus à ARN et il fut montré que le chloroforme pouvait inactiver la transmission de l'hépatite non A non B ce qui confirmait qu'il s'agissait d'un virus enveloppé dont plusieurs caractéristiques conduisaient à penser qu'il pouvait s'agir d'un togavirus. Malgré ces découvertes, les efforts de recherche coordonnés au niveau international pour identifier le virus responsable de cette maladie par les approches classiques de sérologie et de microscopie électronique sont restés sans résultat pendant une décennie.
En 1987, Michael Houghton, Qui-Lim Choo et George Kuo de la Chiron Corporation, en collaboration avec le Dr DW Bradley des centres pour le contrôle et la prévention des maladies (CDC), ont utilisé une nouvelle approche de clonage moléculaire pour identifier l'organisme inconnu[13]. En 1988, l'existence du virus a été confirmée par Alter qui a vérifié sa présence chez un groupe de patients atteints d’hépatite non A non B. En avril 1989, la découverte du virus, connu maintenant sous le nouveau nom de virus de l'hépatite C (VHC), a fait l'objet d'une publication dans deux articles de la revue science[14],[15].
Chiron a déposé plusieurs brevets sur le virus et ses méthodes de diagnostic sérologique[16]. Une demande de brevet concurrente déposée par le CDC a été abandonnée en 1990 après que Chiron eut payé 1,9 million de dollars au CDC et 337 500 dollars à Bradley. En 1994, Bradley a poursuivi Chiron, pour faire invalider le brevet, se considérant lui-même comme co-inventeur, et demandant à recevoir des dommages-intérêts et des royalties. Il a renoncé en 1998 après avoir perdu devant une cour d'appel[17].
En 2000, les Drs Alter et Houghton ont reçu le prix Lasker pour leurs travaux novateurs qui ont abouti à la découverte du virus de l'hépatite C et au développement de méthodes de dépistage permettant de réduire les risques d'hépatite post-transfusionnelle aux États-Unis de 30 % dès 1970 et à les réduire à un niveau proche de zéro en 2000[18].
En 2004, Chiron a obtenu 100 brevets dans 20 pays atteints par l'hépatite C et a poursuivi avec succès devant les tribunaux de nombreuses entreprises qui avaient utilisé illégalement son procédé. Les scientifiques et les concurrents se sont plaints que la société entravait la lutte contre l'hépatite C en exigeant des royalties trop élevées pour utiliser sa technologie[17].
Virus de l'hépatite C
Le virus de l'hépatite C (VHC) est un petit virus à ARN d’environ 60 nanomètres de diamètre, simple brin de polarité positive d'environ 9 600 bases. Avant sa découverte par biologie moléculaire en 1989, il était appelé hépatite « non-A-non-B ». Il s'agit d'un virus enveloppé (l'enveloppe provient de la cellule hôte) et sa capside est icosaédrique de symétrie cubique. Son génome est un ARN qui possède des gènes structuraux (C, protéine de core ; E, glycoprotéine d'enveloppe) et des gènes non structuraux (NS1 à NS5).
Le virus a été classé dans la famille des Flaviviridae qui se compose de trois genres :
- les Flavivirus, responsables d'arboviroses
- les Pestivirus, qui ont des pathologies uniquement chez l'animal
- le VHC (virus de l'hépatite C), qui est le seul membre connu du genre des Hepacivirus
Génotypes
Le VHC est une grande famille, ce virus à ARN a une variété de génome assez importante. Il existe six principaux génotypes, noté de 1 à 6, et de nombreux sous-types. Ces génotypes ne sont pas responsables d'évolutions significativement différentes de l'hépatite. Ils ont par contre une importance dans la réponse aux traitements. Les génotypes 2 et 3 répondent mieux que les 1 de manière démontrée, et certainement mieux que le 4. C'est pour cela que le traitement des génotypes 2 et 3 ne dure que 24 semaines alors qu'il est de 48 semaines pour le 1. Pour le 4, on a moins de recul du fait de son apparition récente en France comme en Europe.
Symptômes
Dans la plupart des cas, les personnes infectées de manière récente par le VHC n'ont aucun symptôme. L'incubation du virus prend en moyenne deux mois, la phase aigüe de la maladie dure quant à elle de deux à douze semaines. La guérison spontanée survient dans environ 25 % des cas. Cependant, dans la plupart des cas, la maladie devient chronique : le virus, hautement mutagène, parvient à échapper à la réponse immunitaire. Lorsque la phase aiguë de l'infection est symptomatique (ictère), le passage à la chronicité est moins fréquent. Les cellules saines du foie sont capables de se renouveler mais la destruction des cellules infectées laisse des cicatrices. L'accumulation de ces cicatrices au cours du temps, sur des années voire des dizaines d'années, aboutit à une « fibrose » du foie. Ces dommages au foie peuvent se développer au bout de dix à quarante ans d'infection. Il peut alors causer à long terme des dommages au foie, allant dans certains cas jusqu'à la cirrhose ou au cancer.
Les symptômes les plus courants sont la fatigue, la perte d'appétit, des nausées, de la fièvre, une faiblesse générale et des douleurs abdominales.
Transmission
Contrairement à l'hépatite B, le virus de l'hépatite C n'est pas considéré comme une maladie sexuellement transmissible. Le mode de contamination est la voie sanguine. La majorité des transmissions ont donc été constatées par usage de drogue intraveineuse (échange de seringue) ou par transfusion sanguine (avant le dépistage systématique en 1992 du VHC chez les donneurs de sang). L'utilisation de préservatifs entre partenaires stables n'est pas indispensable, mais elle est recommandée en cas de lésions, d'infections génitales ou de rapports durant les règles. Les rapports protégés sont également recommandés en cas de partenaires multiples. Le contact avec du sang infecté est possible dans d'autres circonstances : n'importe quelle piqûre ou contact d'une plaie, même minime, avec un instrument infecté peut transmettre le virus (tatouage, piercing, sniff, partage du petit matériel d'injection autre que la seringue…).
Les autres précautions à prendre pour éviter la contamination de son entourage consistent à protéger les plaies et coupures immédiatement après désinfection, éviter le partage d'objets en contact avec du sang (certains objets de toilette comme le coupe-ongles, le rasoir, la pince à épiler, brosse à dent…). Le risque de transmission dans ces conditions est alors très faible.
Épidémiologie
On estime que le VHC infecte environ 170 millions de personnes dans le monde. La co-infection avec le virus VIH est très fréquente.
Il existe maintenant des tests fiables pour détecter le virus dans le sang. En complément, une PCR peut être utilisée pour détailler le génotype du virus. On subdivise le virus en groupes et en localisation. Par exemple, le génotype 1a est le plus répandu en Amérique du Nord tandis que le 1b l'est en Europe.
Contrairement aux virus des hépatites A et B, il n'existe pas de vaccin contre le VHC.
Traitement
Les traitements contre le VHC sont basés sur l'interféron alpha (IFNα), associé à d'autres antiviraux. À l'heure actuelle, le traitement le plus prescrit est l'interféron pegylé accompagné de ribavirine. Aujourd’hui en phase de test on combine aussi un nouvel inhibiteur de la protéase de l'hépatite C, le SCH 503034. Le SCH 503034 a démontré un potentiel d'activité antivirale et a été bien toléré, aussi bien dans une monothérapie(1) qu'en association avec le PEGINTRON(R) et accompagné de ribavirine.
(SCH 503034 en étude phase 3 : NCT00423670 ou bocéprévir)[19].
Les résultats varient suivant le génotype du virus avec jusqu'à 75 % de chance de disparition du virus de l'organisme. Il existe 6 génotypes principaux, 1 2 3 4 5 6, les génotypes 2 et 3 sont donc ceux qui résistent le moins au traitement.
Le TMC435 étude phase 2b : NCT00980330 (TIDP16 C206) en [20]. Est une antiprotéase (associée au traitement interféron et ribavirine) dont la phase 2b est presque terminée. Pourcentage de réussite annoncé chez des non-répondeurs à un premier traitement classique interféron et ribavirine seuls d'après les premiers résultats disponibles pour les génotypes 1 : 92 % (conférence Boston ).
Des phases trois sont déjà annoncées pour le TMC435 TIDP-16 sur clinicaltrials.gov en [21], et les résultats complets de phase 2b attendus.
L'alcool est fortement déconseillé en cas de VHC en raison d'une accentuation des dommages au foie (fibrose) et une diminution de l'efficacité de l'interféron.
Les effets secondaires (interféron /monographie pro 2006[22] et ribavirine / monographie pro 2006[23]) de ces traitements sont importants mais varient énormément d'un individu à l'autre (du simple symptôme grippal, à la fatigue généralisée jusqu'à des atteintes au système immunitaire…). Les effets les plus fréquents sont la diminution du nombre de globules blancs, de plaquette, et des globules rouge, la dépression, l'atteinte thyroïdienne. La seule pouvant persister après l'arrêt du traitement est l'atteinte thyroïdienne nécessitant la prise d'hormones thyroïdiennes.
La ribavirine est tératogène chez l'animal. Chez l'homme comme chez la femme, la conception d'un enfant doit attendre la clairance de la ribavirine, ce qui est obtenu 6 mois après la fin du traitement.
Il n'existe pas de vaccin à ce jour et ce à cause de la grande variabilité antigénique du virus.
Histoire
Mario Rizzetto, en étudiant l’histologie des malades italiens infectés par le VHB mit en évidence en 1977 par immunomarquage dans le foie un nouvel antigène nucléaire distinct de l’antigène Hbc, caractérisant des hépatites d’évolution particulière. Grâce à des études de transmission chez le chimpanzé, il réussit avec Gérin et Purcell[Qui ?] à isoler un nouveau virus exigeant pour sa réplication la présence d’un virus « helper »[Quoi ?] le VHB.
Virologie et épidémiologie
L'agent de l'hépatite D est un virus défectif à ARN c’est-à-dire dépendant du virus B pour sa réplication et son expression. L'agent delta survient par co-infection avec le VHB ou alors par surinfection d'un porteur du VHB. Ce nouveau virus est proche des viroïdes des plantes, c’est le plus petit virus humain identifié à ce jour. Le virus Delta est endémique dans certaines populations et notamment dans les forêts équatoriales de Centre-Afrique et d’Amazonie au Brésil où il est responsable d’épidémies d’hépatites fulminantes. Il s’est également disséminé via la toxicomanie en Europe de l’Est et dans les pays occidentaux. L'agent delta, tout en diminuant la réplication du VHB, aggrave considérablement la maladie hépatique avec des formes fulminantes et de manière beaucoup plus fréquente une accélération de la fibrose hépatique et la survenue de cirrhoses et de carcinome hépatocellulaire. La détection de l'ARN delta permet de dépister les infections actives.
L'hépatite D est en quelque sorte une surinfection de l'hépatite B.
Cette maladie est négligée en raison de son faible impact dans les pays développés et il n’existe aucun vaccin.
Durée d'incubation
L'hépatite delta ne fait qu'incrémenter l'effet destructeur de l'hépatite B. Son temps d'incubation est donc le même que celui du virus dont elle dépend.
Mode de contamination
Le facteur Delta se transmet de la même manière que l'hépatite B, par piqûre, transfusion, tatouage, piercing et contact sexuel non protégé. Les porteurs de l'hépatite B ainsi que les personnes souffrant d'une hépatite fulminante sont particulièrement sensibles au facteur delta.
Virus de l'hépatite E

L'hépatite E est provoquée par un virus. Appelé virus de l'hépatite E (VHE), c'est un virus à ARN (comme l'hépatite C et A). Il a été identifié en 1990. Il est surtout présent dans les pays en voie de développement, mais de plus en plus de cas autochtones sont décrits en France.
Quatre génotypes sont connus (1 à 4). Un réservoir animal est suspecté, très probablement le porc.
Comme pour l'hépatite A, la contamination se fait par voie fécale-orale.
Les manifestations cliniques de l'hépatite E sont banales, peu différentes de celles des autres hépatites aiguës. Les formes sévères semblent cependant plus fréquentes que pour les hépatites A. En cas de grossesse ou d'immunodépression, les formes sévères avec décès par hépatite fulminante sont fréquentes.
Le diagnostic se fait par recherche d'IgM anti-HEV sérique, ou par amplification génique (PCR) sur le sang ou les selles. Il est à évoquer en cas d'hépatite aiguë inexpliquée.
Autres virus
Hépatites virales non alphabétiques
D'autres virus peuvent occasionnellement engendrer des hépatites virales comme les herpesviridae (CMV, EBV, HSV, VZV) ou encore le Virus de la fièvre jaune ou l’Erythrovirus B19.
Notes et références
- site de la World Hepatitis Alliance - W.H.A. The World Hepatitis Alliance is a non-governmental organisation that represents approximately 280 hepatitis B and C patient groups. The long-term objective of the World Hepatitis Day campaign is to prevent new infections and to deliver real improvements in health outcomes for people living with hepatitis B and C.
- Journée mondiale contre l'hépatite depuis 2011.["http://www.who.int/mediacentre/events/annual/world_hepatitis_day/fr/index.html"]
- Lurman A. (1885) Eine icterus epidemic. (en allemand). Berl Klin Woschenschr 22:20–3.
- MacCallum, F.O., Homologous serum hepatitis. Lancet 2, 691, (1947)
- (en)B.S. Blumberg et al., « A Serum Antigen (Australia Antigen) in Down’s Syndrome Leukemia and Hepatitis », Annals of Internal Medicine, vol. 66, , p. 924-31
- (en)Dane DS, Cameron CH, Briggs M, « Virus-like particles in serum of patients with Australia-antigen-associated hepatitis », Lancet, vol. 1, no 7649, , p. 695–8 (PMID 4190997)
- (en) « About 5 500 deaths from hepatitis in the EU », sur europa.eu (consulté le ).
- (en) Baker CJ, Another success for Hepatitis A vaccine, New Eng J Med, 2007;357:1757-1759
- (en) Victor JC, Monto AS, Surdina TY, et als. Hepatitis A vaccine versus immune globulin for postexposure prophylaxis, N Engl J Med, 2007;357:1685-1694
- la forme chronique est définie par la persistance dans le sang de l'Ag HBs depuis plus de 6 mois ; L'Ag HBe mesure la réplication virale
- Revue Prescrire, "Hépatite B chronique : élargissement des possibilités thérapeutiques", no 283, mai 2007
- revue Prescrire no 280, février 2007, p. 128
- (en) 2000 Albert Lasker Award for Clinical Medical Research, The Lasker Foundation. Consulté le 20 février 2008
- (en)Choo Q, Kuo G, Weiner A, Overby L, Bradley D, Houghton M, « Isolation of a cDNA clone derived from a blood-borne non-A, non-B viral hepatitis genome. », Science, vol. 244, no 4902, , p. 359-62 (DOI 10.1126/science.2523562)
- (en)Kuo G, Choo Q, Alter H, Gitnick G, Redeker A, Purcell R, Miyamura T, Dienstag J, Alter M, Stevens C, « An assay for circulating antibodies to a major etiologic virus of human non-A, non-B hepatitis. », Science, vol. 244, no 4902, , p. 362-4 (DOI 10.1126/science.2496467)
- (en) Houghton, M., Q.-L. Choo, and G. Kuo. NANBV Diagnostics and Vaccines. European Patent No. EP-0-3 18-216-A1. European Patent Office (filed 18 novembre 1988, publié le 31 mai 1989).
- (en) Paul Elias. Hepatitis Drug-Maker Complaints Reviewed, The Associated Press, 27 février 2004
- (en) 2000 Winners Albert Lasker Award for Clinical Medical Research, The Lasker Foundation. Consulté le 20 février 2008.
- ,étude : NCT00423670 / Schering-Plough source : clinical trials
- ["http://www.clinicaltrials.gov/ct2/show/NCT00980330?term=tmc+435+tidp16+c206&rank=1"], étude : NCT00980330 / Tibotec Pharmaceuticals, Ireland. source : clinical trials
- ["http://clinicaltrials.gov/ct2/results?term=TMC435+phase+3 "](TMC435 TIDP16 phase 3 sur clinicaltrials.gov)
- monographie interféron Roche "Pegasys" pro (pdf en téléchargement)["http://tatactic.be/downloads/download.php?fid=pegasysPro"]
- monographie ribavirine Roche "Copegus" pro (pdf's en téléchargement)["http://tatactic.be/downloads/download.php?fid=copegusPro"]
Voir aussi
Bibliographie
- Christian Trépo, Philippe Merle, Fabien Zoulim : Hépatites virales B et C , (Pour professionnels, patients et entourage), Éd.: John Libbey Eurotext, 2006, Coll. : Pathologie science formation, (ISBN 2742006044)
Article connexe
- Article général sur les hépatites
Liens externes
- INVS : mise à jour de la liste des maladies à déclaration obligatoire
- INVS : fiche Hépatite A
- Fédération SOS hépatites, Fédération d'Associations Régionales de malades atteints d'hépatites virales
- Site de l'association Réseau Vaccin Hépatite B
- Portail de la médecine
- Portail des maladies infectieuses