Phosphofructokinase-2
La phosphofructokinase-2 (PFK-2) ou fructose-bisphosphatase-2 (FBPase-2) est une enzyme bifonctionnelle, dotée à la fois d'une activité kinase et d'une activité phosphatase, qui catalyse les réactions :
kinase : ATP + β-D-fructose-6-phosphate → ADP + β-D-fructose-2,6-bisphosphate ; phosphatase : β-D-fructose-2,6-bisphosphate + H2O → D-fructose 6-phosphate + Pi.
| Phosphofructokinase-2 / Fructose-bisphosphatase-2 | ||
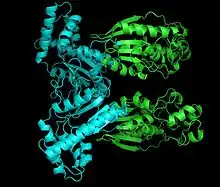
 Dimère de PFKFB1 de foie humain montrant les domaines kinase en bleu et phosphatase en vert (PDB 1K6M) | ||
| Caractéristiques générales | ||
|---|---|---|
| Nom approuvé | 6-Phosphofructo-2-kinase / fructose-2,6-biphosphatase 2 | |
| Symbole | PFKFB | |
| N° EC | 2.7.1.105+3.1.3.46 | |
| Gène PFKFB1 | ||
| Homo sapiens | ||
| Locus | Xp11.21 | |
| Masse moléculaire | 54 681 Da[1] | |
| Nombre de résidus | 471 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Gène PFKFB2 | ||
| Homo sapiens | ||
| Locus | 1q32.1 | |
| Masse moléculaire | 58 477 Da[1] | |
| Nombre de résidus | 505 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Gène PFKFB3 | ||
| Homo sapiens | ||
| Locus | 10p15.1 | |
| Masse moléculaire | 59 609 Da[1] | |
| Nombre de résidus | 520 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Gène PFKFB4 | ||
| Homo sapiens | ||
| Locus | 3p21.31 | |
| Masse moléculaire | 54 040 Da[1] | |
| Nombre de résidus | 469 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
Chez l'homme, il en existe plusieurs isoformes, dont une codée par le gène PFKFB3, situé sur le chromosome 10 a été. Elle participe à la régulation de la phosphofructokinase-1, laquelle intervient à la 3e étape de la glycolyse pour convertir le fructose-6-phosphate en fructose-1,6-bisphosphate, et joue par conséquent un rôle déterminant dans la vitesse de la glycolyse et de la gluconéogenèse.
Il s'agit d'un dimère de deux sous-unités identiques de 55 kDa chacune. Ces sous-unités possèdent chacune un domaine kinase et un domaine phosphatase. La phosphorylation du résidu de sérine-32 favorise l'activité phosphatase, tandis que l'absence de phosphorylation de ce résidu favorise l'activité kinase[2]. Le demaine PFK2 est étroitement apparenté à la superfamille des protéines de liaison aux mononucléotides tels que l'adénylate cyclase, tandis que le domaine FBPase2 est apparenté à la même famille de protéines que les phosphoglycérate mutases.
| N° EC | EC |
|---|---|
| N° CAS |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
| N° EC | EC |
|---|---|
| N° CAS |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Fonction
La PFK-2/FBPase-2 possède une double activité enzymatique antagoniste, à savoir une activité kinase catalysant la phosphorylation du D-fructose-6-phosphate (Fru-6-P) en D-fructose-2,6-bisphosphate (Fru-2,6-BP) par l'ATP, et une activité phosphatase catalysant l'hydrolyse du Fru-2,6-BP en Fru-6-P et Pi :

Le D-fructose-2,6-bisphosphate est un activateur allostérique de la phosphofructokinase-1 (PFK-1), ce qui a pour effet de stimuler la glycolyse et de faire chuter le taux de glucose dans le cytoplasme.
Structure et régulation
La PFK-2/FBPase-2 est un homodimère de deux sous-unités de 55 kDa chacune arrangées en tête-à-tête pour former d'un côté un domaine phosphatase et de l'autre un domaine kinase, ce dernier du côté N-terminal des deux chaînes polypeptidiques. La sérine-32 de ces chaînes peut être phosphorylée, ce qui modifie la conformation de la protéine favorisant l'activité phosphatase FBPase-2 ; lorsque la Ser-32 n'est pas phosphorylée, c'est au contraire l'activité kinase PFK-2 qui est favorisée.
- La phosphorylation de la sérine-32 est catalysée par la protéine kinase A, activée par l'AMPc, elle-même produite comme second messager par l'adénylcyclase sous l'effet du glucagon, qui a donc indirectement pour effet d'arrêter la glycolyse en favorisant la formation de D-fructose-6-phosphate à partir du D-fructose-2,6-bisphosphate, dont la concentration diminue, ce qui bloque la phosphofructokinase-1.
- L'enzyme est au contraire déphosphorylée sous l'effet de la protéine-phosphatase-1 (PP1), elle-même activée par le D-fructose-6-phosphate, dont le taux augmente en même temps que celui du glucose : l'activité kinase PFK-2 convertit le D-fructose-6-phosphate en D-fructose-2,6-bisphosphate, ce qui réactive la phosphofructokinase-1, et donc la glycolyse.
Notes et références
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- (en) I. J. Kurland, M. R. el-Maghrabi, J. J. Correia et S. J. Pilkis, « Rat liver 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase. Properties of phospho- and dephospho- forms and of two mutants in which Ser32 has been changed by site-directed mutagenesis », Journal of Biological Chemistry, vol. 267, no 7, , p. 4416-4423 (PMID 1339450, lire en ligne)
- (en) Mi H. Yuen, Hiroyuki Mizuguchi, Yong-Hwan Lee, Paul F. Cook, Kosaku Uyeda et Charles A. Hasemann, « Crystal structure of the H256A mutant of rat testis fructose-6-phosphate,2-kinase/fructose-2,6-bisphosphatase. Fructose 6-phosphate in the active site leads to mechanisms for both mutant and wild type bisphosphatase activities. », Journal of Biological Chemistry, vol. 274, no 4, , p. 2176-2184 (PMID 9890980, DOI 10.1074/jbc.274.4.2176, lire en ligne)
- Portail de la biologie
- Portail de la médecine