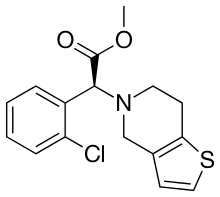
Clopidogrel
Le clopidogrel est un médicament antiagrégant plaquettaire par antagonisme aux récepteurs plaquettaires de l'adénosine diphosphate, appartenant à la classe des thiénopyridines. Il est commercialisé par Bristol-Myers Squibb et Sanofi sous la marque Plavix, par Sun Pharmaceuticals sous le nom de marque Clopilet, par Ranbaxy Laboratories sous le nom de Ceruvin. Il consiste en un énantiomère S dextrogyre. Il a été génériqué en France en 2010.

| Clopidogrel | ||
 | ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | (+)-(S)-2-(2-chlorophényl)-2-(6,7-dihydrothiéno[3,2-c]pyridin-5(4H)-yl)ethanoate de méthyle | |
| No CAS | ||
| No ECHA | 100.127.841 | |
| Code ATC | B01 | |
| DrugBank | APRD00444 | |
| PubChem | 60606 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule brute | C16H16ClNO2S [Isomères] |
|
| Masse molaire[1] | 321,822 ± 0,022 g/mol C 59,71 %, H 5,01 %, Cl 11,02 %, N 4,35 %, O 9,94 %, S 9,96 %, |
|
| Données pharmacocinétiques | ||
| Biodisponibilité | >50 % | |
| Métabolisme | hépatique | |
| Demi-vie d’élim. | 7–8 h (métabolite inactif) | |
| Excrétion | ||
| Considérations thérapeutiques | ||
| Voie d’administration | Oral | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Métabolisme
Il s'agit d'une prodrogue, la molécule nécessitant d'être métabolisée par le cytochrome p450 pour être efficace. Plusieurs familles de ce cytochrome interviennent dans le métabolisme de cette molécule, les plus importants, au niveau fonctionnel étant le CYP3A4 et le CYP2C19[2].
Le retour à une activité plaquettaire correcte requiert un arrêt de cinq jours du médicament[3].
Mode d'action
Le métabolite de clopidogrel se fixe de manière irréversible par deux ponts disulfures[4] sur les récepteurs à l'adénosine diphosphate de type P2Y12 sur les plaquettes sanguines, permettant d'inhiber l'agrégation de ces dernières.
Indications
Le clopidogrel est donnée, en règle, en association avec de l'aspirine, son utilisation comme seul antiagrégant n'ayant que peu été évaluée.
Ses indications sont :
- la prévention d'accident thrombo-embolique artériel tel l'infarctus du myocarde et l'artériopathie oblitérante des membres inférieurs.
- le traitement de l'infarctus du myocarde[5].
- la prévention de sténose ou de thrombose de stent. La durée de la double antiagrégation plaquettaire est discutée et dépend du type de stent. Pour les stents actifs, la durée habituelle est de un an, même s'il semble pouvoir être raccourci à six mois dans les cas des stents actifs de deuxième génération, sans risque augmenté de thrombose[6]. À la fin de cette double antiagrégation, un traitement par aspirine seul est institué.
Lors d'un accident vasculaire cérébral, l'ajout du clopidogrel à l'aspirine ne permet pas de réduire le risque de récidive et augmente le risque hémorragique[7]. Cette association comporte néanmoins un intérêt en cas d'accident ischémique transitoire ou d'accident neurologique de petite taille[8].
Interactions médicamenteuses
Certains inhibiteurs de la pompe à protons (IPP) diminuent significativement l'inhibition plaquettaire provoquée par le clopidogrel. C'est le cas notamment avec l'oméprazole[9], mais pas du pantoprazole ni de l'ésoméprazole[10]. En pratique, le risque d'une telle association reste discutée, certaines études ne semblant pas révéler de problèmes[11], d'autres mettant en évidence un effet délétère, quel que soit l'inhibiteur utilisé[12]. Cet effet négatif pourrait être davantage lié au terrain qu'à la prise d'inhibiteurs de la pompe à protons puisqu'il est également retrouvé en cas d'emploi de ticagrelor, l'activité de ce dernier n'étant pas influencé par la prise d'IPP[13].
Les inhibiteurs calciques sont métabolisés par le même cytochrome que le clopidogrel. Ainsi la prescription d'un inhibiteur calcique diminue l'action sur les plaquettes du clopidogrel[14], mais, semble-t-il, sans conséquence pratique[15].
Certaines statines (dont l'atorvastatine et la simvastatine mais pas la pravastatine ni la rosuvastatine) se fixent fortement sur le cytochrome de type CYP3A4 que requiert le clopidogrel pour son activation. Ainsi l'atorvastatine diminuerait l'efficacité biologique de ce dernier[16], sans que l'on puisse démontrer que cela influe sur l'efficacité clinique[17].
D'autres médicaments interagissent avec les différents cytochromes nécessaire à la formation du métabolite actif du clopidogrel et peuvent donc potentiellement en changer l'efficacité. Le kétoconazole pourrait ainsi en diminuer l'action et la rifampicine l'augmenter. De même, le tabagisme active le cytochrome CYP1A2 et pourrait, par ce biais, augmenter le risque hémorragique du clopidogrel[18]. Le millepertuis perforé agirait dans le même sens, cette fois ci par l'augmentation de l'activité du cytochrome CYP3A4[19].
De même, la morphine pourrait diminuer son absorption et retarder ou diminuer son action par un mécanisme inconnu[20].
Variations de l'activité selon le patient
Génétique
Outre les problèmes d'interactions médicamenteuses, certains patients sont moins répondeurs au clopidogrel que le reste de la population. Ce sont ceux, en particulier, qui sont porteurs d'un polymorphisme sur le gène codant le récepteur plaquettaire P2Y12, ou ceux qui ont un allèle moins actif de la forme CYP2C19 du cytochrome p450. Dans ce dernier cas, le risque d'accidents cardiaques est sensiblement majorés, avec une augmentation du taux de thrombose de stent[21].
Le gène CYP2C19 possède plusieurs allèles : le CYP2C19*1 est la forme active, le CYP2C19*2 est une forme inactive, d'autres codant des protéines d'activité intermédiaire. Le métabolisme du clopidogrel dépend, en partie, de la présence de un ou deux allèles déficients. Un allèle de type CYP2C19*2 est présent chez un chinois sur 2, un tiers des afro-américains et un quart de la population blanche[22]. L'importance clinique de ce gène semble cependant discuté, l'efficacité du médicament semblant parfois être indépendante du type d'allèle[23], parfois non[24].
D'autres gènes et protéines interviennent, de façon moins importante, dans le métabolisme de la molécule : ABCB1 codant une protéine intervenant dans le transport du médicament[25]. Le variant 3435 TT de ce gène entraînerait une moindre efficacité du clopidogrel et un risque augmenté d'accidents cardiaques[26]. Ce variant ne changerait par contre pas l'action du prasugrel et du ticagrelor[27]. Les CYP3A4 et CYP3A5 de la classe des cytochromes[28] interviennent également, de même que le récepteur P2Y12, même si ce dernier ne semble pas, dans ce cas, avoir de conséquence clinique notable[29].
Des tests génétiques, ciblés sur la recherche des allèles du CYP2C19 peuvent être faits, existent mais ont un coût non négligeable. Une alternative est de tester directement l’agrégation des plaquettes chez un individu considéré. Ils ne sont pas fait de manière systématique. En cas de résistance avérée à la molécule, une augmentation des doses peut être faite, ou un changement pour une autre molécule (Prasugrel ou Ticagrelor par exemple). Cette augmentation de dose se révèle efficace pour les hétérozygotes au CYP2C19 mais inutile chez les homozygotes, où seul un changement de médicament peut être envisagé[30].
Ce paramètre génétique n'explique en fait qu'une petite partie (environ 5 %) de la variabilité de l'efficacité du clopidogrel[31].
Autres
Le bénéfice du clopidogrel dans les suites d'un syndrome coronarien aigu semble limité chez le patient non fumeur[32],[33]. L'influence positive du tabac est également suspectée pour d'autres antiagrégants comme le prasugrel et le ticagrelor dont la supériorité par rapport au clopidogrel ne devient plus que marginale chez le non fumeur[33]. La raison n'en est pas claire. Il semble que l'effet anti-aggrégant plaquettaire de la molécule soit supérieur chez le fumeur[34] possiblement par activation du cytochrome p450 de type CYP1A2[35], nécessaire au métabolisme du clopidogrel.
La présence d'un diabète sucré semble également diminuer l'efficacité de la molécule, probablement par perturbation de sa pharmacocinétique[36].
Commercialisation
Le clopidogrel est commercialisé en tant que spécialité princeps par le laboratoire Sanofi en Europe, et par le laboratoire Bristol-Myers-Squibb en Amérique, notamment aux États-Unis. En termes de chiffre d'affaires, il s'agit du 2d médicament le plus vendu au monde (après le Tahor de Pfizer) avec 6,583 milliards d'euros[37]. Il est disponible sous forme de médicament générique depuis fin 2009.
Controverse
L'intérêt du Clopidogrel, particulièrement sous la marque Plavix, a été remis en cause par Philippe Even et par le directeur de publication de la revue Prescrire dans un documentaire sur l'industrie pharmaceutique[5]. Ceux-ci estiment qu'il ne serait pas plus efficace que l'aspirine pour la plupart de ses indications, tout en étant vendu 27 fois plus cher et pris en charge par la sécurité sociale. Celle-ci aurait remboursé pour ce médicament 401 millions d'euros sur l'année 2007[5]. On note toutefois que la même revue Prescrire reconnaît en 2007 que l'association du clopidogrel à l'aspirine est plus efficace que l'aspirine seule mais que ce gain d'efficacité est jugée marginal[38]. Ces deux documents ne critiquent les données que dans les suites d'un infarctus du myocarde et non pas après une angioplastie coronaire, indication où le clopidogrel n'est guère discutée, la somme remboursée citée ne distinguant naturellement pas les indications indiscutables et celles qui ne sont pas.
Liens externes
- Compendium suisse des médicaments : spécialités contenant Clopidogrel
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Bates ER, Lau WC, Angiolillo DJ., « Clopidogrel–Drug Interactions », J Am Coll Cardiol., no 57, , p. 1251-126 (résumé)
- (en) Price MJ, Walder JS, Baker BA. et al., « Recovery of Platelet Function After Discontinuation of Prasugrel or Clopidogrel Maintenance Dosing in Aspirin-Treated Patients With Stable Coronary Disease: The Recovery Trial », J Am Coll Cardiol., no 59, , p. 2338-2343 (résumé)
- (en) Ding Z, Kim S, Dorsam RT, Jin J, Kunapuli SP., « Inactivation of human P2Y12 receptor by thiol reagents requires interaction with both extracellular cysteine residues, Cys 17 and Cys 270 », Blood, no 101, , p. 3908–3914 (résumé)
- Les médicamenteurs diffusé sur France 5 : le Plavix a « la même efficacité que l'aspirine »
- Colombo A, Chieffo A, Frasheri A et al. Second-generation drug-eluting stent implantation followed by 6- versus 12-month dual antiplatelet therapy: The SECURITY randomized clinical Trial, J Am Coll Cardiol, 2014;64:2086-2097
- (en) The SPS3 Investigators, « Effects of clopidogrel added to aspirin in patients with recent lacunar stroke », N Engl J Med., no 367, , p. 817-825 (lire en ligne)
- (en) Wang Y, Wang Y, Zhao X et al., « Clopidogrel with aspirin in acute minor stroke or transient ischemic attack », N Engl J Med., no 369, , p. 11-19 (résumé)
- (en) Gilard M, Arnaud B, Cornily JC. et al., « Influence of omeprazole on the antiplatelet action of clopidogrel associated with aspirin: the randomized, double-blind OCLA (Omeprazole CLopidogrel Aspirin) study », J Am Coll Cardiol., no 51, , p. 256-260 (PMID 18206732)
- (en) Siller-Matula J, Spiel A, Lang I, Kreiner G, Christ G, Jilma B., « Effects of pantoprazole and esomeprazole on platelet inhibition by clopidogrel », Am Heart J., no 157, , p. 148.e1-148.e5 (résumé)
- (en) O'Donoghue ML, Braunwald E, Antman EM. et al., « Pharmacodynamic effect and clinical efficacy of clopidogrel and prasugrel with or without a proton-pump inhibitor: an analysis of two randomised trials », Lancet, no 374, , p. 989-997 (résumé)
- (en) Stock K, Le L, Zakharyan A et al., « Risk of rehospitalization for patients using clopidogrel with a proton pump inhibitor », Arch Intern Med., no 170, , p. 704-710 (résumé)
- (en) Goodman SG, Clare R, Pieper KS. et al., « Association of proton pump inhibitor use on cardiovascular outcomes with clopidogrel and ticagrelor: Insights from the platelet inhibition and patient outcomes trial », Circulation, no 125, , p. 978-986 (résumé)
- (en) Gremmel T, Steiner S, Seidinger D. et al., « Calcium-channel blockers decrease clopidogrel-mediated platelet inhibition », Heart, no 96, , p. 186–189 (lire en ligne)
- (en) Olesen J, Gislason GH, Charlot MG. et al., « Calcium-Channel Blockers Do Not Alter the Clinical Efficacy of Clopidogrel After Myocardial Infarction: A Nationwide Cohort Study », J Am Coll Cardiol., no 57, , p. 409-417 (résumé)
- (en) Clarke TA, Waskell LA., « The metabolism of clopidogrel is catalyzed by human cytochrome P450 3A and is inhibited by atorvastatin », Drug Metab Dispos., no 31, , p. 53–59 (lire en ligne)
- (en) Geisler T, Zürn C, Paterok M. et al., « Statins do not adversely affect post-interventional residual platelet aggregation and outcomes in patients undergoing coronary stenting treated by dual antiplatelet therapy », Eur Heart J., no 29, , p. 1635–1643 (lire en ligne)
- (en) Berger JS, Bhatt DL, Steinhubl SR. et al., « Smoking, clopidogrel, and mortality in patients with established cardiovascular disease », Circulation, no 120, , p. 2337–2344 (résumé)
- (en) Lau WC, Welch TD, Shields T et al., « The Effect of St. John's wort on the pharmacodynamic response of clopidogrel in hyporesponsive volunteers and patients: increased platelet inhibition by enhancement of CYP 3A4 metabolic activity », J Cardiovasc Pharmacol., no 57, , p. 86–93 (résumé)
- Hobl EL, Stimpfl T, Ebner J et al. Morphine decreases clopidogrel concentrations and effects : A randomized, double-blind, placebo-controlled trial, JACC, 2014;63:630–635
- (en) Mega J, Close S, Wiviott S. et al., « Cytochrome p-450 polymorphisms and response to clopidogrel », N Engl J Med., no 360, , p. 354–62. (résumé)
- (en) Holmes DR Jr, Dehmer GJ, Kaul S. et al., « ACCF/AHA Clopidogrel Clinical Alert: Approaches to the FDA "Boxed Warning": A Report of the American College of Cardiology Foundation Task Force on Clinical Expert Consensus Documents and the American Heart Association Endorsed by the Society for Cardiovascular Angiography and Interventions and the Society of Thoracic Surgeons », J Am Coll Cardiol., no 56, , p. 321-341 (lire en ligne)
- (en) Paré G, Mehta SR, Yusuf S., « Effects of CYP2C19 genotype on outcomes of clopidogrel treatment », N Eng J Med., no 363, , p. 1704-1714 (résumé)
- (en) Mega JL, Simon T, Collet JP et al., « Reduced-function CYP2C19 genotype and risk of adverse clinical outcomes among patients treated with clopidogrel predominantly for PCI, a meta-analysis », JAMA, no 304, , p. 1821-1830 (résumé)
- (en) Simon T, Verstuyft C, Mary-Krause M. et al., « Genetic determinants of response to clopidogrel and cardiovascular events », N Engl J Med., no 360, , p. 363-375 (résumé)
- (en) Mega JL, Close SL, Wiviott SD. et al., « Genetic variants in ABCB1 and CYP2C19 and cardiovascular outcomes after treatment with clopidogrel and prasugrel in the TRITON—TIMI 38 trial: a pharmacogenetic analysis », Lancet, no 376, , p. 1312-1319 (résumé)
- (en) Wallentin L, James S, Storey RF et al. for the PLATO investigators, « Effect of CYP2C19 and ABCB1 single nucleotide polymorphisms on outcomes of treatment with ticagrelor versus clopidogrel for acute coronary syndromes: a genetic substudy of the PLATO trial », Lancet, no 376, , p. 1320-1328 (résumé)
- (en) Suh JW, Koo BK, Zhang SY. et al., « Increased risk of atherothrombotic events associated with cytochrome P450 3A5 polymorphism in patients taking clopidogrel », CMAJ, no 174, , p. 1715-1722 (résumé)
- (en) Angiolillo DJ, Fernandez-Ortiz A, Bernardo E. et al., « Lack of association between the P2Y12 receptor gene polymorphism and platelet response to clopidogrel in patients with coronary artery disease », Thromb Res., no 116, , p. 491-497
- (en) Mega JL, Hochholzer W, Frelinger III AL et al., « Dosing clopidogrel based on CYP2C19 genotype and the effect on platelet reactivity in patients with stable cardiovascular disease », JAMA, no 306, , p. 2221-2228 (résumé)
- Price MJ, Murray SS, Angiolillo DJ et al. Influence of genetic polymorphisms on the effect of high- and standard-dose clopidogrel after percutaneous coronary intervention: the GIFT (Genotype Information and Functional Testing) study, J Am Coll Cardiol, 2012;59:1928–1937
- (en) Gurbel PA, Nolin TD, Tantry US., « Clopidogrel efficacy and cigarette smoking status », JAMA, no 307, , p. 2495-2496 (lire en ligne)
- Gagne JJ, Bykov K, Choudhry NK et al. Effect of smoking on comparative efficacy of antiplatelet agents: systematic review, meta-analysis, and indirect comparison, BMJ 2013;347:f5307
- (en) Bliden KP, Dichiara J, Lawal L. et al., « The association of cigarette smoking with enhanced platelet inhibition by clopidogrel », J Am Coll Cardiol., no 52, , p. 531-533 (lire en ligne)
- Kroon LA, Drug interactions with smoking, Am J Health Syst Pharm, 2007;64:1917-21
- Angiolillo DJ, Jakubowski JA, Ferreiro JL et al. Impaired responsiveness to the platelet P2Y12 receptor antagonist clopidogrel in patients with type 2 diabetes and coronary artery disease, J Am Coll Cardiol, 2014;64:1005–1014
- http://www.sanofi-aventis.com/investisseurs/chiffres_cles/chiffres_cles.asp
- « Clopidogrel - Plavix. Associé à l'aspirine : un bénéfice marginal » Rev Prescrire 2007;27:169
- Portail de la pharmacie
- Portail de la médecine
- Portail de la chimie