Polyphénol
Composé phénolique
Les polyphénols constituent une famille de molécules organiques largement présente dans le règne végétal. Ils sont caractérisés, comme l’indique le nom, par la présence d'au moins deux groupes phénoliques[1] associés en structures plus ou moins complexes, généralement de haut poids moléculaire. Ces composés sont les produits du métabolisme secondaire des plantes.
Les polyphénols prennent une importance croissante, notamment grâce à leurs effets bénéfiques sur la santé[2]. En effet, leur rôle d’antioxydants naturels suscite de plus en plus d'intérêt pour la prévention et le traitement du cancer[3], des maladies inflammatoires[4], cardiovasculaires[5] et neurodégénératives[6]. Ils sont également utilisés comme additifs pour les industries agroalimentaire, pharmaceutique et cosmétique[7].
Définition
Le terme « polyphénol » a été introduit en 1980[8], en remplacement de l'ancien terme de « tanin végétal ». L'expression « composés phénoliques » est aussi employée avec la même valeur.
« Ils ont tous en commun la présence d'un ou plusieurs cycles benzéniques portant une ou plusieurs fonctions hydroxyles[9]. » La désignation « polyphénols » est consacrée par l'usage et, alors qu'elle ne devrait concerner que les molécules portant plusieurs fonctions hydroxyle phénolique, elle est habituellement utilisée pour l'ensemble de ces composés.
Le terme « biophénol » fut inventé par Romeo et Uccella en 1996[10] pour désigner les phénols bioactifs dans les olives en remplacement du terme « polyphénol » plus commun mais plus vague d'un point de vue chimique. Utilisé au départ uniquement dans la chimie des olives, le terme a gagné en popularité et est actuellement utilisé par les chercheurs faisant référence aux phénols végétaux en général.
Il s'ajoute à cette définition le fait qu’ils possèdent un pouvoir antioxydant élevé.
Classification
Les polyphénols naturels regroupent donc un vaste ensemble de substances chimiques comprenant au moins un noyau aromatique, portant un ou plusieurs groupes hydroxyle, en plus d’autres constituants[11]. Il y a quatre principales familles de composés phénoliques : les acides phénoliques[12] (catéchol, acide gallique, acide protocatéchique), les flavones, l'acide chlorogénique et les quinones[13]. Ils peuvent aller de molécules simples, comme les acides phénoliques, à des composés hautement polymérisés, de plus de trente mille daltons, comme les tanins (acide tannique).
Les polyphénols sont communément subdivisés en phénols simples, acides phénoliques et coumarines, en naphtoquinones, en stilbénoïdes (deux cycles en C6 liés par deux atomes de carbone), en flavonoïdes, isoflavonoïdes et anthocyanes, et en formes polymérisées : lignanes, lignines, tanins condensés. Ces squelettes carbonés de base sont issus du métabolisme secondaire des plantes, élaborés par la voie du shikimate[14].
En se basant sur la structure carbonée de base, on peut dégager les principales classes de composés phénoliques suivantes :
| Composés phénoliques | ||||
| Squelette carboné |
Classe | Exemple | Structure | Origine |
|---|---|---|---|---|
| C6 | Phénols simples | hydroquinone | Busserole | |
| C6-C1 | Acides hydroxybenzoïques | acide parahydroxybenzoïque |  | Épices, fraises |
| C6-C3 | Acides hydroxycinnamiques | acide paracoumarique |  | Tomates, aïl |
| Coumarines | ombelliférone | 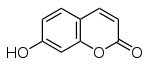 | Carottes, coriandre | |
| C6-C4 | Naphtoquinones | juglon |  | Noix de Grenoble |
| C6-C2-C6 | Stilbénoïdes | trans-resvératrol |  | Raisin |
| C6-C3-C6 | Flavonoïdes lato sensu | kaempférol |  | Fraises |
| Isoflavonoïdes | daidzéine |  | Graines de soja | |
| Anthocyanes | dalphiniol |  |
Dalbergia sissoo, petits fruits rouges | |
| (C6-C3)2 | Lignanes | entérodiol |  | Bactéries intestinales, lin |
| (C6-C3)n | Lignines |  | Bois, fruits à noyau | |
| (C6-C3-C6)n | Tanins condensés | procyanidine | Raisins, kaki | |
Ce tableau s'inspire de Macheix et al. dans Sarni-Manchado et Cheynier (2006)[9], ainsi que de Bruneton (1999)[15].
Pour tenir compte de leurs propriétés particulières, Jean Bruneton regroupe dans la classe des flavonoïdes stricto sensu les flavones, flavonols, dihydroflavonol, flavanones, aurones, chalcones et dihydrochalcones (et leurs hétérosides). Les flavanoïdes au sens large comportent en outre : les flavanols, flavanediols, anthocyanidines (et leurs hétérosides les anthocyanes).
Parmi les flavonoïdes, les flavanones sont responsables de l'amertume du pamplemousse. Les tanins sont responsables de l'astringence de divers fruits (peau et pépins du raisin) et les anthocyanes, de la couleur des fruits rouges.
Les polyphénols sont présents dans diverses substances naturelles : sous forme d'anthocyanine dans les fruits rouges, le vin rouge (en relation avec les tanins, phénomène du « paradoxe français »), sous forme de proanthocyanidines dans le chocolat[16] et le vin, d'acides caféoylquinique et féruloylquinique dans le café, de flavonoïdes dans les agrumes, et sous forme de catéchines comme le gallate d'épigallocatéchine dans le thé vert, de quercétine dans les pommes, les oignons, le vin rouge, etc.
D'après une étude réalisée avec des volontaires via Internet, les sources alimentaires de polyphénols sont principalement le café (36,9 %), le thé — vert ou noir — (33,6 %), le chocolat pour son cacao (10,4 %), le vin rouge (7,2 %) et les fruits (6,7 %)[17]. Parmi les fruits, les polyphénols, très présents dans toutes les pommes, sont encore plus concentrés dans les pommes à cidre (riches en tanin), qui peuvent en contenir jusqu'à quatre fois plus : c'est une biodiversité qui se manifeste en richesse aussi bien qualitativement que quantitativement en polyphénols[18].
Propriétés thérapeutiques
Les polyphénols semblent jouer un rôle important à la fois dans la protection contre le cancer et les maladies cardiovasculaires[19]. L'action protectrice contre le cancer s'expliquerait par un mécanisme assez semblable à celui des prébiotiques par leur capacité à sélectionner un type particulier de microbiote[20], en particulier pour les cancers du système digestif (estomac, côlon, etc.).
Notes et références
- (en) MeSH database, « Polyphenols », sur ncbi.nlm.nih.gov (consulté le ).
- (en) Stanley et al., « Antioxidants and the Free Radical Theory of Degenerative Disease », Alternative Medicine and Rehabilitation, (lire en ligne).
- (en) D. Chen et al., « Green tea and tea polyphenols in cancer prevention », Front Biosci, vol. 9, no 2618, (lire en ligne).
- (en) M. Laughton et al., « Inhibition of mammalian 5-lipoxygenase and cyclo-oxygenase by flavonoids and phenolic dietary additives. Relationship to antioxidant activity and to iron ion-reducing ability », Biochem. Pharmacol., vol. 42, , p. 1673-1681 (PMID 1656994).
- (en) Frankel et al., « Inhibition of oxidation of human low-density lipoprotein by phenolic substances in red wine », Lancet, vol. 341, nos 454-457, .
- (en) J.M. Orgogozo et al., « Wine consumption and dementia in the elderly: A prospective community study in the Bordeaux area », Rev. Neurol. (Paris), vol. 153, , p. 185-192 (lire en ligne).
- (en) « 3rd international Conference on Polyphenols Applications », 2006, The International Society for Antioxidants in Nutrition and Health (ISANH).
- (en) « Polyphenols [Substance Name]; use the precise structure header, most commonly in the Flavonoids group; this term only refers vaguely to phenolic (aromatic) hydroxyls. Date introduced: August 18, 1980 », dans MeSH database.
- P. Sarni-Manchado, V. Cheynier, Les polyphénols en agroalimentaire, Lavoisier, Editions Tec & Doc, , 398 p. (ISBN 2-7430-0805-9)
- Biophenolic components of olives
- (en) C.W. Bamforth, « Beer haze », Journal of the American Society of Brewing Chemists, vol. 57, , p. 81–90 (résumé).
- Dérivés de l'acide benzoïque ou cinnamique.
- (en) Amy King et Gloria Young, « Characteristics and occurrence of phenolic phytochemicals », J. Am. Diet. Assoc., vol. 99, no 2, , p. 213-218 (DOI 10.1016/S0002-8223(99)00051-6)
- (en) P. M. Dewick, « The Biosynthesis of Shikimate Metabolites », Natural Product Reports, vol. 12, , p. 579-607 (lire en ligne).
- Bruneton, J., Pharmacognosie - Phytochimie, plantes médicinales, 4e éd., revue et augmentée, Paris, Tec & Doc - Éditions médicales internationales, , 1288 p. (ISBN 978-2-7430-1188-8)
- Service Presse INRA, « Chocolat, santé et polyphénols », sur inra.fr/presse,
- L'Express, « Le thé, le café et leurs phénoménaux polyphénols », sur lexpress.fr, (consulté le )
- Guyot S., Symoneaux R., Le Quéré J.-M. et Bauduin R., Les polyphénols de la pomme aux cidres : diversité variétale et procédés, facteurs clé de la modulation des saveurs et des couleurs [PDF], Innovations Agronomiques, 42, 2014, p. 105-123.
- Véronique Habauzit et Christine Morand, Evidence for a protective effect of polyphenols-containing foods on cardiovascular health: an update for clinicians, NCBI, mars 2012
- Tugba Ozdal, David A. Sela, Jianbo Xiao, Dilek Boyacioglu, Fang Chen et Esra Capanoglu, The Reciprocal Interactions between Polyphenols and Gut Microbiota and Effects on Bioaccessibility, NCBI, février 2016
Bibliographie
Voir aussi
Articles connexes
Liens externes
- Généralités sur les polyphénols
- (en) Phenol-Explorer : la première base de données en ligne sur les polyphénols alimentaires
- Portail de la biologie
- Portail de la chimie
- Portail de la pharmacie
- Portail de la médecine