Poisson-clown
Amphiprioninae

Les poissons-clowns, ou Amphiprioninae, sont une sous-famille de poissons appartenant à la famille des pomacentridés. Elle contient trente espèces, une seule classée dans le genre Premnas, les autres faisant partie du genre Amphiprion. Ce sont des poissons d'une dizaine de centimètres dans les tons d'orange et de noir. Certaines espèces présentent des bandes ou des barres blanches. Ils fréquentent les lagons et les récifs coralliens du bassin Indo-Pacifique et de la mer Rouge où ils se nourrissent généralement de copépodes et de larves de tuniciers.
Les poissons-clowns sont remarquables à plusieurs titres. Ils sont principalement connus pour la relation mutualiste qu'ils forment avec dix espèces d'anémones de mer — normalement mortelles pour les poissons. Ils se distinguent également des autres espèces de poissons-demoiselles par leur hermaphrodisme successif protandre quand les autres espèces sont généralement protogynes. Cette particularité définit une structure sociale particulière au sein d'une anémone. L'individu dominant est la femelle, plus imposante que le reste du groupe. Elle forme un couple stable avec un mâle sexuellement actif, un peu plus petit. Les autres individus du groupe sont des mâles immatures qui n'interviennent pas dans la reproduction.
Sans être véritablement menacés, les poissons-clowns subissent une pression importante liée à la destruction de leur habitat par les activités humaines et les conséquences du réchauffement climatique. Même si beaucoup proviennent d'élevages, certains individus sont prélevés dans la nature pour le marché de l'aquariophilie marine. En 2003, le poisson-clown du Pacifique est choisi par le studio d'animation Pixar pour incarner Nemo, le petit poisson héros du film d'animation Le Monde de Nemo, ce qui les rendra très populaires.
Description


Les poissons-clowns sont de taille modeste ; adultes leur taille varie de 6 cm (Amphiprion pacificus) à 16 cm (Premnas biaculeatus).
Les caractéristiques qui les distinguent des autres sous-familles sont leurs 50 à 78 rangs d’écailles[1], des opercules généralement dentelés[1], une nageoire dorsale composée de dix épines — neuf ou onze dans de rares cas — et généralement 14 à 20 rayons souples[1].
Les motifs colorés sont le meilleur moyen d'identifier les différentes espèces dans leur environnement. D'autres caractères utiles comme la forme des dents, la disposition des écailles de la tête et les proportions ne sont accessibles qu'en laboratoire sur des spécimens naturalisés[2].
Leur couleur, globalement dans les tons d'orange, varie du jaune-orangé à l'orange sombre voire au rose. Certaines espèces ont de zéro à trois bandes verticales blanches ou une bande dorsale. La couleur blanche des bandes est due à des cellules particulières qui réfléchissent la lumière, des iridophores[3].On observe des variations géographiques de la couleur pour les espèces à large aire de répartition. D'autres facteurs interviennent également sur la coloration des poissons-clowns comme le mélanisme[4] et la taille des individus. Le mélanisme est induit par l'anémone de mer hôte. Il intervient en quelques heures après la mise en contact des partenaires. La plus-value adaptative de ce changement est inconnue[5].
Il n'y a pas de différence de couleur entre les stades mâles et femelles chez les poissons-clowns sauf quelque exceptions. Pour A. clarkii, elles existent mais ne sont pas systématiques. Les mâles de A. perideraion et A. akallopisos présentent souvent des bords orange sur les rayons souples et la caudale[6]. Les juvéniles ont par contre une livrée différente de celle des adultes. Ils se ressemblent beaucoup entre les différentes espèces ce qui rend très difficile leur identification. Il faut généralement observer les autres poissons du groupe dans l'anémone pour pouvoir connaître l'espèce exacte d'un juvénile[2].
Écologie et comportement
Alimentation

Le plancton représente la source principale de l'alimentation des poissons-clowns. L'étude du contenu stomacal de spécimens capturés révèle généralement des copépodes et des larves de tuniciers. A. perideraion consomme également une quantité importante d'algues broutées sur les récifs proches ou gobées en pleine eau[7].
Parfois, en aquarium, un spécimen à qui l'on présente un aliment de grande taille qu'il ne peut pas consommer entièrement le rapporte pour le mettre en sécurité sur son territoire — c'est-à-dire l'anémone. Les anémones sont carnivores et c'est finalement l'hôte qui mange les aliments qu'elle était censée protéger. Le poisson ne nourrit pas intentionnellement l'anémone même si cela peut sembler être le cas pour un observateur. À l'état sauvage ce comportement est absent. Les aliments sont consommés directement à l'endroit où ils sont trouvés car les poissons-clowns ne rencontrent pas d'aliments de taille importante[7].
Reproduction
La durée maximum de vie reste mal connue à l'état sauvage. Il existe des observations attestant des longévités de 6 à 10 ans[7]. Néanmoins, la protection des anémones de mer offre un avantage décisif sur la durée de vie que l'on estime pour les femelles A. percula une espérance de vie de 30 ans[8]. En 1992, le record de longévité en captivité pour des poissons-clowns était de 18 ans pour des individus A. frenatus et A. perideraion élevés au Muséum-aquarium de Nancy en France. Le spécimen A. perideraion était toujours vivant à cette date[7]. Il n'y a pas de lien entre la taille des individus et leur âge : les petits subadultes ne sont pas nécessairement jeunes, la structure sociale des poissons-clowns ayant un impact sur la taille des individus[7]. Par contre, la femelle est toujours la plus âgée du groupe[8].
Les espèces d'Amphiprioninae sont assez similaires en termes de reproduction et de développement : œufs, larves, juvéniles[9].
Accouplement et ponte

Amphiprion et Premnas sont les seuls parmi les demoiselles à former des couples qui peuvent durer des années[9]. Ce lien est à corréler avec la petite taille de leur territoire centré autour de l'anémone hôte et leur structure sociale qui favorisent ce comportement[9].
La période de reproduction dépend de la localisation. Dans les zones tropicales, elle a lieu toute l'année avec des moments de pic ; Dans les zones subtropicales ou tempérées chaudes, la reproduction se limite au printemps et à l'été quand la température de l'eau est la plus haute[9]. Pour certaines populations, il semble également exister des liens entre la nidification et le cycle lunaire, la ponte intervenant à la pleine lune. Le clair de lune permettrait de maintenir alerte le mâle qui assure la majorité de la surveillance du nid. De plus, comme les larves sont attirées par la lumière, le disque lunaire les regrouperait vers la surface, facilitant ainsi leur dispersion grâce aux vagues et aux courants marins[9].

La période des amours est généralement générique et ritualisée. Plusieurs jours avant la ponte, on observe une augmentation de l'activité sociale caractérisée par des courses poursuites, l'érection des nageoires et la préparation du nid[9]. Le mâle adopte un comportement de signal jumping, nage rapide de haut en bas pour attirer la femelle, que l'on retrouve chez d'autres Pomacentridés[9]. Il devient également plus agressif envers sa partenaire et s'exhibe immobile en face d'elle ou sur le côté, toutes nageoires déployées[9].
Le mâle choisit un site pour le nid sur une roche nue proche de l'anémone[9]. Parfois, il mordille les tentacules de l'anémone pour qu'elles se rétractent et il libère ainsi un lieu de ponte sous le disque de l'anémone[10]. Les anémones des fonds sableux n'offrent pas de surface propice à la ponte. A. polymnus résout ce problème en ramenant une surface adéquate de son territoire tels que des tests d'échinodermes, des coquilles de mollusques bivalves, des bouts de feuille de palmier, voire des canettes. Ce support de ponte peut ainsi être déplacé de plusieurs mètres jusqu'à l'anémone[11].
Le site choisi est alors débarrassé de tous les éléments indésirables comme les algues et les débris par le mâle qui les picore[10]. Il est finalement rejoint par sa partenaire[9] indiquant ainsi qu'elle est prête à pondre[10]. Le couple se secoue une fois le nettoyage terminé[10].

La ponte intervient le matin et dure de 30 minutes à plus de 2 heures. L'ovipositeur conique de la femelle est alors proéminent et lui permet de coller les œufs à la roche. Elle nage lentement en zigzag en se frottant l’abdomen sur la roche, suivie de près par le mâle qui fertilise les œufs au fur et à mesure[9]. Le nid peut compter de 600 à 1 600 œufs. Le nombre des œufs dépend de la taille des individus et de l'expérience du couple. En général les couples plus expérimentées pondent plus d'œufs[9]. Le jour, le mâle surveille et ventile les œufs avec ses nageoires pectorales jusqu'à leur éclosion[10]. Il chasse les espèces mangeuses d'œufs comme les labres et maintient le nid sain en retirant à la bouche les débris et les œufs morts. La femelle s'occupe principalement de se nourrir mais peut occasionnellement l'assister[9].
Les œufs sont elliptiques et mesurent environ 3 à 4 mm de long. Ils adhèrent à la roche par une touffe de petits filaments[9]. Ils incubent en une semaine[10]. Juste avant l'éclosion, l'embryon avec ses grandes pupilles miroitantes est visible à travers la membrane transparente. On distingue aussi le sac vitellin rouge-orangé qui donne la couleur générale de la ponte[9].
Stade larvaire et installation
L'éclosion a généralement lieu peu après la tombée de la nuit, six ou sept jours après la ponte[12]. La température de l'eau intervient dans la durée d'incubation. Une eau plus froide ralentit le développement des œufs sans les altérer[13]. Après éclosion, les larves se dispersent dans le plancton, vivant à la surface des océans passivement portés par les courants[12]. Les larves sont transparentes et mesurent environ 3 à 4 mm. La période larvaire dure de 8 à 12 jours et est l'une des plus courtes parmi les Pomacentridés, ce qui explique certainement la faible aire de répartition de certaines espèces[12].

Le stade larvaire se termine lorsque la larve rejoint le fond. Cela amorce la métamorphose en juvénile qui acquiert ses nouvelles couleurs. Cette transformation intervient en environ un jour[12]. Il est alors vital pour le petit de trouver une anémone de mer pour s'associer faute de quoi il sera probablement dévoré par un prédateur. Certaines espèces localisent les cnidaires en suivant un marqueur chimique alors que d'autres les repèrent à vue ou par hasard[12]. En laboratoire, A. perideraion est attiré vers une source de mucus brut extrait de Heteractis crispa. Ce comportement peut être reproduit avec de l'amphikuemine, un ammonium quaternaire obtenu à partir de mucus purifié de H. crispa[14]. Néanmoins, A. clarkii, également symbiote de H. crispa, n'est pas attiré par la molécule[15]. A. ocellaris est attiré par Stichodactyla haddoni grâce à la tyramine, et la tryptamine induit la recherche de l'anémone[14].
Le jeune poisson doit ensuite « s'acclimater » à son hôte pour être immunisé contre ses tentacules urticants et établir l'association. Comme il doit faire face à la compétition inter et intra-spécifique[16] et que le nombre d'anémones est très inférieur à celui des larves, le taux de mortalité à ce stade est très important[12].
Mutualisme


Les noms vernaculaires en anglais, anemonefish[17],[N 1], et en allemand Anemonenfisch[17] rappellent qu'ils vivent en interaction avec des anémones de mer[18]. Les anémones ou Actiniaria[19] forment un ordre de cnidaires pourvu de nombreux tentacules urticants. À de rares exceptions, les poissons-clowns à l'état sauvage sont toujours en association avec une anémone[20]. C'est un mutualisme obligatoire pour les poissons-clowns[21],[5]. Cette association est parfois aussi qualifiée de symbiose qui, dans certaines langues, a le même sens que mutualisme[5].
Cette association biologique est décrite pour la première fois en 1868 par Cuthbert Collingwood au large des côtes de Bornéo[22],[23]. Depuis, deux problématiques ont fait l'objet de nombreuses études : le mécanisme qui empêche les poissons-clowns de se faire piquer par les nématocystes des anémones d'une part, et les avantages et inconvénients de cette association pour chacun des partenaires de l'autre.
Plusieurs hypothèses ont été avancées pour expliquer l’invulnérabilité des poissons-clowns face aux anémones. Plusieurs — comme l'absence de nématocystes sur les tentacules des hôtes ; le fait que le poisson ne touche pas les tentacules ; l'impénétrabilité de la peau des poissons-clowns pour les nématocystes ; l'absence de décharge de nématocyste en présence d'un poisson hôte — ont été invalidées[24]. La source de cette protection n'est pas systémique, elle provient d'un mucus en surface du poisson[25]. La méthode « d'acclimatation » à son hôte et le mécanisme exact de protection des poissons-clowns ne sont pas connus, mais l'accumulation d'observations sur le sujet indique qu'il existe probablement autant de variantes de symbiose entre les anémones et les poissons-clowns qu'il y a de combinaisons d'espèces[20]. Il n'est pas clairement établi si le mucus est produit par le poisson lui-même, par l'anémone ou par les deux. En 2000, une équipe de recherche israélienne met en évidence dans le mucus extracorporel de l'anémone un composé qui neutralise la contraction des cnidocytes[26]. Un clown récemment introduit dans une anémone, ira se frotter dans ses tentacules, peut-être pour se recouvrir de ce mucus. C'est en « ressentant » ce mucus que l'anémone ne se pique pas elle-même lorsque ses tentacules se touchent. Les poissons pourraient utiliser cette propriété à leur avantage. D'autre part, il y a aussi des preuves que le propre mucus des poissons-clowns les protège des anémones[27].

Il est assez évident que le poisson-clown profite du caractère urticant de l'anémone, normalement mortel pour les poissons, pour se protéger de ses prédateurs[20] et augmenter sensiblement son espérance de vie par rapport aux autres Pomacentridés[8]. Il profite également des restes de nourriture et des déchets de l'anémone sans toutefois la parasiter[20]. Les bénéfices pour l'anémone sont moins clairs. Parmi les hypothèses, l'amélioration de la circulation de l'eau ou le déparasitage semblent peu probables, ou du moins, pas significatifs[28]. La défense contre certaines espèces de poisson papillon qui s'attaquent à ses tentacules a été démontrée[29]. En aquarium, le nourrissage de l'anémone par le poisson-clown est observé fréquemment, même si cela semble très rare dans la nature[30].
Le troisième partenaire de cette association complexe sont les zooxanthelles. Ce sont des algues brunes unicellulaires et microscopiques du groupe des Dinoflagellés. Elles sont présentes dans l'endoderme des tentacules de l'anémone et du disque oral[31]. La présence des poissons-clowns profite aux algues par le rejet de nutriments — ammoniac et phosphates — qui favorisent leur croissance[32],[33]. La protection qu'il apporte contre les prédateurs permet indirectement une meilleure photosynthèse pour l'algue. L'anémone Entacmaea quadricolor par exemple, est capable de sentir la présence et le nombre de poissons-clowns dans ses tentacules et d'adapter leur contraction. Cela lui permet d'exposer plus de zooxanthelles endosymbiotiques à la lumière ou au contraire se contracter pour se protéger des prédateurs en l'absence de poisson hôte[32].
Les poissons-clowns s'associent avec 10 espèces d'anémones de mer[34]. Ces espèces n'ont pas de lien taxinomique, elles se répartissent dans trois familles et cinq genres[N 2],[35]. Les espèces qui appartiennent à la famille des Stichodactylidés dans les genres Heteractis et Stichodactyla sont des partenaires fréquents des poissons-clowns[35].

Les 10 espèces d'anémones de mer s'associant avec des poissons-clowns sont[36] :
- Cryptodendrum adhaesivum Klunzinger, 1877 — Anémone adhésive
- Entacmaea quadricolor Rüppell & Leuckart, 1828 — Anémone à bouts renflés
- Heteractis aurora (Quoy & Gaimard, 1833) — Anémone collier de perles
- Heteractis crispa (Hemprich & Ehrenberg in Ehrenberg, 1834) — Anémone-cuir
- Heteractis magnifica (Quoy et Gaimard, 1833) — Anémone magnifique
- Heteractis malu (Haddon & Shackleton, 1893) — Anémone délicate
- Macrodactyla doreensis (Quoy & Gaimard, 1833) — Anémone tire-bouchon
- Stichodactyla gigantea (Forskål, 1775) — Anémone carpette
- Stichodactyla haddoni (Saville-Kent, 1893) — Anémone de Haddon
- Stichodactyla mertensii Brandt, 1835 — Anémone de Mertens
Les anémones des espèces Heteractis aurora et H. malu n'abritent que rarement des couples d'adultes ; on les qualifie d’« anémones nurserie ». Ces hôtes sont peut être inadaptés à la formation de grands groupes pour des raisons biochimiques ou n'offrent pas une protection suffisante pour les grands individus. Néanmoins, ces anémones permettent le développement d'immatures qui, une fois suffisamment grands, changent d'anémone pour une espèce plus favorable. Ils s'insèrent alors dans la hiérarchie sociale du groupe rejoint[37],[5].
Sources : Fautin et Allen 1992, ch. 2, « Anemonefishes », sauf pour Amphiprion barberi Allen, Drew et Kaufman 2008 et Amphiprion pacificus Allen, Drew et Fenner 2010 ; présentation tirée de Fautin 1991, p. 25-27.
Le tableau des associations possibles entre poissons-clowns et actiniaires montre que la relation n'est pas monolithique. De toutes les espèces de clowns, seul Amphiprion clarkii est présent à l'état naturel dans les dix anémones ; environ un quart ne vivent qu'avec une espèce d'actiniaires[38]. Inversement, presque un tiers des anémones accueillent au moins douze espèces de poissons-clowns et deux n'accueillent que A. clarkii[38]. Bien sûr, seuls les couples d'espèces qui partagent les mêmes zones de répartition et les mêmes habitats — sable ou récif, profondeur — peuvent potentiellement s'accorder mais toutes ne le font pas. En effet, le ratio de présence de poissons-clowns par espèces d'anémones hôtes n'est toujours corrélé à leur taux d’abondance relative[16]. D'autres critères interviennent dans l'établissement de la relation et le choix d'un hôte : une préférence innée ou acquise des poissons pour certaines anémones ; certaines formes d'anémones liées à leur croissance sont favorisées ; la compétition intra-spécifique[16], les premiers arrivés empêchant généralement d'autres espèces de s'installer ; le hasard, des poissons peu compétitifs ont parfois trouvés des anémones très recherchées[39]. Au moment de leur installation, les poissons-clowns font preuve d'une importante sélection dans le choix de leur habitat mais il n'est pas établi dans quelle proportion cela peut expliquer la distribution des adultes[16].
Les poissons-clowns sont diurnes. La nuit, ils se réfugient dans les tentacules de leur anémone[40]. Les plus grandes espèces (A. clarkii, A. melanopus, A. chrysopterus, A. bicintus, A. frenatus, etc.) ne trouvent pas toujours un refuge suffisant dans leur anémone. Ils cherchent alors un abri dans les anfractuosités à proximité s'ils sont menacés. Les anémones du genre Stichodactyla notamment ont des tentacules trop courts pour offrir un abri aux adultes des grandes espèces qui, en cas de danger, se cachent sous le disque de l'anémone[41].
Les seules autres demoiselles qui s'associent avec des anémones sont la demoiselle à trois points (Dascyllus trimaculatus) et le dascyllus de Hawaii (D. albisella) qui appartiennent à la famille des Chrominae.
Structure sociale et hermaphrodisme
_in_Heteractis_magnifica_(Magnificent_sea_anemone).jpg.webp)
Les poissons-clowns habitent les anémones soit seuls, soit en couple, soit en groupe. Les groupes sont composés d'un couple d'adultes et d'un certain nombre de mâles et de juvéniles[40].
Les poissons-clowns sont des hermaphrodites successifs comme cela existe dans plusieurs familles de poissons, labridés et poissons-perroquets par exemple. Cependant si le cas commun est la protogynie — femelle puis mâle —, les poissons-clowns sont quant à eux protandres, c'est-à-dire d'abord mâles puis femelles[6].
Le plus gros poisson-clown et dominant socialement sur une anémone est généralement la femelle. Elle présente des ovaires fonctionnels et des tissus testiculaires dégénérés rémanents[6]. Le mâle est plus petit, jusqu'à deux fois plus petit pour les espèces A. frenatus et P. biaculeatus. Il a des testicules fonctionnels mais aussi des ovaires latents[6]. Le mâle dominant est le seul sexuellement actif, les autres sont des mâles subadultes inactifs dans la reproduction. En cas de disparition de la femelle, les gonades du mâle dominant s'arrêtent de fonctionner en tant que testicules et les ovaires s'activent. Son rôle de mâle reproducteur est assumé par le plus gros des mâles subadultes[6]. La nouvelle femelle peut commencer à pondre dès le 26e jour après son changement de sexe[42].
Cette structure sociale rigide est la cause d'un dimorphisme entre les adultes reproducteurs et les autres. La hiérarchie limite la croissance des subadultes mâles. Ils dépensent beaucoup d'énergie et de temps à éviter les attaques du mâle dominant. Cette activité empiète sur le temps d'alimentation. De plus, il est plus risqué pour les petits individus de s'aventurer loin de l'anémone, limitant leur périmètre de ravitaillement[7]. Amphiprion polymnus diffère des autres espèces du genre sur ce point. Le mâle et la femelle A. polymnus sont presque égaux en taille. Les anémones des fonds sableux sont connues pour s'enfouir lorsqu'elles sont stressées. Ne pouvant pas se cacher dans le récif dans cette situation comme l'aurait fait une autre espèce, A. polymnus s'est adapté en ayant de grands mâles pour limiter la prédation[41].
Un nouvel individu entre dans le groupe au bas de la hiérarchie. Il n'évolue qu'à la mort de ceux qui le précèdent dans l'ordre hiérarchique. Un individu atteint le sommet et ne devient femelle qu'après avoir parcouru l'ensemble de la « file » pour cette anémone[8]. Ce qui peut représenter plusieurs dizaines d'années[3].
Communication sonore
Les Pomacentridés sont connus pour produire une grande variété de sons. Chez les poissons-clowns, ce comportement est présent pour au moins dix espèces[44]. Amphiprion akallopisos, A. bicinctus, A. chysopterus, A. clarkii, A. frenatus, A. percula, A. polymnus sont des espèces vocales, alors que Amphiprion ephippium, A. biaculeatus et A. ocellaris ne le sont pas[45]. Les sons sont produits par le frottement des dents pharyngiennes, des os pharyngobranchiales et ceratobranchiales qui sont plus petits sur les espèces non-vocales[45]. Il a été montré que le ligament cérato-mandibulaire, une synapomorphie de la famille, intervient dans le mécanisme de production de son chez Amphiprion clarkii[46].
Contrairement à d'autres espèces de Pomacentridés, les amphiprions n’émettent pas de sons pour attirer un partenaire durant la phase de séduction. Ils interviennent par contre dans l'accession et au maintien du statut d'individu sexuellement actif[43]. Globalement, les sons peuvent être classés en deux groupes : agressif ou de soumission[43]. Ils se distinguent de par le nombre d'impulsions, leur durée et la fréquence dominante. Les mâles produisent également des « grognements » composés de nombreuses impulsions irrégulières et espacées quand la femelle entre dans son nid. D'autres sons sont également produits lors d'interactions agonistiques intraspécifiques ou hétérospécifiques[44].
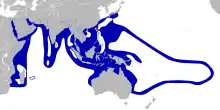
Répartition et habitat

Les poissons-clowns se rencontrent communément dans les eaux chaudes de la zone Indo-pacifique. On n'en trouve qu'une seule espèce en mer Rouge[47]. Ils sont absents de l'Atlantique et des Caraïbes[40]. Bien que la plupart des espèces aient des aires de répartition limitées d'autres sont largement distribuées. Amphiprion clarkii a l'aire de répartition la plus importante : elle s'étend des îles de Micronésie et Mélanésie dans l'océan Pacifique occidental jusqu'au golfe Persique, et de l'Australie au Japon[48]. Ils sont obligatoirement associés à une anémone de mer ; leur abondance et leur aire de répartition sont donc limitées par celles de leurs hôtes[49]. La taille de l'aire de répartition de A. clarkii est à rapprocher du fait que cette espèce est celle qui accepte le plus grand nombre d'espèces d'anémones comme hôtes.
Les poissons-clowns sont des espèces qui fréquentent les lagons et les récifs coralliens jusqu'à 40 m de profondeur[40]. Ils ne sont pas exclusivement présents dans les récifs et peuvent être situés dans les étendues de sable qui longent les récifs, habitat de certaines anémones hôtes (Stichodactyla spp. principalement)[31]. Leur habitat est peu profond car les anémones qui les abritent vivent également en symbiose avec des zooxanthelles, algues qui dépendent de la lumière pour assurer la photosynthèse[31].
On trouve la plus grande diversité de poissons-clowns près de la Papouasie-Nouvelle-Guinée, mais la grande barrière de corail en Australie est aussi célèbre pour sa diversité d'espèces[50].
Étymologie
Le nom de la sous-famille des Amphiprioninés est directement dérivé du nom du genre Amphiprion. Il est composé à partir des suffixes grecs amphi-, ἀμφίς en grec ancien, qui signifie « des deux côtés » et priön, « scie ». Ce genre regroupe donc des espèces dont le préopercule et le sous-opercule sont dentelés comme une scie[51],[52]. L'origine du nom premnas est quant à elle assez cocasse. À l'origine, Premnas, que l'on trouve aussi sous les formes premas et premnadia, était le nom grec d'un poisson indéterminé[53]. Georges Cuvier ignorait quelle espèce il désignait et a utilisé ce terme pour créer un nouveau genre de poisson-clown. Dans son Histoire naturelle des poissons il concède que ce choix ne fut pas très avisé. En effet, il a appris par la suite, dans des descriptions du poisson d'origine chez Athénée et Hésychios, qu'il ressemblait au thon[54]. Il francise le nom Premnas en Prémnades qui est tombé en désuétude.
On trouve plusieurs explications sur l'origine du nom commun des poissons-clowns. Pour certains, il vient des livrées caractéristiques de ces poissons. Leur couleurs vives et les bandes ou lignes blanches qu'ils arborent évoquent le costume[17] ou le maquillage des clowns de cirque[55]. Pour d'autres, c'est leur façon de nager particulière qui ressemble au dandinement d'un canard et rappelle la démarche du clown[56]. Leur nom italien est celui d'un clown par excellence, Pagliaccio le bouffon de la Commedia dell'arte qu'on nomme Paillasse en français. Ils sont nommés payaso en espagnol en référence au même personnage[17].
Systématique
Taxinomie
.png.webp)
Au niveau de la classification scientifique des espèces, les poissons-clowns sont des poissons osseux de la classe des actinoptérygiens ou poissons à nageoires rayonnées. Ils regroupent deux genres de la famille des Pomacentridés dans l'ordre des Perciformes : Amphiprion Bloch & Schneider, 1801[57] et Premnas Cuvier, 1817[58]. Ces deux genres constituent les Amphiprioninae, une des quatre sous-familles des Pomacentridés[59].
En 2001, K.L. Tang a confirmé que la sous-famille des Amphiprioninae est monophylétique. Le genre Premnas a été fusionné à Amphiprion, et est considéré comme un synonyme plus récent[60],[1] mais les bases taxinomiques ne reflètent pas encore cette évolution.
Les ichthyologistes regroupent les espèces du genre Amphiprion en quatre sous-genres : Actinicola, Amphiprion, Paramphiprion et Phalerebus. Ces quatre sous-genres approximent les cinq complexes d'espèces définis sur la base de coloration similaire : Amphiprion (Actinicola) correspond au Percula Complex ; Amphiprion (Amphiprion) regroupe les Clarkii Complex et Tomato Complex ; Amphiprion (Paramphiprion) correspond au Saddleback Complex ; et Amphiprion (Phalerebus) au Skunk Complex[49],[61]
Alors que certaines espèces n'ont été décrites que récemment — Amphiprion barberi en 2008[62] et Amphiprion pacificus en 2010[63] — d'autres sont remises en cause car elles sont soupçonnées d'être des hybrides naturels. Amphiprion leucokranos et Amphiprion thiellei semblent être des variantes de croisement entre Amphiprion chrysopterus et Amphiprion sandaracinos[21] et peuvent être recréées expérimentalement en captivité[64].
Histoire évolutive
L’espèce ancestrale du poisson-clown possédait 3 bandes avant qu’au cours de la diversification des espèces, plusieurs des pertes de bandes ne soient observées. Cette disparition suit un ordre bien précis : de la queue vers la tête, en passant par le tronc, soit l’ordre inverse du développement de l’individu[3],[65].
Liste des espèces

Selon FishBase (12 mars 2012)[66] :
- Genre Amphiprion Bloch & Schneider, 1801
- Amphiprion akallopisos Bleeker, 1853 — Poisson-clown moufette
- Amphiprion akindynos Allen, 1972 — Poisson-clown de la grande barrière
- Amphiprion allardi Klausewitz, 1970 — Poisson-clown d'Allard
- Amphiprion barberi Allen, Drew & Kaufman, 2008
- Amphiprion biaculeatus (Bloch, 1790) — Poisson-clown à joue épineuse
- Amphiprion bicinctus Rüppell, 1830 — Poisson-clown à deux bandes
- Amphiprion chagosensis Allen, 1972
- Amphiprion chrysogaster Cuvier, 1830 — Poisson-clown de Maurice.
 Poisson-clown à nageoires orange (Amphiprion chrysopteru) est une des rares espèces de Poissons-clowns à avoir la caudale blanche
Poisson-clown à nageoires orange (Amphiprion chrysopteru) est une des rares espèces de Poissons-clowns à avoir la caudale blanche - Amphiprion chrysopterus Cuvier, 1830 — Poisson-clown à nageoires orange, Poisson-clown à nageoires jaunes
- Amphiprion clarkii (Bennett, 1830) — Poisson-clown de Clark
- Amphiprion ephippium (Bloch, 1790) — Poisson-clown à selle
- Amphiprion frenatus Brevoort, 1856 — Poisson-clown rouge
- Amphiprion fuscocaudatus Allen, 1972
- Amphiprion latezonatus Waite, 1900
- Amphiprion latifasciatus Allen, 1972 — Poisson-clown de Madagascar
- Amphiprion leucokranos Allen, 1973 — Poisson-clown à capuchon blanc
- Amphiprion mccullochi Whitley, 1929 — Clown de Mc Culloch
- Amphiprion melanopus Bleeker, 1852 — Poisson-clown bistré
- Amphiprion nigripes Regan, 1908 — Poisson-clown des Maldives
- Amphiprion ocellaris Cuvier, 1830 — Poisson-clown à trois bandes
- Amphiprion omanensis Allen and Mee in Allen, 1991 — Poisson-clown d'Oman
- Amphiprion pacificus Allen, Drew & Fenner, 2010.

- Amphiprion percula (Lacépède, 1802) — Poisson-clown du Pacifique
- Amphiprion perideraion Bleeker, 1855 — Poisson-clown à collier, Poisson-clown rose
- Amphiprion polymnus (Linnaeus, 1758) — Poisson-clown selle blanche
- Amphiprion rubrocinctus Richardson, 1842
- Amphiprion sandaracinos Allen, 1972 — Poisson-clown à bande dorsale
- Amphiprion sebae Bleeker, 1853 — Poisson-clown de Seba
- Amphiprion thiellei Burgess, 1981
- Amphiprion tricinctus Schultz and Welander in Schultz, 1953 — Poisson-clown à trois raies
Les Poissons-clowns et l'homme
Statut de conservation

Les poissons-clowns sont affectés par les modifications que le réchauffement climatique fait peser sur leur habitat, les récifs coralliens. Conséquence de leur mutualisme, en plus des menaces directes, ils sont aussi touchés par les facteurs influant sur la baisse des populations des anémones avec lesquelles ils s'associent[50]. Malgré ces différentes pressions écologiques, en 2012, aucune espèce d'amphiprioninés n'est encore considérée comme menacée.
L'acidification des océans entraîne un blanchissement des coraux qui cause également la disparition des anémones de mer[50]. Cette acidification perturbe aussi les signaux chimiques qui guident les larves pour trouver une anémone[50]. La hausse de la température de l'eau accélère le développement des juvéniles ce qui limite leur rayon de dispersion déjà très faible. La température intervient également dans le cycle de reproduction. Avec le réchauffement des océans, moins d'œufs sont viables et le comportement sexuel est perturbé[50].
Les poissons-clowns et les anémones sont très recherchés par les aquariophiles marins. Sur la période allant de 1997 à 2002, Amphiprion ocellaris est la troisième espèce de poisson d'aquarium la plus vendue sur le marché d'import selon la Global Marine Aquarium Database (GMAD) du programme des Nations unies pour l'environnement (UNEP) même si les poissons du commerce sont principalement issus d'élevages[67]. Néanmoins, Amphiprion sandaracinos est inscrit depuis 2010 sur la liste rouge de l'UICN dans la catégorie « Préoccupation mineure » (LC) notamment pour la pression que représente la pêche pour le commerce de l'aquariophilie[68]. Le phénomène de mode des poissons-clowns en aquariophilie a été accentué en 2003 lors la sortie du film Le Monde de Nemo[69],[70].
Plus globalement, les activités humaines et ses conséquences dégradent ou détruisent l'habitat des poissons-clowns et constituent sa principale menace actuellement[50],[68],[71]. Eutrophisation, pratiques de pêche destructives, pollution de l'eau, tourisme intensif et développement des zones côtières participent à l'altération de son habitat. Ces menaces sont majoritairement locales et ne touchent que certaines zones de leurs aires de répartition et ne représentent pas une menace significative sur les populations globales[68].
Aquariophilie

Les poissons-clowns sont parmi les rares poissons de mer qui peuvent être élevés en captivité dans des quantités commerciales rentables. Dans un aquarium, ils peuvent vivre sans anémone ; ces dernières sont d'ailleurs difficiles à maintenir. Les amphiprions sont de couleurs attrayantes et souvent vives notamment orange. Ils sont amicaux et faciles à nourrir. Une bonne maintenance peut aboutir à la reproduction, cependant l'élevage des alevins est complexe à cause de leur alimentation à base de zooplancton, d'abord des rotifères comme Brachionus plicatilis, puis des nauplius d’artémies principalement[72]. Les prélèvements abusifs liés à l'aquariophilie peuvent présenter localement une menace pour les poissons-clowns, mais la tendance à l'élevage en aquarium s'intensifie[73].
Plongée sous-marine
Les poissons-clowns, déjà populaires avant le film d'animation de Pixar, sont devenus de véritables attractions après celui-ci, et font partie des poissons les plus facilement identifiés par les plongeurs sous-marins. Peu craintifs, les poissons-clowns font parfois mine d'attaquer[73] et n'hésitent pas à charger quand ils voient leur reflet dans le masque des plongeurs[74] ou quand ceux-ci s'approchent trop près des jeunes[75].
Aspects culturels
Philatélie
Les poissons-clowns sont le sujet de dizaines de timbres postaux, principalement émis par les pays côtiers de leur aire de répartition. On peut citer notamment[N 3] :
- Anemone Fish 10c, Australie, 1966 (SG 391)
- Anemone Fish Australie, 2004 (SG 2258)
- Amphiprion percula, Royaume du cambodge, 1985 (SG 1484)
- Amphiprion frenatus, Corée du Nord, 1986 (SG N2576)
- Amphiprion frenatus, Corée du Nord, 1991 (SG N3090)
- Ras Mohammed Notical Park, Égypte, 1990 (SG 1793)
- Amphiprion chrysogaster, Maurice, 2000 (SG 1036)
- Iles Ryukyu, 1966 (SG 186)
- Amphiprion allardi, Kenya, 1980 (SG 184)
- Sea anemon with clownfish, Palau, 1980 (SG 18a)
- Palau, 1990 (SG 379)
- Amphiprion leucokranos, Papouasie Nouvelle Guinée, 1987 (SG 539)
Le Monde de Nemo
En 2003, le poisson-clown à trois bandes (Amphiprion ocellaris)[N 4] est choisi pour incarner Nemo, le petit poisson héros du film d'animation Le Monde de Nemo[55] et aussi son père Marin qui est l'un des principaux protagonistes. Le film a eu une notoriété telle qu'il est difficile de ne pas l'évoquer lorsque l'on traite des poissons-clowns[76].
Notes et références
Notes
- Il est aussi appelé clownfish en anglais.
- La taxinomie exacte de l'ordre Actiniaria fait l'objet de désaccords entre systématiciens.
- La référence dans le catalogue Stanley Gibbons est indiquée entre parenthèses.
- Nemo est fréquemment identifié comme étant un individu de l'espèce Amphiprion ocellaris ou A. percula, deux espèces du Percula complex qui se ressemblent beaucoup.
Références
- Nelson 2006, p. 393
- Fautin et Allen 1992, ch. 2, « Anemonefishes : Identification »
- Hecquet 2018, p. 48
- Fautin et Allen 1992, ch. 2, « Anemonefishes : Colour variation »
- Fautin et Allen 1992, ch. 5, « Interactions between fish and sea anemones : How anemone and fish can affect one another »
- Fautin et Allen 1992, ch. 4, « Life history of anemonefishes : Social structure and sex reversal »
- Fautin et Allen 1992, ch. 4, « Life history of anemonefishes : Feeding and growth »
- (en) P. M. Buston et M. B. García, « An extraordinary life span estimate for the clown anemonefish Amphiprion percula », Journal of Fish Biology, no 70, , p. 1710–1719 (DOI doi:10.1111/j.1095-8649.2007.01445.x, lire en ligne)
- Fautin et Allen 1992, ch. 4, « Life history of anemonefishes : Courtship, spawning, and incubation »
- Debelius et Kuiter 2007, p. 518
- Moyer et Steene 1979, p. 209
- Fautin et Allen 1992, ch. 4, « Life history of anemonefishes : Larval life and settlement »
- (en) Lori J. Bell, « Notes on the Nesting Success and Fecundity of the Anemonefish Amphiprion clarkii at Miyake-Jima, Japan », Japanese Journal of Ichtyology, vol. 22, no 4, (lire en ligne)
- (en) Michio Murata, Kazuko Miyagawa-Kohshima, Koji Nakanishi et Yoko Naya, Characterization of compounds that induce symbiosis between sea anemone and anemone fish, vol. 234, , 585-587 p. (DOI 10.1126/science.234.4776.585, lire en ligne), chap. 4776
- (en) A functional biology of sea anemones, Chapman & Hall, , 395 p. (ISBN 0412331500, OCLC 21901727), p. 303
- (en) Daphne Gail Fautin, « Competition by anernonefishes for host actinians », Proceedings of the Fifth International Coral Reef Congress, Tahiti, vol. 5, , p. 373-377 (lire en ligne)
- Walter et Avenas 2011, p. 341
- Fautin et Allen 1992
- Hertwig 1882
- Fautin 1991, p. 38
- Ollerton et al. 2007, p. 592
- (en) Cuthbert Collingwood, « Note on the existence of gigantic sea-anemones in the China Sea, containing within them quasi-parasitic fish », Annals And Magazine of Natural History, 4e série, vol. 1, , p. 31-33 (lire en ligne)
- Fautin 1991, p. 24
- Fautin 1991, p. 29
- Fautin 1991, p. 30
- Jacqueline Goy, « Les paradoxes des méduses », Pour la Science, no 299, , p. 39
- Castro et Huber 2003, p. 320
- Fautin 1991, p. 39
- Godwin et Fautin 1992
- Fautin 1991, p. 40
- Fautin et Allen 1992, Introduction, « Geographical and ecological distribution »
- (en) D. Porat et N. E. Chadwick-Furman, « Effects of anemonefish on giant sea anemones: expansion behavior, growth, and survival », Hydrobiologia, vol. 530-531, nos 1-3, , p. 513-520 (DOI 10.1007/s10750-004-2688-y)
- (en) D. Porat et N. E. Chadwick-Furman, « Effects of anemonefish on giant sea anemones: ammonium uptake, zooxanthella content and tissue regeneration. », Marine and Freshwater Behaviour and Physiology, no 38, , p. 43–51. (DOI 10.1080/102362405000 57929)
- Fautin et Allen 1992, ch. 1, « Sea anemones : Classification »
- Fautin 1991, p. 28
- Fautin et Allen 1992, ch. 1, « Sea anemones »
- (en) Nanette E. Chadwick et Michael Arvedlund, « Abundance of giant sea anemones and patterns of association with anemonefish in the northern Red Sea », Journal of the Marine Biological Association of the United Kingdom, vol. 85, no 5, , p. 1287-1292 (DOI 10.1017/S0025315405012440)
- Fautin 1991, p. 33
- Fautin 1991, p. 34
- Debelius et Kuiter 2007, p. 517
- Moyer et Steene 1979, p. 213
- Castro et Huber 2003, p. 174
- (en) Eric Parmentier, « Overview on the Diversity of Sounds Produced by Clownfishes (Pomacentridae): Importance of Acoustic Signals in Their Peculiar Way of Life », PLOS ONE, Public Library of Science, vol. 7, no 11, , e49179 (ISSN 1932-6203, DOI 10.1371/journal.pone.0049179, lire en ligne)
- (en) E. Parmentier, J.P. Lagardère, P Vandewalle1 et M.L. Fine, « Geographical variation in sound production in the anemonefish Amphiprion akallopisos », Proceedings of The Royal Society B, vol. 272, no 1573, , p. 1697–1703 (DOI 10.1098/rspb.2005.3146, lire en ligne)
- (en) Kuei-Chiu Chen et Hin-Kiu Mok, « Sound Production in the Anemonefish Amphiprion clarkii and A. frenatus (Pomacentridae), in Captivity », Japanese Journal of Ichtyology, vol. 35, no 1, , p. 90-97
- (en) Eric Parmentier, Orphal Colleye, Michael L. Fine, Bruno Frédérich, Pierre Vandewalle et Anthony Herrel, « Sound Production in the Clownfish Amphiprion clarkii », Science, vol. 316, no 5827, , p. 1006 (DOI 10.1126/science.1139753, lire en ligne)
- Pierre Martin-Razi, Le grand livre Hachette de la plongée, Hachette, , 224 p. (ISBN 978-2-01-230187-0), p. 28. Poisson-clown page 212
- Fautin et Allen 1992, ch. 2, « Anemonefishes : Amphiprion clarkii (Bennett, 1830) »
- Allen 1972
- (en) Terry Donaldson, « Clownfish and Climate Change : Losing Nemo », dans Species and Climate Change : More than just the Polar Bear, IUCN, (lire en ligne)
- Walter et Avenas 2011, p. 342
- Bloch et Schneider 1801, p. 200
- Cuvier 1817, p. 345
- Cuvier et Valenciennes 1830, p. 405
- (en) James Prosek et David Doubilet (Photographe), « Beautiful Friendship », National Geographic, (lire en ligne)
- (en) Dick Mills et John Tullock, The Encyclopedia of Aquarium Fish : A Comprehensive Directory of the World's Major Aquarium Breeds, Barron's Educational Series, , 140 p. (ISBN 978-0764153006)
- Bloch et Schneider 1801
- Cuvier 1817
- Fautin et Allen 1992, ch. 2, « Anemonefishes : Classification »
- (en) K. L. Tang, « Phylogenetic relationships among damselfishes (Teleostei: Pomacentridae) as determined by mitochondrial DNA data », Copeia, no 3, , p. 591–601 (DOI 10.1643/0045-8511(2001)001[0591:PRADTP]2.0.CO;2)
- « Keeping Nemo: Clownfish (Anemonefish) », sur tropicalfishfinder.co.uk, Tropical Fish Finder, (consulté le )
- (en) G.R. Allen, J. Drew et L. Kaufman, « Amphiprion barberi, a new species of anemonefish (Pomacentridae) from Fiji, Tonga, and Samoa », Aqua — International Journal of Ichthyology, vol. 14, no 3, , p. 105-114
- (en) G.R. Allen, J. Drew et D. Fenner, « Amphiprion pacificus, a new species of anemonefish (Pomacentridae) from Fiji, Tonga, Samoa, and Wallis Island », Aqua — International Journal of Ichthyology, vol. 16, no 3, , p. 129-138
- (en) B. Carlson, « The Amphiprion leucokranos mystery », Aquarium Frontiers, no 3, , p. 34-37
- Salis, Roux et Soulat 2018
- FishBase, consulté le 12 mars 2012
- (en) Colette Wabnitz, Michelle Taylor, Edmund Green et Tries Razak, From Ocean to Aquarium : The global trade in marine ornamental species, (lire en ligne), p. 20
- (en) Référence UICN : espèce Amphiprion sandaracinos (Allen, 1972) (consulté le )
- AP via Yahoo, « La vague « Nemo » envahit les animaleries » (version du 19 décembre 2003 sur l'Internet Archive), sur yahoo.com,
- Hajdenberg Michël, « « Nemo » inonde les aquariums de poissons-clowns », sur liberation.fr, Libération, (consulté le )
- Florian Bardou, « Les poissons-clowns menacés par la destruction de leur habitat », sur liberation.fr, Libération,
- (en) Forrest A. Young, « Rearing the red sea anemonefish : Amphiprion bicintus », Freshwater and Marine Aquarium, vol. 4, no 14, , p. 136-142 (lire en ligne)
- (en) « Diving with Clown fish », sur dive-the-world.com, Dive the world Newsletter, (consulté le )
- (en) « Clownfish », sur breakaway.cc, Breakaway Destination Guides (International) (consulté le )
- (en) « Blue Planet Aquarium to host clownfish events during half-term holiday », sur ellesmereportpioneer.co.uk, Ellesmere Port Pioneer, (consulté le )
- Walter et Avenas 2011, p. 340
Bibliographie
Ouvrages spécialisés
- (en) Gerald R. Allen, Anemonefishes : Their classification and biology, Neptune City, NJ, Tropical Fish Hobbyist Publications, , 288 p. (OCLC 310721635)
- (en) D.G Fautin et G. R. Allen, Field guide to anemonefishes and their host sea anemones, Perth, WA, Western Australian Museum, (ISBN 0730952169) [lire en ligne]
- (en) D.G Fautin et G.R. Allen, Field guide to anemonefishes and their host sea anemones : a guide for aquarists and divers, Perth, WA, Western Australian Museum, , Revised edition (ISBN 0730983927)
Articles de revue scientifique
- (en) Daphne Gail Fautin, « The Anemonefish Symbiosis: What is Known and What is Not », Symbiosis, no 10, , p. 23-46 (ISSN 0334-5114 et 1878-7665, lire en ligne)
- (en) Jeff Ollerton, Duncan McCollin, Daphne G Fautin et Gerald R. Allen, « Finding NEMO: nestedness engendered by mutualistic organization in anemonefish and their hosts », Proceedings of the Royal Society B, vol. 274, no 1609, , p. 591-598 (DOI 10.1098/rspb.2006.3758, lire en ligne)
- (en) Jack T. Moyer et Roger C. Steene, « Nesting Behavior of the Anemonefish Amphiprion polymnus », Japanese Journal of Ichtyology, vol. 26, no 2, , p. 209-213 (lire en ligne)
- (en) John Godwin et Daphne G. Fautin, « Defense of Host Actinians by Anemonefishes », Copeia, vol. 1992, no 3, , p. 902-908 (lire en ligne)
- P. Salis, N. Roux, O. Soulat et al., « Ontogenetic and phylogenetic simplification during white stripe evolution in clownfishes », BMC Biol, vol. 16, no 90, (DOI https://doi.org/10.1186/s12915-018-0559-7)
Articles de vugarisation
- Romain Hecquet, « Le poisson-clown traîne toujours en bande », CNRS Le journal, no 295, , p. 48 (lire en ligne)
Ouvrages généralistes
- (en) J.S Nelson, Fishes of the world, Hoboken, John Wiley & Sons, Inc., , 4e éd., 601 p. (ISBN 978-0-471-25031-9, LCCN 2005033605)
- Helmut Debelius et Rudie H. Kuiter, Atlas mondial des poissons marins, Paris, Ulmer, (ISBN 978-2-84138-296-5, OCLC 470740074, notice BnF no FRBNF41208815)
- (en) P. Castro et M. Huber, Marine biology, McGraw-Hill, , 4e éd. (ISBN 9780072937251, OCLC 470740074)
- Henriette Walter et Pierre Avenas, La Fabuleuse histoire du nom des poissons : Du tout petit poisson-clown au très grand requin blanc, Robert Laffont, (ISBN 978-2221113561, OCLC 779692713, notice BnF no FRBNF42555033)
Publications originales
- (la) M. E. Bloch, J. G. Schneider et J.F. Hennig (dessinateur), Systema ichthyologiae iconibus CX illustratum, (OCLC 7830344, DOI 10.5962/bhl.title.5750, lire en ligne), p. 200-206
- Georges Cuvier, Le Règne animal distribué d'après son organisation : Les reptiles, les poissons, les mollusques et les annélides, t. II, (lire en ligne), p. 345-346
- Georges Cuvier et Achille Valenciennes, Histoire naturelle des poissons, (lire en ligne), p. 404-411
- (de) R. Hertwig, Die Actinien der Challenger-Expedition, Jena, Gustav Fisher, (lire en ligne)
Liens externes
Genre Amphiprion
- (en) Référence FishBase : (consulté le )
- (en) Référence World Register of Marine Species : taxon Amphiprion Bloch & Schneider, 1801 (+ liste espèces) (consulté le )
- (fr+en) Référence ITIS : Amphiprion Bloch & Schneider, 1801 (consulté le )
- (en) Référence Animal Diversity Web : Amphiprion (consulté le )
- (en) Référence NCBI : Amphiprion (taxons inclus) (consulté le )
- (en) Référence UICN : taxon Amphiprion (consulté le )
- (en) Référence Catalogue of Life : Amphiprion (consulté le )
Genre Premnas
- (en) Référence FishBase : (consulté le )
- (en) Référence World Register of Marine Species : taxon Premnas Cuvier, 1817 (+ liste espèces) (consulté le )
- (fr+en) Référence ITIS : Premnas Cuvier, 1816 (consulté le )
- (en) Référence Animal Diversity Web : Premnas (consulté le )
- (en) Référence NCBI : Premnas (taxons inclus) (consulté le )
- (en) Référence Catalogue of Life : Premnas (consulté le )
- Portail de l’ichtyologie
- Portail de la biologie marine
- Portail de l’aquariophilie