Acétylène
L’acétylène (appelé éthyne par la nomenclature IUPAC) est un composé chimique hydrocarbure de la classe des alcynes de formule brute C2H2. Il a été découvert par Edmund Davy en Angleterre en 1836. C’est l’alcyne le plus simple, constitué de deux atomes de carbone et deux d’hydrogène. Les deux atomes de carbone sont reliés par une triple liaison qui contient la majorité de son énergie chimique.
| Acétylène | |

| |
| Structure tridimensionnelle de l'acétylène | |
| Identification | |
|---|---|
| Nom UICPA | éthyne |
| No CAS | |
| No ECHA | 100.000.743 |
| No CE | 200-816-9 |
| PubChem | 6326 |
| SMILES | |
| InChI | |
| Apparence | gaz incolore dissous dans l'acétone sous pression[1] |
| Propriétés chimiques | |
| Formule | C2H2 [Isomères] |
| Masse molaire[2] | 26,0373 ± 0,0017 g/mol C 92,26 %, H 7,74 %, |
| Propriétés physiques | |
| T° fusion | −80,7 °C (point triple) [3] |
| T° ébullition | −84,7 °C [3] |
| Solubilité | 1,185 g l−1 (eau,20 °C) [4] |
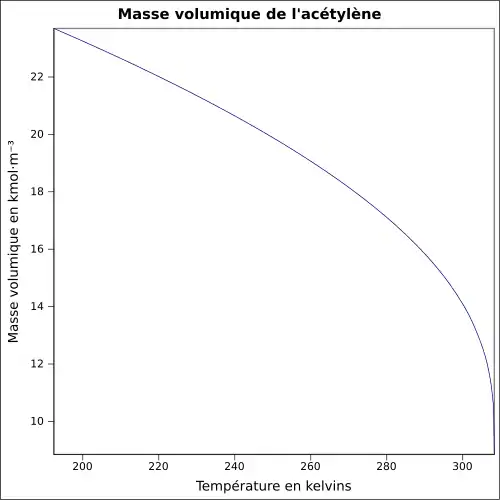
| Masse volumique | |
| T° d'auto-inflammation | 305 °C [4] |
| Point d’éclair | Gaz Inflammable[1] |
| Limites d’explosivité dans l’air | 2,3–100 %vol [4] |
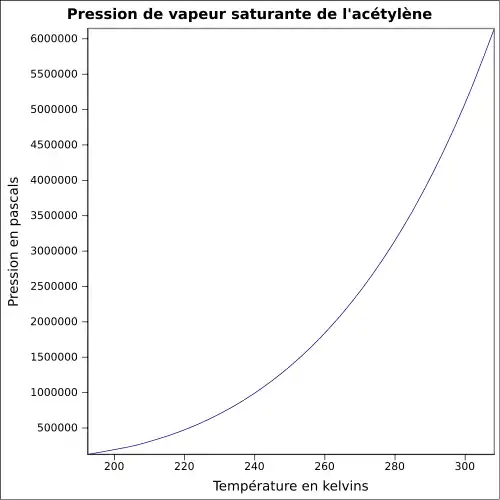
| Pression de vapeur saturante | à 20 °C : 4 460 kPa[1]
|
| Point critique | 35,2 °C 61,38 bar 0.1122 l/mol [6] |
| Point triple | −80,8 °C à 1,2825 bar [7] |
| Thermochimie | |
| S0gaz, 1 bar | 200,93 J mol−1 K−1 (1 bar) [8] |
| ΔfH0gaz | 226,73 kJ·mol-1 [8] |
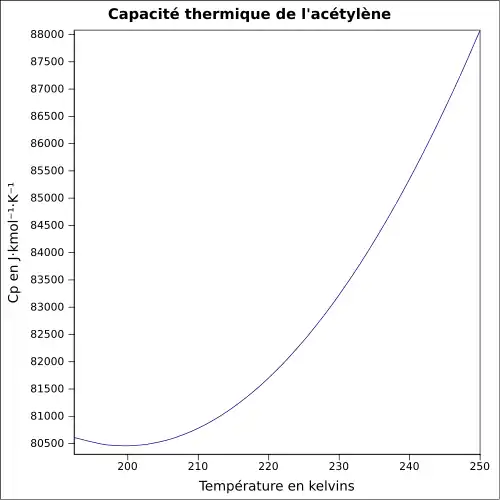
| Cp | 44,04 J mol−1 K−1 à 25 °C [8]
|
| PCS | 1 301,1 kJ·mol-1[10] (25 °C, gaz) |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 11,400 ± 0,002 eV (gaz)[11] |
| Cristallographie | |
| Classe cristalline ou groupe d’espace | Pa3 [12] |
| Paramètres de maille | a = 6,140 Å b = 6,140 Å |
| Volume | 231,48 Å3 [12] |
| Précautions | |
| SGH[13] | |
  Danger |
|
| SIMDUT[14] | |
   A, B1, F, |
|
| NFPA 704 | |
| Transport | |
| Écotoxicologie | |
| LogP | 0,37[1] |
| Seuil de l’odorat | bas : 226 ppm haut : 2 584 ppm[15] |
| Unités du SI et CNTP, sauf indication contraire. | |
Description
Sa structure est linéaire : ![]()
Berthelot, en 1862, fut le premier à synthétiser l’acétylène, dans un appareil surnommé « œuf de Berthelot », par la production d'un arc voltaïque entre deux électrodes de graphite baignant dans une atmosphère d’hydrogène : 2 C + H2 → C2H2
L’acétylène est un gaz incolore, pratiquement inodore quand il est pur (mais on lui attribue généralement une odeur d'ail caractéristique qui provient des impuretés, notamment la phosphine lorsqu'il est produit à partir du carbure de calcium).
L'acétylène est extrêmement inflammable aux conditions normales de température et de pression. Il est endoénergétique par rapport au carbone et à l'hydrogène, et peut se décomposer spontanément, de façon explosive lorsque la pression est supérieure à 100 kPa, et jusqu'à quelques bars où cette décomposition spontanée se produit immanquablement[réf. souhaitée]. C'est pour cette raison qu’il est stocké dissous dans l’acétone ou le diméthylformamide (DMF), eux-mêmes inclus dans une matière poreuse stabilisatrice.
Utilisation
Des applications de l’acétylène :
- La forte teneur en carbone donne une flamme très éclairante utilisée par exemple dans les lampes à acétylène (calebombe) des mineurs ou des spéléologues.
- La haute chaleur de combustion de l’acétylène permet d'atteindre de hautes températures (3 200 °C dans l'oxygène pur), ce qui en fait un candidat idéal comme combustible pour la soudure. Une des particularités de la combustion de l'acétylène est sa combustion en deux temps : l'acétylène réagit en premier avec l'oxygène pour donner du monoxyde de carbone et de l'hydrogène, puis ces produits réagissent dans un second temps pour former du dioxyde de carbone et de l'eau. Le monoxyde de carbone et l'hydrogène sont des gaz réducteurs, ce qui en fait des réactifs appréciés en soudure de l'acier pour réduire les oxydes de fer issus de la réaction entre le fer et l'oxygène à haute température, permettant ainsi une meilleure homogénéisation de la soudure et donc une meilleure qualité de cette dernière. La soudure à l'acétylène permet l'assemblage de métaux variés (aciers, inox, alliages de cuivre), mais aussi sous certaines conditions l'aluminium allié au silicium.
- L'acétylène est également utilisé comme combustible dans des appareils d'analyse. En effet, en spectrométrie d'absorption atomique (SAA), associé à différents comburants (air, oxygène pur, protoxyde d'azote), il permet l'ionisation d'éléments typiquement alcalino-terreux et d'en déterminer la concentration grâce à la loi de Beer-Lambert.
- L'acétylène est aussi utilisé dans les chalumeaux oxy-coupeurs. Cependant, le propane lui est préféré, car moins coûteux. Mais pour les découpes de forte épaisseur, l'acétylène est indispensable pour chauffer suffisamment l'acier et initier l'oxycoupage sur une largeur faible.
- La réaction de l'acétylène avec l'acide chlorhydrique est une manière de produire du chlorure de vinyle (monomère du polychlorure de vinyle).
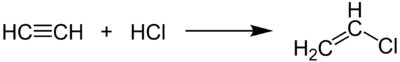
Propriétés physico-chimiques
Les propriétés chimiques de l'acétylène s'expliquent en grande partie par la présence dans sa molécule d'une triple liaison résultant de la superposition d'une liaison simple s (provenant de la fusion de deux orbitales sp) et de deux liaisons p résultant de la fusion de deux orbitales 2p. Cette liaison, de longueur 0,124 nm et caractérisée par une énergie de 811 kJ, est moins stable que les liaisons simples (614 kJ) et doubles (347,3 kJ), et par conséquent plus réactive.
Les réactions de l’acétylène
- L’acétylène et les monoalkylacétylènes sont les seuls hydrocarbures qui ont un hydrogène ayant un caractère acide et qui peut être échangé par un métal.
- Certains acétylénures comme sont détonants au choc.
- L’acétylène réagit avec l’acide cyanhydrique pour former de l’acrylonitrile, monomère de l’acrylonitrile butadiène styrène (ABS) et du styrène-acrylonitrile (SAN).
- L'acétylène donne le benzène par polymérisation sous l'action de la chaleur.
- Par dimérisation en présence de catalyseurs, on obtient du vinylacétylène auquel on ajoute du chlorure d'hydrogène pour obtenir du chloroprène, monomère du polychloroprène ou néoprène.
Production et synthèse
L’acétylène n’existe pas à l'état naturel (d'autres alcynes existent ponctuellement dans les hydrocarbures). Les principales méthodes industrielles pour produire l’acétylène sont :
Méthode carbochimique
On utilise comme matière première le calcaire et le coke ou du charbon de bois. Dans un four à haute température (1 700 °C minimum) chauffé par un courant électrique passant dans le milieu réactionnel en fusion, il se produit du carbure de calcium selon les réactions : CaCO3 → CaO + CO2, CaO + 3 C + 108 300 calories → CaC2 + CO.
Chez l’utilisateur, le carbure réagit avec l’eau pour produire l’acétylène, 1 kg de carbure se combinant avec 562,5 g d’eau pour dégager 350 l d’acétylène[16] : CaC2 + 2 H2O → C2H2 + Ca(OH)2 + 31 000 calories.
Combustion partielle du méthane
La combustion partielle du méthane produit aussi de l’acétylène : 3 CH4 + 3 O2 → C2H2 + CO + 5 H2O.
Déshydrogénation des alcanes
Les alcanes les plus lourds du pétrole et du gaz naturel sont craqués en molécules plus légères qui sont déshydrogénées à haute température : C2H6 → C2H2 + 2 H2.
Notes et références
- ACETYLENE, fiche(s) de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée(s) le 9 mai 2009
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, 89th Edition, Boca Raton, CRC Press/Taylor and Francis, , « Physical Constants of Organic Compounds »
- Entrée « Acetylene » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 14 avril 2009 (JavaScript nécessaire)
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- Clark, A.M.; Din, F., Equilibria Between Solid, Liquid, and Gaseous Phases at Low Temperature binary systems acetylene - carbon dioxide, acetylene - ethylene and acetylene - ethane, Trans. Faraday Soc., 1950, 46, 901.
- Tsonopoulos, C.; Ambrose, D., Vapor-Liquid Critical Properties of Elements and Compounds. 6. Unsaturated Aliphatic Hydrocarbons, J. Chem. Eng. Data, 1996, 41, 645-656.
- « Acetylene », sur http://www.nist.gov (consulté le )
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, 2 et 3, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-857-8, 978-0-88415-858-5 et 978-0-88415-859-2)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press, , 83e éd., 2664 p. (ISBN 0849304830, présentation en ligne), p. 5-89
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- « Acetylene », sur www.reciprocalnet.org (consulté le )
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Acétylène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- « Acetylene », sur hazmap.nlm.nih.gov (consulté le )
- Nowak Ph. (1999) - « L’acétylène », « Le P'tit Usania no 7 », sur USAN (consulté le ) (ISSN 1292-5950), USAN, Nancy, p. 1