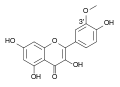
Rutoside
Le rutoside est un diglycoside de la quercétine (quercétol), le quercétol 3-O-rutinoside, relativement fréquent dans la nature. Il porte aussi les noms de rutine et sophorine. C’est un flavonoïde naturel de type flavonol qui possède des propriétés pharmacologiques intéressantes. Il est hydrolysé en quercétol dans le tractus gastro-intestinal.
| Rutoside | |

| |
| Identification | |
|---|---|
| Nom UICPA | 2-(3,4-dihydroxyphényl)- 4,5-dihydroxy-3-[3,4,5- trihydroxy-6-[(3,4,5- trihydroxy-6-méthyl- oxan-2-yl)oxyméthyl] oxan-2-yl]oxy-chromén- 7-one |
| Synonymes |
rutine |
| No CAS | |
| No ECHA | 100.005.287 |
| No CE | 205-814-1 |
| Code ATC | C05 |
| PubChem | |
| SMILES | |
| InChI | |
| Apparence | cristal jaune[réf. nécessaire] |
| Propriétés chimiques | |
| Formule | C27H30O16 [Isomères] |
| Masse molaire[1] | 610,5175 ± 0,0285 g/mol C 53,12 %, H 4,95 %, O 41,93 %, |
| Propriétés physiques | |
| T° fusion | 125 °C[2] |
| Solubilité | Faiblement soluble dans l'eau (125 mg·L-1)[2] |
| Précautions | |
| Directive 67/548/EEC | |
| Écotoxicologie | |
| DL50 | 2 000 mg·kg-1, rat, i.p. 950 mg·kg-1, souris, i.v.[2] |
| Composés apparentés | |
| Autres composés | |
| Unités du SI et CNTP, sauf indication contraire. | |
Le nom de rutine vient de sa présence dans la rue officinale (Ruta graveolens), un arbrisseau très aromatique de la garrigue méditerranéenne.
Plantes riches en rutoside
| Plantes alimentaires riches en rutoside (quercétine 3-O-rutinoside) d'après et Phenol Explorer[3] | ||
| Forme consommée | Nom scientifique de la plante | Teneur |
|---|---|---|
| Câpre | Capparis spinosa | 332,29 mg·100g-1 |
| Olive noire, crue | Olea europaea | 45,36 mg·100g-1 |
| Sarrasin, farine complète | Fagopyrum esculentum | 37,27 mg·100g-1 |
| Asperge, crue | Asparagus officinalis | 23,19 mg·100g-1 |
| Framboise noire | Rubus occidentalis | 19,00 mg·100g-1 |
| Framboise rouge | Rubus idaeus | 11,00 mg·100g-1 |
| Cassis | Ribes nigrum | 4,65 mg·100g-1 |
| Prune, fraiche | Prunus domestica | 5,90 mg·100g-1 |
| Haricot vert, cru | Phaseolus vulgaris | 2,49 mg·100g-1 |
| Thé noir, infusion | Camellia sinensis | 1,62 mg·100g-1 |
| Thé vert, infusion | Camellia sinensis | 1,46 mg·100g-1 |
| Vin rouge | Vitis vinifera | 0,81 mg·100g-1 |
Les plantes les plus riches[4] sont :
- Sophora japonica : le sophora est un grand arbre de la famille des Fabacées, originaire de Chine, cultivé en Europe à des fins ornementales. L’industrie pharmaceutique l’utilise pour ses boutons floraux[5] qui contiennent juste avant leur épanouissement, de 15 à 20 % de rutoside. Avant l’arrivée des colorants synthétiques, il était aussi utilisé en Asie Orientale pour teindre la soie.
- le sarrasin (Fagopyrum esculentum) est une pseudocéréale annuelle de la famille des Polygonacées, cultivée pour ses graines alimentaires. Ses feuilles contiennent de 2 à 3 % de rutoside et les variétés améliorées jusqu’à 5 à 8 % mais la présence de substances photosensiblisantes (fagopyrines) compliquent l'extraction.
- Eucalyptus macrorrhyncha a les feuilles suffisamment riches en rutoside pour en permettre l’extraction[6]
- la pensée sauvage (Viola tricolor), avec 23 % de rutoside, est la plante la mieux pourvue[7]
- le mûrier blanc (Morus alba) dont les feuilles contiennent 6 % de rutoside
- le persil (Petroselimum crispum) est aussi riche (3 % dans ses feuilles)
- la rhubarbe (Rheum rhabarbarum) contient un grand nombre de phénols dont le rutoside (0,6 % dans les feuilles)
- la myrtille (Vaccinum myrtillus) a des baies dont le contenu total en flavonols est compris entre 540 et 1 300 mg d’équivalent de rutoside par kilogramme de matière sèche
- les asperges : ce sont des légumes ayant une des plus grandes activités antioxydantes parmi 43 légumes et le rutoside est leur flavonoïde principal (450 mg·kg-1 du poids frais des asperges blanches)[8]
- les oignons sont une source majeure de flavonols et en particulier de quercétol et de ses glycosides comme le rutoside
- le Ginkgo biloba, riche en quercétol et rutoside
- le coing (Cydonia oblonga), le tabac, le forsythia, etc.
Absorption et métabolisme
Seule une petite fraction (17 %) du rutoside est absorbée dans l’intestin grêle, le reste (83 %) passe dans le côlon où il est métabolisé. Le rutoside y est d’abord déglycolisé en quercétol. Les bactéries de la microflore du côlon clivent aussi le rutoside et le quercétol en acides phénylacétiques (acide 3,4-dihydroxyphénylacétique 3,4DHPAA, acide 3-hydroxyphénylacétique 3HPAA), ainsi qu’en formate, acétate, butyrate, etc. et divers produits intermédiaires tel le phloroglucinol. La bactérie fécale responsable du clivage du rutoside a été identifiée comme étant Eubacterium ramulus[9].
Une fois absorbés, ces métabolites sont conduits par le sang dans le foie et les reins où ils subissent une méthylation et une glucuronisation.
 Voie métabolique du rutoside, d'après Olthof et als. 2003 et les réf. citées | |
|
Les métabolites en acides phénylacétiques ont une moindre activité anti-oxydante que les composés dont ils sont issus. De plus, seul le 3,4DHPPAA montre une activité antiproliférative sur les cellules du cancer du côlon et de la prostate. [10],[11],[12].
Activités biologiques
De nombreuses études ont montré que le rutoside était capable de piéger les radicaux libres[13], d’être doté d’une puissante activité anti-oxydante[8],
d’avoir des effets anti-inflammatoires[14],
d’avoir des propriétés anticancéreuses[15],[16]
et de réduire la cytotoxicité de la lipoprotéine LDL (le mauvais cholestérol) oxydé[17].
L’activité anti-oxydante du rutoside est du même ordre de grandeur que celle du quercétol, elle est moindre que celle du myricétol et supérieure à celle du kaempférol[18] : Myricétol > Quercétol, Rutoside > Kaempférol.
Sawa et als.(1999)[19] ont montré que la puissante activité de piégeur de radicaux libres in vitro du rutoside pourrait jouer un rôle dans la protection contre quelques cancers.
Une étude de Koda et als. (2008)[20]a établi que le rutoside avait un effet protecteur contre les déficits de mémoire spatiale induite chez le rat par la perte de cellules pyramidales de la région CA3 de l’hippocampe.
Utilisations diététiques et thérapeutiques
De nombreuses études épidémiologiques ont montré que la consommation régulière de fruits et légumes riches en flavonoïdes était clairement liée à une diminution des risques de maladies cardiovasculaires, neurologiques et cancéreuses[21].
L’identification des principes actifs permettra de passer de la diététique aux utilisations thérapeutiques. Mais pour l’instant, la majorité des études étant des tests biochimiques in vitro ou des études de pharmacologie animale, les essais chez l’homme trop rares ne permettent pas d’établir la réelle efficacité clinique des composés flavonoïques.
Une étude de Bamigboye et Hofmeyr[22] (2006) a montré que la prise de comprimés de rutoside par des femmes enceintes pouvait améliorer les symptômes associés aux œdèmes des membres inférieurs et aux varices. Une réduction de l’œdème de la patte a aussi été obtenue chez la souris souffrant d’arthrite septique[23]. L'efficacité du composé pourrait provenir d'une inhibition de la production de NO par les macrophages et de la prolifération des lymphocytes T.
Une étude pilote[24] a montré les effets bénéfiques de la prise orale de rutoside et d’acide ascorbique sur le purpura progressif pigmenté.
Jean Bruneton[5] résume les utilisations thérapeutiques du rutoside, seul ou associé (esculoside, citroflavonoïdes, acide ascorbique, etc.) en quatre types d’emplois :
- dans les manifestations fonctionnelles de l’insuffisance veinolymphatique,
- dans le traitement symptomatique des troubles fonctionnels de la fragilité capillaire,
- dans le traitement des signes fonctionnels liés à la crise hémorroïdaire,
- en cas de baisse d’acuité et de troubles du champ visuel présumé d’origine vasculaire.
Rutoside et dérivés sont parfois associés à des alcaloïdes (ex. : vincamicine) dans des spécialités proposées pour améliorer certains symptômes au cours du déficit intellectuel pathologique du sujet âgé.
Le rutoside est utilisé dans les industries chimique, cosmétique et d'aliments pour animaux comme pigment naturel et conservateur alimentaire.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) ChemIDplus, « Rutin - RN: 153-18-4 », sur chem.sis.nlm.nih.gov, U.S. National Library of Medicine (consulté le )
- http://phenol-explorer.eu/contents/polyphenol/296?utf8=%E2%9C%93&options%5Blist_format%5D=list&options%5Bsort_by%5D=by_average&options%5Bempty_rows%5D=off&options%5Bunit_type%5D=weight
- (en) Fereidoon Shahidi, Marian Naczk, Phenolics in Food and Nutraceuticals, CRC Press, (ISBN 1-58716-138-9)
- Bruneton, J., Pharmacognosie - Phytochimie, plantes médicinales, 4e éd., revue et augmentée, Paris, Tec & Doc - Éditions médicales internationales, , 1288 p. (ISBN 978-2-7430-1188-8)
- Dr. Duke's Phytochemical and Ethnobotanical Databases
- (en) Jianxiong Yang, Juan Guo, Jiangfeng Yuan, « In vitro antioxidant properties of rutin », LWT - Food Science and Technology, vol. 41, , p. 1060-1066 (doi:10.1016/j.lwt.2007.06.010)
- (en) Schneider, H., Schwiertz, A., Collins, M.D., Blaut, M., « Anaerobic transformation of quercetin-3-glucoside by bacteria from the human intestinal tract », Archives of Microbiology, vol. 171, , p. 81-91
- (en) Winter J., Lilian H.M.,Dowel V.R., Bokkenheuser V.D., « C-ring cleavage of flavonoids by human intestinal bacteria », Applied and Environmental Microbiology, vol. 55, , p. 1203-1208
- (en) M.R. Olthof, P.C. Hollman, M.N.C.P. Buijsman, J.M.M. van Amelsvoort and M.B. Katan, « Chlorogenic acid, quercetin-3-rutinoside and black tea phenols are extensively metabolized in humans », J. Nutr., vol. 133, , p. 1806-1814
- (en) Jaganath IB, Mullen W, Edwards CA, Crozier A., « The relative contribution of the small and large intestine to the absorption and metabolism of rutin in man. », Free Radical Research, vol. 40, no 10, , p. 1035-1046
- (en) Kandaswami C, Middleton E., « Free radical scavenging and antioxidant activity of plant flavonoids. », Adv Exp Med Biol, no 336, , p. 351-76
- (en) Guardia T, Rotelli AE, Juarez AO, Pelzer LE, « Anti-inflammatory properties of plant flavonoids. Effects of rutin, quercetin and hesperidin on adjuvant arthritis in rat. », Farmaco, vol. 56, , p. 683-7
- Deschner EE, Ruperto JF,WongGY, et al, « The effect of dietary quercetin and rutin on AOM-induced acute colonic epithelial abnormalities in mice fed a high-fat diet », Nutr Cancer, vol. 20, , p. 199-204
- Jing-Pin Lina, Jai-Sing Yangb, Chi-Cheng Luc, Jo-Hua Chiangc, Chang-LinWud, Jen-Jyh Line, Hui-Lu Linf, Mei-Due Yangg, Kuo-Ching Liuh, Tsan-Hung Chiui, Jing-Gung Chungd, « Rutin inhibits the proliferation of murine leukemia WEHI-3 cells in vivo and promotes immune response in vivo », Leukemia Research, (doi:10.1016/j.leukres.2008.09.032)
- (en) Milde, J., Elstner, E. F., & GraXmann, J., « Synergistic inhibition of low-density lipoprotein oxidation by rutin, g-terpinene, and ascorbic acid », Phytomedicine, vol. 11, , p. 105-113
- (en) Jessica Tabart, Claire Kevers, Joël Pincemail, Jean-Olivier Defraigne et Jacques Dommes, « Comparative antioxidant capacities of phenolic compounds meausured by various tests », Food Chemistry, vol. 113, , p. 1226-1233
- (en) Sawa, T., Nakao, M., Akaike, T., Ono, K, and Maeda, H., « Alkylperoxyl radical scavenging activity of various flavonoids and other phenolics compounds : implication for the antitumor-promoter effects of vegetables », Journal of agricultural and food chemistry, vol. 47, , p. 397-402
- (en) Tomoko Koda, Yoshiki Kuroda, Hideki Imai, « Protective effect of rutin against spatial memory impairment induced by trimethyltin in rats », Nutrition Research, vol. 28, , p. 629-634
- (en) Willet, W. C., Eat, drink, and be healthy – The Harvard Medical School guide to healthy eating., New York, Simon and Schuster.,
- (en) Bamigboye A.A., Hofmeyr G.J., « Interventions for leg edema and varicosities in pregnancy. What evidence? », European journal of obstetrics, gynecology, and reproductive biology, vol. 129, no 1, , p. 3-8
- (en) Han Y., « Rutin has therapeutic effect on septic arthritis caused by Candida albicans », International Immunopharmacology,
- (en) Reinhold U, Seiter S, Ugurel S, Tilgen W., « Treatment of progressive pigmented purpura with oral bioflavonoids and ascorbic acid: an open pilot study in 3 patients. », Journal of the American Academy of Dermatology, vol. 41,
Voir aussi
Articles connexes
Liens externes
- Portail de la chimie
- Portail de la médecine