Liaison carbone-azote
En chimie, une liaison carbone-azote est la liaison covalente entre un atome de carbone et un atome d'azote. La liaison carbone-azote est l'une des liaisons les plus abondantes en chimie organique et en biochimie[1].
Le carbone possède quatre électrons de valence et est la plupart du temps tétravalent, sauf dans les cas où il forme un liaison double (alcène, carbonyle, imine, etc.) où il devient trivalent, et les cas plus rares où il forme un liaison triple (alcyne, nitrile) où il devient divalent. Les composés où le carbone porte un doublet libre sont extrêmement rares et en général assez instables.
L'azote possède cinq électrons de valence et dans les amines simples, il est trivalent, portant les deux électrons restant en doublet libre. Par ce doublet libre, l'azote peut former une liaison additionnelle avec un hydrogène (ion ammonium) ou une autre chaine alkyle (ion ammonium quaternaire) et dans ces cas devient tétravalent et porteur d'une charge positive. Beaucoup de composés de l'azote peuvent être potentiellement des bases mais à un degré dépendant de la configuration : l'atome d'azote d'un amide n'est pas basique à cause de la délocalisation du doublet libre pouvant former une liaison double, ou dans la pyrrole ce doublet fait partie du système aromatique.
De façon similaire aux liaisons carbone-carbone, les liaisons carbone-azote peuvent former des liaisons doubles stables, comme dans les imines, et des liaisons triples comme dans les nitriles. La longueur de liaison varie de 147,9 pm pour les amines simples à 147,5 pm pour les composés C-N= tels que le nitrométhane, à 135,2 pm pour les liaisons doubles partielles (cycle aromatique) dans la pyridine et à 115,8 pm pour les liaisons triples dans les nitriles[2].
Une liaison C-N est fortement polarisée et plus localisée du côté de l'azote, (l'électronégativité de C et N sont respectivement de 2,55 et 3,04) et par conséquent, le moment dipolaire d'une telle liaison peut être élevé : 4,27 D pour le cyanamide, 1,5 D pour le diazométhane, 2,17 D pour l'azoture de méthyle et 2,19 D pour la pyridine. Pour cette raison, beaucoup de composés contenant une liaison CN sont hydrosolubles.
Groupes fonctionnels contenant une liaison carbone-azote
| Classe | Ordre de liaison | Formule | Représentation topologique | Exemple | Longueur C–N moyenne (Å)[3] |
|---|---|---|---|---|---|
| amines | 1 | R2C-NH2 |  Méthylamine |
1,469 (amine neutre) 1,499 (sel d'ammonium) | |
| Aziridines | 1 | CH2NHCH2 |  |
 Mitomycine |
1,472 |
| Azotures | 1 | R2C-N3 |  azoture de phényle |
||
| Anilines | 1 | Ph-NH2 | 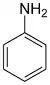 |
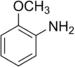 Anisidine |
1,355 (sp2 N) 1,395 (sp3 N) 1,465 (sel d'ammonium) |
| Pyrroles | 1 | 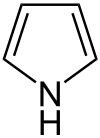 |
 Porphyrine |
1.372 | |
| Amides | 1,2 | R-CO-NR2 | 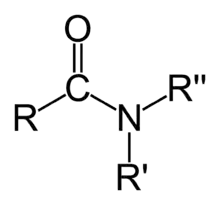 |
 Acétamide |
1,325 (primaire) 1,334 (secondaire) 1,346 (tertiaire) |
| Pyridines | 1,5 | pyr |  |
 Nicotinamide |
1,337 |
| Imines | 2 | R2C=NR |  |
 DBN |
1,279 (C=N) 1.465 (C–N) |
| Nitriles | 3 | R-CN |  Benzonitrile |
1,136 | |
| Isonitriles | 3 | R-NC | TOSMIC |
Notes et références
- Organic Chemistry John McMurry 2d Ed.
- CRC Handbook of Chemistry and Physics 65Th Ed.
- F. H. Allen, O. Kennard, D. G. Watson, L. Brammer, A. G. Orpen. Tables of bond Lengths determined by X-Ray and Neutron Diffraction. Part 1. Bond Lengths in Organic Compounds. J. Chem. Soc. Perkin Trans. II 1987, S1-S19.
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Carbon–nitrogen bond » (voir la liste des auteurs).
Voir aussi
| CH | He | |||||||||||||||||
| CLi | CBe | CB | CC | CN | CO | CF | Ne | |||||||||||
| CNa | CMg | CAl | CSi | CP | CS | CCl | CAr | |||||||||||
| CK | CCa | CSc | CTi | CV | CCr | CMn | CFe | CCo | CNi | CCu | CZn | CGa | CGe | CAs | CSe | CBr | CKr | |
| CRb | CSr | CY | CZr | CNb | CMo | CTc | CRu | CRh | CPd | CAg | CCd | CIn | CSn | CSb | CTe | CI | CXe | |
| CCs | CBa | * | CLu | CHf | CTa | CW | CRe | COs | CIr | CPt | CAu | CHg | CTl | CPb | CBi | CPo | CAt | Rn |
| Fr | CRa | * * |
Lr | Rf | Db | CSg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| ↓ | ||||||||||||||||||
| * | CLa | CCe | CPr | CNd | CPm | CSm | CEu | CGd | CTb | CDy | CHo | CEr | CTm | CYb | ||||
| * * |
Ac | CTh | CPa | CU | CNp | CPu | CAm | CCm | CBk | CCf | CEs | Fm | Md | No | ||||
| Liaison de base en chimie organique | Nombreuses utilisations en chimie |
| Recherche académique, mais pas d'usage courant | Liaison inconnue / non évaluée |
- Portail de la chimie