Organomagnésien
Un organomagnésien est un composé organique présentant une liaison carbone–magnésium. Il s'agit d'une famille de composés organométalliques importante en synthèse organique car elle inclut les réactifs de Grignard, qui sont des organomagnésiens mixtes de la forme R–MgX, où R est une chaîne carbonée et X un halogène, généralement le brome ou le chlore, parfois l'iode — le fluor n'est généralement pas utilisé en raison de la trop faible polarisabilité du difluor F2. Ces réactifs sont couramment employés dans l'industrie et leur découverte à la fin du XIXe siècle par le chimiste français Victor Grignard[1] a permis à ce dernier d'obtenir le prix Nobel de chimie 1912[2] car ils permettent de lier une grande variété de synthons à des molécules organiques.

Outre les réactifs de Grignard, les organomagnésiens comptent des molécules telles que le diméthylmagnésium (CH3)2Mg, le dibutylmagnésium (CH3CH2CH2CH2)2Mg ou l'anthracène-magnésium.
Caractère organométallique des R—Mg—X
Le carbone a une électronégativité forte : . Et on remarque aussi que . Ce fait physique impose donc la polarisation de la liaison C—M : C—M. On remarque une inversion de la polarité des liaisons classiques du carbone : dans un organométallique, le carbone porte une charge (ce carbone est appelé carbanion), d'ailleurs cette liaison est 35% ionique, ce qui permettra par réaction avec par exemple un halogénure d'alkyle (R—X) la création d'une liaison carbone-carbone.
Les organomagnésiens sont une des bases au sens de Brönsted les plus fortes de la chimie organique avec un pKa de l'ordre de 40 à 60. R—Mg—X est un nucléophile puissant.
Synthèse des organomagnésiens
Du fait de leur extrême basicité, les organomagnésiens n'existent pas à l'état naturel. Le bilan global de la synthèse est le suivant:
Mode opératoire
La synthèse des organomagnésiens est délicate : le milieu réactionnel doit être anhydre, en raison des propriétés du produit souhaité ; la réaction est fortement exothermique et le solvant est volatil et inflammable. Une mauvaise manipulation entraîne aussi la création d'un produit parasite — appelé « Couplage de Wurtz ».
Matériel requis :
- Ballon tricol ;
- Ampoule de coulée isobare ;
- Réfrigérant de reflux ;
- Garde à CaCl2 (ou alors travailler sous atmosphère inerte);
- Agitateur magnétique chauffant ;
- Magnésium en copeaux ;
- Éther diéthylique ou THF anhydre ;
- Dérivé halogéné ;
- Bain marie puis eau froide.
Mode opératoire
- Réaliser un montage d'addition avec reflux, avec protection du milieu réactionnel contre l'humidité atmosphérique, et en mettant un barreau aimanté ovoïde dans le tricol.
- Placer dans le tricol les copeaux de magnésium, ayant été au préalable activés au four. Les couvrir de quelques cm3 d'éther éthylique anhydre. Rajouter un petit cristal de diiode.
- Conditionner l'ampoule de coulée avec la solution du dérivé halogéné dans l'éther éthylique anhydre, et la boucher avec un bouchon en verre.
- Verser quelques gouttes de la solution d'halogénure sur les copeaux de magnésium, attendre quelques minutes l'observation d'une décoloration se produisant dans le milieu réactionnel.
- Lorsque la couleur de l'iode a disparu dans le milieu réactionnel, chauffer au bain marie afin d'installer un reflux, et verser l'halogénure lentement et goutte à goutte en agitant magnétiquement.
- Une fois l'addition finie, chauffer à reflux le milieu réactionnel de manière à obtenir une réaction complète.
Commentaires
Pour éviter qu'il se produise un couplage de Würtz entre l'organomagnésien synthétisé et l'halogénure. Dès le début de la réaction, l'éther entre en ébullition : le reflux sert à condenser les vapeurs d'éther qui s'écoulent dans le ballon ; le reflux est lui aussi à maintenir très faible, afin de ne pas créer la réaction parasite citée précédemment. Il n'est pas nécessaire de chauffer tout le long de la manipulation car la réaction est très exothermique.
La solution finalement obtenue est de couleur grisâtre assez claire, en général.
Solvant
L'éther joue ici un rôle double, il solvate l'organomagnésien formé et le stabilise, l'organomagnésien est ici un acide de Lewis, le solvant joue ici le rôle de base de Lewis, ainsi les doublets non liants de l'oxygène vont permettre de stabiliser le centre réactif du magnésium. On peut par exemple utiliser l'éther diéthylique, ou encore le THF — tétrahydrofurane, cf. figure ci-dessous.

Le milieu dans lequel baigne l'organomagnésien doit être complètement anhydre : la réaction eau/RMgX est vive.
Réactivité des organomagnésiens
Sur l'eau
La réaction des organomagnésiens sur l'eau est très vive (c'est une réaction acido-basique : pKa(RH/R-) = 50), et exothermique. C'est pour cela que le mode opératoire impose une déshydratation totale de l'air dans la verrerie, ainsi que des surfaces et solvants. Sauf cas particuliers, cette réaction est considérée comme parasite, et entraîne la destruction de l'organomagnésien.
La réaction de l'organomagnésien sur l'eau est la suivante :
Avec les alcools

Avec les acides carboxyliques

Avec les amines
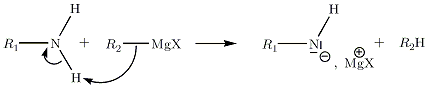
Avec les alcynes terminaux

Substitution nucléophile, exemple de I2
On propose la substitution nucléophile de RMgX sur I2 (la polarité de cette molécule est induite).

Substitution nucléophile avec les dérivés halogénés
Dérivé halogéné: R'-X mécanisme: SN2
R-MgX + R'-X —> R-R' + MgX2
Remarque: fonctionne bien avec R-I et Ar-CH2X car ils sont stabilisés par effet inductif pour R-I et mésomère pour Ar-CH2X
Réaction sur les époxydes
Mécanisme: SN2
Dans l'éther:
R----Mg----X + O(CH2)2 (cycle) → R-CH2-CH2-O-Mg-X
Puis hydrolyse acide H3O+ :
R-CH2-CH2-O-Mg-X + H+ → R-CH2-CH2-OH + MgX+
… sur les aldéhydes et cétones
- Sur les aldéhydes :

La réaction entre les organomagnésiens et les aldéhydes mènent à la formation d'un alcool secondaire, si les chaines R1 et R2 contiennent au minimum un carbone. Si le carbone d'appui du groupement alcool final est asymétrique, c’est-à-dire si les deux chaines R sont différentes, le produit sera composé des deux isomères de configuration R et S.
- Sur les cétones :

Cette réaction conduit à la création d'un alcool tertiaire. Comme pour les aldéhydes, si le carbone formé est asymétrique, on obtient un mélange R/S 50/50 ; ainsi, il n'y a pas de stéréosélectivité. Une étude du mécanisme de la réaction montre qu'en fait il y a un intermédiaire cyclique:

- Cas particulier de la synthèse d'un alcool primaire :

… sur les esters
La réaction est similaire à la réaction sur une cétone. Après hydrolyse, nous obtenons de manière intermédiaire l'hémiacétal;
Celui-ci est instable, il subit une élimination conduisant à une cétone. L'organomagnésien présent va réagir chimiosélectivement avec la cétone avant l'ester, moins réactif car le noyau du carbone de son carbonyle est un peu masqué par les électrons non liants de l'oxygène lié par une liaison simple. Le bilan global de la réaction conduit donc à la formation d'un alcool tertiaire, sans possibilité d'isoler la cétone intermédiaire.
… sur les chlorures d'acyle
La réaction est similaire à la réaction sur une cétone mais plus rapide car le noyau du carbone lié au chlore montre une charge positive plus attirante pour le radical de l'organomagnésien.
R----Mg----X + R'-CO-Cl → R'-CO-R + Cl-Mg-X
La réaction conduit donc à la formation d'une cétone isolable s'il n'y a pas trop d'organomagnésien. Cette cétone instable va réagir avec l'organomagnésien qui se trouve dans le milieu réactionnel selon la réaction suivante : R'-CO-R + RMgX → R-R'COMgX-R et puis sous l'action de H2O on obtient un alcool tertiaire. Si on veut s'arrêter au stade de cétone, il faut opérer à −65 °C
… sur le CO2
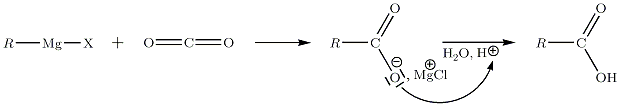
On utilise le dioxyde de carbone à l'état de carboglace. La réaction à −40 °C conduit à la formation d'un acide carboxylique R-COOH.
Notes et références
- Victor Grignard, « Sur quelques nouvelles combinaisons organométalliques du magnésium et leur application à des synthèses d'alcools et d'hydrocarbures », Comptes rendus hebdomadaires des séances de l'Académie des sciences, vol. 130, , p. 1322-1325 (lire en ligne)
- (en) « The Nobel Prize in Chemistry 1912 » (consulté le ).