Johann Josef Loschmidt
Johann Josef Loschmidt, né le à Počerny, village de Bohême proche de la célèbre station thermale de Carlsbad ou Karlovy Vary, et mort le à Vienne, était un physicien et chimiste autrichien. On lui doit les premières modélisations moléculaires à l'occasion desquelles il introduit les symboles des double et triple liaisons ainsi que la possibilité de l'existence de molécules cycliques et hétérocycliques. Il a réalisé la première détermination du nombre d'Avogadro qui sera affinée par James Clerk Maxwell, puis par Jean Perrin. Par sa rigueur intellectuelle et par ses qualités humaines, il a eu une influence décisive sur Ludwig Boltzmann, son jeune collègue enseignant-chercheur à l'Institut de Physique de l'Université de Vienne.
Biographie
Josef Loschmidt (il n'emploiera que son deuxième prénom) était originaire la région des Sudètes qui faisait partie de l'Empire Austro-Hongrois et qui, à l'heure actuelle, constitue la Région de Karlovy Vary en République tchèque. Il est né dans une famille d'agriculteurs pauvres. Sur recommandation de l'abbé Adalbert Czech, il est scolarisé, entre 1833 et 1837, au monastère piariste de Schlackenwerth (Ostrov nad Ohří, en tchèque), près de Prague. Il peut ensuite s'inscrire à l'Université Charles de Prague en 1839 pour y étudier la philosophie et les mathématiques. Il arrive dans cette université en même temps que son professeur de philosophie, Franz Serafin Exner qui sera son second mentor. Ce dernier lui suggère d'appliquer les méthodes mathématiques aux problèmes psychologiques. Bien que ce projet échoue, Loschmidt devient un bon mathématicien. En 1841, il s'inscrit à l'Institut de Polytechnique de Vienne dont il sort, en 1846, avec un diplôme de chimie et de physique équivalent à la licence[1].
Ne parvenant pas à obtenir un poste universitaire, il fonde, avec un ami, une société de fabrication de nitrate de potassium à Vienne. Mais la société fait faillite en 1849. Il fait divers métiers en Styrie, en Bohême, et en Moravie avant de revenir à Vienne. En 1856, il devient professeur dans une école secondaire viennoise où il enseigne les mathématiques, la physique, la chimie et la comptabilité, tout en commençant ses recherches en chimie. En 1866, Josef Stefan, percevant l'importance de ses projets, lui ouvre les portes de l'Institut de Physique.
C'est à l'Institut de Physique de la rue Erdberg, dirigé par Josef Stefan, à l'université de Vienne qu'il rencontre, entre 1866 et 1869, son jeune collègue Ludwig Boltzmann, qui devient son ami et sur qui il exerce une grande influence. Loschmidt est nommé professeur-assistant en 1868. Un doctorat honoraire lui est conféré en 1869 ce qui lui permet d'accéder à la chaire de chimie physique en 1872 et de prendre la direction du Laboratoire de Chimie physique en 1875. En 1877 il est élu Doyen de la Faculté. Il est élu membre de l' Académie autrichienne des sciences[2].
En 1887, à l'âge de 66 ans, Josef Loschmidt épouse Karoline Mayr (1846-1930), sa femme de ménage de longue date. Peu de temps après, naît Josef, «notre enfant unique» (inscription sur la pierre tombale), décédé en 1898, trois ans après son père. Cependant, le quatrième et dernier nom figurant sur la pierre tombale est celui d'une "Karoline Mayr (1885-1950), qui est donc née deux ans avant leur fils Josef. La tombe de la famille Loschmidt se trouve dans le cimetière central de Vienne.
Josef Loschmidt prend sa retraite de professeur en 1891. Il meurt à Vienne en 1895. Ludwig Boltzmann prononce son éloge funèbre devant l'Académie des sciences. Il évoque ses deux mentors: Josef Stefan et Josef Loschmidt[3]:
« Parce qu'ils étaient sans prétention aucune, de par leur simplicité et leur modestie, ils se ressemblaient beaucoup. Ils n'essayaient jamais de faire montre de leur supériorité intellectuelle. Pendant les longues années que je passai auprès d'eux, d'abord comme étudiant, puis comme assistant, ils me traitèrent toujours comme un ami. Leur sérénité olympienne et leur humour si fin, qui faisaient des discussions les plus âpres un divertissement ludique pour les étudiants, me marquèrent au point d'influencer ma manière d'être. »
Travaux
En 1861, Loschmidt publie à ses frais un petit livre intitulé Études chimiques. Le livre contient deux parties. La première intitulée Représentation graphique des formules constitutionnelles de la chimie organique. La seconde partie intitulée Sur la loi de Mariotte. Le texte est suivi de 7 feuilles pliées sur lesquelles sont dessinées les modèles de molécules, certaines connues, d'autres seulement possibles. Le livre a été réimprimé en 1912 avec les figures intégrées au texte. Cet ouvrage expose deux avancées révolutionnaires: la description de la structure des molécules chimiques et la première approche de la détermination du nombre d'Avogadro[4].
Contexte de la parution des Études Chimiques (1861)
Dans la première partie de son ouvrage, Loschmidt décrit 368 molécules (dont 121 aromatiques) à l'aide de ses formules constitutionnelles, encore très bien comprises par les chimistes aujourd'hui, montrant la disposition spatiale des atomes[5], ce qui fait que certains le considèrent comme le père de la modélisation moléculaire[2]. D'autres affirment qu'il a écrit le premier traité de chimie organique illustrée[4]. Pourtant, quand il publie son travail, Loschmidt n'est qu'un petit professeur de l'enseignement secondaire qui n'est pas docteur ès-sciences, que personne ne connait. Il n'a donc aucune chance de publier son travail dans une revue scientifique de bon niveau. Mais le fait qu'il ne soit pas universitaire est aussi un avantage: il n'est pas soumis à la philosophie dominante concernant la signification des formules chimiques introduites par Berzelius. L'année même où parait Études Chimiques, August Kekulé, le pape de la chimie européenne (il enseigne alors à l'Université de Gand), publie son Traité de chimie organique dans lequel il écrit[6]:
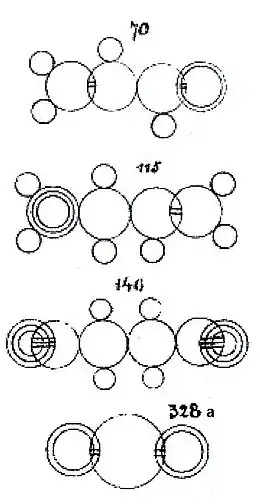
Fig. 115, Allylamine;
Fig. 140, Ethanedinirile (cyanogène);
Fig. 328a, Dioxyde de soufre
« On doit garder à l'esprit que les formules rationnelles ne sont que des formules et non des formules de constitution...Elles ne décrivent en aucune façon la position des atomes... Cela doit être clairement souligné parce que, assez malheureusement, certains chimistes croient encore que ces formules décrivent les positions atomiques. »
Loschmidt fait donc partie de ces chimistes hétérodoxes qui n'adhèrent pas aux thèses de Kekulé. Il est difficile de savoir quel impact a eu son livre, pourtant publié chez un éditeur renommé. Loschmidt fait référence explicite aux travaux des autres chimistes mais, contrairement aux usages académiques, il ne cite aucune publication dans son ouvrage. En retour, ses confrères font semblant de l'ignorer même s'ils ont lu son exposé. S'il a intitulé son livre Études chimiques I, c'est qu'il a l'intention de publier un second volume, peut-être sur l'isomérie. Cependant, la critique méprisante de son travail par Kekulé semble l'avoir conduit à se détourner définitivement de la chimie et à se consacrer aux problèmes de la physique[2].
Valence et représentation des liaisons doubles et triples
En 1852, le chimiste anglais Edward Frankland introduit le concept d'atomicité pour exprimer la capacité des atomes des différents éléments à se lier avec l'hydrogène. L'atomicité de l'oxygène est 2 (OH2), celle de l'azote est 3 (NH3) et celle du carbone est 4 (CH4). En 1857, Kekulé reconnait que les atomes de carbone sont capables de former une chaîne (CCCC) qu'Archibald Couper propose d'écrire (-C-C-C-C-) en introduisant des traits pour figurer les liaisons. Mais comment écrire la molécule d'éthylène C2H4? C'est là qu'intervient Loschmidt.
Tout d'abord, pour rendre compte de la capacité des atomes à former des liaisons, Loschmidt remplace le concept d'atomicité par celui de valence qu'il nomme Pollenz et qui ne sera nommé Valenz par Hermann Wichelhaus qu'en 1868. Ce concept lui permet de symboliser pour la première fois les liaisons doubles ou triples avec deux ou trois traits parallèles, comme il est courant de les représenter aujourd'hui[7].
Il représente le carbone par un simple cercle, l'oxygène par deux cercles concentriques et l'azote par trois cercles concentriques. Ces trois atomes sont représentés de même taille. L'hydrogène est représenté par un cercle plus petit et le soufre par un cercle plus grand. Dans les liaisons simples, les cercles sont juxtaposés. Dans les liaisons multiples, les cercles se chevauchent et de façon plus importante pour les liaisons triples que pour les liaisons doubles. Il considère donc que la distance inter-atomique varie et que les atomes sont capables de partager leur espace propre avec leurs voisins de façon d'autant plus importante que le nombre de liaisons impliquées est plus grand.
Représentation des molécules cycliques
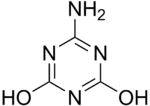
Loschmidt innove en osant représenter des molécules cycliques. Il dessine l'ozone comme une molécule formée de trois atomes d'oxygène liés deux à deux par des liaisons simples, ce que les contraintes d'angles de valence ne permettent pas. Il décrit également la structure du cyclopropane, qui ne sera découvert que 21 ans plus tard par August Freund. Il décrit aussi une vingtaine de molécules plus ou moins complexes mettant en jeu des cycles 1,3,5-triazine, comme l'acide cyanurique, la mélamine ou l'ammélide.
Il écrit qu'il est probable que les radicaux phényles aient une constitution similaire à celle du cyclopropane. Il propose donc un modèle de benzène constitué de deux groupes allyles superposés, reprenant la structure en feuillets évoquée auparavant par Kekulé. Ne trouvant pas de solution satisfaisante, il décrit les composés aromatiques en représentant le noyau phényle par un grand cercle, une sorte de super-atome de valence 6.
Qui a découvert la structure cyclique du benzène ?
Il existe une controverse sur la paternité de la découverte de la structure cyclique du benzène: est-ce bien August Kekulé qui en est l'auteur, ou bien s'est-il fortement inspiré des idées de Loschmidt ?
Travaux de Kekulé
August Kekulé, inventeur de la tetratomicité du carbone, de la distinction entre les corps gras, composés d’enchaînements linéaires d'atomes de carbone, et les corps aromatiques, a d'abord proposé une structure linéaire du benzène en 1859, puis une structure cyclique en feuillets en 1865[8], puis un hexagone régulier en 1866[9], avant d'aboutir, en 1872, à une structure cyclique dans laquelle les doubles liaisons sont mobiles[10]. Les figures de composés aromatiques qu'il publie en 1865 ne sont pas des modèles moléculaires comme ceux de Loschmidt. Ce sont des schémas de principe dans lesquels il représente les atomes par des bâtonnets (ce que ses contemporains appelleront les saucisses de Kekulé). Il affirme: « Je conserve la forme que j'avais adoptée en 1859... Cette forme me parait préférable aux modifications proposées par MM. Loschmidt et Crum-Brown (note 2). » Dans une lettre à Emil Erlenmeyer, Kekulé traite les modèles de Loschmidt de Confusionsformeln, c'est-à-dire de Formules confusionnelles au lieu de Formules constitutionnelles.
Cependant, on peut noter qu'il utilise la représentation des liaisons doubles introduite par Loschmidt et que c'est même cette représentation des liaisons simples et doubles alternées qui constituent le cœur de sa représentation[8]:
« Lorsque plusieurs atomes de carbone se combinent entre eux, ils peuvent se réunir de manière qu'une des quatre affinités de chaque atome se sature par une affinité de l'atome voisin. C'est ainsi que j'ai expliqué l'homologie et, en général, la constitution des substances grasses.
Or, on peut admettre de même que plusieurs atomes de carbone se réunissent en se combinant par deux affinités contre deux.On peut aussi admettre encore qu'ils se combinent alternativement par une et par deux affinités.
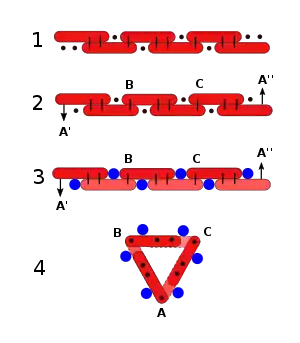
Si le premier mode explique la composition des substances grasses, le second rend compte de la constitution des substances aromatiques, ou au moins du noyau qui leur est commun à toutes. En effet, six atomes de carbone, en se combinant d'après cette loi,de symétrie donneront un groupe, lequel, considéré comme une chaîne ouverte, aura encore huit affinités non saturées (Fig. 1). Si l'on admet, au contraire, que les deux atomes qui terminent cette chaîne se combinent entre eux, on aura une chaîne fermée possédant encore six affinités non saturées (Fig. 2). »
« Je dois faire remarquer que, pour la chaîne fermée C6A6, j'ai préféré conserver la ligne horizontale, et que j'ai représenté par des flèches les affinités (terminantes) qui sont censées se saturer mutuellement. Les points des deux premières formules indiquent les affinités non saturées (note 2). »
La fermeture de la chaîne n'est concevable que dans un plan perpendiculaire au plan de la page. Kekulé n'indique pas comment la chaîne, qu'il représente composée de bâtons, peut se courber. Roth propose que les deux couples d'atomes situés à chaque extrémité de la chaîne pivotent autour des liaisons simples B et C, de telle sorte que les "affinités" libres A' et A" se combinent en A (Fig. 4)[11].

Cette découverte a une portée considérable pour le développement de la chimie organique. En 1890, la Société allemande de chimie organise un symposium en l'honneur de Kekulé pour célébrer le 25ème anniversaire de sa publication sur le benzène. Ce congrès est connu sous le nom de Benzolfest. À cette occasion, Kekulé déclare que l'idée du benzène comme d'une molécule annulaire lui est venue à la suite d'un rêve dans lequel un serpent se mangeait la queue, ce qui correspond au symbole antique connu comme le ouroboros[2]. En prenant en compte les anecdotes et les circonstances citées par Kekulé, ce rêve aurait eu lieu en 1862[12].
Kekulé aurait donc acquis en rêve la formule cyclique du benzène, l'année même où il a pris connaissance de l'ouvrage de Loschmidt dans lequel ce dernier représente le noyau phényle comme un cercle? Alfred Bader voit là une concordance dont Sigmund Freud aurait pu analyser la signification: Kekulé a-t-il inconsciemment caché l'origine réelle de son idée sous le couvert d'une histoire onirique? Bader souligne aussi qu'il était difficile pour un professeur allemand célèbre de reconnaître le moindre mérite à un Autrichien inconnu et jugé prétentieux, dans le contexte de l'hostilité croissante entre la Prusse et l'Autriche qui a culminé avec la guerre austro-prussienne de 1866[2].
La mise en cause de l'originalité de la découverte de Kekulé remonte au début du XXe siècle, quand Richard Anschütz, en publiant les œuvres de Kekulé découvre l'importante contribution de Loschmidt, devenue (ou restée) totalement inconnue, et décide de republier une version mise à jour et modernisée de Chemische Studien I[13]. En 1987, F. Kirchof écrit que « l'idée qu'un composé puisse avoir une structure circulaire était totalement inconnue des chimistes de l'époque. Le cercle était le symbole de l'indivisible, de l'atome, et le mérite d'avoir dépeint le noyau C6VI comme un cercle revient indiscutablement à Loschmidt »[2]. Georges Kauffmann souscrit a cette déclaration[4]. Depuis lors, un certain nombre d'historiens et de chimistes pensent que Kekulé s'est inspiré des travaux de Loschmidt, au moins pour la construction du cycle benzénique.
Loschmidt et la formule du benzène
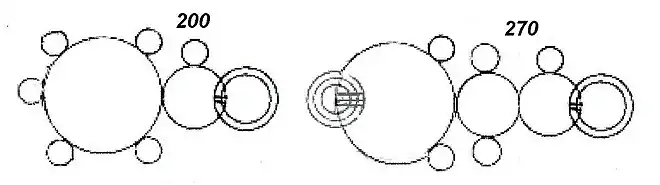
Loschmidt ne décrit pas et ne dessine pas la structure hexagonale du benzène dans son livre Chemische Studien. Il note juste, à propos du cyclopropane, que la structure en anneau « comme on le verra plus loin à propos du phényle, apparaît, dans certains cas, comme la plus acceptable des suppositions ». Il l'a donc envisagé mais ne sait pas comment la dessiner avec la même précision que ces autres modèles. Il propose donc de représenter symboliquement le noyau phényle par un grand cercle, comme un atome hexavalent. Ce qui lui permet de représenter plusieurs molécules aromatiques de façon correcte: benzène, toluène, acide benzoïque, etc. Mais cette représentation conduit aussi à des aberrations comme celle de ce qu'il nomme l'indigo. Ce modèle impliquerait qu'un atome de carbone soit pentavalent (position 4), que deux atomes soient divalents (positions 3 et 5) et que deux atomes soient trivalents (positions 2 et 6). Loschmidt n'a manifestement aucune notion de ce que représente son cercle[11].
En conclusion, August Kekulé est bien le "père du benzène". Il a proposé une structure que Loschmidt n'a pas réussi à conceptualiser. Il y a cependant deux choses surprenantes dans l'histoire de cette découverte.
- La première est que Loschmidt, ayant dessiné en détail et de façon exacte un grand nombre de molécules contenant le cycle 1,3,5-triazide, n'ait pas réalisé lui-même qu'en échangeant les atomes d'azote par des atomes de carbone, il aurait obtenu une molécule benzénique tout à fait défendable.
- La deuxième est que Kekulé, obsédé par la structure du benzène, n'ait pas fait immédiatement, en regardant les modèles de Chemische Studien, la découverte qu'aurait dû faire Loschmidt. Son mépris pour son collègue autrichien l'a empêché de lire et d'accorder le moindre crédit aux formules constitutionnelles de Loschmidt... mais il les a vues. Ce qui lui a permis de concrétiser, quatre ans après la publication de Loschmidt, une formule du benzène qui ressemble fortement à celle des 1,3,5-triazides.
Nombre de Loschmidt
En 1811, Amedeo Avogadro avait émis l'idée selon laquelle le volume d'une certaine quantité d'un gaz devait être proportionnel au nombre de molécules contenues dans ce volume. En 1865, dans la seconde partie de son ouvrage Etudes chimiques, Josef Loschmidt calcule la première approximation du nombre de molécules d'air par unité de volume. Il estime qu'il y a 1,81 × 1024 molécules par m3 d'air. Ce nombre est réestimé à 1,9 × 1025 par Maxwell qui l'appelle Constante de Loschmidt [14]. En 1909, Jean Perrin[15] a calculé le nombre de molécules contenues dans une mole de gaz et l'a appelé Nombre d'Avogadro : NA= 6,02 × 1023. Sachant qu'une mole de gaz occupe 22,4 l dans les conditions normales de température et de pression, la constante de Loschmidt est égale à L=2,69 × 1025 m−3. Cette découverte de Loschmidt fut très importante pour le jeune Boltzmann. Elle consolida ses conceptions atomistes et son approche probabiliste de sa théorie de la chaleur.
Taille des molécules d'air
En 1866, il détermine la taille des molécules constituant l'air. Il s'appuie sur les mesures et les calculs précédents de Rudolf Clausius et de James Clerk Maxwell. Il aboutit à un ordre de grandeur du diamètre des molécules d'air de 10−9 m. C'est un calcul remarquable puisqu'on sait aujourd'hui que le diamètre moléculaire du dioxygène est 0,29 × 10−9 m et que celui du diazote est 0,31 × 10−9 m.
Principales publications
- (de) Josef Loschmidt, Chemische Studien I, A. Constitutions-Formeln der organischen Chemie in graphischer Darstellung ; B. Das Mariotte'sche gesetz (Etudes chimiques; A. Représentation graphique des formules constitutionnelles de la chimie organique; B. La loi de Mariotte), Vienne, Carl Gerold's Sohn, , 53 p. (lire en ligne)
- (de) Richard Anschütz, « Josef Loschmidt, Chemische Studien I, A. Constitutions-Formeln der organischen Chemie in graphischer Darstellung ; B. Das Mariotte'sche gesetz », Ber. Deut. Chem. Ges., Vol. 45, , p. 539-600?
- (de) Josef Loschmidt, « Zur Grösse der Luftmolecüle (Sur la taille des molécules d'air) », Sitzungsberichte der kaiserlichen Akademie der Wissenschafften Wien, 52, Vol. II,, , p. 395-413 (lire en ligne)
- (en) Josef Loschmidt, traducteurs, William Porterfield and Walter Kruse, « On the size of air molecules », Journal of Chemical Education, 72 (10), , p. 870-875 (lire en ligne)
Hommages

- The Joseph Loschmidt Prize donné par la Royal Society of Chemistry[16]
- The Josef Loschnmidt medal attribuée par la Gesellschaft Österreichischer Chemiker (GÖCH), la Société Autrichienne de Chimie[17]
- Symposium en l'honneur de Josef Loschmidt tenu à Vienne en Autriche du 25 au [18].
- En 1995, un timbre commémoratif a été émis par la poste autrichienne à l'occasion du centenaire de la mort de Josef Loschmidt.
- Plaque commémorative et buste en pierre claire à l'Université de Vienne.
- Plaque commémorative sur son lieu de naissance à Pocerny.
- Plaque en bronze avec portrait (conçue par le professeur Ferdinand Welz) sur la dernière maison habitée par Loschmidt à Vienne, Lacknergasse 79, entre 1890 et 1895.
- 2003, Plaque en bronze avec portrait, créée par Mikos Armulidis dans l'ancien monastère d' Ostrov nad Ohří (en allemand : Schlackenwerth), où il a été à l'école entre 1833 et 1837.
Voir aussi
- Robert Knott, Loschmidt, Johann Joseph dans Allgemeine Deutsche Biographie (Biographie générale allemande) Vol.52, Leipzig, Duncker & Humblot, (lire en ligne), p. 82-84
- Franziska Seidl, Loschmidt, Johann Joseph dans Österreichisches Biographisches Lexikon 1815–1950 (Lexique biographique autrichien 1815-1950) Vol.5, Leipzig, Académie autrichienne des sciences, (lire en ligne), p. 326-327
- (de) Claus Priesner, Loschmidt, Johann Joseph dans Neue Deutsche Biographie (Nouvelle biographie allemande) Vol.15, Berlin, Duncker & Humblot, , 783 p. (ISBN 3-428-00196-6, lire en ligne), p. 195-196
- Peter M. Schuster, From Curiosity to Passion: Loschmidt's Route from Philosophy to Natural Science in [18]
- (en) S. Ramasesha, « Experimental determination of the Avogadro constant », Resonance, , p. 79-87 (lire en ligne)
Références
- (en) Alfred Bader and Leonard Parker, « Joseph Loschmidt, Physiscist and Chemist », Physics Today 54 (3), , p. 45 (lire en ligne)
- (en) Alfred Bader, « Josef Loschmidt, the Father of molecular modelling », Royal Institution Proceedings, Vol. 64,, 1995?, p. 197-205 (lire en ligne)
- (de) Ludwig Boltzmann, Populäre Schriften, Leipzig, 1905, J. A. Barth, reprinted by Friedr. Vieweg & Sohn, Wiesbaden., , “Zur Erinnerung an Josef Loschmidt,”(En souvenir de Josef Loschmidt) une eulogie présentée à l'Académie Impériale des Sciences de Vienne le 29 octobre 1895
- (en) George B. Kauffman, « J. Loschmidt's Konstitution-Formeln der organischen Chemie in graphischer Darstellung », J. Chem. Educ. 66 (11), , A281 (lire en ligne)
- (en) « Josef Loschmidt. Structural formulae.1861 », sur www.ch.ic.ac.uk, (consulté le )
- (de) August Kekulé, Lerbuch der Organischen Chemie (Traité de Chimie Organique), Erlangue, Ferdinand Enke,
- Jean-Claude Baudet, Histoire de la chimie, Louvain-la-Neuve, de Boeck Supérieur, , 354 p. (ISBN 978-2-8073-0692-9, lire en ligne), p. 172
- August Kekulé, « Sur la constitution des substances aromatiques », Bull. Soc. Chim. Paris, Vol.3, , p. 98-110 (lire en ligne)
- (de) August Kekulé, « Untersuchungen über aromatische Verbindungen », Ann. Chem. Pharm. Vol.137, , p. 129-136 (lire en ligne)
- (de) August Kekulé, « Ueber einige Condensationsproducte des Aldehyds », Liebigs Ann. Chem. 162 (1), , p. 77–124 (lire en ligne)
- (en) Heinz D. Roth, « 150 years after their emergence: a new look at Loschmidt's representations of benzene », Bulletin for the History of Chemistry, vol. 38, no 1, , p. 29-36 (lire en ligne [PDF])
- Jean Gillis, « Auguste Kekulé et son oeuvre, réalisée a Gand de 1858 à 1867 », Memoires de l'Academie Royale de Belgique, vol. 37, no 1, , p. 1–40
- (de) Richard Anschütz, « Josef Loschmidt, Chemische Studien I, A. Constitutions-Formeln der organischen Chemie in graphischer Darstellung ; B. Das Mariotte'sche gesetz », Ber. Deut. Chem. Ges., Vol. 45, , p. 539-600?
- Eduardo Arroyo Pérez, Boltzmann et l'entropie, Paris, RBA France, , 159 p. (ISBN 978-2-8237-0235-4), p. 45
- Jean Perrin, « Mouvement brownien et réalité moléculaire », Annales de Chimie et de Physique sér.8, 18, , p. 5-114
- (en) « Josef Loschmidt award », sur www.rsc.org, (consulté le )
- (en) « Autrian Chemical Society », sur www.goech.at, (consulté le )
- (en) Fleischhacker and T. Schönfeld (Editors), Pioneering Ideas for the Physical and Chemical Sciences, Proceedings of the Josef Loschmidt Symposium, held in Vienna, Austria, June 25–27, 1995, New York, Plenum Press, , 320 p. (ISBN 0-306-45684-2, lire en ligne)
Liens externes
- Robert Knott: Loschmidt, Johann Joseph. Dans: Biographie générale allemande (ADB). Volume 52, Duncker & Humblot, Leipzig 1906, p. 82-84.
- Seidl: Loschmidt Johann Josef. Dans: Lexique biographique autrichien 1815-1950 (ÖBL). Volume 5, publié par l'Académie autrichienne des sciences, Vienne 1972, page 326 et suivantes. (Liens directs à la page 326, p. 327).
- Claus Priesner: Loschmidt, Johann Joseph. Dans: Nouvelle biographie allemande (NDB). Volume 15, Duncker & Humblot, Berlin 1987, (ISBN 3-428-00196-6), p. 195 et suiv. (Numérisé).
- Peter M. Schuster: From Curiosity to Passion: Loschmidt's Route from Philosophy to Natural Science, in: W. Fleischhacker and T. Schönfeld (Editors): Pioneering Ideas for the Physical and Chemical Sciences, Proceedings of the Josef Loschmidt Symposium, held in Vienna, Austria, June 25–27, 1995; Plenum Press, 1997, New York. - (ISBN 0-306-45684-2)
- Portail de la chimie
- Portail de la physique