Acétylcholinestérase
En enzymologie, une acétylcholinestérase est une hydrolase qui catalyse la réaction :
| Acétylcholinestérase | ||
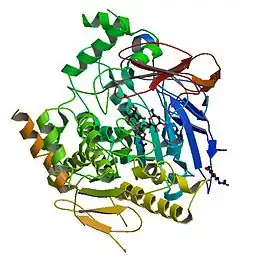 Structure d'une acétylcholinestérase humaine (PDB 1B41[1]) | ||
| Caractéristiques générales | ||
|---|---|---|
| Symbole | ACHE | |
| N° EC | 3.1.1.7 | |
| Homo sapiens | ||
| Locus | 7q22.1 | |
| Masse moléculaire | 67 796 Da[2] | |
| Nombre de résidus | 614 acides aminés[2] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
Ces enzymes assurent le clivage de l'acétylcholine, un neurotransmetteur, en ion acétate et choline dans les synapses, réaction nécessaire pour permettre aux neurones cholinergiques de revenir à l'état de repos après leur activation par des influx nerveux, par exemple dans les plaques motrices.
On trouve également une protéine de 535 résidus d'acides aminés, N-glycosylée, ayant une activité enzymatique d'acétylcholinestérase (AChE) liée par un glycosylphosphatidylinositol (GPI) à la surface des globules rouges. Le polymorphisme (Yta→Ytb : His353Asn) de cette AChE érythrocytaire est à l'origine des antigènes du système de groupes sanguins Cartwright, système YT (011) antigènes Yta (001) très fréquent et Ytb(002) rare. Gène ACHE, OMIM (en) 112100 , localisé en 7q22.1, fréquences allèliques en Europe : Yta 0.9559, Ytb 0.0441. Lié génétiquement au gène Kell, lod score de 3.48 pour Θ = 0.28, soit une distance de 28 centimorgans. Un épissage au niveau du quatrième exon fait qu'au niveau C-terminal cette protéine peut être ancrée par un GPI à la surface de l'érythrocyte, mais pas sur le tissu nerveux[3].
| N° EC | EC |
|---|---|
| N° CAS |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Notes et références
- (en) G. Kryger, M. Harel, K. Giles, L. Toker, B. Velan, A. Lazar, C. Kronman, D. Barak, N. Ariel, A. Shafferman, I. Silman et J. L. Sussman, « Structures of recombinant native and E202Q mutant human acetylcholinesterase complexed with the snake-venom toxin fasciculin-II », Acta Crystallographica. Section D, Biological Crystallography, vol. 56, no Pt 11, , p. 1385-1394 (PMID 11053835, DOI 10.1107/S0907444900010659, lire en ligne)
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- Geoff Daniels, Human Blood Groups, 2e édition, Blackwell Publishing.
- (en) Yves Bourne, Palmer Taylor, Pierre E. Bougis et Pascale Marchot, « Crystal Structure of Mouse Acetylcholinesterase – A Peripheral Site-Occluding Loop in a Tetrameric Assembly », Journal of Biological Chemistry, vol. 274, no 5, , p. 2963-2970 (PMID 9915834, DOI 10.1074/jbc.274.5.2963, lire en ligne)
- (en) Florian Nachon, Oluwatoyin A. Asojo, Gloria E. O. Borgstahl, Patrick Masson et Oksana Lockridge, « Role of Water in Aging of Human Butyrylcholinesterase Inhibited by Echothiophate: The Crystal Structure Suggests Two Alternative Mechanisms of Aging », Biochemistry, vol. 44, no 4, , p. 1154-1162 (PMID 15667209, DOI 10.1021/bi048238d, lire en ligne)
- Portail de la biochimie
