Récepteur Fc
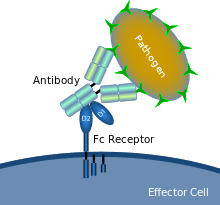
Un récepteur Fc est une protéine présente à la surface de certaines cellules —dont les lymphocytes B, les cellules dendritiques folliculaires, les lymphocytes NK, les macrophages, les neutrophiles, les éosinophiles, les basophiles, les thrombocytes et les mastocytes— qui contribuent aux fonctions protectrices du système immunitaire. Son nom est dérivé de sa liaison spécifique à une partie des anticorps connue sous le nom de région Fc (Fragment cristallisable). Les récepteurs Fc se lient aux anticorps qui sont attachés aux cellules infectées ou aux pathogènes les envahissant. Leur activité stimule la destruction des microbes par des cellules phagocytes ou cytotoxiques, ou celle des cellules infectées par phagocytose ou cytotoxicité à médiation cellulaire dépendante des anticorps. Certains virus tels que les flavivirus utilisent les récepteurs Fc pour infecter les cellules, par un mécanisme connu sous le nom de facilitation dépendante des anticorps[1].
Classes
Il existe plusieurs types de récepteurs Fc (en abrégé FcR), qui sont classés en fonction du type d'anticorps qu'ils reconnaissent. La lettre latine utilisée pour identifier un type d'anticorps est remplacée par la lettre grecque correspondante, après " Fc " pour former le nom du récepteur. Par exemple, ceux qui se lient le plus communément à la classe des anticorps IgG, sont appelés récepteurs Fc-gamma (FcyR) ; ceux qui se lient à IgA sont appelés récepteurs Fc-alpha (FcαR) et ceux qui se lient à IgE sont appelés récepteurs Fc-epsilon (FcεR). On distingue aussi les classes de FcR en fonction des cellules qui les expriment (macrophages, granulocytes, lymphocytes NK, lymphocytes B, cellules T et B) et des propriétés de signalisation de chaque récepteur[2].
Récepteurs Fc-gamma
L'ensemble des récepteurs Fcγ (FcγR) appartiennent à la superfamille des immunoglobulines et les plus importants sont les récepteurs Fc induisant la phagocytose de microbes opsonisés (marqués)[3]. Cette famille comprend plusieurs membres, FcγRI (CD64), FcγRIIA (CD32), FcγRIIB (CD32), FcγRIIIA (CD16a), FcγRIIIB (CD16b), qui diffèrent dans leurs affinités anticorps en raison de leur différente structure moléculaire[4]. Par exemple, FcyRI se lie à IgG plus fortement que FcγRII ou FcγRIII. FcγRI a aussi une partie extracellulaire composé de trois domaines de type immunoglobuline (Ig), soit un de plus que FcγRII ou FcγRIII. Cette propriété permet à FcγRI de se lier à une molécule isolée d'IgG (ou monomère), mais tous les récepteurs Fcγ doivent se lier à plusieurs molécules d'IgG au sein d'un complexe immunitaire pour être activés[5].
Les récepteurs Fc-gamma se distinguent par leur affinité pour les IgG et de la même manière que les différentes sous-classes d'IgG ont des affinités pour chacun des récepteurs Fc gamma. Ces interactions sont de plus régulées par le glycane (oligosaccharides) présent à la position CH2-84.4 des IgG. Par exemple, en créant un encombrement stérique, la fucose contenant des glycanes CH2-84.4 réduit l'affinité des IgG pour FcγRIIIA. En revanche, les glycanes G0, qui manquent de galactose et se terminent par des groupements GlcNAc, ont une affinité accrue pour FcγRIIIA.
Un autre FcR est exprimé sur plusieurs types de cellules et possède une structure similaire à celle du Complexe majeur d'histocompatibilité de classe I. Ce récepteur se lie également aux IgG et est impliqué dans la préservation de cet anticorps[6]. Toutefois, comme ce récepteur Fc est également impliqué dans le transfert des IgG de la mère via le placenta à son fœtus ou via le lait au nourrisson qu'elle allaite, il est appelé récepteur Fc néonatal (FcRn)[7],[8]. Récemment, la recherche a suggéré que ce récepteur joue un rôle dans l'homéostasie des niveaux d'IgG sériques.
Récepteurs Fc- alpha
Un seul récepteur Fc appartient au sous-groupe Fcα , il s'agit de FcαRI (ou CD89)[9]. FcαRI se trouve sur la surface des neutrophiles, des éosinophiles, monocytes, de certains macrophages (y compris les cellules de Kupffer), et de quelques cellules dendritiques. Il est composé de deux domaines extracellulaire de type Ig, et fait partie à la fois de la superfamille des immunoglobulines et de la famille des récepteurs de reconnaissance immunitaire multi-chaîne (MIRR). Il signale en s'associant avec deux FcRy de signalisation des chaînes.[style à revoir] Un autre récepteur peut également se lier aux IgA, même s'il a une plus grande affinité pour un autre anticorps, l'immunoglobuline M[10]. Ce récepteur est appelé récepteur Fc-alpha/mu (Fcα/µR) et est un type I de protéine transmembranaire. Avec un domaine de type Ig dans sa partie extracellulaire, ce récepteur Fc est également un membre de la superfamille des immunoglobulines[11].
Récepteurs Fc-epsilon
Deux types de FcεR sont connus :
- Le récepteur FcεRI de forte affinité est un membre de la superfamille des immunoglobulines (il a deux domaines de type Ig). On trouve FcεRI sur les cellules de Langerhans épidermiques, les éosinophiles, les mastocytes et les basophiles[12],[13] En raison de sa distribution cellulaire, ce récepteur joue un rôle majeur dans le contrôle des réactions allergiques. FcεRI est également exprimé sur les cellules présentatrices de l'antigène, et contrôle la production d'importants médiateurs immunitaires appelées cytokines qui favorisent l'inflammation[14].
- le récepteur de faible affinité FcεRII (CD23) est une lectine de type C. FcεRII a de multiples fonctions qu'il soit liée à la membrane ou comme récepteur soluble ; il contrôle la croissance et la différenciation des cellules B et bloque la liaison IgE des éosinophiles, monocytes et des basophiles[15].
Tableau récapitulatif
| Nom du récepteur | Principal ligand anticorps | Affinité pour le ligand | Cellules concernées | Effet résultant de la liaison aux anticorps |
| FcγRI (CD64) | IgG1 et IgG3 | Forte (Kd ~ 10−9 M) | Macrophages |
Phagocytose Activation cellulaire |
| FcγRIIA (CD32) | IgG | Faible (Kd > 10−7 M) | Macrophages Neutrophiles |
Phagocytose Dégranulation (eosinophiles) |
| FcγRIIB1 (CD32) | IgG | Faible(Kd > 10−7 M) | Lymphocyte B |
Absence de phagocytose Inhibition de l'activité cellulaire |
| FcγRIIB2 (CD32) | IgG | Faible (Kd > 10−7 M) | Macrophages Neutrophiles |
Phagocytose Inhibition de l'activité cellulaire |
| FcγRIIIA (CD16a) | IgG | Faible (Kd > 10−6 M) | NK cells Macrophages (certain tissues) |
Induction de la cytotoxicité à médiation cellulaire dépendante des anticorps (ADCC) Induction de la libération de cytokine release par les macrophages |
| FcγRIIIB (CD16b) | IgG | Faible (Kd > 10−6 M) | Eosinophiles Macrophages |
Induction de la lyse microbienne |
| FcεRI | IgE | Forte (Kd ~ 10−10 M) | Blastocytes Eosinophiles |
Degranulation Phagocytose |
| FcεRII (CD23) | IgE | Faible (Kd > 10−7 M) | Leucocytes B Eosinophiles |
Possible adhésion moléculaire transport d'IgE à travers l'épithelium intestinal |
| FcαRI (CD89) | IgA | Faible (Kd > 10−6 M) | Monocytes Macrophages |
Phagocytose Induction de la lyse microbienne |
| Fcα/μR | IgA et IgM | Forte pour IgM, Moyenne pour IgA | Lymphocytes B Cellules mésangiales |
Endocytose Induction de la lyse microbienne |
| FcRn | IgG | Monocytes Macrophages |
Transfère les IgG de la mère au fœtus via le placenta Transfère les IgG de la mère à l'enfant par le lait |
Fonctions
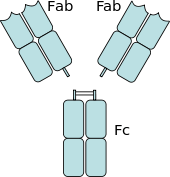
Les récepteurs Fc sont présents sur nombre de cellules du système immunitaire, dont les phagocytes tels que macrophages et monocytes ; les granulocytes tels que neutrophiles, éosinophiles et lymphocytes du système immunitaire inné (lymphocytes NK) ou du système immunitaire adaptatif (par exemple, lymphocytes B)[16],[17],[18]. Ils permettent à ces cellules de se lier aux anticorps qui sont attachés à la surface des microbes ou aux microbes de cellules infectées, en aidant ces cellules à identifier et à éliminer les microbes pathogènes. Les récepteurs Fc lient les anticorps à leur région Fc, une interaction qui active la cellule possédant le récepteur Fc[19]. L'activation des phagocytes est la fonction la plus communément attribuée aux récepteurs Fc. Par exemple, les macrophages commencent à ingérer et à tuer les agents pathogènes enveloppés d'IgG en les phagocytant quand ils se sont liés à leurs récepteurs Fcy[20]. Un autre processus impliquant les récepteurs Fc est appelé cytotoxicité à médiation cellulaire dépendante des anticorps (ADCC). Au cours de l'ADCC, les récepteurs FcγRIII présents sur la surface des lymphocytes NK stimulent la libération de molécules cytotoxiques à partir de leurs granules par les cellules NK, pour tuer les cellules cibles couvertes d'anticorps[21].
FcRI a une fonction différente. FceRI est le récepteur Fc des granulocytes, qui est impliqué dans les réactions allergiques et de défense contre les parasites infectieux. Lorsqu'un certain allergique de l'antigène ou du parasite est présent, la réticulation d'au moins deux des IgE des molécules et de leurs récepteurs Fc sur la surface des granulocytes va activer les cellules pour libérer rapidement les médiateurs préformés de ses granules.
Les mécanismes de signalisation - récepteurs Fc gamma
Activation
Les récepteurs Fc gamma générent des signaux à l'intérieur de leurs cellules via un important motif d'activation appelé Motif d’activation des récepteurs immuns basé sur la tyrosine (ITAM)[22]. Un ITAM est une séquence spécifique d'acides aminés (YXXL) apparaissant deux fois de façon rapprochée dans la queue intracellulaire d'un récepteur. Lorsque des groupes phosphate sont ajoutés à des résidus de tyrosine (Y) de l'ITAM par des enzymes appelées tyrosine kinases, une cascade de signalisation est générée à l'intérieur de la cellule. Cette réaction de phosphorylation suit généralement l'interaction d'un récepteur Fc avec son ligand. Un ITAM est présent dans la queue intracellulaire de FcyRIIA, et sa phosphorylation induit la phagocytose des macrophages. FcyRI et FcyRIIIA n'ont pas d'ITAM mais peuvent transmettre une activation du signal à leurs phagocytes par l'intermédiaire d'une autre protéine. Cette protéine adaptatrice est appelée sous-unité Fcy et, comme FcyRIIA, contient les deux séquences YXXL qui sont caractéristiques d'un ITAM.
Inhibition
La présence d'un seul motif YXXL n'est pas suffisante pour activer les cellules, et représente un motif (I/VXXYXXL) connu comme motif d’inhibition des récepteurs immuns basé sur la tyrosine (ITIM). FcγRIIB1 et FcγRIIB2 présentent des séquences ITIM et sont des inhibiteurs des récepteurs Fc ; ils n'induisent pas de phagocytose. L'action inhibitrice de ces récepteurs est contrôlée par des enzymes qui éliminent les groupes de phosphates à partir de résidus de tyrosine; les phosphatases PTPN6 (en) et INPP5D (en) inhibent la signalisation par les récepteurs Fcγ[23]. La liaison du ligand à FcγRIIB conduit à la phosphorylation de la tyrosine du motif ITAM . Cette modification génère un site de liaison de la phosphatase, un domaine de reconnaissance SH2. L'arrêt du signal d'activation de l'ITAM est causé par l'inhibition des protéines tyrosine kinases de la famille Src, et par hydrolyse de la membrane PIP3, qui interrompt la signalisation aval par les récepteurs d'activation, telles que l'activation par FcγRs, TCR, BCR et les récepteurs de cytokines (par exemple, c-Kit)[24].
La signalisation négative par FcγRIIB est surtout importante pour la régulation des lymphocytes B activés. La signalisation positive des lymphocytes B est initiée par la liaison de l'antigène étranger à la surface des immunoglobulines. Le même anticorps spécifique à l'antigène est sécrété et il peut le supprimer or déclencher un signal négatif. Ce signal négatif est fourni par FcγRIIB[25] : ((en)) Experiments using B cell deletion mutants and dominant-negative enzymes⇔des expériences utilisant des mutations de cellules et des enzymes à dominant négatif ont établi le rôle important dans la signalisation négative du domaine SH2 contenant de l'inositol 5-phosphatase (SHIP). La signalisation négative par SHIP semble inhiber la voie de signalisation Ras par le biais d'une concurrence entre le domaine SH2 et les Grb2 et Shc ; elle peut impliquer la consommation de médiateurs lipides intracellulaires qui agissent comme activateurs d'enzymes allostériques ou qui favorisent l'entrée du Ca2+ extracellulaire[26].
Activation cellulaire
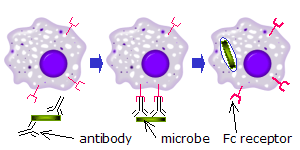
Sur les phagocytes
Lorsque des molécules d'IgG, spécifiques à un antigène ou à des composants membranaires donnés, se lient à l'agent pathogène dans leurs régions Fab (fragment antigen binding région), leurs régions Fc pointent vers l'extérieur, à portée immédiate des phagocytes. Les phagocytes lient ces régions Fc régions avec leurs récepteurs Fc. De nombreuses interactions de faible affinité se produisent entre les récepteurs et les anticorps qui travaillent ensemble pour se lier fermement aux microbes enveloppés d'anticorps. La faible affinité individuelle empêche les récepteurs Fc de se lier aux anticorps en l'absence d'antigène, et, par conséquent, réduit la probabilité de l'activation des cellules immunitaires en l'absence d'infection. Cela empêche également l'agglutination des phagocytess par des anticorps lorsqu'il n'y a pas d'antigène. Après qu'un agent pathogène a été lié, les interactions entre la région Fc de l'anticorps et les récepteurs Fc des phagocytes provoquent l'initiation de le phagocytose. L'agent pathogène est englouti par les phagocytes par un processus actif impliquant la liaison et la libération du complexe région Fc/récepteur Fc, jusqu'à ce que la membrane cellulaire de la phagocyte recouvre entièrement l'agent pathogène[27].
Sur les lymphocytes NK
Les récepteurs Fc sur les cellules NK qui reconnaissent les IgG liées à la membrane d'une cellule-cible infectée par un agent pathogène sont appelées CD16 ou FcγRIII[28]. L'activation de FcγRIII par les IgG provoque la libération de cytokines telles que l'IFN-γ qui envoie des signaux à d'autres cellules immunitaires et médiateurs cytotoxiques comme la perforine et le granzyme, lesquelles entrent dans la cellule cible et déclenchent la mort cellulaire par apoptose. Ce processus est connu sous le nom de Cytotoxicité à médiation cellulaire dépendante des anticorps (ADCC). Les récepteurs FcγRIII présents sur les cellules NK peuvent également être associés avec des IgG monomères (c'est-à-dire des IgG non liées à des antigènes). Lorsque cela se produit, le récepteur Fc inhibe l'activité des lymphocytes NK[29].
Sur les mastocytes
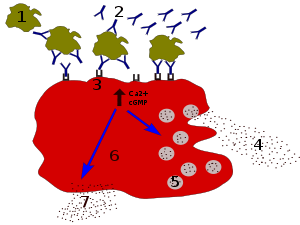
Les anticorps IgE se lient aux antigènes des allergènes. Ces allergènes liés à des molécules d'IgE interagissent avec les récepteurs Fcε à la surface des mastocytes. L'activation des mastocytes après l'engagement de FcεRI provoque un processus appelé la dégranulation, dans lequel les mastocytes libèrent des molécules préformées à partir de leurs granules cytoplasmiques. Celles-ci sont un mélange de composés incluant histamine, protéoglycanes, et protéases à sérine[30] Les mastocytes activés synthétisent et sécrétent aussi des médiateurs lipidiques (tels que prostaglandine, leucotriène, et platelet-activating factor) et des cytokines (interleukine 1, interleukine 3, interleukine 4, interleukine 5, interleukine 6, interleukine 13, facteur de nécrose tumorale-alpha, GM-CSF, et plusieurs chimiokines[31],[32].. Ces médiateurs contribuent à l'inflammation en attirant d'autres leucocytes.
Sur les éosinophiles
Les gros parasites comme les helminthes (vers) Schistosoma mansoni sont trop grands pour être ingérés par les phagocytes. Ils ont aussi une structure externe appelé tégument qui est résistant à l'attaque par des substances libérées par les macrophages et les mastocytes. Cependant, ces parasites peuvent être recouverts par des IgE et reconnus par FcεRI sur la surface des éosinophiles. Les éosinophiles activés libérent des médiateurs préformés comme la protéine basique majeure, et des enzymes telles que la peroxydase, contre qui les helminthes ne sont pas résistants[33],[34]. L'interaction de la FcεRI récepteur avec la portion Fc des helminthes lié IgE entraîne la libération par les éosinophiles de ces molécules dans un mécanisme similaire à celui des cellules NK au cours de l'ADCC[35].
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Receptor Fc » (voir la liste des auteurs).
- R. Anderson, « Manipulation of cell surface macromolecules by flaviviruses », Advances in Virus Research, vol. 159, , p. 229–74 (PMID 14696331, DOI 10.1016/S0065-3527(03)59007-8)
- Judith Owen, Jenni Punt, Sharon Stranford et Patricia Jones, Immunology, New York, W.H. Freeman and Company, , 7e éd. (ISBN 978-14641-3784-6), p. 423
- W. H. Fridman, « Fc receptors and immunoglobulin binding factors », FASEB Journal, vol. 5, no 12, , p. 2684–90 (PMID 1916092)
- Z. K. Indik, J. G. Park, S. Hunter et A. D. Schreiber, « The molecular dissection of Fc gamma receptor mediated phagocytosis », Blood, vol. 86, no 12, , p. 4389–99 (PMID 8541526)
- P. T. Harrison, W. Davis, J. C. Norman, A. R. Hockaday et J. M. Allen, « Binding of monomeric immunoglobulin G triggers Fc gamma RI-mediated endocytosis », The Journal of Biological Chemistry, vol. 269, no 39, , p. 24396–402 (PMID 7929100)
- X. Zhu, G. Meng, B. L. Dickinson, X. Li, E. Mizoguchi, L. Miao, Y. Wang, C. Robert, B. Wu, P. D. Smith, W. I. Lencer et R. S. Blumberg, « MHC class I-related neonatal Fc receptor for IgG is functionally expressed in monocytes, intestinal macrophages, and dendritic cells », Journal of Immunology, vol. 166, no 5, , p. 3266–76 (PMID 11207281, PMCID 2827247, DOI 10.4049/jimmunol.166.5.3266)
- M. Firan, R. Bawdon, C. Radu, R. J. Ober, D. Eaken, F. Antohe, V. Ghetie et E. S. Ward, « The MHC class I-related receptor, FcRn, plays an essential role in the maternofetal transfer of gamma-globulin in humans », International Immunology, vol. 13, no 8, , p. 993–1002 (PMID 11470769, DOI 10.1093/intimm/13.8.993)
- N. E. Simister, I. Jacobowitz, E. srael, J. C. Ahouse et C. M. Story, « New functions of the MHC class I-related Fc receptor, FcRn », Biochemical Society Transactions, vol. 25, no 2, , p. 481–6 (PMID 9191140, DOI 10.1042/bst0250481)
- « The Fc receptor for IgA (FcalphaRI, CD89) », Immunology Letters, vol. 92, nos 1–2, , p. 23–31 (PMID 15081523, DOI 10.1016/j.imlet.2003.11.018)
- « Molecular and functional characteristics of the Fcalpha/muR, a novel Fc receptor for IgM and IgA », Springer Seminars in Immunopathology, vol. 28, no 4, , p. 377–82 (PMID 17061088, DOI 10.1007/s00281-006-0050-3)
- « Molecular characteristics of IgA and IgM Fc binding to the Fcalpha/muR », Biochemical and Biophysical Research Communications, vol. 345, no 1, , p. 474–8 (PMID 16681999, DOI 10.1016/j.bbrc.2006.04.084)
- « A review on Fc epsilon RI on human epidermal Langerhans cells », International Archives of Allergy and Immunology, vol. 104 Suppl 1, no 1, , p. 63–4 (PMID 8156009, DOI 10.1159/000236756)
- « 5. IgE, mast cells, basophils, and eosinophils », The Journal of Allergy and Clinical Immunology, vol. 117, no 2 Suppl Mini-Primer, , S450-6 (PMID 16455345, DOI 10.1016/j.jaci.2005.11.016)
- « The central role of FcepsilonRI in allergy », Clinical and Experimental Dermatology, vol. 28, no 2, , p. 184–7 (PMID 12653710, DOI 10.1046/j.1365-2230.2003.01209.x)
- « Structure and function of Fc epsilon receptor II (Fc epsilon RII/CD23): a point of contact between the effector phase of allergy and B cell differentiation », Ciba Foundation Symposium, vol. 147, , p. 23-31; discussion 31-5 (PMID 2695308)
- P. Selvaraj, N. Fifadara, S. Nagarajan, A. Cimino et G. Wang, « Functional regulation of human neutrophil Fc gamma receptors », Immunologic Research, vol. 29, nos 1–3, , p. 219–30 (PMID 15181284, DOI 10.1385/IR:29:1-3:219)
- A. Sulica, W. H. Chambers, M. Manciulea, D. Metes, S. Corey, H. Rabinowich, T. L. Whiteside et R. B. Herberman, « Divergent signal transduction pathways and effects on natural killer cell functions induced by interaction of Fc receptors with physiologic ligands or antireceptor antibodies », Natural Immunity, vol. 14, no 3, , p. 123–33 (PMID 8832896)
- M. Sarfati, S. Fournier, C. Y. Wu et G. Delespesse, « Expression, regulation and function of human Fc epsilon RII (CD23) antigen », Immunologic Research, vol. 11, nos 3–4, , p. 260–72 (PMID 1287120, DOI 10.1007/BF02919132)
- M. Raghavan et P. J. Bjorkman, « Fc receptors and their interactions with immunoglobulins », Annual Review of Cell and Developmental Biology, vol. 12, , p. 181–220 (PMID 8970726, DOI 10.1146/annurev.cellbio.12.1.181)
- J. A. Swanson et A. D. Hoppe, « The coordination of signaling during Fc receptor-mediated phagocytosis », Journal of Leukocyte Biology, vol. 76, no 6, , p. 1093–103 (PMID 15466916, DOI 10.1189/jlb.0804439)
- P. D. Sun, « Structure and function of natural-killer-cell receptors », Immunologic Research, vol. 27, nos 2–3, , p. 539–48 (PMID 12857997, DOI 10.1385/IR:27:2-3:539)
- New nomenclature for the Reth motif (or ARH1/TAM/ARAM/YXXL) Cambier J.C. (1995) Immunology Today Feb;16(2):110 DOI: 10.1016/0167-5699(95)80105-7
- « The effect of phosphatases SHP-1 and SHIP-1 on signaling by the ITIM- and ITAM-containing Fcgamma receptors FcgammaRIIB and FcgammaRIIA », Journal of Leukocyte Biology, vol. 73, no 6, , p. 823–9 (PMID 12773515, DOI 10.1189/jlb.0902454)
- « Inhibitory receptors abound? », Proceedings of the National Academy of Sciences of the United States of America, vol. 94, no 12, , p. 5993–5 (PMID 9177155, PMCID 33673, DOI 10.1073/pnas.94.12.5993)
- « Augmented humoral and anaphylactic responses in Fc gamma RII-deficient mice », Nature, vol. 379, no 6563, , p. 346–9 (PMID 8552190, DOI 10.1038/379346a0)
- « Inhibitory signaling by B cell Fc gamma RIIb », Current Opinion in Immunology, vol. 10, no 3, , p. 306–12 (PMID 9638367, DOI 10.1016/s0952-7915(98)80169-6)
- « Fcgamma receptor signaling in phagocytes », International Journal of Hematology, vol. 84, no 3, , p. 210–6 (PMID 17050193, DOI 10.1532/IJH97.06140)
- « Receptors for the Fc fragment of IgG on natural killer cells », Natural Immunity, vol. 12, nos 4–5, , p. 218–34 (PMID 8257828)
- « Regulation of human natural cytotoxicity by IgG. IV. Association between binding of monomeric IgG to the Fc receptors on large granular lymphocytes and inhibition of natural killer (NK) cell activity », Cellular Immunology, vol. 147, no 2, , p. 397–410 (PMID 8453679, DOI 10.1006/cimm.1993.1079)
- « Regulation of mast cell activation through FcepsilonRI », Chemical Immunology and Allergy, vol. 87, , p. 22–31 (PMID 16107760, DOI 10.1159/000087568)
- « Gene expression profiles for Fc epsilon RI, cytokines and chemokines upon Fc epsilon RI activation in human cultured mast cells derived from peripheral blood », Cytokine, vol. 16, no 4, , p. 143–52 (PMID 11792124, DOI 10.1006/cyto.2001.0958)
- « Mast cells », Physiological Reviews, vol. 77, no 4, , p. 1033–79 (PMID 9354811)
- « Mechanism of the interaction mediating killing of Schistosoma mansoni by human eosinophils », The American Journal of Tropical Medicine and Hygiene, vol. 29, no 5, , p. 842–8 (PMID 7435788)
- « Eosinophils: from low- to high-affinity immunoglobulin E receptors », Allergy, vol. 50, no 25 Suppl, , p. 20–3 (PMID 7677229, DOI 10.1111/j.1398-9995.1995.tb04270.x)
- « High-affinity IgE receptor on eosinophils is involved in defence against parasites », Nature, vol. 367, no 6459, , p. 183–6 (PMID 8114916, DOI 10.1038/367183a0)
- Portail de la biologie cellulaire et moléculaire
- Portail de la médecine