Lemuriformes
Les lémuriens (Lemuriformes) forment un infra-ordre de primates strepsirrhiniens endémiques de l'île de Madagascar. Leur nom dérive de celui des lémures (des fantômes ou esprits de la mythologie romaine) en raison de leurs vocalisations rappelant les bruits attribués aux fantômes, de leurs grands yeux réfléchissant la lumière et des habitudes nocturnes de certaines espèces. Bien que les lémuriens soient souvent confondus avec les premiers primates, ils ne sont pas les ancêtres des primates anthropoïdes (singes, grands singes et humains) avec lesquels ils partagent des caractères morphologiques et comportementaux trouvés chez les primates primitifs.
Pour les articles homonymes, voir Lémurien.

| Règne | Animalia |
|---|---|
| Embranchement | Chordata |
| Sous-embr. | Vertebrata |
| Classe | Mammalia |
| Infra-classe | Placentalia |
| Ordre | Primates |
| Sous-ordre | Strepsirrhini |
Statut CITES
Les lémuriens sont arrivés sur Madagascar depuis le continent africain, il y a de cela de 62 à 65 millions d'années, en traversant la mer sur des tapis de végétation à une époque où les courants océaniques étaient favorables à une dispersion vers l'île. Depuis cette époque, les lémuriens ont évolué pour faire face à un environnement extrêmement saisonnier et leur capacité d'adaptation leur a donné une diversité qui rivalise avec celle de tous les autres groupes de primates. Il y a près de 2 000 ans, peu après l'arrivée des humains à Madagascar, il y avait encore sur l'île des lémuriens de la taille d'un gorille mâle. Aujourd'hui, on y dénombre une centaine d'espèces de lémuriens, et la plupart de ces espèces ont été découvertes (ou promues au rang d'espèce à part entière) dans les années 1990, mais leur classification taxonomique est controversée et dépend de la notion utilisée pour définir une espèce. Même la taxonomie de niveau supérieur est contestée, certains experts préférant placer la plupart des lémuriens dans l'infra-ordre des lémuriformes, tandis que d'autres regroupent tous les strepsirrhiniens actuels dans les Lemuriformes, et placent tous les lémuriens dans la super-famille des Lemuroidea et tous les loris et les galagos dans la super-famille des Lorisoidea.
Leur poids varie de 30 grammes à 9 kilogrammes et ils partagent de nombreux traits de base des primates, comme des doigts opposables aux mains et aux pieds, et des ongles au lieu de griffes pour la plupart des espèces. Cependant, la taille du cerveau par rapport à leur corps est inférieure à celle des primates anthropoïdes et, comme d'autres primates strepsirrhiniens, ils ont un rhinarium. Les lémuriens sont généralement les plus sociaux des primates strepsirrhiniens et communiquent davantage avec les odeurs et les vocalisations qu'avec la vue. Les lémuriens ont des métabolismes de base relativement faibles et peuvent avoir une reproduction saisonnière, une dormance (comme l'hibernation ou la léthargie), ou une femelle dominante socialement. Leur régime alimentaire est généralement composé d'une grande variété de fruits et de feuilles, mais certains ont une alimentation plus spécialisée. Bien que de nombreuses espèces de lémuriens aient des régimes alimentaires similaires, les différentes espèces de lémuriens occupent des niches distinctes dans les mêmes forêts.
La recherche sur les Lémuriens axée sur la taxonomie et la collection de spécimens a commencé au cours des XVIIIe et XIXe siècles. Bien que les premières observations sur le terrain datent des premiers explorateurs, les études modernes sur leur écologie et leur comportement n'ont véritablement commencé qu'en 1950 et 1960. Initialement entravées par l'instabilité et les troubles politiques à Madagascar au milieu des années 1970, les études de terrain ont repris dans les années 1980 et ont grandement amélioré la compréhension de ces primates. Les installations de recherche comme le Centre sur les Lémuriens de Duke ont fourni des moyens de recherche sous des paramètres contrôlés. Les lémuriens sont importants pour la recherche car leur mélange de caractères primitifs et de traits communs aux primates anthropoïdes peut apporter un éclairage nouveau sur l'évolution des primates et de l'homme. Cependant, de nombreuses espèces de lémuriens sont menacées d'extinction en raison de la régression de leur habitat et de la chasse. Même si les traditions locales aident généralement à protéger les lémuriens et leurs forêts, l'abattage illégal, la pauvreté généralisée et l'instabilité politique empêchent et sapent les efforts de conservation.
Étymologie
Carl von Linné, le fondateur de la nomenclature binominale moderne, a donné leur nom aux lémuriens dès 1758, dans son ouvrage Systema Naturae. Il décrivait trois espèces dans le genre Lemur : Lemur tardigradus (le Loris paresseux, maintenant connu sous le nom de Nycticebus coucang), Lemur catta (le Lémur catta) et Lemur volans (le Galéopithèque, maintenant connu sous le nom de Cynocephalus volans)[2]. Bien que le terme « lémuriens » ait apparemment été d'abord destiné à désigner les loris, le nom a rapidement été limité aux primates endémiques à Madagascar, qui sont maintenant connus sous le nom de « lémuriens »[3]. Le nom dérive du terme latin lemures[4] qui désigne des spectres ou des fantômes qui étaient exorcisés pendant la fête de Lemuria[5]. Linné connaissait les habitudes nocturnes et l'aspect fantomatique des lémuriens et des loris[6], ainsi que leurs mouvements silencieux la nuit, le pouvoir réfléchissant de leurs grands yeux et leurs cris de fantômes. Il se peut également qu'il ait eu connaissance des légendes colportées par certains peuples malgaches selon lesquelles les lémuriens étaient les âmes de leurs ancêtres[7]. Familier des œuvres de Virgile et d'Ovide et trouvant là une analogie qui cadrait avec son schéma de nommage, Linné a adopté le terme de « Lemur » pour désigner ces primates nocturnes[8].
Histoire évolutive
Les lémuriens sont des primates prosimiens appartenant au sous-ordre des Strepsirrhini. Comme d'autres primates strepsirrhiniens, tels que les loris, le potto et les galagos, ils partagent des traits ancestraux avec les premiers primates. À cet égard, les lémuriens sont souvent présentés comme les ancêtres des primates, mais il n'en est rien et la lignée des lémuriens n'a pas engendré celle des Haplorrhini, qui inclut les hominidés. Ils ont évolué de façon indépendante dans l'isolement de Madagascar[9]. Traditionnellement, tous les strepsirrhiniens modernes, dont les lémuriens, sont considérés comme ayant évolué à partir des primates primitifs connus sous le nom d'Adapiformes au cours de l'Éocène (il y a 56 à 34 Ma) ou au Paléocène (il y a de 65 à 56 Ma)[9],[10],[11]. Toutefois les Adapiformes n'avaient pas l'arrangement spécial de dents, connu sous le nom de peigne dentaire, que presque tous les strepsirrhiniens vivants possèdent[12],[13],[14]. Une hypothèse plus récente veut que les lémuriens descendent des primates Lorisiformes. Cette hypothèse résulte des études comparatives du gène du cytochrome b et de la présence du peigne dentaire dans les deux groupes[14],[15]. Au lieu d'être les ancêtres directs des lémuriens, les Adapiformes ont peut-être donné naissance à la fois aux lémuriens et aux Lorisiformes, une division qui serait soutenue par des études de phylogénétique moléculaire[14]. La séparation entre lémuriens et loris se serait produite il y a 62 à 65 Ma selon les études moléculaires[16], bien que d'autres tests génétiques et les gisements de fossiles en Afrique suggèrent des estimations plus prudentes datant cette divergence de 50 à 55 Ma[17].
Jadis partie du supercontinent Gondwana, l'île de Madagascar a été isolée après s'être séparée de l'Afrique orientale (il y a environ 160 Ma), de l'Antarctique (il y a entre 80 et 130 Ma) et de l'Inde (il y a 80 à 90 Ma)[18],[19]. Comme les premiers lémuriens sont probablement venus d'Afrique il y a autour de 62 à 65 Ma, ils ont dû traverser le canal de Mozambique, un chenal profond entre l'Afrique et Madagascar, d'une largeur minimale d'environ 560 km[14]. En 1915, le paléontologue William Diller Matthew note que la biodiversité des mammifères de Madagascar (lémuriens compris) ne peut s'expliquer que par le hasard de dispersion par radeau de végétation, où de très petites populations de petits animaux venus d'Afrique proche ont été portées sur des tapis de végétaux enchevêtrés partis à la mer depuis l'embouchure de grands fleuves et sont arrivées sur l'île[20]. Cette forme de dispersion biologique a pu se produire de façon aléatoire sur des millions d'années[14],[21]. Dans les années 1940, le paléontologue américain George Gaylord Simpson a inventé le terme d'« hypothèse de la loterie » pour ces événements aléatoires[22]. Le radeau de végétation est depuis l'explication la plus acceptée pour la colonisation de Madagascar par les lémuriens[23],[24] mais, jusqu'à récemment, on pensait que ce voyage était très peu probable car les courants océaniques ont tendance à éloigner les objets de l'île[25]. En , un rapport a démontré que, il y a environ 60 Ma, Madagascar et l'Afrique étaient toutes deux à 1 650 km plus au sud que leurs positions actuelles, les plaçant dans des courants océaniques différents, inverses de ce qu'ils sont aujourd'hui. Les courants océaniques auraient été encore plus forts qu'aujourd'hui, ce qui aurait poussé un radeau végétal plus vite, raccourcissant le temps de voyage à 30 jours ou moins, délai assez court pour que de petits mammifères puissent survivre facilement. Comme les plaques continentales ont dérivé vers le nord, les courants ont progressivement changé, et au bout de 20 Ma la fenêtre pour la dispersion océanique a été fermée, isolant les lémuriens et le reste de la faune terrestre malgache de l'Afrique continentale[25]. Isolés sur Madagascar avec seulement un nombre limité de concurrents chez les mammifères, les lémuriens n'ont pas eu à rivaliser avec d'autres mammifères arboricoles comme les écureuils dans leur évolution[26]. Ils n'ont pas eu également à rivaliser avec les singes, qui ont évolué plus tard en Afrique. En effet, l'intelligence, l'agressivité et la rouerie des singes leur a donné un avantage sur les autres primates dans l'exploitation de l'environnement[4],[13].
Phylogénie au sein de l'ordre
Phylogénie des infra-ordres actuels de primates, d'après Perelman et al. (2011)[27] :
| Primates |
| ||||||||||||||||||||||||
Note: l'Aye-Aye est ici classé en dehors des lémuriformes.
Répartition et diversité

Depuis leur arrivée sur Madagascar, les lémuriens se sont adaptés pour occuper de nombreuses niches écologiques disponibles[13],[26]. Leur diversité de comportements et de morphologie sont comparables à celle des singes du reste du monde[4]. D'un poids allant de 30 g pour le Microcèbe de Mme Berthe, le plus petit primate du monde[28], à 160-200 kg pour Archaeoindris fontoynonti récemment éteint[29], les lémuriens ont évolué selon diverses formes de locomotion, différents niveaux de complexité sociale, et des adaptations uniques aux conditions climatiques locales[13],[30].
Les lémuriens n'ont pas de traits communs qui les distingueraient des autres primates[31]. Les différents types de lémuriens ont évolué en des combinaisons uniques de caractéristiques inhabituelles pour faire face au climat rude et saisonnier de Madagascar. Ces caractéristiques peuvent inclure le stockage saisonnier de graisses, l'hypométabolisme (y compris la léthargie et l'hibernation), les groupes de petite taille, la faible encéphalisation, la cathéméralité (activité de jour comme de nuit entrecoupée de périodes de repos) et les saisons de reproduction strictes[10],[30]. Les importantes limitations de ressources et la reproduction saisonnière sont également considérées comme ayant donné lieu à trois autres traits relativement courants chez les lémuriens : la dominance sociale féminine, le monomorphisme sexuel et la concurrence entre mâles avec de faibles niveaux d'agonisme, tels que la compétition spermatique[32].
Avant l'arrivée des humains, il y a environ 1 500 à 2 000 ans, on trouvait les lémuriens sur toute l'île[26]. Cependant, les premiers colons ont rapidement transformé les forêts en rizières et en prairies par le biais d'abattis-brûlis (connus localement sous le nom de « tavy »), restreignant le territoire des lémuriens à environ 10 % de la superficie de l'île, soit environ 60 000 km2[33]. Aujourd'hui, la diversité et la complexité des communautés de lémuriens croit avec la biodiversité végétale et les précipitations et est la plus élevée dans les forêts tropicales de la côte Est, qui sont les plus arrosées et montrent la plus grande richesse floristique[11]. En dépit de leurs adaptations à une adversité extrême, la destruction de leurs habitats et la chasse ont entraîné une forte baisse des populations de lémuriens, et leur diversité a diminué, avec l'extinction récente d'au moins 17 espèces dans huit genres[26],[29],[34], connues collectivement comme les « lémuriens subfossiles ». La plupart des quelque 100 espèces et sous-espèces de lémuriens sont menacées ou en voie de disparition. Sauf changement de tendance, les extinctions sont susceptibles de continuer[35].
Jusqu'à récemment, les lémuriens géants vivaient à Madagascar. Maintenant, on ne les trouve plus que par les restes récents ou sub-fossiles, alors qu'ils étaient des formes modernes qui faisaient autrefois partie de la riche diversité de lémuriens qui vivaient sur l'île. Certaines de leurs adaptations étaient différentes de celles trouvées dans leurs familles actuelles[26]. Les 17 lémuriens éteints étaient plus grands que les espèces actuelles, certains pesant jusqu'à 200 kg[4] et on pense qu'ils étaient actifs durant la journée[36]. Non seulement ils étaient différents en taille et en apparence, mais ils occupaient en plus des niches écologiques qui n'existent plus ou sont restées vides[26]. Une grande partie de Madagascar, qui est maintenant dépourvue de forêts et de lémuriens, accueillait autrefois diverses communautés de primates avec plus de 20 espèces de lémuriens couvrant la gamme complète de taille des lémuriens[37].
Classification taxonomique et phylogénie interne
| Phylogénie des lémuriens[23],[38],[37] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
D'un point de vue taxonomique, le terme « lémur » désigne à l'origine le genre Lemur, qui ne contient actuellement que le lémur catta. Le terme est maintenant utilisé dans le sens familier pour nommer tous les primates malgaches[39].
La taxonomie des lémuriens est controversée et les experts ne sont pas d'accord, surtout avec l'augmentation récente du nombre d'espèces reconnues[31],[40],[41]. Selon Russell Mittermeier, le président du Conservation International (CI), le taxonomiste Colin Groves et d'autres, il y aurait près de 100 espèces ou sous-espèces actuelles reconnues de lémuriens, divisées en cinq familles et quinze genres[42]. Comme les données génétiques indiquent que les lémuriens sub-fossiles récemment éteints étaient étroitement liés aux lémuriens actuels[43], trois autres familles, huit genres et dix-sept espèces peuvent être inclus dans le total[29],[34]. En revanche, d'autres experts contestent cette inflation taxonomique[41], n'admettant qu'un total proche de 50 espèces[31].
La classification des lémuriens dans le sous-ordre des Strepsirrhini est tout aussi controversée, bien que la plupart des experts s'entendent sur le même arbre phylogénétique. Dans une taxonomie publiée par Colin Groves, l'Aye-aye a été placé dans son propre infra-ordre, les Chiromyiformes, tandis que le reste des lémuriens a été placé dans celui des lémuriformes[44]. Dans une autre taxinomie, les lémuriformes contiennent tous les strepsirrhiniens répartis en deux super-familles, les Lemuroidea pour tous les lémuriens et les Lorisoidea pour les loris et les galagos[17].
| 3 infra-ordres, 2 super-familles[44] | 1 infra-ordre, 2 super-familles[17],[45] |
|---|---|
|
|

La taxonomie des lémuriens a considérablement changé depuis la première classification de Carl von Linné en 1758. Un des plus grands défis a été la classification de l'aye-aye, sujet à controverse jusqu'à très récemment[4]. Avant que Richard Owen publie une étude anatomique détaillée en 1866, les naturalistes ne savaient pas si l'aye-aye (genre Daubentonia) était un primate, un rongeur ou un marsupial[46],[47],[48]. Toutefois, le classement de l'aye-aye dans le Primates est resté problématique jusqu'à très récemment. Sur la base de son anatomie, les chercheurs ont trouvé un argument pour placer le genre Daubentonia comme un indriidé spécialisé, un groupe sœur de tous les strepsirrhiniens, et un taxon indéterminé au sein de l'ordre des Primates[15]. Des tests moléculaires ont montré que les Daubentoniidae étaient à la base de tous les lémuriformes[15],[49] et en 2008, Russell Mittermeier, Colin Groves et autres ont abandonné la taxonomie de niveau supérieur et défini les lémuriens comme monophylétique et contenant cinq familles, dont les Daubentoniidae[42].
Les relations entre les familles de lémuriens se sont également avérées problématiques et ne sont pas encore définitivement établies[15]. Pour compliquer davantage la question, plusieurs primates fossiles du Paléocène ayant vécu hors de Madagascar, comme Bugtilemur, ont été classés comme des lémuriens[50]. Toutefois, un consensus scientifique s'est fait pour n'accepter que des preuves génétiques[15],[49] et, par conséquent, on admet généralement que les primates malgaches sont monophylétiques[15],[23],[38]. Un autre sujet de discorde est la relation entre les Lepilemuridae et les Megaladapidae aujourd'hui disparus. Regroupés auparavant dans la même famille en raison des similitudes dans leur dentition[51], ils ne sont plus considérés comme étant étroitement liés grâce aux études génétiques[38],[52].
Le plus grand nombre de changements taxonomiques a eu lieu au niveau des genres et, même si ces révisions se sont pas définitives, elles sont souvent appuyées sur des analyses génétiques et moléculaires. Les révisions les plus notables portent sur la scission progressive du genre Lemur en genres distincts : l'actuel genre Lemur qui ne contient plus que le Lémur catta, le genre Varecia (lémurs à crinière) et le genre Eulemur qui se distinguent par de nombreux caractères morphologiques[53],[54].
En raison de plusieurs révisions taxonomiques par Russell Mittermeier, Colin Groves et autres, le nombre d'espèces de lémuriens reconnues est passé de 33 espèces et sous-espèces en 1994 à environ 100 en 2008[31],[42],[55]. Avec le progrès des recherches de cytogénétique et de génétique moléculaire, ainsi que des études de terrain en cours, en particulier avec les espèces cryptiques et minuscules appartenant au genre Microcebus, le nombre d'espèces reconnues de lémuriens est susceptible de continuer à croître[31]. Toutefois, l'augmentation rapide du nombre d'espèces a ses détracteurs parmi les taxonomistes spécialistes des lémuriens. Cette classification dépendra finalement de la définition donnée à la notion d'espèce, les écologistes sont souvent favorables à des définitions qui aboutissent à la séparation de populations génétiquement distinctes en espèces distinctes afin d'obtenir une protection accrue de l'environnement. D'autres penchent pour des différences plus importantes[31],[41].
Anatomie et physiologie
Les lémuriens varient fortement en taille. Ils comprennent les plus petits primates du monde et, jusqu'à récemment, incluaient également certains des plus grands. Ils se situent actuellement dans une échelle de poids allant d'environ 30 g pour le microcèbe de Mme Berthe (Microcebus berthae) jusqu'à 7 à 9 kg pour l'indri (Indri indri) et le Propithèque à diadèmes (Propithecus diadema)[56],[57]. Si l'on y inclut les espèces récemment disparues, l'échelle de taille va jusqu'à 160 à 200 kg, le poids d'un gorille mâle adulte pour Archaeoindris fontoynonti[4],[29].

Comme tous les primates, les lémuriens ont cinq doigts opposables avec des ongles (dans la plupart des cas) aux mains et aux pieds. La plupart des lémuriens possèdent un ongle long, épais, comprimé latéralement, appelé une griffe de toilette, très souvent sur le deuxième orteil et utilisée par l'animal pour se gratter et se toiletter[47],[58]. En plus de la griffe de toilette, les lémuriens partagent un certain nombre de traits avec d'autres strepsirrhiniens qui sont un rhinarium, un organe voméro-nasal fonctionnel et permettant donc de détecter les phéromones ; ils ont une barre post-orbitaire mais il existe une ouverture post-orbitaire, la cavité orbitaire n'étant pas complètement fermée à l'arrière, les orbites ne sont pas entièrement orientées vers l'avant ; les branches gauche et droite de leur mandibule (mâchoire inférieure) ne sont pas entièrement fusionnées, et le rapport du poids du cerveau au poids du corps est bas[14],[59].
Ils partagent d'autres traits avec des primates prosimiens (primates strepsirrhiniens et tarsiers) comme un utérus bicorne (à deux cornes) et une implantation du placenta épithéliochoriale[12],[59]. Parce que leurs pouces ne sont pas complètement opposables, ils sont moins indépendants des autres doigts que chez les autres primates[58], leurs mains sont loin d'être parfaites pour saisir et manipuler des objets[19]. Aux pieds, au contraire, ils ont un gros orteil largement séparé des autres doigts ce qui facilite la préhension des branches[47]. Contrairement à une croyance très répandue, les lémuriens n'ont pas une queue préhensile, ce caractère étant limité aux singes du Nouveau Monde, en particulier chez les atélidés[58]. Les lémuriens comptent aussi beaucoup sur leur sens de l'odorat, comme la plupart des autres mammifères et primates primitifs, mais pas beaucoup sur l'orientation visuelle comme c'est le cas les primates évolués[19].
Les lémuriens sont un groupe diversifié de primates en termes de morphologie et de physiologie[31]. Certains lémuriens, comme les lépilémuridés et les indriidés, ont des membres postérieurs plus longs que les membres antérieurs, ce qui en fait d'excellents sauteurs[60],[61],[62]. Les indriidés ont aussi un système digestif adapté à leur régime wikt:folivore, présentant de grandes glandes salivaires, un estomac spacieux et un cæcum allongé ce qui facilite la fermentation[11],[13],[57],[63],[64]. Le Chirogale à oreilles velues (Allocebus trichotis) aurait une langue très longue, ce qui lui permet de se nourrir de nectar[47]. De même, le Lémur à ventre roux (Eulemur rubriventer) a une langue en forme de brosse couverte de poils, conçue pour se nourrir uniquement de nectar et de pollen[11]. L'aye-aye a quelques traits qui sont uniques chez les primates, et qui le met à part chez les lémuriens. Ce sont une croissance permanente, des dents antérieures de rongeurs pour ronger le bois et les graines coriaces, un majeur très mobile filiforme pour pouvoir extraire des aliments des petits trous, de grandes oreilles de chauve-souris pour détecter des cavités dans les arbres[13],[26],[47],[65] et d'utiliser des sons qu'il émet pour prospecter[46].
Les lémuriens sont inhabituels dans ce qu'ils ont une grande variabilité dans leur structure sociale[pas clair], mais ils n'ont généralement pas de dimorphisme sexuel en taille et en morphologie des canines[11],[39]. Cependant, certaines espèces ont tendance à avoir des femelles plus grosses que les mâles[46] et deux espèces d'Eulémurs, Eulemur cinereiceps et E. rufus, présentent des différences de taille dans les canines[66]. Certains lémuriens présentent un dichromatisme sexuel (différence sexuelle de coloration de la fourrure)[39] mais cette différence varie de l'évidence, comme chez le lémur noir (E. macaco), à très peu de chose dans le cas du Lémur fauve (E. fulvus)[66].
L'incapacité pour les humains de distinguer visuellement entre deux ou plusieurs espèces a été découverte récemment chez les lémuriens, en particulier chez les lépilémurs et les microcèbes.[pas clair] Chez les lépilémurs, les sous-espèces sont traditionnellement définies sur la base de légères différences morphologiques, mais de nouvelles preuves génétiques ont donné un véritable statut d'espèce à des populations régionales[52]. Dans le cas des lémuriens, le Microcèbe mignon (M. murinus), le Microcèbe brun-doré (M. ravelobensis), et le Microcèbe de Goodman (M. lehilahytsara) étaient considérés comme appartenant à la même espèce jusqu'à récemment, lorsque des tests génétiques les ont identifiés comme des espèces cryptiques[67].
Denture
| Famille | Formule dentaire déciduale[51],[68] | Formule dentaire définitive[39],[47] [69],[70] |
|---|---|---|
| Cheirogaleidae, Lemuridae | 2.1.32.1.3 × 2 = 24 | 2.1.3.32.1.3.3 × 2 = 36 |
| Lepilemuridae | 2.1.32.1.3 × 2 = 24 | 0.1.3.32.1.3.3 × 2 = 32 |
| † Archaeolemuridae | 2.1.32.0.3 × 2 = 22 | 2.1.3.31.1.3.3 × 2 = 34 |
| † Megaladapidae | 1.1.32.1.3 × 2 = 22 | 0.1.3.32.1.3.3 × 2 = 32 |
| Indriidae, † Palaeopropithecidae | 2.1.22.1.3 × 2 = 22[N 1] | 2.1.2.32.0.2.3 × 2 = 30[N 2] |
| Daubentoniidae | 1.1.21.1.2 × 2 = 16 | 1.0.1.31.0.0.3 × 2 = 18 |
La denture des lémuriens est hétérodonte (les dents ont des morphologies différentes) et dérive d'une denture permanente des premiers primates de formule : 2.1.3.32.1.3.3. Les indriidés, les lépilémuridés, l'aye-aye, et les lémuriens aujourd'hui disparus qu'étaient les Palaeopropithecidae, les Archaeolemuridae et les Megaladapidae ont des dentures réduites, ayant perdu une partie de leurs incisives, canines ou prémolaires[72]. La denture primitive temporaire avait la formule suivante : 2.1.32.1.3 mais les jeunes indriidés, aye-ayes, Palaeopropithecidae, Archaeolemuridae et Megaladapidae avaient sans doute moins de dents de lait[51],[68].
Il y a aussi des différences notables dans la morphologie et la topographie dentaire entre les lémuriens. Les Indriis, par exemple, ont des dents qui sont parfaitement conçues pour couper les feuilles et broyer les graines[57]. Dans le peigne dentaire de la plupart des lémuriens, les incisives et les canines sont orientées vers l'avant plutôt que vers le haut et sont finement espacées, fournissant ainsi un outil utilisé pour le toilettage ou l'alimentation[14],[51],[72]. Par exemple, les indriis utilisent leur peigne, non seulement pour la toilette, mais aussi pour extraire les grosses graines difficiles à séparer de la pulpe des fruits de Beilschmiedia[73], tandis que les lémuriens du genre Phaner utilisent leur peigne relativement long pour mordre à travers l'écorce des arbres jusqu'à atteindre la sève[47]. Seul l'aye-aye, Daubentonia robusta, et les plus grands des Palaeopropithecidae n'avaient pas de peigne fonctionnel[72],[70]. Dans le cas de l'aye-aye, la morphologie des incisives temporaires, qui sont perdues peu après la naissance[74], indique que ses ancêtres avaient un peigne. Ces dents de lait sont remplacées par des incisives à racine ouverte et à croissance continue (dents hypselodontes)[72].
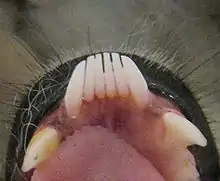
Le peigne des lémuriens se compose normalement de six dents (quatre incisives et deux canines), mais les indriidés, les Archaeolemuridae et certains Palaeopropithecidae ont ou avaient seulement un peigne à quatre dents en raison de la perte soit de deux canines soit de deux incisives[14],[72]. Lorsque la canine inférieure est incluse dans le peigne ou perdue, la denture inférieure peut être difficile à déchiffrer, surtout lorsque la première prémolaire (P2) est en forme de canine pour remplir le rôle de la canine disparue[51]. Chez les lémuriens folivores, à l'exception des indriidés, les incisives supérieures sont réduites ou absentes[51],[72]. Utilisé en association avec le peigne de la mandibule (mâchoire inférieure), cet ensemble n'est pas sans rappeler celui des ruminants[72].
Les lémuriens ont la particularité chez les primates d'avoir un développement dentaire rapide, en particulier pour les plus grandes espèces. Par exemple, la croissance du corps des indriidés est relativement lente, mais la formation et l'éruption des dents extrêmement rapide[75]. En revanche, les primates anthropoïdes présentent un développement dentaire plus lent associé à la croissance et au développement de l'individu[72]. Les lémuriens ont également un développement dentaire précoce à la naissance, et ont leur denture permanente complète au moment du sevrage[30].
Les lémuriens ont généralement un émail dentaire plus mince que celui des primates anthropoïdes. Cela peut entraîner une usure supplémentaire et des bris de la partie antérieure des dents en raison de l'usage important qui en est fait dans la toilette, l'alimentation et les combats. On a peu d'informations sur la santé dentaire des lémuriens, en dehors des lémuriens sauvages de la réserve privée de Berenty où l'on a observé parfois des abcès dentaires (considérés comme des plaies ouvertes sur le museau) et des caries, probablement en raison de la consommation d'aliments introduits[72].
Sens
L'odorat est un sens très important chez les lémuriens et est fréquemment utilisé dans leurs communications[11],[13],[19]. Les lémuriens ont un museau plus long que celui des haplorrhiniens ce qui est traditionnellement considéré comme leur permettant d'avoir un meilleur criblage des odeurs[13] bien que cela ne se traduise pas nécessairement par une meilleure acuité olfactive puisque ce n'est pas la taille relative de la cavité nasale qui est corrélée à l'acuité de l'odorat mais la densité des récepteurs olfactifs[76],[77]. À noter cependant qu'un museau allongé peut faciliter la mastication[77].
.jpg.webp)
Le rhinarium, est un organe partagé avec les autres strepsirrhiniens et de nombreux autres mammifères, mais pas avec les primates haplorrhiniens[47]. Bien que l'on prétende qu'il serve à renforcer l'odorat[59], c'est surtout un organe du toucher associé à un organe voméronasal bien développé. Comme les phéromones sont généralement des molécules de grande taille, non-volatiles, le rhinarium sert à toucher un objet possédant des phéromones et à les transférer par le philtrum (la fente sous-nasale centrale) jusqu'à l'organe voméronasal via le foramen incisif situé dans le palais osseux[12].
Pour communiquer par l'odorat, ce qui est utile la nuit, les lémuriens marquent les lieux avec de l'urine ainsi qu'avec des glandes odorantes situées sur les poignets, à l'intérieur du coude, les régions génitales ou le cou[12],[59]. La peau du scrotum de la plupart des lémuriens mâles a des glandes odorantes[78]. Les lémuriens Varecia et les propithèques mâles possèdent une glande à la base du cou[12],[47], tandis que le grand hapalémur (Prolemur simus) et le lémur catta ont des glandes à l'intérieur des bras, près des aisselles[12]. Les lémurs catta mâles possèdent également des glandes odorantes à l'intérieur de leur avant-bras, à côté d'un éperon pointu, dont ils se servent comme gouge lorsqu'ils marquent les branches de leur empreinte olfactive[47]. Ils peuvent également frotter leur queue contre leurs avant-bras, puis s'engager dans une combat odorant en agitant la queue devant leur adversaire[12].
Les lémuriens (et les strepsirrhiniens en général) sont considérés comme s'orientant moins visuellement que les primates supérieurs mais dépendent très fortement de leur sens de l'odorat et de la détection des phéromones. La fovéa rétinienne, qui donne une bonne acuité visuelle supérieure, n'est pas bien développée. La paroi postorbitaire (la fermeture osseuse derrière l'œil) des primates haplorrhiniens est considérée comme stabilisant légèrement l'œil, permettant l'évolution de la fovéa. Avec seulement une barre postorbitaire, les lémuriens ont été incapables d'utiliser une fovéa[79]. Par conséquent, quelle que soit leur période d'activité (nocturne, cathémérale ou diurne), les lémuriens ont une faible acuité visuelle et une haute sommation rétinienne[30]. Les lémuriens ont cependant un champ visuel plus large que les primates anthropoïdes en raison d'une légère différence dans l'angle entre les deux yeux, comme indiqué dans le tableau suivant[80] :
| Angle des yeux | Champ binoculaire | Champ visuel total | |
|---|---|---|---|
| Lémuriens | 10–15° | 114–130° | 250–280° |
| Anthropoïdes | 0° | 140–160° | 180–190° |
Bien que dépourvus de fovéa, certains lémuriens diurnes ont une zone riche en cônes, bien que moins bien regroupés que dans la fovéa, l'area centralis[79]. On a constaté que cette zone de la rétine a cependant un rapport cellules à bâtonnet / cellules à cônes élevé chez de nombreuses espèces diurnes étudiées jusqu'à présent, alors que les anthropoïdes diurnes n'ont pas de cellules à bâtonnet dans leur fovéa. Encore une fois, cela suggère une acuité visuelle inférieure des lémuriens par rapport aux anthropoïdes[81]. En outre, ce rapport de cellules peut être variable, même chez les espèces diurnes. Par exemple, le sifaka de Verreaux (Propithecus verreauxi) et l'indri (Indri indri) ont seulement quelques grands cônes dispersés dans leur rétine dominée par les bâtonnets. Les yeux du lémur catta contiennent un cône pour cinq bâtonnets. Par contre, les lémuriens nocturnes comme les microcèbes et les cheirogales ont des rétines entièrement composées de bâtonnets[12].
_4.jpg.webp)
Comme les cellules à cône permettent la vision des couleurs, la prévalence élevée de cellules à bâtonnet dans les yeux des lémuriens suggère qu'ils n'ont pas évolué dans la vision des couleurs[12]. Chez le lémurien le plus étudié, le Lémur catta, on a démontré la possibilité de distinguer les couleurs bleu et jaune, mais aussi leur incapacité à voir le rouge et le vert[82]. En raison du polymorphisme des gènes du chromosome X qui codent les opsines, les protéines réceptives à la couleur, on peut quelquefois trouver quelques femelles de lémuriens tels que le sifaka de Coquerel (Propithecus coquereli) et le Maki vari roux (Varecia rubra) qui ont une vision trichromatique. La plupart des lémuriens, par conséquent, ont soit une vision monochromatique (ne voient qu'une couleur) soit une vision dichromatique[12].
La plupart des lémuriens ont conservé leur tapetum lucidum, une couche réfléchissante située dans l'œil, que l'on retrouve chez de nombreux vertébrés[39]. Ce trait est absent chez les primates haplorrhiniens et sa présence limite l'acuité visuelle chez les lémuriens[30],[81]. Le tapetum des strepsirrhiniens est unique chez les mammifères car il est constitué de riboflavine cristallisée, et la diffusion résultante de la lumière est le facteur limitant de leur acuité visuelle[81]. Bien que le tapetum soit considéré comme omniprésent chez les lémuriens, il semble y avoir des exceptions chez les Eulémurs, comme le lémur noir et le Lémur brun commun, ainsi que les lémuriens huppés[12],[30],[81]. Mais comme la riboflavine a tendance à se dissoudre et disparaître lors des traitements pour examen histologique, ces exceptions sont encore discutables[12].
Métabolisme
Les lémuriens ont un métabolisme de base (MB) réduit, ce qui les aide à conserver leur énergie pendant la saison sèche, quand l'eau et la nourriture sont rares[11],[62]. Ils peuvent optimiser leur consommation d'énergie en abaissant leur besoins métaboliques à 20 % en dessous des valeurs prédites pour les mammifères de masse corporelle similaire[83]. Le Lépilémur à queue rousse (Lepilemur ruficaudatus), par exemple, a un des métabolismes les plus bas chez les mammifères. Son faible métabolisme peut être lié à son régime alimentaire folivore et à sa masse corporelle relativement faible[62]. Les adaptations comportementales des lémuriens complètent ces explications, comme leur exposition au soleil, leur tenue assise dos voûté, le fait de se blottir groupés et le partage du nid pour réduire les pertes de chaleur et économiser les calories[83]. Les cheirogales et les microcèbes présentent une période de dormance pour économiser l'énergie[83]. Avant la saison sèche, ils accumulent des graisses à la base de la queue et dans leurs pattes arrière, doublant ainsi leur poids[28],[84],[85]. Des lémuriens qui ne connaissent pas la dormance sont également en mesure d'arrêter certains aspects de leur métabolisme pour conserver leur énergie[83].
Comportement
Le comportement des lémuriens est aussi variable que leur morphologie. Les différences dans le régime alimentaire, les systèmes sociaux, les types d'activité, la locomotion, les communications, les tactiques d'évitement des prédateurs, les systèmes d'élevage des petits et les niveaux d'intelligence aident à différencier les taxons lémuriens de chaque espèce. Bien que la tendance soit souvent de distinguer les petits lémuriens nocturnes des grands lémuriens diurnes, il y a souvent des exceptions qui contribuent à illustrer le caractère unique et diversifié de ces primates malgaches.
Alimentation

L'alimentation des lémuriens est très variable et montre un haut degré de plasticité[86] bien que la tendance générale soit que les plus petites espèces consomment surtout des fruits et des insectes (omnivore) et que les plus grandes soient plutôt herbivores[36]. Comme tous les primates, les lémuriens affamés peuvent manger tout ce qui est comestible que ce soit ou non l'un de leurs aliments préférés[12]. Par exemple, le Lémur catta se nourrit d'insectes et de petits vertébrés en cas de besoin[36],[53] et, par conséquent, il est généralement considéré comme un omnivore opportuniste[72]. Le Microcèbe de Coquerel (Mirza coquereli) est surtout frugivore mais il peut consommer des sécrétions d'insectes pendant la saison sèche[36].
Une hypothèse courante en mammalogie est que les petits mammifères ne peuvent pas subsister en consommant uniquement des végétaux et doivent avoir un régime alimentaire riche en calories pour survivre. En conséquence, on pensait que le régime alimentaire des plus petits primates devaient être riches en protéines et donc contenir des insectes (insectivores). La recherche a montré toutefois, que les microcèbes, les plus petits primates actuels, consomment plus de fruits que d'insectes, ce qui contredit l'hypothèse populaire[12],[36].
Les végétaux constituent la majorité des régimes de la plupart des lémuriens. Les lémuriens exploitent au moins 109 familles de plantes poussant à Madagascar (soit 55 % de la végétation malgache). Comme les lémuriens sont principalement arboricoles, la plupart d'entre eux consomment des parties de plantes ligneuses, comme les arbres, les arbustes ou les lianes. Seul le Lémur catta, les hapalémurs (genre Hapalemur), et le Maki vari noir et blanc (Varecia variegata) consomment des herbes. Bien que Madagascar soit riche en fougères variées, les lémuriens en mangent rarement. Une raison possible est que les fougères n'ont pas de fleurs, de fruits ou graines, des produits alimentaires courants dans les régimes de lémuriens. On trouve aussi les fougères près du sol alors que les lémuriens passent le plus clair de leur temps dans les arbres. Enfin, les fougères ont un goût désagréable en raison de la haute teneur en tanins dans leurs frondes. De même, les mangroves semblent être rarement exploitées par des lémuriens en raison de leur forte teneur en tanins[86]. Quelques lémuriens semblent s'être adapté aux plantes possédant des moyens de défense usuels comme les tanins et les alcaloïdes[73]. L'Hapalémur doré (Hapalemur aureus), par exemple, mange du bambou géant (Cathariostachys madagascariensis), qui contient des concentrations élevées en cyanure. Ce lémurien peut consommer quotidiennement douze fois la dose létale pour la plupart des mammifères. Les mécanismes physiologiques qui le protègent contre l'empoisonnement au cyanure sont inconnus[11]. Au centre de lémuriens de Duke aux États-Unis, des lémuriens qui errent dans des enclos extérieurs mangent du Sumac grimpant (Taxicodendron radicans) sans montrer d'effets néfastes[58].

Bon nombre d'espèces de lémuriens consomment des feuilles (folivorie)[86] notamment les indriidés[60]. Certains lémuriens plus petits, comme les genres Lepilemur et les Avahi, mangent aussi beaucoup de feuilles, faisant d'eux les plus petits primates à le faire[62]. Les plus petits des lémuriens n'en consomment généralement pas beaucoup[86]. On a constaté que l'ensemble des lémuriens consommaient au moins 82 familles de plantes indigènes et 15 familles de plantes exotiques. Les lémuriens ont tendance à être sélectifs dans les parties et l'âge des feuilles et des pousses qu'ils consomment. Souvent, ils préfèrent les jeunes feuilles aux feuilles matures[86].
De nombreux lémuriens qui mangent des feuilles ont tendance à le faire pendant les périodes où les fruits sont rares, ce qui entraine parfois des pertes de poids[87]. La plupart des espèces de lémuriens, dont la plupart des plus petits mais pas certains indriidés, mangent surtout des fruits lorsqu'il y en a de disponibles. Des études ont montré que, collectivement, les lémuriens consommaient les fruits d'au moins 86 familles de plantes indigènes et de 15 familles de plantes exotiques. Comme chez la plupart des animaux qui consomment des fruits tropicaux, les différentes espèces de figues constituent le fruit préféré des lémuriens[86]. Chez de nombreux anthropoïdes, les fruits sont une des principales sources de vitamine C, mais à la différence des anthropoïdes, les lémuriens (et tous les strepsirrhiniens) peuvent synthétiser la vitamine C[88]. Les premiers lémuriens élevés en captivité ont eu des régimes qui comportaient beaucoup de fruits riches en vitamine C ce qui pouvait provoquer une hémosidérose, une maladie par surcharge en fer, la vitamine C augmentant l'absorption du fer. Cependant la plupart des lémuriens ne sont pas sujets à cette maladie, dont la fréquence varie selon les lieux d'élevage et peut dépendre de l'alimentation, des protocoles d'élevage et des caractéristiques génétiques. Les hypothèses relatives au problème doivent être testés séparément pour chaque espèce[89]. Le lémur catta, par exemple, semble être moins enclin à la maladie que d'autres espèces de lémuriens[90].
On connait seulement huit espèces de lémuriens qui consomment des graines (granivores), mais cela peut être sous-estimé, car la plupart des observations qui rapportent la consommation de fruits ne semblent pas avoir étudié la consommation de graines. Ces lémuriens incluent certains indriidés, comme le Propithèque à diadèmes(Propithecus diadema), le Propithèque à couronne dorée (Propithecus tattersalli), l'indri[11],[64] et l'aye-aye. L'aye-aye, qui se spécialise dans une alimentation difficile, peut broyer des graines de Canarium, qui sont trop dures pour être cassées par les singes du Nouveau Monde[46]. Les lémuriens consomment les graines d'au moins 36 genres de 23 familles de plantes[86].
Les lémuriens allant des minuscules microcèbes aux relativement grands Varecia consomment les inflorescences (grappes de fleurs) d'au moins 60 familles de plantes. Si elles ne consomment parfois pas les fleurs, certaines espèces en consomment le nectar (nectarivores) ou/et le pollen (pollinivores). Au moins 24 espèces indigènes de 17 familles de plantes servent à la consommation de nectar ou de pollen par les lémuriens[86].
Quelques espèces de lémuriens consomment l'écorce et la gomme des arbres. 18 espèces de plantes sont ainsi utilisées pour leur sève et ce seulement dans les régions sèches du sud et de l'ouest de Madagascar. Seul le Phaner à fourche (Phaner furcifer) et le Microcèbe de Coquerel consomment régulièrement la gomme des arbres. Les écorces n'ont jamais été signalées comme une denrée alimentaire importante dans l'alimentation des lémuriens, mais au moins quatre espèces en mangent : l'aye-aye, le Lépilémur à queue rousse (Lepilemur ruficaudatus), le Lémur brun (Eulemur fulvus) et le Propithèque de Verreaux (Propithecus verreauxi). Dans la plupart des cas la consommation d'écorce est directement liée à l'absorption de gommes, sauf pour les écorces d'Afzelia bijuga consommées par les aye-ayes dans la région de Nosy Mangabe au nord de Madagascar[86].
Les lémuriens consomment aussi de la terre (géophagie) ce qui aide probablement à la digestion, apporte des minéraux et des sels, et aide à absorber les toxines. Les propithèques mangent des termitières, absorbant éventuellement une flore intestinale qui facilitera la digestion de la cellulose des feuilles[58].
Les systèmes sociaux
Les lémuriens sont des animaux sociaux qui vivent en groupes comprenant habituellement moins de 15 individus[11]. Les modèles sociaux observés comprennent les types « solitude, mais sociabilité », « fission-fusion », « vie de couple » et « groupe multi-mâles »[91]. Les lémuriens nocturnes sont souvent solitaires, mais sociaux, recherchant leur nourriture seuls la nuit, mais nichant souvent en groupe pendant la journée. Le degré de socialisation varie selon l'espèce, le sexe, le lieu et la saison[26],[36]. Chez de nombreuses espèces nocturnes, par exemple, les femelles, avec leurs petits, partagent leurs nids avec d'autres femelles et peut-être un mâle, dont le territoire vital contiendrait une ou plusieurs femelles reproductrices. Chez les lépilémurs et les phaners, une ou deux femelles peuvent partager un même territoire, éventuellement avec un mâle. En plus de partager les mêmes nids, ils peuvent également interagir vocalement ou physiquement avec leurs petits pendant qu'ils cherchent leur nourriture au cours de la nuit[36]. Les lémuriens diurnes présentent de nombreux systèmes sociaux analogues à ceux des singes[11],[36] vivant de façon relativement permanente et cohérente en groupes sociaux. Les groupes à plusieurs mâles sont les plus communs, comme chez la plupart des primates anthropoïdes. Les eulémurs utilisent ce système social, vivant souvent en groupes de dix individus ou moins. On a constaté que les Varecia vivaient en système fission-fusion[36] et les indris vivent en couple[91].

Certaines espèces de lémuriens femelles sont philopatres, les femelles vivant sur leur lieu de naissance et les mâles émigrant lorsqu'ils atteignent l'âge adulte, alors que chez d'autres espèces les deux sexes vont migrer[11]. Dans certains cas, la philopatrie des femelles comme trouvée chez le Lémur catta, le propithèque de Milne-Edwards (Propithecus edwardsi) et le propithèque de Verreaux. Leurs ancêtres étaient peut-être plus solitaires, avec des femelles qui vivaient en dyades mère-fille. Au fil du temps, ces dyades ont pu s'allier entre dyades voisines afin de pouvoir mieux défendre des ressources réparties sur un plus vaste territoire. Si cela est vrai, les groupes multi-mâles des lémuriens peuvent être fondamentalement différents dans leur structure interne de ceux des primates catarrhiniens (singes du Vieux Monde et grands singes)[92].
La dominance sociale des femelles retrouvée chez les lémuriens les met à l'écart de la plupart des autres primates et des mammifères[11],[36],[39],[93] ; chez la plupart des primates, les mâles sont dominants sauf lorsque les femelles se mettent ensemble pour les chasser[94]. Cependant, de nombreuses espèces d'eulémurs font exception[36],[66] et le grand hapalémur (Prolemur simus) ne connait pas de dominance des femelles[95]. Lorsque les femelles sont dominantes au sein d'un groupe, la façon dont elles exercent leur domination varie. Les lémurs catta mâles agissent docilement, qu'il y ait ou non des signes d'agressivité des femelles alors que les lémurs couronnés mâles (Eulemur coronatus), ne se montreront soumis que si les femelles se montrent agressives à leur égard. L'agressivité des femelles est souvent associée à, mais sans s'y limiter, l'alimentation[96].
Il y a eu de nombreuses hypothèses pour tenter d'expliquer pourquoi, chez les lémuriens, la dominance sociale est assurée par les femelles alors que ce n'est pas le cas chez les autres primates ayant des structures sociales similaires[11],[93] mais il n'y a toujours aucun consensus après des décennies de recherche. L'opinion dominante dans la littérature est que la domination féminine est une caractéristique avantageuse compte tenu des coûts reproductifs et de la rareté des ressources disponibles[93]. En effet, on a montré que la domination des femelles est liée à une augmentation de l'investissement maternel[94]. Toutefois, lorsqu'on a comparé ce mode de vie dans des conditions de coûts reproductifs et d'extrême saisonnalité des ressources avec celui des autres primates, les autres primates ont une dominance mâle même dans des conditions plus difficiles que celles rencontrées par les lémuriens. En 2008, une nouvelle hypothèse a vu le jour en utilisant la théorie des jeux simples. On a fait valoir que, lorsque deux individus de force équivalente se battent, celui qui a le plus besoin de gagner remporte le conflit car c'est lui qui a le plus à perdre. Par conséquent, la femelle, qui a besoin de plus de ressources pour sa grossesse, son allaitement et les soins maternels, est plus susceptible de gagner dans les conflits avec des mâles de taille égale. Ceci, cependant, suppose un monomorphisme entre les sexes[93]. L'année suivante, une nouvelle hypothèse a été proposée pour expliquer ce monomorphisme, expliquant que la plupart des femelles n'étant réceptives sexuellement que pendant un jour ou deux par an, les mâles peuvent utiliser une forme plus passive de gardiennage : les bouchons copulateurs, qui bloquent l'appareil reproducteur féminin et qui empêchent les autres mâles de s'accoupler avec elle avec succès, et réduisent donc le besoin d'agressivité et la nécessité d'une évolution vers un dimorphisme sexuel[32].

En général, le niveau d'agressivité a tendance à être corrélé à la longueur relative des canines. Le lémur catta a de longues canines pointues à la mâchoire supérieure chez les deux sexes et un niveau élevé d'agonisme. Au contraire, l'Indri, qui a des canines plus petites, a un comportement moins agressif[30]. Lorsque des groupes voisins de la même espèce s'affrontent pour défendre leurs territoires, le conflit peut prendre une forme ritualisée. Chez les propithèques, ces combats ritualisés comportent des affrontements du regard, des grognements, des marquages odorants et des sauts pour occuper certaines parties de l'arbre. L'indri défend son territoire par des combats de « chants rituels »[11](appelés chants d’Eurélien).
Comme chez les autres primates, les lémuriens s'épouillent mutuellement pour apaiser les tensions et améliorer les relations. Ils s'épouillent en guise de salutation, au réveil, au moment d'aller dormir, entre mère et enfant, dans les relations entre jeunes et pour des avances sexuelles[97]. Contrairement aux primates anthropoïdes, qui écartent les poils avec les mains et ramassent les parasites avec les doigts ou la bouche, les lémuriens épouillent avec la langue et en grattant les poils avec leur peigne dentaire[11],[97]. Malgré les différences dans la technique, les lémuriens s'épouillent avec la même fréquence et pour les mêmes raisons que les anthropoïdes[97].
Rythmes d'activité
La période d'activité se situe généralement la nuit chez les petits lémuriens et le jour chez la plupart des plus grands. On ne trouve pas d'activité diurne chez tous les autres prosimiens[26]. Il existe une activité cathémérale -où un animal est actif sporadiquement jour et nuit- chez quelques-uns des plus grands lémuriens. Rares sont les autres primates présentant ce genre de cycle d'activité[98], régulier ou irrégulier suivant les conditions changeantes d'environnement[11]. Les lémuriens à cycle cathéméral les mieux étudiés sont les eulémurs[39],[99]. Même si le lémur mongos (Eulemur mongoz) est l'exemple le mieux documenté, toutes les espèces étudiées de ce genre ont montré un certain taux de comportement cathéméral[66] bien que l'activité nocturne soit souvent limitée par la possibilité d'avoir une certaine luminosité et soit donc dépendante du cycle lunaire[12]. Ce type de comportement a été étudié dans les années 1960 chez des espèces d'eulémurs ainsi que d'autres espèces de Lemuridae, comme les Varecia et les Hapalemur. Initialement défini comme « crépusculaire » (actif à l'aube et au crépuscule), ce comportement a été étudié par des recherches supplémentaires effectuées par l'anthropologue Ian Tattersall qui a inventé le nouveau terme « cathéméral »[98], bien que de nombreux non-anthropologues préfèrent les termes « circadiens » ou « journaliers »[12].

Afin d'économiser l'énergie et l'eau dans un environnement très variable selon les saisons[83],[100], les microcèbes et les chirogales ont des cycles saisonniers avec une période de dormance, où le métabolisme et la température corporelle sont abaissés. Ce sont les seuls primates connus à le faire[83]. Ils accumulent des réserves de graisse dans leurs pattes postérieures et la base de leur queue avant la saison sèche, avant que la nourriture et l'eau deviennent rares[28],[84], ils peuvent présenter des périodes de torpeur courtes ou prolongées pendant la saison sèche. Les périodes courtes durant moins de 24 heures alors que les périodes prolongées durent en moyenne deux semaines et voient les animaux présenter des signes d'hibernation[83]. Les microcèbes ont des périodes de torpeur courtes qui se répètent plusieurs jours consécutifs, tandis que les chirogales hibernent pendant six à huit mois chaque année[26],[28],[85] en particulier sur la côte ouest de Madagascar[100].
Les chirogales sont les seuls primates connus pour hiberner pendant des périodes prolongées[83],[101]. Contrairement à d'autres mammifères qui hibernent dans les régions tempérées et qui se réveillent régulièrement pendant quelques jours, ces lémuriens peuvent hiberner profondément pendant cinq mois en continu (de mai à septembre). Avant et après cette longue période d'hibernation, il y a deux mois (avril et octobre) de transition, où ils se nourrissent de façon limitée pour éviter d'utiliser leurs réserves de graisse[100]. Contrairement aux autres mammifères qui hibernent chez qui la température corporelle reste basse et stable, leur température varie en fonction de la température ambiante[28],[85],[100].
Les lémuriens qui ne présentent pas de période de dormance économisent leur énergie en sélectionnant des microhabitats thermorégulés (tels que des trous d'arbres), partageant les mêmes nids et réduisant les surfaces du corps exposées au froid en se tenant si possible assis, courbés et blottis les uns contre les autres. En outre, le lémur catta, le Varecia et les propithèques s'exposent au soleil, utilisant le rayonnement solaire au lieu de la chaleur métabolique pour chauffer leur corps[83].
Locomotion

Le mode de déplacement des lémuriens, actuels ou disparus, est très varié et sa diversité dépasse celle des anthropoïdes[36]. Les postures et les comportements adaptés pour se déplacer comportent l'accrochage vertical et le saut (y compris la marche par bonds), trouvé chez les indriidés et les hapalémurs[36],[60] ; la locomotion lente dans les arbres en utilisant les quatre membres (comme retrouvée chez les actuels loris) appliquée autrefois par Mesopropithecus[102] ; les déplacements rapides dans les arbres retrouvés chez les eulémurs et les Varécias[36],[103] ; l'intermittente marche à quatre pattes du Lémur catta ; l'habituelle marche à quatre pattes trouvée autrefois chez les Archaeolemuridae comme Hadropithecus[36] et le lent déplacement en suspension, autrefois utilisé par de nombreux Palaeopropithecidae, comme Palaeopropithecus[11],[36] L'Hapalémur gris d'Alaotra (Hapalemur alaotrensis) est même considéré comme un bon nageur[11]. Parfois, ces types de locomotion sont utilisés pour partager les lémuriens en deux groupes : les lémuriens à accrochage vertical et saut et ceux se déplaçant avec leurs quatre membres dans les arbres ou sur le sol[58].
Les prouesses de saut des indriidés sont bien connues et sont un sujet d'attraction des écotouristes visitant Madagascar[104]. Avec leurs longues pattes arrière puissantes, ils se propulsent en l'air pour arriver en position verticale sur un arbre voisin, accrochant le nouveau support vertical des deux mains et des deux pieds[13]. Les Indriidés peuvent ainsi parcourir jusqu'à 10 m en sautant rapidement de tronc d'arbre en tronc d'arbre[13],[63], une caractéristique appelée « sauts en ricochets »[73]. Le Propithèque de Verreaux (Propithecus verreauxi) parvient à se déplacer ainsi dans les forêts épineuses du sud de Madagascar. On ne sait pas comment il évite de s'empaler les paumes sur les troncs couverts d'épines des arbres tels que les Alluaudia[13]. Lorsque la distance entre les arbres est trop grande, ces propithèques vont descendre sur le sol et se déplacer sur le sol sur plus de 100 m, debout, en bondissant sur le côté, les bras écartés et en balançant de haut en bas la moitié supérieure du corps et la tête, sans doute pour des questions d'équilibre[13],[63]. On appelle parfois ce mode de déplacement « danse-saut »[13].
Communication
| Fichiers audio | |
| Duo d'Indris | |
| Le chant lamentatif d'indris. | |
| Grincements suraigus et rapides d'un microcèbe mignon | |
| Appel d'alarme, émis en cas de surprise (microcèbe mignon). | |
| Caquètement d'un lémur catta | |
| Vocalise de défense, en cas de confrontation (lémur catta). | |
| Chœur de grognements et hurlements de varis | |
| Signal d'espacement entre groupes (varis). | |
| Trois types de clics suivis de jappements bruyants | |
| Alerte avisant d'un mammifère prédateur, par un lémur catta. | |
| Braillements pulsés de forte intensité | |
| Alerte avisant d'un mammifère prédateur, par un vari. | |
Des difficultés à utiliser ces médias ? | |
|---|---|
Les lémuriens peuvent communiquer par la voix, la vue et l'odorat. Le lémur catta, par exemple, utilise des comportements complexes fortement stéréotypés tels que les marquages odorants et les vocalisations[82]. Ils utilisent probablement moins les signaux visuels car il leur manque la plupart des muscles utilisés par les autres primates pour les expressions faciales[80]. Du fait de leur mauvaise vue, les postures du corps entier sont probablement plus efficaces. Toutefois, le lémur catta possède plusieurs expressions faciales, telles que la fixité du regard pour la menace, les lèvres tirées vers l'arrière pour la soumission et les oreilles tirées en arrière avec les narines dilatées pendant qu'ils marquent un endroit de leur odeur[82]. On a observé aussi que cette espèce utilisait le bâillement comme signe de menace[105],[106]. Leur queue rayée sert également à communiquer à distance, mettant en garde les troupes voisines et aidant à localiser les membres de la troupe[82]. On sait que les propithèques se tiennent bouche ouverte pour jouer[107] de même qu'ils font une grimace en montrant les dents en signe de soumission dans les confrontations agressives[64].

L'odorat est particulièrement important chez les lémuriens[11] sauf pour l'indri qui n'a pas la plupart des glandes odoriférantes des autres lémuriens et a une région olfactive considérablement réduite dans le cerveau[73]. L'olfaction peut servir à transmettre des informations sur l'âge, le sexe, le statut de reproduction, ainsi que pour marquer les limites d'un territoire, ce qui est très utile pour communiquer entre animaux qui se rencontrent rarement[46]. Les petits lémuriens nocturnes marquent leur territoire avec de l'urine, tandis que les plus grands, les espèces diurnes, utilisent des glandes odoriférantes situées sur différentes parties de leur anatomie. Le lémur catta se livre à des « combats de puanteur » en frottant leur queue sur les glandes odorantes de leurs poignets, puis en effleurant de leur queue d'autres adversaires mâles. Certains lémuriens défèquent dans des endroits spécifiques, comportement connu comme « comportement des latrines ». De nombreux animaux présentent ce comportement mais il est rare chez les primates. Ce comportement peut correspondre à un marquage territorial et une signalisation inter espèces[12].
Par rapport à d'autres mammifères, les primates sont en général très vocalisateurs et les lémuriens ne font pas exception[12]. Quelques espèces de lémuriens ont de vastes répertoires vocaux, comme le Lemur catta et les Varecias[82],[108]. Certains des appels les plus courants entre lémuriens sont des cris d'alarme contre les prédateurs. Les lémuriens répondent non seulement aux appels d'urgence de leur propre espèce, mais aussi aux cris d'alarme des autres espèces et des oiseaux non-prédateurs. Le Lémur catta et quelques autres espèces ont différents appels et réactions à certains types spécifiques de prédateurs[36]. Dans les appels d'accouplement, on a démontré que les microcèbes qui ne peuvent se voir réagissent plus fortement à l'appel de leur propre espèce, en particulier lorsqu'ils entendent des appels d'autres microcèbes que ceux qu'ils rencontrent normalement dans leur domaine vital[67]. L'appel des lémurs peut aussi être très fort et parcourir de longues distances. Les Varécias utilisent plusieurs appels bruyants qui peuvent être entendus jusqu'à 1 km par journée claire et calme[108]. Le plus bruyant est l'Indri, dont les appels peuvent être entendus jusqu'à 2 km ou plus[47],[57] et qui peut donc communiquer efficacement jusqu'aux frontières de son territoire qui couvre 34 à 40 hectares[73]. Les varécias et les indris ont des appels contagieux où un individu ou un groupe commence à appeler fort et d'autres individus ou groupes vont se joindre à eux[57],[108]. Le chant des indris peut durer de 45 secondes à plus de 3 minutes et tend à se coordonner pour former des duos comparables à ceux des gibbons[57],[62].
La communication tactile (toucher) est principalement utilisée par les lémuriens pour le toilettage, bien que les lémurs cattas se regroupent pour dormir (dans un ordre déterminé par leur rang), tendent la main et le bras à ceux d'à côté et en calottent d'autres. Chez cette espèce tendre la main pour toucher un autre individu est un signe de soumission, effectué par les animaux les plus jeunes ou plus âgés soumis à des membres dominants de la troupe. Le toilettage réciproque, toutefois, semble se produire plus fréquemment entre individus de rang plus élevé, une caractéristique partagée par d'autres espèces de primates[109]. Contrairement aux primates anthropoïdes, le toilettage des lémuriens semble être plus intime et mutuel, souvent directement réciproque. Chez les anthropoïdes, d'autre part, l'utilisation du toilettage des autres peut servir à gérer les interactions agressives[110]. Le Lemur catta est connu pour son besoin de toucher passant entre 5 et 11 % de son temps au toilettage[109].
Prédation
Tous les lémuriens subissent une certaine pression de la part des prédateurs[111] mais ils ont un système de défense commun en ayant recours à des cris d'alarme et au harcèlement de l'ennemi[112], surtout chez les lémuriens diurnes[36]. Leur possibilité de sauter d'arbre en arbre semble être une évolution pour éviter des prédateurs plutôt qu'un véritable système de déplacement selon une étude de cinématique[113]. Les lémuriens nocturnes sont difficiles à voir et à suivre à la trace la nuit et ils diminuent leur visibilité en cherchant leur nourriture seuls. Ils cherchent également à éviter les prédateurs en dormant dans des lieux bien cachés, comme des nids, des trous d'arbres ou de la végétation dense[36] et en utilisant des lieux de couchage multiples[28]. Même les états de torpeur ou d'hibernation des cheirogalidés peuvent être dus en partie à des risques élevés de prédation[111]. Les jeunes sont protégés lorsque les parents partent en quête de nourriture, soit en les laissant dans le nid ou en les laissant dans une cache où ils restent immobiles en l'absence du parent[36].
Les lémuriens diurnes sont bien visibles pendant la journée, mais ils vivent en groupes, augmentant ainsi le nombre d'yeux et d'oreilles aidant à la détection des prédateurs. Ils utilisent et répondent aux cris d'alarme, même à ceux d'autres espèces de lémuriens et d'oiseaux non-prédateurs. Le lémur catta a différents types d'appels et de réactions selon les différentes classes de prédateurs : oiseaux prédateurs, mammifères ou serpents[36]. Certains lémuriens, tels que l'Indri, utilisent le camouflage utiliser pour se cacher. On les entend souvent mais on les voit difficilement dans les arbres en raison de leur pelage tacheté, qui leur a valu la réputation d'être des « fantômes de la forêt »[73].
Reproduction
À part l'aye-aye et l'Hapalémur gris d'Alaotra, les lémuriens ont une reproduction saisonnière[11],[39] avec une période d'accouplement très courte et une saison des naissances influencées par la disponibilité très saisonnière des ressources de leur environnement. La saison des amours dure habituellement moins de trois semaines chaque année[36], le vagin de la femelle ne s'ouvrant que pendant quelques heures ou quelques jours au moment où elle est le plus fécondable[78]. Ces périodes de reproduction et de possibilité de grossesse courtes pourraient se rapporter à leurs périodes de gestation courte, à leur développement rapide et à faible métabolisme de base, ainsi qu'au coût élevé d'énergie demandé aux femelles qui se reproduisent. Il pourrait également être en relation avec un taux de mortalité relativement élevé chez les femelles adultes et une proportion plus forte de mâles adultes dans certaines populations de lémuriens, deux caractères inhabituels chez les primates. Chez l'aye-aye et l'Hapalémur gris d'Alaotra, la période des naissances s'étale sur une période de six mois[11].
La période l'accouplement et de naissance afin que la période de sevrage des lémuriens sont synchronisées pour correspondre à la période de plus grande disponibilité des aliments[78],[87]. Le sevrage se produit avant ou peu après l'éruption des premières molaires permanentes chez les lémuriens[30]. Les microcèbes sont en mesure d'adapter leur cycle de reproduction sur la saison des pluies, alors que les grandes lémuriens, comme les propithèques, doit allaiter pendant deux mois de saison sèche[87]. Chez certaines espèces comme le propithèque de Milne-Edward, la survie infantile est directement en relation avec les conditions environnementales et le rang, l'âge et la santé de la mère. La saison de reproduction est également affectée par la situation géographique. Par exemple, les microcèbes mettent bas entre septembre et octobre dans leur habitat naturel de l'hémisphère sud, mais de mai à juin en captivité dans l'hémisphère nord[78].

Les odeurs jouent un rôle très important dans la reproduction de lémuriens. Les marquages odorants s'intensifient au cours de la saison des amours. Les phéromones peuvent synchroniser le calendrier de reproduction pour que les femelles deviennent fécondes[78]. L'accouplement peut être monogame ou de promiscuité tant pour les mâles que pour les femelles, et peut aller jusque avec des individus extérieurs au groupe[11],[36]. Les principaux lémuriens monogames sont le Lémur à ventre roux (Eulemur rubriventer) et le Lémur mongos (Eulemur mongoz), quoiqu'on ait observé chez ce dernier des manquements à la règle[36]. La monogamie est très courante chez les espèces nocturnes, même s'il une certaine démonstration de puissance, mise à l'écart sexuel des subordonnés, ou compétitions entre mâles qui permettent d'éviter des combats directs[30]. Chez les microcèbes, les mâles utilisent des bouchons spermatiques, ont les testicules qui gonflent au cours de la saison des amours et développent un dimorphisme de taille (probablement en liaison avec le gonflement des testicules). Ce système de reproduction se rencontre chez les espèces où les mâles ne peuvent pas défendre les femelles ou ne disposent pas d'arguments pour les séduire[114].
La période de gestation varie chez les lémuriens, allant de 9 semaines chez les Microcèbes, 9 à 10 semaines chez les Chirogales à 18 à 24 semaines chez les autres lémuriens[78]. Les plus petits, les lémuriens nocturnes, comme les Microcèbes, les Mirzas et les Chirogales, donnent généralement naissance à plusieurs petits, alors que les plus grands, les lémuriens diurnes, comme les Phaners, les Lépilémurs et l'aye-aye ont généralement un seul petit[26]. Les Chirogales et les Microcèbes peuvent avoir jusqu'à quatre petits mais n'en ont le plus souvent que deux. Les Varecias sont les seuls grands lémuriens diurnes à toujours donner naissance à deux ou trois petits. Tous les autres lémuriens ne donnent naissances qu'à un seul petit. Les jumeaux chez les lémuriens sont normalement dizygotes, et on sait que cela se produit toutes les cinq à six mises bas chez le lémur catta et certains Eulemur[78].
Les petits nés, la mère peut soit les transporter ou les cacher pendant qu'elle cherche sa nourriture. Lors du transport, les nourrisson sont, soit accrochés à la fourrure de la mère soit transportés dans la bouche saisis par la peau du cou. Chez certaines espèces, comme les Hapalemur, les bébés sont portés par la bouche jusqu'à ce qu'ils soient capables de s'accrocher à la fourrure de leur mère[115]. Les espèces qui cachent leur progéniture sont les espèces nocturnes (par exemple, les microcèbes, les lépilémurs et les chirogales), le hapalémurs et les varécias[26],[115]. Chez les varecias, les jeunes sont nidicoles et les mères construisent des nids pour eux, un peu comme chez les plus petits lémuriens nocturnes[11]. Les avahis ont un comportement particulier pour des lémuriens nocturnes, car ils vivent en groupes familiaux soudés et emmènent leurs petits avec eux plutôt que de les laisser dans un nid[60],[61]. La pluriparentalité a été rapportée dans toutes les familles de lémuriens, sauf les lépilémurs et l'aye-aye. On l'a retrouvé aussi entre familles[116]. Même les mâles prennent soin des petits dans les espèces telles que le Lémur à ventre roux, le Lémur mongos[66], l'Hapalémur gris, le Sifaka soyeux[116], le Chirogale moyen[117] et les Varecia[118].
Pourtant, un autre trait qui caractérise la plupart des lémuriens en dehors des primates anthropoïdes est leur longue durée de vie ainsi que leur taux de mortalité infantile élevé[87]. Beaucoup de lémuriens comme le Lemur catta, se sont adaptés à un environnement hautement saisonnier, qui affecte leur taux de natalité, d'arrivée à l'âge adulte et de gémellité (r-sélection). Cela les aide à se remettre rapidement d'un effondrement de population[82]. En captivité, les lémuriens peuvent vivre deux fois plus longtemps qu'à l'état sauvage, bénéficiant d'une nutrition consistante qui répond à leurs besoins alimentaires, de soins médicaux et d'une meilleure compréhension de leurs besoins en logement. En 1960, on pensait que les lémuriens pouvaient vivre entre 23 et 25 ans. On sait maintenant que les plus grandes espèces peuvent vivre plus de 30 ans, sans signes de vieillissement (sénescence) et être encore capable de se reproduire[78].
Les aptitudes cognitives et d'utilisation d'outils
Les lémuriens sont traditionnellement considérés comme moins intelligents que les primates anthropoïdes[119], décrits comme étant plus malins[13]. De nombreuses espèces de lémuriens, tels que les propithèques et le lémur catta, ont obtenu des notes inférieures aux singes à des tests conçus pour les singes ou non[13],[97]. Ces comparaisons ne peuvent pas être justes puisque les lémuriens préfèrent manipuler des objets avec la bouche (plutôt qu'avec les mains) et ne s'intéressent pas aux objets quand ils sont en captivité[97]. On n'a jamais vu de lémuriens utiliser d'outils à l'état sauvage mais on a montré, qu'en captivité, le Lémur fauve et le Lémur catta sont en mesure de comprendre l'utilisation et d'utiliser des outils[12].
Quelques lémuriens ont un cerveau relativement grand. Hadropithecus, aujourd'hui disparu, était grand comme un babouin mâle et avait un cerveau de taille comparable, ce qui lui donne aussi la plus grande taille relative de cerveau par rapport à la taille du corps chez tous les prosimiens[120]. L'Aye-aye a également un grand rapport cerveau-corps, ce qui peut indiquer qu'il a un niveau plus élevé d'intelligence[39]. Cependant, en dépit d'un outil intégré sous la forme de son mince doigt majeur de forme allongée, qu'il utilise pour attraper les larves d'insectes, l'aye-aye a de mauvais résultats aux tests d'utilisation d'outils externes[12].
Écologie
Madagascar n'a que deux zones climatiques radicalement différentes : les forêts tropicales de l'est et les régions sèches de l'ouest[11] mais aussi des périodes de sécheresse prolongées ainsi que des inondations à la suite de cyclones tropicaux[121]. Ces conditions climatiques et géographiques, ainsi que les sols pauvres, la faible productivité des plantes, les vastes zones d'écosystèmes complexes et le manque régulier d'arbres fruitiers (tels que les figuiers) ont conduit à une immense diversité morphologique et comportementale des lémuriens[10],[11],[30],[87]. Leur survie a exigé qu'ils soient capables de supporter des extrêmes persistants[121].


Les lémuriens occupent ou ont occupé les niches écologiques normalement occupées par des singes, les écureuils, les pics et les pâturages des ongulés[13]. La diversité des adaptations pour des niches écologiques spécifiques, les sélections d'habitat entre familles de lémuriens et certains genres souvent très distincts, minimisent la concurrence[11]. Parmi les lémuriens nocturnes vivant dans les forêts de l'ouest de l'île, cinq espèces peuvent coexister pendant la saison humide en raison de l'abondance de la nourriture. Cependant, pour supporter les périodes de sécheresse extrême, trois des cinq espèces utilisent des habitudes alimentaires et des caractéristiques physiologiques qui leur permettent de coexister : Les Phaner se nourrissent de la gomme des arbres, les Lepilemur des feuilles, et les Mirzas parfois de sécrétions d'insectes. Les deux autres espèces, le Microcèbe mignon et le Chirogale moyen (Cheirogaleus medius), évitent la concurrence par une activité réduite. Le Microcèbe mignon présente des épisodes de torpeur, tandis que le Chirogale moyen hiberne complètement[26]. De même, sur la côte est des genres entiers ont des aliments spécifiques pour éviter trop de chevauchement dans la niche. Les Eulémurs et les Varecias sont frugivores, les indriidés sont folivores et les Hapalémurs se nourrissent presque exclusivement de bambous et d'autres graminées. Une fois de plus, des différences saisonnières de régime alimentaire ainsi que de subtiles différences dans les préférences alimentaires, les strates de forêt utilisées, les périodes d'activité, l'organisation sociale permettent aux différentes espèces de lémuriens de coexister, mais cette fois-ci, les espèces sont plus étroitement liées et ont des niches écologiques similaires[11]. Un exemple classique concerne le partage des ressources entre les trois espèces d'Hapalémurs qui vivent proches les unes des autres sur de petites surfaces : l'Hapalémur doré, le grand Hapalémur et l'Hapalemur gris. Chacun utilise des espèces différentes de bambou, différentes parties de la plante ou de étages différents dans la forêt[13],[51]. La teneur en éléments nutritifs et en toxines (comme le cyanure) aide aussi à réguler le choix des aliments[11], même si des préférences alimentaires suivant les saisons jouent également un rôle[51].
Les régimes alimentaires des lémuriens comprennent la consommation de feuilles, de fruits ou un régime omnivore, certains étant très capables de s'adapter tandis que d'autres se spécialisent sur les denrées alimentaires telles que les gommes d'arbre ou les bambous[122]. Dans certains cas, les modes d'alimentation des lémuriens sont bénéfiques à la vie des plantes indigènes. Lorsque les lémuriens consomment du nectar, ils peuvent agir comme pollinisateurs pour autant que les parties fonctionnelles de la fleur ne soient pas endommagées[86]. En fait, plusieurs plantes malgaches montrent des traits spécifiques pour la pollinisation par les lémuriens et les études montrent que certaines espèces de lémuriens diurnes, telles que le lémuriens à ventre roux et les varecias, agissent comme d'importants pollinisateurs[11]. On peut citer deux exemples d'espèces de plantes qui dépendent des lémuriens pour leur pollinisation : l'Arbre du voyageur (Ravenala madagascariensis)[54] et une espèce de liane, Strongylodon cravieniae[11]. Les lémuriens fournissent un autre service aux plantes : la dispersion des graines. Après avoir traversé l'intestin des lémuriens, les graines d'arbres et de lianes lèvent plus facilement et germent plus rapidement[87]. Le comportement pour déféquer de certains lémuriens peut aussi aider à améliorer la qualité des sols et à faciliter la dispersion des graines[12]. En raison de leur importance dans le maintien de la santé des forêts, les lémuriens frugivores peuvent être considérés comme des espèces clés de voûte[87].
Tous les lémuriens, en particulier les plus petites espèces, sont victimes de prédateurs[26],[111] et ils sont des proies importantes pour eux[114]. L'homme est le prédateur le plus important de lémuriens diurnes, malgré les tabous qui de temps en temps interdisent la chasse et la consommation de certaines espèces de lémuriens[11]. Parmi les autres prédateurs les eupleridés, comme les fossas, les chats sauvages, les chiens domestiques, les serpents, les oiseaux de proie diurnes, les hiboux et les crocodiles. Des aigles géants aujourd'hui disparus, comme une ou deux espèces du genre Aquila et l'aigle malgache couronné(Stephanoaetus Mahery), ainsi que le Fossa géant (Cryptoprocta spelea), sont connus pour s'être nourris de lémuriens, peut-être même de lémuriens subfossiles géant ou du moins de leur progéniture subadulte[26],[111]. L'existence de ces animaux géants disparus suggère que des interactions prédateur-proies étaient plus complexes que ce qu'elles sont aujourd'hui[11]. Aujourd'hui, la taille des hiboux ne leur permet que de s'attaquer aux lémuriens les plus petits, pesant généralement 100 g ou moins, tandis que les lémuriens diurnes peuvent être victimes de grands oiseaux de proie diurnes, tels que le Gymnogène de Madagascar (Polyboroides radiatus) et la Buse de Madagascar (Buteo brachypterus)[111].
Recherche
Les similitudes que les lémuriens partagent avec les primates anthropoïdes, comme l'alimentation et l'organisation sociale, ainsi que leurs caractéristiques propres, ont fait des lémuriens les mammifères les plus étudiés de Madagascar[11],[56]. Les recherches portent surtout sur les liens entre l'écologie et l'organisation sociale, mais aussi sur leur comportement et leur morphophysiologie (l'étude de l'anatomie par rapport au fonctionnement)[11]. L'étude de leurs traits de caractère, de leur comportement et de leur relation avec le milieu environnant aide à comprendre l'évolution des primates, car on pense qu'il existe une certaine similitude entre leurs traits et ceux des premiers primates.
Les lémuriens ont fait l'objet d'une série de monographies, de plans d'action, de guides de terrain et d'œuvres classiques en éthologie[56]. Quelques espèces ont été soigneusement étudiées à ce jour mais la plupart des recherches ont été seulement amorcées et limitées à une seule localité[11]. Ce n'est que récemment que de nombreux articles scientifiques ont été publiés pour expliquer les aspects fondamentaux du comportement et de l'écologie d'espèces peu connues. Les études de terrain ont donné un aperçu sur la dynamique des populations et l'écologie évolutive de la plupart des genres et de nombreuses espèces[56]. La recherche à long terme axée sur des individus identifiés en est à ses débuts et n'a été lancée que pour quelques populations. Toutefois, les possibilités d'étude diminuent au fur et à mesure que la destruction de leurs habitats et d'autres facteurs menacent leur existence à travers l'île[11].

Les lémuriens sont mentionnés dans des journaux de voyage de marins dès 1608 et, en 1658, au moins sept espèces de lémuriens ont été décrites en détail par le marchand français, Étienne de Flacourt, qui semble être le seul occidental à avoir vu et décrit un lémurien géant (aujourd'hui disparu) qu'il a appelé le « tretretretre ». À partir de 1703 des marchands et des marins ont commencé à ramener des lémuriens en Europe, parmi lesquels James Petiver, un apothicaire londonien, qui a décrit et dessiné le Lémur mongos. À partir de 1751, l'illustrateur George Edwards a commencé à décrire et dessiner certaines espèces de lémuriens, dont quelques-uns ont été inclus dans les différentes éditions du Systema Naturae de Carl von Linné. Dans les années 1760 et 1770, les naturalistes français Buffon et Daubenton ont commencé à décrire l'anatomie de plusieurs espèces de lémuriens. Le premier naturaliste à être allé sur place voir les lémuriens a été Philibert Commerson en 1771 mais c'est Pierre Sonnerat qui a décrit le plus grand nombre d'espèces de lémuriens cours de ses voyages[121],[123].
Au cours du xixe siècle, il y a une explosion de nouvelles descriptions et dénominations de lémuriens ce qui demandera des décennies pour régler tous les problèmes. Pendant ce temps, les collectionneurs professionnels recueillent des spécimens pour les musées, les ménageries et les vitrines. Parmi les plus grands collectionneurs de l'époque on peut citer Johann Maria Hildebrandt et Charles Immanuel Forsyth Major. Grâce à ces collections, ainsi qu'à l'augmentation des observations de lémuriens dans leur habitat naturel, les systématiciens de musées Albert Günther et John Edward Gray contribuent à créer de nouveaux noms pour de nouvelles espèces de lémuriens. Cependant, les contributions les plus remarquables de ce siècle sont dues aux travaux d'Alfred Grandidier, un naturaliste et un explorateur qui se consacre à l'étude de l'histoire naturelle de Madagascar et de sa population locale. Avec l'aide d'Alphonse Milne-Edwards, il dessine la plupart des lémuriens diurnes. Toutefois, la nomenclature taxonomique lémurien ne prend sa forme moderne que dans les années 1920 et 1930, qui est normalisée par Ernst Schwarz en 1931[121],[123].
Même si la taxonomie des lémuriens est au point, il faut attendre les années 1950 et 1960 pour que les études du comportement in-situ des lémuriens commencent à fleurir. Jean-Jacques Petter et Arlette Petter-Rousseaux visitent Madagascar en 1956 et 1957, dressent les zones de peuplement de nombreuses espèces de lémuriens et font des observations importantes sur leurs comportements sociaux et leur reproduction. En 1960, l'année de l'indépendance de Madagascar, David Attenborough fait connaitre les lémuriens au monde occidental par un film commercial. Sous la direction de Jean-Janusch Buettner, qui crée le centre des lémuriens Duke en 1966, Alison Jolly se rend à Madagascar en 1962 pour étudier le comportement alimentaire et social des lémurs catta et des propithèques de Verreaux à la Réserve privée de Berenty. Jolly et Petters ouvrent une nouvelle ère d'intérêt pour l'étude écologique des lémuriens et ils sont suivis de peu par les anthropologues Alison Richard, Robert Sussman, Ian Tattersall et autres. Après la crise politique du milieu des années 1970 et la révolution malgache, les études de terrain reprennent dans les années 1980, en partie grâce à l'engagement renouvelé du Centre Duke sous la direction de Simons Elwyn et des efforts de protection de Patricia Wright[11],[121],[123]. Dans les décennies qui suivent, des progrès considérables sont accomplis dans la connaissance des lémuriens et de nombreuses espèces nouvelles sont découvertes[4].
Les recherches ex-situ sont également populaires parmi les chercheurs qui essaient de répondre à des questions difficiles à tester sur le terrain. Par exemple, le séquençage du génome du Microcèbe mignon aidera les chercheurs à comprendre quels traits génétiques le séparent des primates et autres mammifères et d'en déduire quels sont les traits du génome humain qui distinguent l'homme des autres primates[31]. Un de ces centres de recherche est le centre des lémuriens Duke à Durham, en Caroline du Nord. Il est le plus important centre de lémuriens captifs en dehors de Madagascar, où ils sont l'objet de recherches non-invasives et de reproduction en captivité[124]. De nombreux projets de recherche importants y ont été menés, y compris des études sur leurs vocalisations[125], leurs modes de déplacement[126], la cinématique de leur déplacement bipéde[127], le rôle du raisonnement transitif dans leur société complexe[128] et les études pour comprendre comment les lémuriens organisent et récupèrent les évènements dans leur mémoire[129]. D'autres centres, tels que la Fondation pour la protection des lémuriens, situé près Myakka City, en Floride, ont également organisé des projets de recherche, comme celui qui s'est penché sur la capacité de lémuriens à préférer les outils en se basant sur leurs qualités fonctionnelles[130].
Conservation


Les lémuriens sont menacés par nombre de problèmes environnementaux, notamment la déforestation, la chasse pour la viande de brousse, le commerce d'animaux exotiques[131] et les changements climatiques[87]. Toutes les espèces sont répertoriées à l'Annexe I par la CITES, qui interdit le commerce de ces spécimens par entier ou parties, sauf à des fins scientifiques[1]. En 2005, l'Union Internationale pour la Conservation de la Nature (UICN) a classé 16 % de toutes les espèces de lémuriens comme en danger critique, 23 % en voie de disparition, 25 % comme vulnérables, 28 % « Données insuffisantes » et seulement 8 % préoccupation mineure[124]. Au cours des cinq dernières années, au moins 28 espèces ont été identifiées mais aucune n'a vu son état de conservation évalué[42]. Beaucoup d'entre elles doivent être considérées comme menacées car ces nouvelles espèces de lémuriens sont généralement confinées à de petits territoires[132]. Étant donnée la vitesse de destruction actuelle des habitats, des espèces pourraient s'éteindre avant d'avoir été identifiées[56]. Depuis l'arrivée des humains sur l'île il y a environ 2 000 ans, toutes les espèces de vertébrés endémiques de Madagascar de plus de 10 kg ont disparu[35] soit 17 espèces, 8 genres et 3 familles de lémuriens[34],[37]. La Commission sur la survie des espèces de l'UICN (UICN/CSE), la Société internationale de primatologie (IPS) et Conservation International (CI) ont inclus cinq lémuriens dans leur tableau biennal du « Top 25 des primates les plus menacés »". La liste 2008-2010 inclut le grand hapalémur, Eulemur cinereiceps, le Lémur aux yeux turquoises (Eulemur flavifrons), le Lépilémur du nord (Lepilemur septentrionalis) et le Sifaka soyeux[133].
Madagascar est l'un des pays les plus pauvres au monde[134],[135] avec un taux de croissance démographique de 2,5 % par an et près de 70 % de la population vivant dans la pauvreté[36],[134]. Le pays est également handicapé par ses lourdes dettes et ses ressources limitées[135]. Ces questions socio-économiques compliquent les efforts de conservation, même si l'île de Madagascar est reconnue par l'UICN/SSC comme une région cruciale pour les primates depuis plus de 20 ans[132]. En raison de sa relativement faible superficie (587 045 km2) comparée aux autres régions de biodiversité de haute priorité et de ses niveaux élevés d'endémisme, le pays est considéré comme l'un des points les plus importants de la biodiversité mondiale, la conservation de lémuriens étant considérée comme d'une haute priorité[124],[132]. Malgré l'accent mis sur leur conservation, il n'y a aucune indication que les extinctions qui ont commencé avec l'arrivée des humains soient finies[35].
Menaces sur la faune sauvage
En 2020, à cause principalement de la déforestation et parfois de la chasse illégale, sur les 107 espèces de lémuriens de Madagascar, la quasi totalité (103) sont menacées de disparition[136]. La liste des 25 primates les plus menacés au monde publiée tous les 2 ans depuis l'an 2000 mentionne 18 espèces de lémuriens en grand danger d'extinction.
Déforestation
La principale préoccupation pour la survie des lémuriens est la destruction et la dégradation de leurs habitats[36],[1]. La déforestation prend la forme d'une utilisation pour la subsistance des habitants, tels que l'agriculture sur brûlis (appelée « tavy » en malgache), la création de pâturages pour le bétail par les incendies, la collecte légale et illégale de bois pour la production de bois de chauffage ou de charbon de bois, la recherche minière et l'exploitation illégale des bois précieux pour les marchés étrangers[36],[131] Après des siècles d'utilisation sans gestion, et l'augmentation rapide de la destruction des forêts depuis 1950[124], moins de 60 000 km2 soit 10 % de la superficie de Madagascar sont encore boisées. Seules 17 000 km2 ou 3 % de la superficie de l'île sont protégées en raison de conditions économiques désastreuses et de l'instabilité politique, la plupart des aires protégées sont gérées et défendues inefficacement[131],[132]. Certaines zones sont naturellement protégées par leur distance, leur isolement, souvent au sommet de falaises abruptes. D'autres, telles que les forêts sèches et les forêts épineuses de l'ouest et du sud, peu protégées, sont en grave danger de destruction[36].
Certaines espèces de lémuriens peuvent être en danger d'extinction, même sans le déboisement complet, comme les Varecias, qui sont très sensibles aux perturbations de leur habitat[56]. Si on enlève les arbres à gros fruits, la forêt peut nourrir moins d'individus d'une espèce et leur chance de reproduction peut être affectée pendant des années[87]. Les petites populations peuvent être en mesure de persister sur des parcelles de forêts isolées pendant 20 à 40 ans à cause de longue durée de vie, mais à long terme, ces populations peuvent ne pas être viables[137]. De petites populations isolées peuvent également disparaitre à la suite de catastrophes naturelles ou d'épidémies (épizooties). Deux maladies qui sont mortelles pour les lémuriens et pourraient peser lourdement sur les populations de lémuriens isolés sont la toxoplasmose, qui se transmet par les chats sauvages, et l'herpès simplex transmis par l'homme[138].

Les changements climatiques et les catastrophes naturelles climatiques menacent aussi la survie des lémuriens. Au cours des 1 000 dernières années, les régions montagneuses de l'Ouest ont connu de plus en plus de sécheresses et, au cours des dernières décennies, les périodes de sécheresse sont devenues beaucoup plus fréquentes. Il y a des signes montrant que la déforestation et la fragmentation des forêts accélèrent ce dessèchement progressif[87]. Les effets de la sécheresse se font encore sentir dans les forêts tropicales. Avec la diminution de la pluviométrie, les grands arbres qui forment la voûte de la forêt souffrent, ce qui augmente leur mortalité, supprime les fruits et diminue la production de nouvelles feuilles, qui sont la nourriture préférée des lémuriens folivores. Les cyclones tropicaux peuvent défolier une région, abattre les arbres de la canopée et créer des glissements de terrain et des inondations. Cela peut laisser les populations de lémuriens sans fruits ou feuilles jusqu'au printemps suivant, les obligeant à consommer des aliments utilisés seulement en cas de crise, tels que les épiphytes[139].
Chasse illégale
Les lémuriens sont chassés pour leur chair par les villageois malgaches, soit pour leur propre subsistance[4],[131] soit pour fournir le marché de la viande de luxe dans les grandes villes[140]. La plupart des ruraux malgaches ne comprennent pas le « danger » de ces méthodes, car la plupart d'entre eux ne savent pas que la chasse des lémuriens est illégale ou que les lémuriens ne vivent qu'à Madagascar[141]. Beaucoup de malgaches ont des tabous, ou « fady », vis-à-vis de la chasse et de la consommation des lémuriens mais cela n'empêche pas leur chasse dans de nombreuses régions[11]. Même si la chasse a été une menace pour les populations de lémuriens dans le passé, elle est récemment devenue une menace beaucoup plus grave car les conditions socio-économiques se détériorent[131]. Les difficultés économiques ont amené les gens à se déplacer dans le pays à la recherche de travail ce qui conduit à abandonner les traditions locales[56],[1],[141]. La sécheresse et la famine peuvent également faire oublier les « fady » qui protègent les lémuriens[56]. Les espèces les plus grandes, telles que les propithèques et les varécias, sont des objectifs communs, mais même les espèces plus petites sont aussi chassées ou capturées accidentellement dans des pièges destinés à des proies plus grosses[4],[1]. Des chasseurs expérimentés organisent des parties de chasse à l'aide d'armes à feu, de pièges et de sarbacanes, tuant jusqu'à huit à vingt lémuriens en une seule chasse. Ces parties de chasse et la pose de pièges à lémuriens peuvent être trouvées dans les zones non-protégées et dans les parties les plus reculées des zones protégées[56]. Les parcs nationaux et autres aires protégées ne sont pas suffisamment protégées par les organismes chargées de faire appliquer la loi[141]. Souvent, il y a trop peu de gardes forestiers pour couvrir une vaste zone et parfois le terrain du parc est trop accidenté pour être vérifié régulièrement[142].
Autre : le commerce d'animaux
Bien qu'elle ne soit pas aussi nuisible que la déforestation et la chasse, le maintien en captivité de certains lémuriens tels que les Lémurs couronnés et d'autres espèces gardés comme animaux de compagnie exotiques par les Malgaches est un élément négatif[47],[124]. Les Hapalémurs sont également capturés pour servir d'animaux de compagnie[124] alors qu'ils ne survivent que deux mois au maximum[143]. La capture d'animaux vivants pour le commerce d'animaux exotiques vers les pays riches ne sont pas normalement considérés comme une menace en raison des règles strictes de contrôle de leur exportation[124],[1].
D’ici à 2070, 95 % de l’habitat des lémuriens de Madagascar pourrait être détruits en raison du réchauffement climatique et de la déforestation[144].
Efforts de conservation

Les lémuriens ont beaucoup attiré l'attention sur Madagascar et ses espèces en voie de disparition. À ce titre, ils agissent comme des espèces phares[56],[124], le plus célèbre d'entre eux étant le Lémur catta qui est considéré comme une icône du pays[54]. La présence de lémuriens dans les parcs nationaux permet la pratique de l'écotourisme[124] qui aide notamment à vivre les communautés locales situées à proximité des parcs nationaux, car elle leur offre des possibilités d'emploi et les communautés reçoivent la moitié des droits d'entrée dans les parcs. Dans le cas du parc national de Ranomafana, les salaires et autres revenus liés à la recherche rivalisent avec les revenus de l'écotourisme[145].
À partir de 1927, le gouvernement malgache a déclaré « protégées » toutes les espèces de lémuriens[65] en créant des zones classées à l'heure actuelle en trois catégories : les Parcs Nationaux, les Réserves Naturelles Intégrales et les Réserves Spéciales. Il y a actuellement 18 parcs nationaux, 5 réserves naturelles et 22 réserves spéciales, ainsi que plusieurs autres petites réserves privées, comme la réserve de Berenty et la réserve privée Sainte Luce, toutes les deux situées près de Fort-Dauphin[124]. Toutes les zones protégées représentent environ 3 % de la surface des terres de Madagascar et sont gérées par Madagascar National Parks, anciennement connue sous le nom d'Association Nationale Pour la Gestion des Aires Protégées (ANGAP), ainsi que d'autres Organisations Non-Gouvernementales (ONG), notamment Conservation International (CI), la Wildlife Conservation Society (WCS) et le Fonds mondial pour la nature (WWF)[124],[132]. La plupart des espèces de lémuriens vivent dans ce réseau d'aires protégées et même quelques espèces peuvent être trouvées dans de nombreux parcs ou réserves[132].
La protection est également facilitée par le Madagascar Fauna Group (MFG), une association de près de 40 zoos et organisations connexes, comme le Centre des lémuriens Duke, la Durrell Wildlife Conservation Trust, le Zoo de San Diego et le Parc zoologique de Saint-Louis. Cette ONG internationale soutient le Parc Ivoloina à Madagascar, aide à protéger la réserve de Betampona et d'autres zones protégées et encourage les recherches sur le terrain, les programmes de sélection, la planification de la protection et la formation des soigneurs dans les jardins zoologiques[146]. Un de leurs grands projets est la remise dans la nature de lémurs catta et varécias nés en captivité pour aider à compenser la diminution de population dans la réserve de Betampona[146],[147].

Des corridors sont nécessaires pour relier ces zones protégées afin que de petites populations ne soient pas isolées[132]. En , à Durban, en Afrique du Sud, l'ancien président de Madagascar, Marc Ravalomanana avait promis de tripler en cinq ans la superficie des aires protégées sur l'île[131]. Cela est maintenant connu sous le nom de « Vision de Durban »[124]. En , le Comité du patrimoine mondial classe une partie importante des forêts tropicales de l'est de Madagascar en tant que nouveau site du patrimoine mondial de l'UNESCO[31].
L'allégement de la dette de Madagascar peut aider le pays à protéger sa biodiversité[135]. Avec la crise politique de 2009, l'exploitation forestière illégale a proliféré et menace maintenant les forêts tropicales dans le nord-est de l'île, y compris leurs lémuriens et l'écotourisme sur lequel les collectivités locales comptent pour leur subsistance[134].
Des populations de lémuriens sont conservées en captivité dans de nombreux zoos à l'extérieur de Madagascar mais que la diversité des espèces est limitée. Les propithèques, par exemple, ne survivent pas bien en captivité, aussi peu de centres zoologiques en ont[11],[57]. La plus importante population captive de lémuriens se trouve au centre des lémuriens Duke dont la mission inclut la recherche non-invasive, la conservation (par exemple l'élevage en captivité), et l'éducation publique[124].
Références culturelles
Dans la culture malgache, les lémuriens et les animaux en général, ont une âme (« ambiroa ») qui peut se venger si on se moque d'eux de leur vivant ou s'ils sont tués de manière cruelle. Pour cette raison, les lémuriens, comme beaucoup d'autres éléments de la vie quotidienne, ont été une source de tabous, connue localement sous le nom de « fady », qui peut reposer sur l'une des quatre croyances de base suivantes : Un village ou une région peut croire qu'un certain type de lémuriens est l'ancêtre du clan. Les gens croient également que l'âme d'un lémurien peut se venger. L'animal peut apparaître aussi comme un bienfaiteur. Les lémuriens peuvent donner leurs qualités, bonnes ou mauvaises, aux bébés humains[148]. En général, le « fady » s'étend au-delà de l'interdit, pouvant comprendre des événements qui portent malheur[74].

Un exemple de « fady » sur les lémuriens a circulé dans les années 1970 vient d'Ambatofinandrahana, dans la province de Fianarantsoa. Selon ce fady, un homme a pris au piège un lémurien vivant. Ses enfants voulaient le garder comme animal de compagnie, mais lorsque le père leur a dit que ce n'était pas un animal domestique, les enfants ont demandé à le tuer. Après avoir été torturé par les enfants, l'animal meurt et est mangé. Un peu plus tard, tous les enfants sont morts de maladie. En conséquence, le père a déclaré que quiconque torture les lémuriens pour le plaisir « sera anéanti et n'aura pas de descendants »[148].
Le fady peut ne pas forcément aider à protéger les lémuriens et leurs forêts dans les situations socio-économiques stables, mais il peut aussi conduire à sa discrimination et à sa persécution, si un lémurien est connu pour apporter le malheur, par exemple, s'il se promène en ville[56],[148]. De plus, le fady ne protège pas tous les lémuriens de la même manière. Par exemple, alors que la chasse et la consommation de certaines espèces peut être taboue, d'autres espèces peuvent ne pas partager la même protection et sont donc tuées à leur place[11],[148]. Le fady peut varier d'un village à l'autre dans la même région[65]. Si les gens déménagent vers un nouveau village ou une autre région, le fady peut ne pas s'appliquer à des espèces de lémuriens qui sont présents localement, ce qui les rend disponibles pour la consommation. Les restrictions sur la consommation de viande de lémuriens peuvent être assouplies en période de famine et de sécheresse[56].
L'aye-aye est presque universellement considéré de façon défavorable dans tout Madagascar[74] même si les contes varient de village en village et de région en région. Si les gens voient une aye-aye, ils peuvent le tuer et pendre le cadavre à un poteau près d'une route à l'extérieur de la ville (pour que les autres puissent emporter le mauvais sort avec eux) ou brûler leur village et aller s'installer ailleurs[48],[65]. Les superstitions veulent que les ayes-ayes tuent et mangent les poulets ou les personnes, tuent les gens dans leur sommeil en leur coupant l'aorte[56] ou, au contraire, qu'ils incarnent les esprits des ancêtres[65] ou qu'ils protègent de la maladie, la mort ou la malchance dans la famille[47],[48]. En 1970, la population du district de Marolambo dans la province de Toamasina craint l'aye-aye, car elle croit qu'il a des pouvoirs surnaturels. De ce fait, personne n'avait le droit de s'en moquer, de tuer ou d'en manger[148].
Il y a aussi des fadys répandus sur les indris et les propithèques. Ils sont souvent protégés de la chasse et de la consommation en raison de leur ressemblance avec les humains et leurs ancêtres, principalement en raison de leur grande taille et de leur posture debout. La ressemblance est encore plus forte pour les Indris, qui n'ont pas la longue queue retrouvée chez la plupart des lémuriens vivants[57],[75]. Connu localement sous le nom de « babakoto » (« ancêtre de l'homme »), l'indri est parfois considéré comme l'ancêtre de la famille ou du clan. Il y a aussi des histoires d'un indri qui a aidé un homme tombé d'un arbre, de sorte qu'ils sont considérés comme des bienfaiteurs[148]. D'autres fadys de lémuriens incluent la croyance qu'une femme aura des enfants laids si son mari tue un avahi ou que si une femme enceinte mange un Moicrocèbe, son bébé aura de grands yeux ronds[148].
Les lémuriens sont également devenus populaires dans la culture occidentale ces dernières années. Le film d'animation Madagascar sorti en 2005 a été vu par 100 millions de personnes dans les salles et 200 à 300 millions de personnes dans le monde entier sur DVD[55]. Avant ce film, Zoboomafoo, une série télévisée pour les enfants distribuée par Public Broadcasting Service (PBS) de 1999 à 2001[149], a aidé à populariser les propithèques en présentant un propithèque de Coquerel du Centre des lémuriens Duke[150]. Une série de vingt épisodes, appelée le « Royaume des lémuriens » (aux États-Unis) ou la « Rue des lémuriens » (au Royaume-Uni et au Canada) a été diffusée en 2008 sur Animal Planet. Elle combine le documentaire animalier typique à la narration dramatique pour raconter l'histoire de deux groupes de lémurs catta à la réserve de Berenty[151],[152],[153],[154]. Un lémurien de compagnie, en France, apparaît dans le film Les Amours d'Anaïs (2021) : les personnages le désignent à l'occasion comme « le singe » mais sont bien conscients qu'il s'agit en fait d'un lémurien.
Annexes
Bibliographie
- (en) F. Ankel-Simons, Primate Anatomy : an introduction, Amsterdam, Academic Press, , 3e éd., 724 p. (ISBN 978-0-12-372576-9 et 0-12-372576-3)
- (en) W. Blunt et W.T. Stearn, Linnaeus : the compleat naturalist, Princeton University Press, , 264 p. (ISBN 978-0-691-09636-0, lire en ligne)
- [PDF] (en) Robin Huw Crompton et William Irvin Sellers, « A consideration of leaping locomotion as a means of predator avoidance in prosimian primates », cité dans (en) K.A.I. Gursky et S.L. Nekaris, Primate Anti-Predator Strategies, Springer, (ISBN 978-1-4419-4190-9, DOI 10.1007/978-0-387-34810-0_6, lire en ligne), p. 127–145
- (en) W.H. Flower et R. Lydekker, An introduction to the study of mammals living and extinct, (ISBN 978-1-110-76857-8, lire en ligne)
- (en) N. Garbutt, Mammals of Madagascar, A Complete Guide, A&C Black éditeurs, , 304 p. (ISBN 978-0-300-12550-4)
- (en) S.M. Goodman et J.P. Benstead, The Natural History of Madagascar, Chicago (Ill.), University of Chicago Press, , 1709 p. (ISBN 0-226-30306-3)
- J.J. Flynn et A.R. Wyss, « Mesozoic Terrestrial Vertebrate Faunas: The Early History of Madagascar's Vertebrate Diversity », p. 34–40
- D.W. Krause, « Late Cretaceous Vertebrates of Madagascar: A Window into Gondwanan Biogeography at the End of the Age of Dinosaursy », p. 40–47
- D.A. Burney, « Madagascar's Prehistoric Ecosystems », p. 47–51
- S.M. Goodman, J.U. Ganzhorn et D. Rakotondravony, « Introduction to the Mammals », p. 1159–1186
- J. Schmid et P.J. Stephenson, « Physiological Adaptations of Malagasy Mammals: Lemurs and Tenrecs Compared », p. 1198–1203
- C.R. Birkinshaw et I.C. Colquhoun, « Lemur Food Plants », p. 1207–1220
- S.M. Goodman, « Predation on Lemurs », p. 1221–1228
- J.U. Ganzhorn, S.M. Goodman et A. Dehgan, « Effects of Forest Fragmentation on Small Mammals and Lemurs », p. 1228–1234
- A.D. Yoder, « Phylogeny of the Lemurs », p. 1242–1247
- L.R. Godfrey et W.L. Jungers, « Subfossil Lemurs », p. 1247–1252
- J. Fietz, « Primates: Cheirogaleus, Dwarf Lemurs or Fat-tailed Lemurs », p. 1307–1309
- P.M. Kappeler et R.M. Rasoloarison, « Microcebus, Mouse Lemurs, Tsidy », p. 1310–1315
- D.J. Overdorff et S. Johnson, « Eulemur, True Lemurs », p. 1320–1324
- T. Mutschler et C.L. Tan, « Hapalemur, Bamboo or Gentle Lemur », p. 1324–1329
- A. Jolly, « Lemur catta, Ring-tailed Lemur », p. 1329–1331
- N. Vasey, « Varecia, Ruffed Lemurs », p. 1332–1336
- U. Thalmann et J.U. Ganzhorn, « Lepilemur, Sportive Lemur », p. 1336–1340
- U. Thalmann, « Avahi, Woolly Lemurs », p. 1340–1342
- U. Thalmann et J. Powzyk, « Indri indri, Indri », p. 1342–1345
- A. Richard, « Propithecus, Sifakas », p. 1345–1348
- E. Sterling, « Daubentonia madagascariensis, Aye-aye », p. 1345–1348
- P.C. Wright et B. Andriamihaja, « The conservation value of long-term research: a case study from the Parc National de Ranomafana », p. 1485–1488
- R.A. Mittermeier, W.R. Konstant et A.B. Rylands, « Lemur Conservation », p. 1538–1543
- E.L. Sargent et D. Anderson, « The Madagascar Fauna Group », p. 1543–1545
- A. Britt, B.R. Iambana, C.R. Welch et A.S. Katz, « Restocking of Varecia variegata variegata in the Réserve Naturelle Intégrale de Betampona », p. 1545–1551
- (en) S.M. Goodman et B.D. Patterson, Natural Change and Human Impact in Madagascar, Smithsonian Institution Press, (ISBN 978-1-56098-682-9)
- E.L. Simons, chap. 6 « Lemurs: Old and New », p. 142–166
- (en) L. Gould et M.L. Sauther, Lemurs : Ecology and Adaptation, New York, Springer, , 450 p. (ISBN 978-0-387-34585-7, lire en ligne)
- L. Gould et M.L. Sauther, « Preface », p. vii–xiii
- I. Tattersall, chap. 1 « Origin of the Malagasy Strepsirhine Primates », p. 3–18
- A. Jolly et R.W. Sussman, chap. 2 « Notes on the History of Ecological Studies of Malagasy Lemurs », p. 19–40
- L.R. Godfrey, W.L. Jungers et G.T. Schwartz, chap. 3 « Ecology and Extinction of Madagascar's Subfossil Lemurs », p. 41–64
- F.P. Cuozzo et N. Yamashita, chap. 4 « Impact of Ecology on the Teeth of Extant Lemurs: A Review of Dental Adaptations, Function, and Life History », p. 67–96
- J. Fietz et K.H. Dausmann, chap. 5 « Big Is Beautiful: Fat Storage and Hibernation as a Strategy to Cope with Marked Seasonality in the Fat-Tailed Dwarf Lemur (Cheirogaleus medius) », p. 97–110
- B.Z. Freed, chap. 6 « Polyspecific Associations of Crowned Lemurs and Sanford's Lemurs in Madagascar », p. 111–132
- D.J. Curtis, chap. 7 « Cathemerality in Lemurs », p. 133–158
- E.J. Sterling et E.E. McCreless, chap. 8 « Adaptations in the Aye-aye: A Review », p. 159–184
- S.E. Johnson, chap. 9 « Evolutionary Divergence in the Brown Lemur Species Complex », p. 187–210
- M.T. Irwin, chap. 14 « Ecologically Enigmatic Lemurs: The Sifakas of the Eastern Forests (Propithecus candidus, P. diadema, P. edwardsi, P. perrieri, and P. tattersalli) », p. 305–326
- J.A. Powzyk et C.B. Mowry, chap. 16 « The Feeding Ecology and Related Adaptations of Indri indri », p. 353–368
- C.L. Tan, chap. 17 « Behavior and Ecology of Gentle Lemurs (Genus Hapalemur) », p. 369–382
- P.C. Wright, chap. 18 « Considering Climate Change Effects in Lemur Ecology », p. 385–402
- J. Ratsimbazafy, chap. 19 « Diet Composition, Foraging, and Feeding Behavior in Relation to Habitat Disturbance: Implications for the Adaptability of Ruffed Lemurs (Varecia variegata editorium) in Manombo Forest, Madagascar », p. 403–422
- R.E. Junge et M. Sauther, chap. 20 « Overview on the Health and Disease Ecology of Wild Lemurs: Conservation Implications », p. 423–440
- (en) Colin P. Groves, « Strepsirrhini », cité dans Don E. Wilson et DeeAnn M. Reeder, Mammal Species of the World : A Taxonomic and Geographic Reference, Baltimore, Johns Hopkins University Press, , 3e éd., 2 volumes, 2142 p. (ISBN 978-0-8018-8221-0, OCLC 62265494, lire en ligne)
- (en) C. Harcourt, « Introduction », cité dans (en) J. Thornback, Lemurs of Madagascar and the Comoros : The IUCN Red Data Book, World Conservation Union, (ISBN 978-2-88032-957-0)
- (en) W.C. Hartwig, The primate fossil record, Cambridge University Press, , 530 p. (ISBN 978-0-521-66315-1, lire en ligne)
- L.R. Godfrey et W.L. Jungers, chap. 7 « Quaternary fossil lemurs », p. 108–110
- (en) Alison Jolly, Lemur Behavior, Chicago, University of Chicago Press, (ISBN 978-0-226-40552-0)
- (la) Carl von Linnaeus, Systema naturae per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis, t. I, Holmiae (Laurentii Salvii), , 10e éd., 824 p. (lire en ligne)
- « Dentes primores ſuperiores IV: intermediis remotis.
inferiores VI, longiores, porrecti, compreſſi, paralleli, approximati.
Laniarii ſolitarii, approximati.
Molares plures, ſublobati: antici longiores acutiores. »
- « Dentes primores ſuperiores IV: intermediis remotis.
- (en) Russell A. Mittermeier, I. Tattersall, W.R. Konstant, D.M. Meyers et R.B. Mast (ill. S.D. Nash), Lemurs of Madagascar, Washington, D.C., Conservation International, , 1re éd., 356 p. (ISBN 1-881173-08-9)
- (en) Russell A. Mittermeier, W.R. Konstant, F. Hawkins, E.E. Louis, O. Langrand, J. Ratsimbazafy, R. Rasoloarison, J.U. Ganzhorn, S. Rajaobelina, I. Tattersall et D.M. Meyers (ill. S.D. Nash), Lemurs of Madagascar, Conservation International, , 2e éd. (ISBN 1-881173-88-7)
- (en) T. Nield, Supercontinent : ten billion years in the life of our planet, Cambridge, Mass., Harvard University Press, , 288 p. (ISBN 978-0-674-02659-9, lire en ligne)
- (en) R.M. Nowak, Walker's Mammals of the World, Johns Hopkins University Press, , 6e éd. (ISBN 0-8018-5789-9)
- (en) M. Platt et A. Ghazanfar, Primate Neuroethology, New York, Oxford University Press, , 670 p. (ISBN 978-0-19-532659-8)
- M. Cartmill, chap. 2 « Primate Classification and Diversity », p. 10–30
- (en) J.M. Plavcan, R. Kay, W.L. Jungers et C. van Schaik, Reconstructing behavior in the primate fossil record, Springer, , 437 p. (ISBN 978-0-306-46604-5, lire en ligne)
- L.R. Godfrey, A.J. Petto et M.R. Sutherland, chap. 4 « Dental ontogeny and life history strategies: The case of the giant extinct indroids of Madagascar », p. 113–157
- (en) K. Preston-Mafham, Madagascar : A Natural History, Facts on File, , 224 p. (ISBN 978-0-8160-2403-2)
- (en) C.F. Ross et R.F. Kay, Anthropoid Origins : New Visions, Springer, , 2e éd., 749 p. (ISBN 978-0-306-48120-8, lire en ligne)
- L.R. Godfrey, C.F. Ross et R.F. Kay, chap. 1 « Evolving Perspectives on Anthropoidea », p. 3–41
- C.E. Kirk et R.F. Kay, chap. 22 « The Evolution of High Visual Acuity in the Anthropoidea », p. 539–602
- (en) N. Rowe, The Pictorial Guide to the Living Primates, Pogonias Press, , 263 p. (ISBN 978-0-9648825-1-5)
- (en) J. Ruud, Taboo : A Study of Malagasy Customs and Beliefs, Oslo University Press, , 2e éd.
- (en) R.W. Sussman, Primate Ecology and Social Structure : Lorises, lemurs, and tarsiers, Pearson Custom Publishing, , 284 p. (ISBN 978-0-536-74363-3)
- (en) I. Tattersall, Primates of Madagascar, Columbia University Press, , 382 p. (ISBN 978-0-231-04704-3)
Articles connexes
Liens externes
- (en) Référence Mammal Species of the World (3e éd., 2005) : Lemuriformes Gray, 1821
- (en) Référence Tree of Life Web Project : Lemuriformes
- (en) Référence Paleobiology Database : Lemuriformes Gregory 1915
- (en) Référence Animal Diversity Web : Lemuriformes
- (en) Référence NCBI : Lemuriformes (taxons inclus)
Notes et références
Notes
- Aucun reste de jeune Mesopropithecus, Babakotia ou Archaeoindris n'a été trouvé et on sait peu de choses sur celui de Palaeopropithecus. Les modèles proposés ici sont empruntés à leurs plus proches parents, les indriidae[71].
- Chez les indriidés, ni les canines ni les incisives inférieures ne sont remplacées. Il existe différentes explications à ce phénomène particulier. Par conséquent une autre formule dentaire possible pour cette famille est : 2.1.2.31.1.2.3 × 2 = 30[51].
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Lemur » (voir la liste des auteurs).
- Harcourt 1990, p. 7–13.
- Linnaeus 1758, p. 29–30.
- Tattersall 1982, p. 43–44.
- Garbutt 2007, p. 85–86.
- (en) J. Lux, « What are lemures? », Humanitas, vol. 32, no 1, , p. 7–14 (lire en ligne [PDF]).
- Flower et Lydekker 1891, p. 682.
- Nield 2007, p. 41.
- Blunt et Stearn 2002, p. 252.
- (en) R.F. Kay, C. Ross et B.A. Williams, « Anthropoid Origins », Science, vol. 275, no 5301, , p. 797–804 (PMID 9012340, DOI 10.1126/science.275.5301.797).
- Gould et Sauther 2006, p. vii–xiii.
- Sussman 2003, p. 149–229.
- Ankel-Simons 2007, p. 392–514.
- Preston-Mafham 1991, p. 141–188.
- Tattersall 2006, p. 3–18.
- Yoder 2003, p. 1242–1247.
- (en) A.D. Yoder et Z. Yang, « Divergence dates for Malagasy lemurs estimated from multiple gene loci: geological and evolutionary context », Molecular Ecology, vol. 13, no 4, , p. 757–773 (PMID 15012754, DOI 10.1046/j.1365-294X.2004.02106.x, lire en ligne [PDF]).
- (en) M. Godinot, « Lemuriform Origins as Viewed from the Fossil Record », Folia Primatologica, vol. 77, no 6, , p. 446–464 (PMID 17053330, DOI 10.1159/000095391).
- Flynn et Wyss 2003, p. 34–40.
- Mittermeier et al. 2006, p. 23–26.
- (en) W.D. Matthew, « Climate and Evolution », Annals of the New York Academy of Sciences, vol. 24, , p. 171–318 (DOI 10.1111/j.1749-6632.1914.tb55346.x, Bibcode 1914NYASA..24..171M).
- Garbutt 2007, p. 14–15.
- (en) G. Brumfiel, « Lemurs' wet and wild past », Nature News, .
- (en) J.E. Horvath, D.W. Weisrock, S.L. Embry, I. Fiorentino, J.P. Balhoff, P. Kappeler, G.A. Wray, H.F. Willard et A.D. Yoder, « Development and application of a phylogenomic toolkit: Resolving the evolutionary history of Madagascar's lemurs », Genome Research, vol. 18, no 3, , p. 489–499 (PMID 18245770, PMCID 2259113, DOI 10.1101/gr.7265208, lire en ligne [PDF]).
- Krause 2003, p. 40–47.
- (en) J.R. Ali et M. Huber, « Mammalian biodiversity on Madagascar controlled by ocean currents », Nature, vol. 463, no 7281, , p. 653–656 (PMID 20090678, DOI 10.1038/nature08706, Bibcode 2010Natur.463..653A, lire en ligne).
- Sussman 2003, p. 107–148.
- (en) P. Perelman, W. E. Johnson, C. Roos, H. N. Seuánez, J. E. Horvath, M. A. M. Moreira, B. Kessing, J. Pontius, M. Roelke, Y. Rumpler, M. P. Schneider, A. Silva, S. J. O'Brien et J. Pecon-Slattery, « A molecular phylogeny of living primates », PLoS Genetics, vol. 7, no 3, , e1001342 (PMID 21436896, PMCID 3060065, DOI 10.1371/journal.pgen.1001342, lire en ligne)
- Mittermeier et al. 2006, p. 89–182.
- Mittermeier et al. 2006, p. 37–51.
- Godfrey, Jungers et Schwartz 2006, p. 41–64.
- (en) A.D. Yoder, « Lemurs: a quick guide », Current Biology, vol. 17, no 20, , p. 866–868 (lire en ligne [PDF]).
- (en) A.E. Dunham et V.H.W. Rudolf, « Evolution of sexual size monomorphism: the influence of passive mate guarding », Journal of Evolutionary Biology, vol. 22, no 7, , p. 1376–1386 (PMID 19486235, DOI 10.1111/j.1420-9101.2009.01768.x, lire en ligne [PDF]).
- Preston-Mafham 1991, p. 10–21.
- (en) D. Gommery, B. Ramanivosoa, S. Tombomiadana-Raveloson, H. Randrianantenaina et P. Kerloc’h, « A new species of giant subfossil lemur from the North-West of Madagascar (Palaeopropithecus kelyus, Primates) », Comptes Rendus Palevol, vol. 8, no 5, , p. 471–480 (DOI 10.1016/j.crpv.2009.02.001).
- Burney 2003, p. 47–51.
- Sussman 2003, p. 257–269.
- Godfrey et Jungers 2003, p. 1247–1252.
- (en) L. Orlando, S. Calvignac, C. Schnebelen, C.J. Douady, L.R. Godfrey et C. Hänni, « DNA from extinct giant lemurs links archaeolemurids to extant indriids », BMC Evolutionary Biology, vol. 8, no 121, (PMID 18442367, PMCID 2386821, DOI 10.1186/1471-2148-8-121, lire en ligne).
- Rowe 1996, p. 27.
- (en) L.F. Groeneveld, D.W. Weisrock, R.M. Rasoloarison, A.D. Yoder et P.M. Kappeler, « Species delimitation in lemurs: multiple genetic loci reveal low levels of species diversity in the genus Cheirogaleus », BMC Evolutionary Biology, vol. 9, , p. 30 (PMID 19193227, PMCID 2652444, DOI 10.1186/1471-2148-9-30, lire en ligne [PDF]).
- (en) Ian Tattersall, « Madagascar's Lemurs: Cryptic diversity or taxonomic inflation? », Evolutionary Anthropology: Issues, News, and Reviews, vol. 16, , p. 12–23 (DOI 10.1002/evan.20126).
- (en) R.A. Mittermeier, J.U. Ganzhorn, W.R. Konstant, K. Glander, I. Tattersall, C.P. Groves, A.B. Rylands, A. Hapke et J. Ratsimbazafy, « Lemur Diversity in Madagascar », International Journal of Primatology, vol. 29, no 6, , p. 1607–1656 (DOI 10.1007/s10764-008-9317-y, lire en ligne [PDF]).
- (en) K.P. Karanth, T. Delefosse, Rakotosamimanana B., T.J. Parsons et A.D. Yoder, « Ancient DNA from giant extinct lemurs confirms single origin of Malagasy primates », Proceedings of the National Academy of Sciences, vol. 102, no 14, , p. 5090–5095 (PMID 15784742, PMCID 555979, DOI 10.1073/pnas.0408354102, Bibcode 2005PNAS..102.5090K, lire en ligne [PDF]).
- Groves 2005.
- Cartmill 2010, p. 10–30.
- Sterling et McCreless 2006, p. 159–184.
- Ankel-Simons 2007, p. 48–161.
- Garbutt 2007, p. 205–207.
- (en) A.D. Yoder, R. Vilgalys et M. Ruvolo, « Molecular evolutionary dynamics of cytochrome b in strepsirrhine primates: The phylogenetic significance of third-position transversions », Molecular Biology and Evolution, vol. 13, no 10, , p. 1339–50 (PMID 8952078, lire en ligne [PDF]).
- (en) L. Marivaux, J.-L. Welcomme, P.-O. Antoine, G. Métais, I.M. Baloch, M. Benammi, Y. Chaimanee, S. Ducrocq et J.-J. Jaeger, « A Fossil Lemur from the Oligocene of Pakistan », Science, vol. 294, no 5542, , p. 587–591 (PMID 11641497, DOI 10.1126/science.1065257, Bibcode 2001Sci...294..587M).
- Ankel-Simons 2007, p. 224–283.
- Garbutt 2007, p. 115–136.
- Mittermeier et al. 2006, p. 209–323.
- Garbutt 2007, p. 137–175.
- Mittermeier et al. 2006, p. 85–88.
- Goodman, Ganzhorn et Rakotondravony 2003, p. 1159–1186.
- Thalmann et Powzyk 2003, p. 1342–1345.
- Ankel-Simons 2007, p. 284–391.
- Rowe 1996, p. 13.
- Garbutt 2007, p. 176–204.
- Thalmann 2003, p. 1340–1342.
- Thalmann et Ganzhorn 2003, p. 1336–1340.
- Nowak 1999, p. 84–89.
- Richard 2003, p. 1345–1348.
- Sterling 2003, p. 1348–1351.
- Overdorff et Johnson 2003, p. 1320–1324.
- (en) P. Braune, S. Schmidt et E. Zimmermann, « Acoustic divergence in the communication of cryptic species of nocturnal primates (Microcebus ssp.) », BMC Biology, vol. 6, no 19, (PMID 18462484, PMCID 2390514, DOI 10.1186/1741-7007-6-19).
- C. Lamberton, « Dentition de lait de quelques lémuriens subfossiles malgaches », Mammalia, vol. 2, , p. 57–80.
- Mittermeier et al. 1994, p. 33–48.
- Godfrey et Jungers 2002, p. 108–110.
- Godfrey, Petto et Sutherland 2001, p. 113–157.
- Cuozzo et Yamashita 2006, p. 67–96.
- Powzyk et Mowry 2006, p. 353–368.
- (en) E.L. Simons et D.M. Meyers, « Folklore and beliefs about the Aye aye (Daubentonia madagascariensis) », Lemur News, vol. 6, , p. 11–16 (ISSN 0343-3528, lire en ligne [PDF]).
- Irwin 2006, p. 305–326.
- Ankel-Simons 2007, p. 206–223.
- Ankel-Simons 2007, p. 162–205.
- Ankel-Simons 2007, p. 521–532.
- Ross et Kay 2004, p. 3–41.
- (en) N. Bolwig, « Observations and thoughts on the evolution of facial mimic », Koedoe – African Protected Area Conservation and Science, vol. 2, no 1, , p. 60–69 (DOI 10.4102/koedoe.v2i1.854, lire en ligne).
- Kirk et Kay 2004, p. 539–602.
- Jolly 2003, p. 1329–1331.
- Schmid et Stephenson 2003, p. 1198–1203.
- Nowak 1999, p. 65–71.
- Fietz 2003, p. 1307–1309.
- Birkinshaw et Colquhoun 2003, p. 1207–1220.
- Wright 2006, p. 385–402.
- (en) Y. Nakajima, T.R. Shantha et G.H. Bourne, « Histochemical detection of l-gulonolactone: phenazine methosulfate oxidoreductase activity in several mammals with special reference to synthesis of vitamin C in primates », Histochemistry and Cell Biology, vol. 18, no 4, , p. 293–301 (DOI 10.1007/BF00279880).
- (en) C.V. Williams, J. Campbell et K.M. Glenn, « Comparison of serum iron, total iron binding capacity, ferritin, and percent transferrin saturation in nine species of apparently healthy captive lemurs », American Journal of Primatology, vol. 68, no 5, , p. 477 (PMID 16550526, DOI 10.1002/ajp.20237).
- (en) K.M. Glenn, J.L. Campbell, D. Rotstein et C.V. Williams, « Retrospective evaluation of the incidence and severity of hemosiderosis in a large captive lemur population », American Journal of Primatology, vol. 68, no 4, , p. 369 (PMID 16534809, DOI 10.1002/ajp.20231).
- Sussman 2003, p. 3–37.
- (en) Alison Jolly, « Pair-Bonding, Female Aggression and the Evolution of Lemur Societies », Folia Primatologica, vol. 69, , p. 1–13 (PMID 9595685, DOI 10.1159/000052693).
- (en) A.E. Dunham, « Battle of the sexes: cost asymmetry explains female dominance in lemurs », Animal Behaviour, vol. 76, , p. 1435–1439 (DOI 10.1016/j.anbehav.2008.06.018).
- (en) A.L. Young, A.F. Richard et L.C. Aiello, « Female Dominance and Maternal Investment in Strepsirhine Primates », The American Naturalist, vol. 135, , p. 473–488 (DOI 10.1086/285057).
- Tan 2006, p. 369–382.
- (en) L.J. Digby et S.M. Kahlenberg, « Female dominance in blue-eyed black lemurs (Eulemur macaco flavifrons) », Primates, vol. 43, no 3, , p. 191–199 (PMID 12145400, DOI 10.1007/BF02629647).
- (en) A. Jolly, « Lemur Social Behavior and Primate Intelligence », Science, vol. 153, no 3735, , p. 501–506 (PMID 5938775, DOI 10.1126/science.153.3735.501, Bibcode 1966Sci...153..501J).
- Curtis 2006, p. 133–158.
- Johnson 2006, p. 187–210.
- Fietz et Dausmann 2006, p. 97–110.
- Garbutt 2007, p. 86–114.
- (en) L.R. Godfrey et W.L. Jungers, « The extinct sloth lemurs of Madagascar », Evolutionary Anthropology: Issues, News, and Reviews, vol. 12, , p. 252–263 (DOI 10.1002/evan.10123, lire en ligne [PDF]).
- Nowak 1999, p. 71–81.
- Mittermeier et al. 2006, p. 324–403.
- (en) M.L. Sauther, « Antipredator behavior in troops of free-ranging Lemur catta at Beza Mahafaly special reserve, Madagascar », International Journal of Primatology, vol. 10, no 6, , p. 595–606 (DOI 10.1007/BF02739366).
- Jolly 1966, p. 135.
- (en) B. Grieser, « Infant development and parental care in two species of sifakas », Primates, vol. 33, no 3, , p. 305–314 (DOI 10.1007/BF02381192).
- Vasey 2003, p. 1332–1336.
- (en) G.R. Hosey et R.J. Thompson, « Grooming and touching behaviour in captive ring-tailed lemurs (Lemur catta L.) », Primates, vol. 26, no 1, , p. 95–98 (DOI 10.1007/BF02389051).
- (en) R.A. Barton, « Allogrooming as mutualism in diurnal lemurs », Primates, vol. 28, no 4, , p. 539–542 (DOI 10.1007/BF02380868).
- Goodman 2003, p. 1221–1228.
- (en) M. Eberle et P.M. Kappeler, « Mutualism, reciprocity, or kin selection? Cooperative rescue of a conspecific from a boa in a nocturnal solitary forager the gray mouse lemur », American Journal of Primatology, vol. 70, no 4, , p. 410–414 (PMID 17972271, DOI 10.1002/ajp.20496, lire en ligne [PDF]).
- Crompton et Sellers 2007, p. 127–145.
- Kappeler et Rasoloarison 2003, p. 1310–1315.
- Mutschler et Tan 2003, p. 1324–1329.
- (en) E.R. Patel, « Non-maternal infant care in wild Silky Sifakas (Propithecus candidus) », Lemur News, vol. 12, , p. 39–42 (ISSN 1608-1439).
- (en) J. Fietz et K.H. Dausmann, « Costs and Potential Benefits of Parental Care in the Nocturnal Fat‐Tailed Dwarf Lemur (Cheirogaleus medius) », Folia Primatologica, vol. 74, nos 5–6, , p. 246–258 (PMID 14605471, DOI 10.1159/000073312).
- (en) N. Vasey, « The breeding system of wild red ruffed lemurs (Varecia rubra): a preliminary report », Primates, vol. 48, no 1, , p. 41–54 (PMID 17024514, DOI 10.1007/s10329-006-0010-5).
- (en) A. Ehrlich, J. Fobes et J. King, « Prosimian learning capacities », Journal of Human Evolution, vol. 5, no 6, , p. 599–617 (DOI 10.1016/0047-2484(76)90005-1).
- (en) Penn State, « Piecing together an extinct lemur, large as a big baboon », ScienceDaily, (consulté le ).
- Jolly et Sussman 2006, p. 19–40.
- (en) U. Thalmann, « Lemurs – ambassadors for Madagascar », Madagascar Conservation & Development, vol. 1, , p. 4–8 (ISSN 1662-2510, lire en ligne [PDF]).
- Mittermeier et al. 2006, p. 27–36.
- Mittermeier et al. 2006, p. 52–84.
- (en) J.M. Macedonia, « The Vocal Repertoire of the Ringtailed Lemur (Lemur catta) », Folia Primatologica, vol. 61, , p. 186–217 (PMID 7959437, DOI 10.1159/000156749).
- (en) C.D. Tilden, « A study of locomotor behavior in a captive colony of red-bellied lemurs (Eulemur rubriventer) », American Journal of Primatology, vol. 22, no 2, , p. 87–100 (DOI 10.1002/ajp.1350220203).
- (en) R.E. Wunderlich et J.C. Schaum, « Kinematics of bipedalism in Propithecus verreauxi », Journal of Zoology, vol. 272, no 2, , p. 165–175 (DOI 10.1111/j.1469-7998.2006.00253.x).
- (en) E.L. MacLean, D.J. Merritt et E.M. Brannon, « Social complexity predicts transitive reasoning in prosimian primates », Animal Behaviour, vol. 76, no 2, , p. 479–486 (PMID 19649139, PMCID 2598410, DOI 10.1016/j.anbehav.2008.01.025, lire en ligne [PDF]).
- (en) D. Merritt, E.L. MacLean, S. Jaffe et E.M. Brannon, « A comparative analysis of serial ordering in ring-tailed lemurs (Lemur catta) », Journal of Comparative Psychology, vol. 121, no 4, , p. 363–371 (PMID 18085919, PMCID 2953466, DOI 10.1037/0735-7036.121.4.363, lire en ligne [PDF]).
- (en) L.R. Santos, N. Mahajan et J.L. Barnes, « How Prosimian Primates Represent Tools: Experiments with Two Lemur Species (Eulemur fulvus and Lemur catta) », Journal of Comparative Psychology, vol. 119, no 4, , p. 394–403 (PMID 16366773, DOI 10.1037/0735-7036.119.4.394, lire en ligne [PDF]).
- Mittermeier et al. 2006, p. 15–17.
- Mittermeier, Konstant et Rylands 2003, p. 1538–1543.
- (en) R.A. Mittermeier, J. Wallis, A.B. Rylands, J.U. Ganzhorn, J.F. Oates, E.A. Williamson, E. Palacios, E.W. Heymann, M.C.M. Kierulff, Yongcheng Long, J. Supriatna, C. Roos, S. Walker, L. Cortés-Ortiz et C. Schwitzer (ill. S.D. Nash), Primates in Peril : The World's 25 Most Endangered Primates 2008–2010, IUCN/SSC Primate Specialist Group, International Primatological Society, et Conservation International, (ISBN 978-1-934151-34-1, lire en ligne [PDF]), p. 1–92.
- (en) « Country brief: Madagascar »(Archive • Wikiwix • Archive.is • Google • Que faire ?), eStandardsForum, (consulté le ).
- (en) World Wildlife Fund, « Monumental debt-for-nature swap provides $20 million to protect biodiversity in Madagascar », ScienceDaily, (consulté le ).
- Julie Renson Miquel, « Les lémuriens en danger critique d'extinction », sur liberation.fr, Libération, .
- Ganzhorn, Goodman et Dehgan 2003, p. 1228–1234.
- Junge et Sauther 2006, p. 423–440.
- Ratsimbazafy 2006, p. 403–422.
- (en) Rhett Butler, « Madagascar's political chaos threatens conservation gains », sur Yale Environment 360, Yale School of Forestry & Environmental Studies, (consulté le ).
- Simons 1997, p. 142–166.
- (en) Derek Schuurman, « Illegal logging in Madagascar », Traffic Bulletin, vol. 22, no 2, , p. 49 (lire en ligne [PDF]).
- Rowe 1996, p. 46.
- « Les lémuriens de Madagascar menacés de disparition à cause du réchauffement », Le Monde, (lire en ligne, consulté le ).
- Wright et Andriamihaja 2003, p. 1485–1488.
- Sargent et Anderson 2003, p. 1543–1545.
- Britt et al. 2003, p. 1545–1551.
- Ruud 1970, p. 97–101.
- (en) Denise Barnes, « Fun in the sun with lemurs », The Washington Times, (lire en ligne).
- (en) Louis Jacobson, « Looking for lemurs », sur USA Today, (consulté le ).
- (en) R. Huff, « Tonight », New York Daily News, , p. 122.
- (en) « Highlights », The Washington Post, , C04.
- (en) « Madagascar; country's unknown creatures on DSTV », Africa News, .
- (en) H. Walmark, « Critic's choice: Lemur Street », The Globe and Mail, , R37.
- Portail des primates
- Portail de Madagascar