Ostéoporose
L'ostéoporose est caractérisée par une fragilité excessive du squelette, due à une diminution de la masse osseuse et à l'altération de la micro-architecture osseuse. La solidité de l'os résulte en effet d'un équilibre subtil entre deux types de cellules osseuses : les ostéoblastes, qui solidifient l'os, et les ostéoclastes (responsables de la résorption osseuse), qui les fragilisent. Une activité dominante des ostéoclastes conduit donc à l'ostéoporose qui peut résulter soit d'un capital osseux insuffisant en fin de la croissance, soit d'une perte osseuse excessive lors de la vieillesse ou de certaines affections.
Des facteurs génétiques, nutritionnels et environnementaux déterminent l'acquisition du capital osseux pendant la croissance, puis la perte osseuse.
| Spécialité | Endocrinologie |
|---|
| CISP-2 | L95 |
|---|---|
| CIM-10 | M80-M82 |
| CIM-9 | 733.0 |
| OMIM | 166710 |
| DiseasesDB | 9385 |
| MedlinePlus | 000360 |
| eMedicine | 330598 et 985221 |
| eMedicine | med/1693 ped/1683pmr/94pmr/95 |
| MeSH | D010024 |
![]()
C'est une maladie fréquente chez les femmes après la ménopause , la masse osseuse diminuant avec l'âge et avec la carence en hormones féminines (œstrogènes). Elle touche moins souvent les hommes que les femmes, mais prend alors des formes plus graves. Exceptionnellement les enfants peuvent en être victimes.
C'est un facteur de risque important de fractures osseuses (col du fémur, vertèbres et côtes, notamment).
Facteurs de risque
Cette section ne cite pas suffisamment ses sources (septembre 2011). Pour l'améliorer, ajoutez des références vérifiables [comment faire ?] ou le modèle {{Référence nécessaire}} sur les passages nécessitant une source. |
L'hérédité est le déterminant le plus important du capital osseux acquis en fin de croissance. Les filles de mère ostéoporotique ont une densité osseuse plus basse et font davantage de fractures que les filles de mère non ostéoporotique. On n'a cependant pas pu identifier un gène unique de l'ostéoporose ; le déterminisme de l'ostéoporose est multigénique.[réf. nécessaire] Plusieurs mutations sur les gènes LPR5 et LPR6 (low-density lipoprotein receptor) semblent corrélées avec un risque légèrement accru d'ostéoporose[1].
Une déficience prolongée en calcium conduit tôt ou tard à l'ostéoporose, ou aggrave une ostéoporose en cours de développement ; cependant la plus grande partie des ostéoporoses dans le monde semblent être dues à d'autres causes[2].
L'exposition au cadmium aggrave ou provoque des pertes osseuses[3].
De façon globale, les facteurs de risque de développer une ostéoporose sont :
- l'âge élevé ;
- l'origine ethnique (les sujets originaires du nord de l'Europe y sont plus sensibles) ;
- le sexe féminin ;
- les antécédents familiaux de fracture du col du fémur ;
- la consommation excessive de sel, d'alcool, de café, de tabac ;
- le faible indice de masse corporelle ;
- certaines carences :
- carence en calcium ;
- carence en protéines ;
- carence en vitamine D (déficit d'ensoleillement et/ou d'apport nutritionnel) ;
- la sédentarité[4], l'immobilisation prolongée ;
- le déficit en hormones sexuelles :
- L'exposition au plomb (en diminution depuis l'interdiction du plomb dans l'essence) et au cadmium. Le cadmium est une cause connue depuis longtemps pour les fortes expositions, causes de lésions osseuses, notamment ostéoporotiques. Chez le rat il perturbe le système hormonal[5], et chez la souris, il aggrave la perte osseuse induite par un déficit hormonal[6]. Mais on a récemment (2006) montré[3],[7] qu'une faible exposition a aussi des effets osseux négatifs chez l'homme[8]. Les femmes de 53 à 64 ans sont à la fois les plus sensibles à la rétention du cadmium (qui semble ensuite diminuer légèrement) et à l'ostéoporose[3]. Chez 820 femmes étudiées en Suède, le taux de cadmium urinaire était statistiquement corrélé à une diminution de la densité osseuse, négativement associée à l'hormone parathyroïdienne (impliquée dans le métabolisme osseux) et positivement associée à la désoxypyridinoline urinaire (marqueur de résorption osseuse), y compris dans le sous-groupe des femmes les moins exposées et n'ayant jamais fumé (le tabac est une des sources de cadmium)[3]. La gravité des effets osseux augmentait après la ménopause[3] ;
- certaines maladies hormonales hyperthyroïdie, hyperparathyroïdie, diabète insulinodépendant, hypercorticisme (maladie de Cushing, etc.), hyperandrogénisme, syndrome de Klinefelter, syndrome de Turner ;
- certaines maladies métaboliques : hémochromatose génétique, hypercalciurie isolée, idiopathique ou familiale…
- les rhumatismes inflammatoires : polyarthrite rhumatoïde, spondylarthrite ankylosante ;
- d'autres maladies chroniques : insuffisance rénale chronique, insuffisance hépatocellulaire, cirrhose, mastocytose,
- certains traitements, en particulier corticothérapie prolongée[9], analogues du GnRH, anti-aromatases.
Calcium, vitamine D et protéines
Le calcium constitue, avec le phosphore, la charpente minérale de l'os. La vitamine D permet la fixation du calcium dans le squelette.
Selon les termes d'un rapport conjoint de la FAO et de l'OMS, « la contribution de la déficience en calcium à l'apparition de l'ostéoporose est bien documentée dans les expérimentations sur animaux ; elle est beaucoup plus controversée chez l'humain, étant donné que dans beaucoup d'études les grandes variations d'apport calcique dans les populations à travers le monde n'apparaissent pas associées à une quelconque variation de la prévalence de l'ostéoporose. »[2].
Selon une revue systématique de 2015, il n'y a pas de preuve que la supplémentation en calcium prévienne les fractures[10].
Un apport suffisant en protéines est également nécessaire pour avoir un bon métabolisme osseux, mais un excès de protéines, notamment animales[11], peut générer une acidification de l'organisme lors de la digestion de celles-ci (et donc une déminéralisation)[2],[12]. Il a par exemple été constaté que la prévalence des fractures de la hanche, dont l'ostéoporose est l'un des facteurs de risque, est liée aux apports en protéines animales[2],[13]. Une revue des études existantes indique ainsi que, si une alimentation essentiellement végétale est corrélée avec une densité minérale osseuse plus faible, elle est également corrélée avec un taux plus faible de fracture de la hanche[11].
Sédentarité, immobilisation prolongée
L'activité physique est l'un des meilleurs moyens de se protéger contre l'ostéoporose, car elle sollicite l'ossature et va donc la renforcer.
Faible indice de masse corporelle
Le risque d'ostéoporose est faible chez les personnes en surpoids pour deux raisons :
- l'excès de graisse augmente le taux d'œstrogène (qui protège contre la perte osseuse rapide) ;
- il y a une pression et une sollicitation plus importante de l'ossature. Ce qui la renforce.
Mais si le surpoids peut protéger de l'ostéoporose, il a aussi de nombreux autres impacts, négatifs, sur la santé.
Signes et symptômes
L'ostéoporose majore très sensiblement le risque de fractures, mais ne s'accompagne habituellement d'aucun signe clinique. S'il est largement considéré que ce risque est inversement corrélé à la densité minérale osseuse, un grand nombre de sources indiquent au contraire que la densité osseuse ne semble pas être systématiquement associée à un taux de fracture plus important, contrairement à l'association avec la qualité du tissu osseux[14], voire qu'il n'y a pas de lien causal direct entre une faible densité osseuse et le risque de fracture[15].
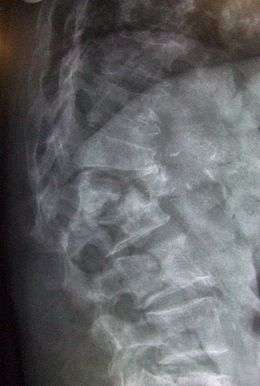
Le fait qu'une personne, notamment âgée, se voûte et que sa taille diminue est un indice d'ostéoporose avec de probables tassements successifs asymptomatiques, et éventuelles fractures vertébrales franches. Mais aucune donnée clinique ne peut remplacer la mesure de la masse osseuse dans la pose du diagnostic[16]. On sera très attentif aux antécédents individuels et familiaux de fracture ainsi qu'à un IMC faible. La fracture de Pouteau-Colles (fracture de l'extrémité inférieure du radius) sera à prendre tout particulièrement en considération[16].
Diagnostic
Il repose sur la mesure de la densité minérale osseuse par ostéodensitométrie, le plus souvent via la mesure de l'absorption des rayons X DEXA. On parle d'ostéoporose si cette densité est en dessous de 2.5 déviations standards par rapport à la normale. Entre -2.5 et -1 déviations standards, on parle d'ostéopénie[17].
Un grand nombre de paramètres supplémentaires sont proposés pour améliorer le diagnostic apporté par l'ostéodensitométrie. Le profil clinique (facteurs de risque) peut être pris en compte par exemple avec le questionnaire FRAX développé par l'OMS et l'université de Sheffield. D'autres paramètres peuvent être extraits de l'image DEXA ou d'autres images radiologiques, basés sur la géométrie des os (par exemple la longueur ou le diamètre du col fémoral, ou son angle par rapport à l'axe fémoral), sur une estimation de la quantité d'os cortical du fémur ou des phalanges (estimation de l'épaisseur d'os cortical ou du « moment d'inertie » du col fémoral), sur la recherche de déformations vertébrales, ou encore sur une analyse de la texture d'images DEXA dans le TBS (Trabecular Bone Score) permettant, selon la société qui le commercialise, d'évaluer la structure osseuse trabéculaire.
Des chercheurs, japonais notamment, travaillent sur les marqueurs biologiques du renouvellement osseux qui peuvent être des indicateurs de risque de fracture chez la femme âgée atteinte d'ostéoporose[18].
Étiologie
Le tissu osseux se renouvelle tout au long de la vie grâce à un processus appelé « remodelage osseux » : ce remodelage ne s'effectue pas en même temps sur l'ensemble des surfaces osseuses mais sur de minuscules foyers. Dans ces foyers le remodelage commence par une phase de résorption osseuse aboutissant à la formation d'une cavité, suivie d'une phase de formation osseuse au cours de laquelle la cavité est remplie par de l'os nouveau. Ce processus de remodelage est déficitaire, c’est-à-dire qu'il est formé un peu moins d'os qu'il n'en a été résorbé. Ce bilan déficitaire explique la perte osseuse liée avec l'âge, qui va conduire à l'ostéoporose si le capital osseux en fin de croissance était insuffisant ou si l'activité de remodelage a un bilan très déficitaire. Ce bilan déficitaire est favorisé par une déficience ou une moins bonne absorption du calcium et de la vitamine D. Chez la femme, la baisse du taux d'hormones sexuelles féminines à la ménopause est un facteur déterminant. Cela explique qu'en moyenne, la perte de densité osseuse devienne sensible à partir de 50 ans pour les femmes, et 70 ans chez les hommes, avec de fortes variations individuelles selon les prédispositions génétiques de chacun, l'alimentation, l'activité physique. L'ostéoporose est fréquente après un alitement prolongé. C'est également un symptôme du mal de l'espace.
Souvent appelée « épidémie silencieuse », l'ostéoporose expose à un risque plus important de fractures, principal danger, notamment les fractures du col du fémur, du poignet et les fractures de la colonne vertébrale.
Liste de maladies associées à l'ostéoporose
L'ostéoporose peut être secondaire à une affection ce qui permet d'envisager la mise en place d'une prévention de cette perte osseuse :
- insuffisance gonadotrope notamment dans les maladies suivantes : syndrome de Turner, syndrome de Klinefelter, anorexie mentale, insuffisance hypothalamique, hyperprolactinémie ;
- affections endocriniennes que l'on retrouve dans : syndrome de Cushing, hyperparathyroïdie, hyperthyroïdie, diabète insulinodépendant, acromégalie ;
- troubles digestifs et nutritionnels suivants : malnutrition, nutrition parentérale prolongée, syndromes de malabsorption, gastrectomie, hépatopathies sévères (telle la cirrhose biliaire primitive), la maladie cœliaque ;
- maladies rhumatismales : polyarthrite rhumatoïde, spondylarthrite ankylosante ;
- maladies hématologiques, notamment : myélome multiple, lymphome et leucémie, mastocytose, hémophilie, thalassémie ;
- Maigreur constitutionnelle
Épidémiologie
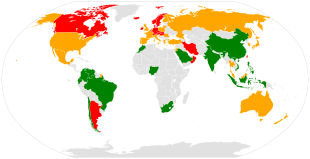
- Faible (< 150 / 100 000)
- Moyen (150-250 / 100 000)
- Élevé (> 250 / 100 000)
L'ostéoporose est un enjeu majeur de santé publique, puisqu'on estime à 200 millions le nombre de personnes souffrant de cette pathologie dans le monde et que 30 % des femmes ménopausées en Europe et aux États-Unis présentent de l'ostéoporose[20].
Les sièges classiques des fractures d'origine ostéoporotique sont :
- les fractures vertébrales (également appelées tassements vertébraux) dont les symptômes (douleurs dans le dos plus ou moins importantes, perte de taille) sont le plus souvent négligés ou non signalés par les patients. L'incidence des fractures vertébrales est donc difficile à estimer ;
- les fractures de l'extrémité inférieure de l'avant-bras (fracture de Pouteau-Colles ou de Gérard Marchand), dont l'incidence est estimée en Europe à 7.3 ;
- les fractures de l'extrémité supérieure du fémur, les plus pourvoyeuses de complications. L'incidence mondiale annuelle est estimée à 1,7 million, et plus de 20 % des fractures surviennent chez les hommes[21].
- les fractures des côtes (chutes).
L'ostéoporose et ses complications ont des répercussions économiques notables : le coût en a été estimé à 17 milliards de dollars en 2003 aux États-Unis[22].
Traitement
Le but essentiel d'un traitement est la diminution du risque de fractures.
Règles hygiéno-diététiques
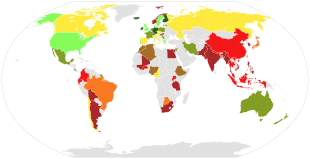
- 400-500
- 500-600
- 600-700
- 700-800
- 800-900
- 900-1000
- >1000
La prévention de l'ostéoporose fait appel à plusieurs types d'interventions :
- sur le mode vie : l'exercice physique tend à stimuler la densification des os sous réserve qu'il soumette l'os à des forces de torsion. Cela implique l'application de charges importantes ou de chocs : course à pied, musculation. À l'inverse, les activités en décharge (natation, cyclisme, etc.) n'ont pas d'effets significatifs ;
- sur l'alimentation : un régime apportant quotidiennement les quantités nécessaires de calcium et de vitamine D est préconisé. Cela peut être complété par une supplémentation en calcium sous contrôle médical, notamment chez les femmes ménopausées. L'efficacité de la supplémentation en calcium seul est toutefois faible sur la prévention des fractures[24]. Chez les végétariens, l'intérêt des produits laitiers est également discuté[25],[26]. La prise de calcium sous forme de comprimés n'est pas anodine et pourrait même augmenter le risque d'infarctus du myocarde[27]. La prise de vitamine D aurait une certaine efficacité, plus nettement démontrée en ce qui concerne ses analogues que pour la vitamine D native[28].
La consommation de fruits et légumes est recommandée, mais aucune étude n'a pu prouver que leur effet bénéfique était lié à leur alcalinité[29] ou au fait que le calcium sert à diminuer l'acidité du corps produite par certains aliments tels que les protéines. Une analyse des études existantes sur les interactions entre protéines et santé osseuse a révélé que les protéines n'ont pas d'effet défavorable à la densité minérale osseuse et ont au contraire un très léger effet positif, sans influence sur le risque de fracture[30].
La supplémentation en silicium associé au calcium et à la vitamine D, a plus d'effets bénéfiques sur le renouvellement des ostéoblastes, du collagène, comparé à la supplémentation en calcium et Vitamine D seuls[31].
Une hypothèse[réf. souhaitée] est qu'une alimentation riche en protéines augmente l'acidité du corps, acidité qui va être diminuée par un relargage du calcium et donc une perte calcique. Enfin, une alimentation riche en sel est un facteur aggravant par l'augmentation liée de la natriurèse et de la calciurèse[32]. La prévention des fractures de la personne âgée repose également sur la prévention des chutes[33].
Traitements médicamenteux
Certains traitements médicamenteux ont démontré leur efficacité dans la prévention des fractures[28].
- On utilise le plus souvent les bisphosphonates, les SERMs (Selective Estrogen Receptor Modulator, classe représentée par le raloxifène) et le ranélate de strontium. Aucun de ces médicaments n'a démontré une supériorité par rapport aux autres[34]. Dans les formes sévères d'ostéoporose avec plusieurs fractures vertébrales, on peut utiliser la parathormone injectable (teriparatide). L'intérêt de ces médicaments n'est toutefois pas établi en cas de faibles risques de fracture[28] ;
- Le traitement hormonal de la ménopause, seul traitement efficace disponible avant 1995, est actuellement discuté car, selon les produits et protocoles utilisés (œstrogènes seuls ou associés au progestatifs, hormones humanisées ou d'origine équine, absorption per os ou par patch…), il peut parfois exposer à un risque augmenté de cancer du sein et d’accidents cardio-vasculaires (études WHI et One million women). L'efficacité sur la prévention des fractures reste discutée, toutes les études ne démontrant pas une diminution significative de ces dernières[35].
Pistes de nouveaux traitements
- Le denosumab est un anticorps monoclonal ciblant le récepteur activateur du NF-κB ligand (RANKL) qui intervient dans la maturation des ostéoclastes. En deux prises annuelles, il diminue par ce biais l'ostéolyse et le risque de fracture chez la femme ménopausée ostéoporotique[36].
- L'odanacatib est un inhibiteur de la cathepsine K, cette dernière intervenant dans l'ostéolyse. Il est en cours de test chez le même type de population avec des résultats favorables sur les marqueurs du remodelage osseux[37].
- Le coton est l'une des plantes utilisées en médecine traditionnelle au Vietnam. Il contient une molécule d'intérêt pour le traitement de l'ostéoporose, en bloquant la dégradation de l'os par les ostéoclastes (in vitro, dans jusqu'à 97 % des cellules osseuses en culture, et apparemment sans effets nocifs sur d'autres cellules)[38].
Pronostic
La complication principale reste la survenue de fractures : plus de la moitié des femmes de plus de 50 ans auront une fracture secondaire à l'ostéoporose durant leur vie[39] (ce qui représente environ 260.000 fractures par an en France chez les femmes[40]), cette dernière pouvant comporter un risque vital chez la personne âgée s'il s'agit du col du fémur. En effet, des complications, notamment cardiaques, neurologiques et pulmonaires, peuvent se produire : en 2004, le taux de mortalité était de 14,7 % à 6 mois[41], entre 8,5 et 36 % à 1 an selon les études et les pays puisqu'il est difficile de rattacher le décès à sa cause initiale[42].
L'ostéoporose masculine
Elle est significativement plus rare, mais aussi plus grave que l'ostéoporose féminine.
Un homme sur cinq peut subir une fracture ostéoporotique après 50 ans, avec un taux de mortalité après une fracture deux à trois fois plus élevé que chez la femme[43].
En complément de l’ostéodensitométrie, un outil en ligne dit FRAX Tool (en anglais) permet d'évaluer le risque de fracture à 10 ans. Les biphosphonates sont les médicaments les plus prescrits dans ce cas, mais de nouveaux médicaments sont à l'étude (ex : rénalate de strontium = Protelos)[43].
L'exercice physique régulier, une alimentation équilibrée et une limitation du tabac et de l'alcool sont recommandés en prévention[43].
Controverse
Une controverse existe relativement à l'ostéoporose, explicitée par le Dr Jean-Pierre Poinsignon, rumathologue, auteur d'un livre sur le sujet [44]. Les questionnements sont relatifs à plusieurs aspects :
- L'ostéoporose, initialement considérée comme un risque serait devenue une maladie inventée par les laboratoires pharmaceutiques,
- Le fait de prendre comme référence la densité osseuse moyenne d'une femme de 30 ans, décidée en 1992, et d'établir un seuil a été considéré comme arbitraire,
- La densité osseuse ne serait pas le reflet de la solidité osseuse,
- Certains traitements sont dénoncés pour leurs effets secondaires.
Une émission de télévision est consacrée à ce sujet le [45]
Notes et références
- (en) van Meurs JB, Trikalinos TA, Ralston SH et al. « Large-scale analysis of association between LRP5 and LRP6 variants and osteoporosis » JAMA 2008;299:1277-90.
- (en) Rapport FAO/OMS, Human Vitamin and Mineral Requirements, chap. 11 Calcium, 2002. « Although it is well established that calcium deficiency causes osteoporosis in experimental animals, the contribution that calcium deficiency makes to osteoporosis in humans is much more controversial, not least because of the great variation in calcium intakes across the world (Table 30), which does not appear to be associated with any corresponding variation in the prevalence of osteoporosis.»
- (en) Ernie Hood « Putting a Load on Your Bones : Low-Level Cadmium Exposure and Osteoporosis » Environ Health Perspect. 2006;114(6):A369–A370. PMCID:PMC1480517 (résumé)
- M. Pirotte et I. Mimeault, L'ostéoporose, Santé des os et prévention des fractures, brochure du Réseau québécois d'action pour la santé des femmes, 2009
- (en) MM. Brzoska et J. Moniuszko-Jakoniuk « Disorders in bone metabolism of female rats chronically exposed to cadmium » Toxicol Appl Pharmacol. 2005;202(1):68–83
- (en) Bhattacharyya MH, Whelton BD, Stern PH, Peterson DP. « Cadmium accelerates bone loss in ovariectomized mice and fetal rat limb bones in culture » Proc Natl Acad Sci. USA 1988;85(22):8761–5.
- (en) Alfvén T, Elinder CG, Carlsson MD, Grubb A, Hellström L, Persson B et al. « Low-level cadmium exposure and osteoporosis » J Bone Miner Res. 2000;15(8):1579–1586
- (en) Åkesson A, Lundh T, Vahter M, Bjellerup P, Lidfeldt J, Nerbrand C et al. « Tubular and glomerular kidney effects in Swedish women with low environmental cadmium exposure » Environ Health Perspect. 2005;113:1627–1631
- http://www.cortisone-info.fr/Effets-indesirables/Os
- Calcium intake and risk of fracture: systematic review. « In summary, our analyses indicate that dietary calcium intake is not associated with risk of fracture, and there is no evidence currently that increasing dietary calcium intake prevents fractures. »
- (en) Jane E Kerstetter, Kimberly O O’Brien, Karl L Insogna « Dietary protein, calcium metabolism, and skeletal homeostasis revisited », American Journal of Clinical Nutrition 2003;78(3):584S-592S
- (en) C M Weaver et K L Plawecki « Dietary calcium: adequacy of a vegetarian diet » American Journal of Clinical Nutrition 1994;59(5):1238S-1241S
- (en) Abelow BJ, Holford TR, Insogna KL « Cross-cultural association between dietary animal protein and hip fracture: a hypothesis » Calcif Tissue Int. 1992 Jan;50(1):14-8.
- Erick Legrand, Ostéoporose masculine, site de l'université d'Angers, mise à jour janvier 2002.
- (en) T.J. Wilkin « Changing Perceptions in Osteoporosis » British Medical Journal 1999;318:862-5.
- Pathologie de l'appareil locomoteur, cours de la faculté de médecine de Rouen, chapitre sur l'ostéoporose p. 325 à 333[PDF]
- (en) Khosla S, Melton LJ. « Osteopenia » N Eng J Med. 2007;356;2293-300.
- (en) SHIGA Toshiki, TSUJI Yoshiro, FUJIOKA Mikihiro et KUBO Toshikazu « Risk factors for hip fracture in Japanese elderly women with osteoporosis: Applicability of biochemical markers in bone turnover » Geriatrics and Gerontology International 2009;9(1) Résumé
- J. A. Kanis, A. Odén, E. V. McCloskey et H. Johansson, « A systematic review of hip fracture incidence and probability of fracture worldwide », Osteoporosis International, vol. 23, no 9, , p. 2239–2256 (ISSN 0937-941X, PMID 22419370, PMCID PMC3421108, DOI 10.1007/s00198-012-1964-3, lire en ligne)
- http://www.iofbonehealth.org/health-professionals/about-osteoporosis/epidemiology.html
- http://www.iofbonehealth.org/facts-and-statistics.html
- (en) Keen RW, « Burden of osteoporosis and fractures » Curr Osteoporos Rep. 2003;1:66-70
- (en) E. M. Balk, G. P. Adam, V. N. Langberg et A. Earley, « Global dietary calcium intake among adults: a systematic review », Osteoporosis International, vol. 28, no 12, , p. 3315–3324 (ISSN 0937-941X et 1433-2965, PMID 29026938, PMCID PMC5684325, DOI 10.1007/s00198-017-4230-x, lire en ligne)
- (en) B. Shea, G. Wells, A. Cranney et al., « Meta-analyses of therapies for postmenopausal osteoporosis : VII Meta-analysis of calcium supplementation for the prevention of postmenopausal osteoporosis », Endocrine Reviews, vol. 23, no 4, , p. 552-559. (DOI 10.1210/er.2001-7002, lire en ligne)
- (en) Amy Joy Lanou « Should dairy be recommanded as part of a healthy vegetarian diet? Counterpoint » Am J Clin Nutr. 2009;89(5):1638S-1642S. DOI:10.3945/ajcn.2009.26736P
- (en) Connie M Weaver, « Should dairy be recommended as part of a healthy vegetarian diet? Point », American journal of clinical nutrition, vol. 89, no 5, (DOI 10.3945/ajcn.2009.26736O, lire en ligne)
- (en) Bolland MJ, Avenell A, Baron JA et al. « Effect of calcium supplements on risk of myocardial infarction and cardiovascular events: meta-analysis » BMJ 2010;341:c3691
- (en) MacLean C, Newberry S, Maglione M et al. « Comparative effectiveness of treatments to prevent fractures in men and women with low bone density or osteoporosis » Ann Int Med. 2008;148:197-213
- (en) Fenton TR, Tough SC, Lyon AW, Eliasziw M, Hanley DA. « Causal assessment of dietary acid load and bone disease: a systematic review & meta-analysis applying Hill's epidemiologic criteria for causality » Nutr J. 2011;10:41. (Résumé).
- (en) Andrea L Darling, D Joe Millward, David J Torgerson, Catherine E Hewitt et Susan A Lanham-New, « Dietary protein and bone health: a systematic review and meta-analysis », American Society for Nutrition, décembre 2009
- Effect on Bone Turnover and BMD of Low Dose Oral Silicon as an adjunct to Calcium/Vitamin D3 in a Randomized, Placebo-Controlled Trial., T.D. Spector, M.R. Callome, S. Anderson, septembre 2005, American society for bone and mineral research, 2005
- (en) RP Heaney, « Role of dietary sodium in osteoporosis », J Am Coll Nutr., vol. 25(3 Suppl), , p. 271S-276S. (PMID 16772639, lire en ligne)
- (en) Gates S, Fisher JD, Cooke MW, Carter YE, Lamb SE, « Multifactorial assessment and targeted intervention for preventing falls and injuries among older people in community and emergency care settings: systematic review and meta-analysis » BMJ 2008;336:130-3.
- (en) Cadarette SM, Katz JN, Brookhart MA et al. « Relative effectiveness of osteoporosis drugs for preventing nonvertebral fracture » Ann Int Med. 2008;148:637-46.
- (en) Wells G, Tugwell P, Shea B et al. « Meta-analyses of therapies for postmenopausal osteoporosis. V. Meta-analysis of the efficacy of hormone replacement therapy in treating and preventing osteoporosis in postmenopausal women » Endocr Rev. 2002;23:529-39.
- (en) McClung MR, Lewiecki EM, Cohen SB et al. « Denosumab in postmenopausal women with low bone mineral density » N Engl J Med. 2006;354:821-31.
- (en) Bone HG, McClung MR, Roux C et al. « Odanacatib, a cathepsin-K inhibitor for osteoporosis: a two-year study in postmenopausal women with low bone density » J Bone Miner Res. 2010;25:937-47.
- (en) Nguyen Xuan Cuong, Chau Van Minh, Phan Van Kiem, Hoang Thanh Huong, Ninh Khac Ban, Nguyen Xuan Nhiem, Nguyen Huu Tung, Ji-Won Jung, Hyun-Ju Kim, Shin-Yoon Kim, Jeong Ah Kim, Young Ho Kim « Inhibitors of Osteoclast Formation from Rhizomes of Cibotium barometz » Journal of Natural Products 2009;72(9):1673-7. (Résumé)
- (en) Chrischilles EA, Butler CD, Davis CS, Wallace RB. « A model of lifetime osteoporosis impact » Arch Intern Med. 1991;151:2026-32.
- « Pourquoi l’ostéoporose fait vraiment souffrir les femmes », (consulté le 31 août 2018)
- (en) Rosencher, N, Vielpeau, C, Emmerich, J., Fagnani, F., Chibedi, D et Samama, Ch. M., « Clinical events after hip fracture surgery: the Escorte study A-325 », European Journal of Anaesthesiology, vol. 21, , p. 82 (lire en ligne)
- Philippe Oberlin et Marie-Claude Mouquet, « Les fractures du col du fémur en France entre 1998 et 2007 : quel impact du vieillissement ? », Études et résultats, no 723, (lire en ligne [PDF])
- Source : Professeur Francis Berenbaum, (hôpital Saint-Antoine, Paris) au congrès l’European League Against Rheumatism (Eular)], qui a réuni plus de 14 000 personnes de 117 pays à Paris en 200, cité in « Les oubliés de l’ostéoporose et de l’arthrose »(Archive • Wikiwix • Archive.is • Google • Que faire ?), décembre 2013, consulté 2013-12-11
- Dr Jean-Pierre Poinsignon «Ostéoporose : mythe ou réalité ?» Essai, Ed. Du Rocher, septembre 2015
- « Ostéoporose : vraie menace ou fausse maladie ? »
Voir aussi
Bibliographie
- (en) Ismail AA, Pye SR, Cockerill WC, Lunt M, Silman AJ, Reeve J et al. « Incidence of limb fracture across Europe: results from the European Prospective Osteoporosis Study (EPOS) » Osteoporos Int. 2002;13(7):565–71.
- (en) Fenton TR, Tough SC, Lyon AW, Eliasziw M, Hanley DA. « Causal assessment of dietary acid load and bone disease : a systematic review & meta-analysis applying Hill's epidemiologic criteria for causality » Nutr J. 2011 Apr 30; 10:41. (Résumé).
- (en) Alfvén T, Elinder CG, Carlsson MD, Grubb A, Hellström L, Persson B, Pettersson C, Spång G, Schütz A, et Järup L. « Low level cadmium exposure and osteoporosis » J Bone Miner Res. 2000;15:1579-86.
- (en) Conférence de consensus (1993) « Consensus development conference: diagnosis, prophylaxis, and treatment of osteoporosis » Am J Med. 1993;94(6):646–50.
Liens externes
- Groupe de recherche et d'information sur les ostéoporoses (GRIO, France)
- L'ostéoporose masculine sur le site de l'université d'Angers
- [PDF] Le traitement médicamenteux de l'ostéoporose post-ménopausique : document de l'AFSSAPS
- (en) International Osteoporosis Foundation Website
- Portail de la médecine