Plasticité synaptique
La plasticité synaptique, en neurosciences, désigne la capacité des synapses à moduler, à la suite d'un événement particulier - une augmentation ou une diminution ponctuelle et significative de leur activité - l'efficacité de la transmission du signal électrique d'un neurone à l'autre et à conserver, à plus ou moins long terme, une "trace" de cette modulation[1],[2],[3].
Pour les articles homonymes, voir Plasticité (homonymie).
De manière schématique, l'efficacité de la transmission synaptique, voire la synapse elle-même, est maintenue et modulée par l'usage qui en est fait[4]. La plasticité synaptique serait un des mécanismes neuronaux support de la mémoire et de l'apprentissage des organismes dotés d'un système nerveux[5],[6],[7].
La plasticité synaptique correspond à différents types de mécanismes moléculaires et cellulaires associés à des modifications de la physiologie neuronale (potentialisation et dépression à long terme) et/ou du comportement de l'organisme (habituation, sensibilisation, etc.). En effet, la connexion entre deux neurones n'est pas figée, comme on le pensait au début des recherches dans ce domaine, mais dépend des activités antérieures des neurones, de l'"utilisation" qui a pu être faite de cette connexion. La plasticité synaptique est considérée comme un type de plasticité des réseaux neuronaux et du cerveau en général, la plasticité neuronale (ou cérébrale). Néanmoins, cette forme de plasticité, à l'échelle de la synapse, permet d'expliquer différentes formes d'apprentissage et de mémorisation observés chez tous les organismes possédant un système nerveux, y compris les espèces les plus anciennes.
Historique
En , Jerzy Konorski (en) est le premier à avoir utilisé l’expression de "plasticité synaptique" pour évoquer l'idée de Santiago Ramón y Cajal selon laquelle la mémoire était conservée sous forme de modifications anatomiques dans la force des connexions synaptiques[8],[9]. Une notion similaire est développée par Donald Hebb à la même époque, de l'autre côté du rideau de fer[10].
Transmission synaptique et plasticité
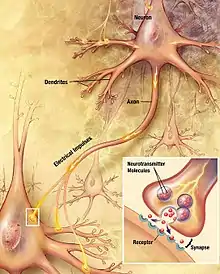
Une synapse est une spécialisation de la membrane plasmique du neurone permettant aux neurones le transfert d'un influx nerveux électrique sous forme chimique (figure 1). Au niveau présynaptique, l'arrivée d'un influx nerveux, codé sous forme de potentiels d'action et véhiculé le long de l'axone, provoque la libération de neurotransmetteurs dans la fente synaptique. Les neurotransmetteurs se lient à des récepteurs spécifiques localisés au niveau de la membrane du neurone postsynaptique. Ces récepteurs, qui peuvent être métabotropes ou ionotropes, une fois activés, génèrent, par l'ouverture de canaux ioniques, des potentiels postsynaptiques membranaires qui, s'ils atteignent un seuil au niveau du cône d'émergence (ou zone gâchette), généreront des potentiels d'actions par le neurone postsynaptique. C'est ces différents mécanismes de la transmission synaptique qui vont pouvoir être modifiés par des phénomènes de plasticité synaptique.
Le signal nerveux généré par le neurone postsynaptique dépend de l'amplitude de sa dépolarisation. Celle-ci est dépendante de nombreux paramètres intervenant aux trois niveaux de la synapse et présentés ici de manière non exhaustive :
- neurone présynaptique : fréquence des potentiels d'action afférents (en Hz), ensemble ("pool") de vésicules synaptiques disponible, quantité de neurotransmetteurs par vésicule, action d'interneurones modulateurs ;
- fente synaptique : nature et concentration des neurotransmetteurs (en mol/L), implication des astrocytes dans la recapture des neurotransmetteurs[11] ;
- neurone postsynaptique : identité, nombre et efficacité des récepteurs post-synaptiques.
La plasticité synaptique résulte d'un changement quantitatif des différents paramètres de codage d'entrée et de sortie, il y a donc deux composantes possibles, une composante présynaptique et une composante postsynaptique.
Modèles
Historique
À l'aube des années , peu de choses sont connues sur le support biologique de la mémoire et de l'apprentissage. Le cerveau humain étant d'une grande complexité (plus de 100 milliards de neurones avec chacun plus de 7 000 synapses en moyenne), déterminer quels neurones sont impliqués dans la mémoire et quelles synapses sont modulées par un apprentissage pouvait paraître difficile, voire impossible. Au début des années , des scientifiques, et parmi eux Eric Kandel (prix Nobel de médecine/physiologie en 2000), décidèrent d'avoir une approche réductionniste en utilisant des organismes modèles ayant des systèmes nerveux et des comportements plus simples, comme le lièvre de mer[12] (figure 2), la mouche du vinaigre[13] ou bien encore la souris.

L'Aplysie (figure 2) possède un système nerveux composé d'à peu près 20 000 neurones présentant plus ou moins toujours la même localisation. Ses neurones sont, pour certains, de très grande taille (jusqu'à 1 mm), visibles à l’œil nu, ils facilitent les mesures électrophysiologiques, leur dissection pour des études biochimiques et l'injection de divers composés (anticorps, constructions génétiques, etc.)[12].
Classification
La recherche en neurosciences a mis à jour différentes modifications du comportement ou de la physiologie neuronale associées à diverses formes de plasticité synaptique. On distingue les plasticités comportementales comme :
- l'habituation,
- la sensibilisation,
- le conditionnement,
Des plasticités synaptiques au niveau moléculaire [14]:
- la facilitation,
- l'augmentation,
- la potentialisation,
- la dépression,
- la potentialisation à long terme,
- la dépression à long terme.
Chacun de ces phénomènes comprend des variantes classées en sous-types. À l'heure actuelle, il est évident qu'on ne peut se prétendre exhaustif dans l'énumération des différents types et sous-types de plasticité, puisqu'on n'a pas encore entièrement compris quelle logique englobante régit leur apparition. Il se peut que les variantes de plasticité soient quasi illimitées et que la fréquence de leur apparition respective soit en rapport direct avec le type de neurones qu'elles modifient, ainsi qu'en fonction de leur environnement cellulaire.
Phases
On distingue en général deux phases à la plasticité synaptique[3] :
- Une phase dite "à court terme"[15] qui correspond à des modifications d'efficacité de la transmission synaptique dues aux processus de fabrication, de libération, de recyclage des neurotransmetteurs, des modifications post-traductionnelles de protéines existantes, l'ensemble influençant la fréquence des potentiels d'action émis par les neurones postsynaptiques. La potentialisation post-tétanique est un exemple[5].
- Une phase dite "à long terme"[16] qui implique des modifications de l’activité, du nombre de récepteurs aux neurotransmetteurs, la transcription, la traduction et des modifications structurales du nombre de synapses entre les neurones. Cette phase inclut les phases tardives de la potentialisation à long terme et de la dépression à long terme.
Plasticités comportementales
L'habituation
L'habituation, du point de vue comportemental, a tout d'abord été étudiée par Ivan Pavlov et Charles Sherrington. Elle l'a été ensuite par Alden Spencer et Richard F. Thompson (en) du point de vue cellulaire. C'est une des formes les plus simples de l'apprentissage, elle consiste à ignorer un stimulus insignifiant et inoffensif comme la sensation du vêtement au contact de la peau.
Chez l'Aplysie


Chez ce mollusque, il existe un comportement réflexe inné de défense, le réflexe de retrait des branchies. Lorsqu'on applique un stimulus tactile léger au siphon de cet animal, il le rétracte, ainsi que ses branchies, dans un réflexe de protection. Si l'on répète la stimulation tactile, au fur et à mesure, la réponse comportementale s’atténue dans un phénomène qui s’apparente à l'habituation chez l'humain[17].
D'un point de vue cellulaire, ce mécanisme repose sur un circuit neuronal simple composé d'un nombre limités de neurones (figure 3), schématiquement, un neurone sensoriel et un neurone moteur connectés ensemble par une synapse[18],[12]. Le neurone sensoriel, activé par le stimulus tactile, active à son tour le neurone moteur responsable du retrait du siphon et des branchies, de manière tout à fait similaire au réflexe rotulien chez l'humain.
D'un point de vue moléculaire, le neurone sensoriel libère du glutamate, un neurotransmetteur excitateur, au niveau de la fente synaptique le séparant du neurone moteur (figure 4, contrôle). La stimulation répétée du neurone sensoriel conduit à une diminution progressive de la libération de glutamate, on parle de "dépression synaptique" (figure 4, habituation). Cette diminution correspond à une réduction du nombre de vésicules pouvant libérer ce neurotransmetteur[19].
On distingue deux phases au phénomène d'habituation qui dépendent du nombre de stimulations :
- Dix stimulations tactiles produisent une mémoire à court terme qui dure quelques minutes[20].
- Quatre sessions de 10 stimuli produisent une mémoire à long terme qui peut durer jusqu'à trois semaines. Les sessions doivent cependant être espacées dans le temps, de quelques heures à une journée. Si elles sont données les unes à la suite des autres, sans repos - on parle d'apprentissage "massé" - les mêmes sessions d'apprentissage ne produisent pas de mémoire à long terme. Il s'agit d'un des principes général de la psychologie de l'apprentissage, l'entraînement espacé est plus efficace que le massé pour produire de la mémoire à long terme[20]. Par ailleurs, la formation de la mémoire à long terme s'accompagne de modifications structurales au niveau de la terminaison présynaptique, le nombre de synapses se réduit par élagage. On observe jusqu'à 30 % de connections en moins avec les neurones moteurs[21].
On retrouve ce phénomène d'habituation, avec d'autres modalités sensorielles, comme l'olfaction, et chez des espèces ayant évolué plus récemment comme la mouche[22] ou la souris[23], y compris chez l'humain[24].
La sensibilisation
Lors de ce processus, la réponse à un stimulus nociceptif se généralise à d'autres stimuli neutres, l'ensemble des réflexes défensifs sont augmentés. Il s'agit d'un phénomène similaire à la sensibilisation chez l'humain. Lorsqu'on entend un bruit très fort et inattendu, pendant une courte période de temps, même un stimulus neutre comme une main posée sur l'épaule peut provoquer un sursaut. Classiquement, une sommation sensorielle brusque et inopinée (douloureuse) induit ensuite des réactions plus vives face à divers stimuli sensoriels neutres (état d'hypervigilance, d'alerte).
Chez l'Aplysie

À court terme
Dans le cas de l'Aplysie, si l'on applique un choc électrique à la queue de l'animal et qu'ensuite on applique un stimulus tactile au siphon, la réponse de retrait est fortement augmentée[25].
Du point de vue cellulaire, la sensibilisation fait intervenir les neurones impliqués dans l'habituation ainsi que deux populations de neurones supplémentaires (figure 3). Il s'agit de neurones sensoriels localisés dans la queue de l'animal et d'interneurones reliant ces neurones aux terminaisons présynaptiques des neurones sensoriels du siphon. Le neurone sensoriel de la queue, activé par le stimulus électrique, active l'interneurone sérotoninergique (5-HT) facilitateur situé en aval. La libération de sérotonine sur la terminaison présynaptique amplifie la libération de neurotransmetteurs par le neurone sensoriel du siphon lorsqu'il est activé par un stimulus neutre.
D'un point de vue moléculaire, la sérotonine se lie à deux types de récepteurs, couplés à des protéines G (Go et Gs), localisés sur la terminaison présynaptique des neurones sensoriels du siphon. L'activation des récepteurs Gs induit une production d'AMPc par l'adénylate cyclase. L'AMPc, en se liant à la protéine kinase A (PKA), déplace des sous-unités régulatrices et libère les unités catalytiques qui phosphorylent différentes cibles. La PKA agit par trois voies de signalisation[26] :
- La PKA phosphoryle des canaux potassiques () diminuant leur probabilité d'ouverture, induisant une augmentation de la durée du potentiel d'action et par conséquent augmente le nombre de canaux de type N ouverts et la transmission synaptique.
- La PKA favorise la mobilisation des vésicules synaptiques ainsi que leur exocytose.
- Les récepteurs à la sérotonine couplés à la protéine Go induisent une activation de la phospholipase C qui produit du diacylglycérol activant à son tour la protéine kinase C. Protéines kinase A et C agissent conjointement pour activer des canaux de type L.
L'augmentation de l'entrée de dans la terminaison présynaptique induit une augmentation de la quantité de glutamate libérée lors de la stimulation des neurones du siphon et donc une stimulation accrue des neurones moteurs et une contraction plus importante des muscles branchiaux[12].
À long terme
Une stimulation électrique unique de la queue de l'Aplysie induit une forme de sensibilisation à court terme qui dure quelques minutes. Cinq répétitions, ou plus, génèrent une forme à plus long terme qui peut durer des jours voir des semaines. L'espacement des chocs, comme pour l'habituation, assure au comportement de s'inscrire dans le long terme. Pour parler du processus de conversion de la mémoire à court terme en mémoire à long terme, on parle de "consolidation" de la mémoire[27]. La mémoire à long terme, à la différence de la mémoire à court terme, est dépendante de l'expression génique, de la synthèse protéique et de la croissance de nouvelles - ou de l’élagage de - connections synaptiques[28].
La protéine kinase A (PKA), à la suite de son activation prolongée par la sérotonine, active une nouvelle protéine par phosphorylation, la MAPK (mitogen-activated protein kinase). Ensemble, ces deux kinases sont transloquées dans le noyau où elles activent par phosphorylation le facteur de transcription CREB-1 (cAMP Response Element-binding protein 1)[29]. De manière indirecte, ces protéines participent également à la suppression de l'action inhibitrice de CREB-2, un répresseur transcriptionnel.
CREB-1, une fois activé, se lie à des séquences régulatrices spécifiques appelées CRE (cAMP response element) et localisées sur l'ADN nucléaire (5'-TGACGTCA-3'). Il active la transcription de gènes de réponse précoce/immédiate (en)[30]. CREB-1 stimule l'expression de l'UCH (ubiquitine carboxy-terminale hydrolase) (en)[31], du facteur de transcription C/EBP (CCAAT enhancer-binding protein) (en)[32] et de la chaîne lourde de la kinésine[33].
L'ubiquitine hydroxylase induit la dégradation des sous-unités régulatrices de la PKA par le protéasome activant de manière permanente la PKA et contribue ainsi à entretenir, sur le long terme, l'activation des cibles de la PKA, dont CREB-1. C/EBP va favoriser, par l'activation d'autres gènes (notamment EF1α (en) (elongation factor 1 alpha)), la formation de nouvelles terminaisons synaptiques et augmenter ainsi le nombre de synapses reliant neurones sensoriels et moteurs (+ 100 %). Les modifications structurales des terminaisons synaptiques renforcent à long terme l'efficacité de la transmission synaptique entre neurone sensoriel et moteur et de cette manière la contraction des muscles branchiaux.
De ces études chez l'Aplysie, on a pu conclure que la modification d'un comportement pouvait dépendre d'un changement d'efficacité de la transmission synaptique d'un nombre restreint de synapses. De plus, la mémoire à court terme dépend de modifications post-traductionnelles (phosphorylation) de protéines déjà existantes (PKA) alors que la mémoire à long terme repose sur des changements de l'expression génique, protéique (ubiquitine hydroxylase, C/EBP) et de modifications structurales (nouvelles synapses). Des études chez d'autres invertébrés, comme la drosophile[34], ou chez des mammifères[35] permettront par la suite une généralisation de ces mécanismes.
Habituation et sensibilisation sont deux formes de mémoire que l'on retrouve chez l'humain et qui sont dites "implicites" (ou non-déclaratives) et "non-associatives".
Facilitation à long terme
La mémorisation à long terme requiert l'expression génique, or, ce processus a lieu dans le noyau du neurone. Une des questions qui s'est posée a donc été de déterminer si les ARNm sont uniquement transportés jusqu’aux synapses impliquées dans l'apprentissage ou s'ils sont répartis de manière homogène et traduits localement[12].
Afin de répondre à cette question, un modèle ex vivo a été mis au point, la facilitation, à partir de neurones d'Aplysie[36]. Dans ce modèle, un neurone sensoriel bifurqué faisant synapse avec deux neurones moteurs distincts sont mis en culture. Il est ensuite possible d'appliquer de la sérotonine sur une des deux synapses (avec une microélectrode) et d'enregistrer l'activité électrique induite par le neurone sensoriel dans l'un ou l'autre des neurones moteurs. Les auteurs ont ainsi pu constater que l'application d'une bouffée de sérotonine induisait une augmentation de l'amplitude des potentiels postsynaptiques excitateurs (PPSE) pendant une dizaine de minutes. S'ils appliquaient cinq bouffées de sérotonine espacées dans le temps, l'augmentation de l'amplitude des PPSE persistait pendant plus de 24 heures. Ces modifications concernaient uniquement le neurone moteur associé à la synapse qui avait été traitée indiquant que la plasticité était "synapse-spécifique". De plus, la facilitation à long terme était dépendante de la transcription, de CREB-1 et induisait des modifications structurales. Les auteurs disposaient donc d'un modèle similaire à la sensibilisation, ex vivo, avec un dispositif neuronal minimal.
Comment les ARNm induits par CREB-1 pouvaient-ils "reconnaître" la synapse activée par la sérotonine et ne participer au renforcement que de celle-ci ? Les auteurs de cette étude vont faire deux observations importantes[36]. Tout d'abord, l'application locale, sur la synapse activée, d'un inhibiteur de la synthèse protéique (l'émétine) supprime la facilitation à long terme. Ensuite, l'application d'une seule bouffée de sérotonine, sur la branche opposée à celle où a été induite la facilitation à long terme, induit également une facilitation à long terme. Ces résultats indiquent que les ARNm sont répartis dans le neurone sensoriel et qu'ils sont traduits localement au niveau de la synapse où la facilitation a été induite[37]. Il existe donc un phénomène de "marquage" synaptique lors de l'induction de la facilitation - également observé lors du processus de potentialisation à long terme chez le mammifère (voir plus bas)[38] - qui permet aux ARNm d’être traduits localement. Par ailleurs, une synapse peut "capturer" le produit de la transcription, et générer une facilitation à long terme, si elle est également marquée par une stimulation unique à la sérotonine.
De ces expériences il ressort que l'unité fonctionnelle de base de la plasticité synaptique à long terme, et potentiellement de la mémorisation, est la synapse. Ceci a encore été confirmé récemment chez la Drosophile[39]. De plus, la traduction locale joue un rôle majeur dans la formation de la mémoire à long terme.
Marquage synaptique
En , l'équipe d'Eric Kandel s'est intéressée à la nature du marquage synaptique et en particulier au rôle d'une protéine de liaison à l'ARN, CPEB (en) (cytoplasmic polyadenylation element binding protein)[40]. CPEB avait été initialement décrite comme capable d'activer la traduction d'ARNm "dormants" grâce à sa liaison à des éléments de polyadénylation cytoplasmiques (CPE (en)) présents dans la région 3'UTR de certains ARNm[41]. Cette protéine, présente au niveau des dendrites et activée par une stimulation synaptique, recrute ensuite des facteurs participant à la régulation de la traduction, comme eIF4E (en), ou à l'élongation de la queue poly(A)[42].
Kausik Si et ses collègues ont tout d'abord mis en évidence qu'il existait une forme de CPEB conservée par l'évolution et présente chez l'Aplysie[43]. Présente à un faible niveau dans les neurones, son expression est augmentée - localement dans la synapse activée - par l'induction d'un facilitation à court terme. De plus, cette augmentation est nécessaire à la formation de la facilitation à long terme. CPEB pourrait donc jouer le rôle de "marque" au niveau des synapses activées lors de la facilitation. CPEB se lierait ensuite à la région 3'UTR de l'ARNm de cibles spécifiques comme l'actine, induisant leur polyadénylation et leur traduction locale, et participerait ainsi aux modifications structurales nécessaires à la facilitation à long terme de la transmission synaptique, comme la mise en place de nouvelles synapses.
Protéine de type prion et mémoire
Lors de leur étude, Kandel et ses associés découvrirent que la protéine CPEB présentait une structure primaire enrichie en acides aminés glutamine et asparagine au niveau de l'extrémité N-terminale[44]. Ces derniers conféraient une structure secondaire particulière à la protéine, structure proche du domaine prion de la protéine du même nom[45]. Ce domaine prion permettrait aux protéines CPEB d'effectuer une transition entre deux états conformationnels aux fonctions distinctes. La transition s’effectuerait lorsque des protéines CPEB s’agrègent et que l'une d'entre elles, ayant déjà effectué la transition, induit un changement de conformation vers la forme prion chez ses partenaires. À partir de ces expériences, les auteurs ont pu développer une hypothèse selon laquelle un changement initial de conformation de CPEB, vers la forme prion, constituerait la "marque locale" induite lors de la facilitation à court terme. Ce changement de conformation de CPEB induirait par la suite une facilitation à long terme par sa capacité à induire la traduction d'ARNm au niveau de la synapse marquée et par sa capacité à entretenir, à long terme, un ensemble de protéines CPEB avec une conformation prion.
Ce type de mécanisme, impliquant un homologue de CPEB, Orb2 et CPEB-3 respectivement, sera décrit quelques années plus tard chez la drosophile[46],[47] puis chez le mammifère lors de la formation d'une mémoire spatiale[48].
Les conditionnements
Il existe d'autres types de mémoire implicite, "associatives", appelées conditionnements (classique et opérant) et qui reposent sur des mécanismes de plasticité synaptique différents de l'habituation et de la sensibilisation.
Classique
Depuis Aristote déjà ( - ), les philosophes pensent que l'apprentissage se fait par association d'idées. Ce concept sera ensuite développé au XVIIe siècle par John Locke et la psychologie empiriste[49]. Et c'est au début du XXe siècle, en , qu'Ivan Pavlov défini le conditionnement classique et l'introduit dans l'étude de l'apprentissage et de la mémorisation[50]. Plus connu sous le nom de réflexe Pavlovien, il fait maintenant partie de la culture populaire et on le retrouve mentionné, pour le meilleur et pour le pire, dans de nombreuses œuvres comme Orange mécanique, Les Sous-doués, etc. C'est de manière fortuite qu'Ivan Pavlov avait découvert ce phénomène chez le chien alors qu'il étudiait la physiologie digestive. Son travail de recherche lui vaudra le prix Nobel de physiologie/médecine en .
Le conditionnement classique consiste, pour l'organisme, à associer deux stimuli sensoriels. La mesure de cette association est réalisée en analysant des modifications du comportement. On associe généralement une réponse comportementale inconditionnelle à un stimulus sensoriel neutre. En prenant l'exemple de l'olfaction chez la mouche, dans les conditions initiales, un odorant (composé chimique) déclenche la perception d'une odeur, par le système nerveux, qui n'aura, a priori, que peu de manifestations comportementales (stimulus conditionné). Par ailleurs, l'application d'un choc électrique léger aux pattes de l'animal (stimulus inconditionnel) induit un comportement de défense prenant la forme d'une fuite (réponse inconditionnelle). Si l'on associe de manière répétée l'odorant à un choc électrique et qu'on soumet ensuite les mouches à l'odorant, elles vont chercher à le fuir. C'est l'odorant qui déclenche le mouvement de fuite (réponse conditionnée), l'odorant a acquis une valeur aversive, il y a eu conditionnement olfactif aversif[51].
Les autres modalités sensorielles peuvent également être conditionnées comme l’ouïe, le toucher, etc. Il est également possible d'utiliser un stimulus inconditionnel déclenchant une réponse d'approche, comme une source alimentaire, on parlera alors de conditionnement appétitif. En fonction de l’espèce considérée et de l'évolution de son système nerveux, différentes régions seront impliquées mais ce seront les mèmes mécanismes de plasticité synaptique qui permettront l'apprentissage et la mémorisation du conditionnement. Le conditionnement est un processus fortement conservé par l'évolution et qui permet à l'organisme de rechercher, notamment, des sources d'alimentation bénéfiques et de fuir de potentiels prédateurs. Schématiquement, il permet à l'organisme d'associer une infinité de stimuli sensoriels à un registre de comportements innés limité, l'attraction et la fuite. Le conditionnement est un des mécanismes permettant d'apprendre de nouvelles règles sur un environnement en perpétuel changement[52].
Chez l'Aplysie
Chez l'Aplysie, le conditionnement classique est une forme plus complexe d'apprentissage que la sensibilisation[53]. L'animal apprend qu'une stimulation tactile sur une partie de son anatomie, le repli du manteau, est associée à un choc électrique léger. Ceci induit une contraction forte des branchies, plus importante que lors de la sensibilisation, et qui est uniquement associée à la stimulation du manteau et pas à d'autres parties du corps, comme le siphon. À la différence de la sensibilisation, le stimulus conditionnel doit immédiatement précéder le stimulus inconditionnel lors du conditionnement (~ 0,5 s). Bien que ce soient les mêmes acteurs cellulaires que ceux de la sensibilisation, la proximité temporelle des stimuli déclenche des mécanismes moléculaires spécifiques. Par ailleurs, il existe une composante postsynaptique, en plus de la composante présynaptique, à cette forme de plasticité synaptique[54].
D'un point de vue moléculaire, l'activation des neurones sensoriels du manteau déclenche un influx de calcium () au niveau présynaptique. Cet influx active la calmoduline (CaM), une protéine qui s'associe au (). Le complexe -CaM se lie à l'adénylate cyclase, ce faisant, il active la production d'AMPc. Simultanément, l'activation, par le choc électrique, des interneurones sérotoninergiques déclenche la libération de sérotonine sur la terminaison présynaptique. La sérotonine se lie à ses récepteurs spécifiques couplés aux protéines Gs qui activent également l'adénylate cyclase. L'activation simultanée de l'adénylate cyclase potentialise la production d'AMPc qui agit comme un "détecteur de coïncidence". L'adénylate cyclase joue le même rôle lors du conditionnement classique chez la mouche[55].
Lors de l'activation simultanée des neurones sensoriels et sérotoninergiques, l'influx nerveux activant le neurone moteur postsynaptique est suffisant pour recruter les récepteurs au glutamate de type NMDA (N-méthyl-D-aspartate) (voir figure 7). Ces "récepteurs-canaux", lorsque la membrane est à son potentiel de repos, sont bloqués par un ion magnésium (). La dépolarisation est telle que le est expulsé du récepteur NMDA libérant le canal et permettant un influx important de dans la terminaison postsynaptique. Cet influx de active à son tour une voie de signalisation conduisant à l’émission d'un signal rétrograde capté par la terminaison présynaptique qui amplifie la transmission synaptique et participe ainsi à une augmentation de l'efficacité de la transmission synaptique et de la contraction des branchies.
Ces types de mécanismes de plasticité impliquant l'AMPc, la PKA et CREB ont été décrits dans d'autres espèces comme la mouche[56] et ainsi être généralisés au conditionnement classique.
Opérant
Les bases du conditionnement opérant sont similaires à celles du conditionnement classique, elles différent seulement par le fait que ce sont les actions de l'organisme - et non plus un stimulus externe - qui sont associées à des conséquences positives ou négatives[57].
Plasticités synaptiques au niveau moléculaire
Plasticité synaptique à court terme
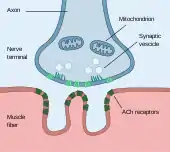
Ces formes de plasticité ont été étudiées de la manière la plus détaillée au niveau de la jonction neuromusculaire, synapse particulière reliant un neurone à des fibres musculaires et permettant d'induire une contraction musculaire (figure 5). Leurs durées n'est que de quelques minutes ou moins[58],[59].
Facilitation synaptique
Ce type d'augmentation transitoire (< 1 s) de l'efficacité synaptique (paired-pulse facilitation en anglais) se produit lorsque deux potentiels d'action (PA), ou plus, se suivent de manière rapide au niveau de la jonction neuromusculaire[60]. Chaque PA induit une libération plus importante de neurotransmetteur (l'acétylcholine) que le précédent. Ceci a pour conséquence d'augmenter progressivement le potentiel de plaque motrice (PPM).
D'un point de vue moléculaire, l'arrivée de chaque PA induit une entrée de calcium () au niveau présynaptique. Si l'entrée du est rapide (1 à 2 ms), les mécanismes lui permettant de ressortir sont beaucoup plus lents. La succession rapide de PA conduit donc à une accumulation progressive de la concentration calcique présynaptique, elle ne peut pas revenir à son niveau de base entre deux PA. L'exocytose des vésicules synaptiques étant provoquée par l'augmentation de la concentration présynaptique de , l'arrivée de chaque PA induit une libération de neurotransmetteur de plus en plus importante. Il en résulte au niveau de la plaque motrice un PPM de plus en plus grande amplitude. Le PPM induit par le dernier PA d'une volée de PA est plus important que pour le premier, il y a facilitation synaptique[58].
Dépression synaptique
Le phénomène de dépression synaptique intervient à la suite d'une forte activité de la synapse et à la survenue de nombreux potentiels d'action en succession rapide[59]. Elle correspond à un épuisement des vésicules synaptiques de neurotransmetteurs, la force de la transmission diminue. L'efficacité synaptique pourra être rétablie lorsque le stock de vésicules aura été rétabli, notamment grâce au processus de recyclage des vésicules synaptiques[58].
Potentialisation post-tétanique
Une stimulation électrique à haute fréquence (appelée "tétanique") conduit à une autre forme de facilitation à court terme qui apparaît au bout de quelques minutes après la stimulation. Cette forme de plasticité est caractérisée par des augmentations des taux de calcium présynaptiques sur le plus long terme. Ces augmentations conduiraient à l'activation de protéines kinases qui potentialiseraient la capacité des vésicules synaptiques à fusionner avec la membrane plasmique lors de l'exocytose[58].
La potentialisation à long terme

La potentialisation à long terme (long-term potentiation (LTP) en anglais) a été décrite pour la première fois dans l'hippocampe de lapin en par Timothy Bliss (en) et Terje Lømo (en)[61]. Elle correspond au renforcement de l'efficacité de la transmission synaptique à la suite d'une stimulation électrique à haute fréquence (tétanique). La LTP étant un modèle cellulaire potentiel de l'apprentissage et de la mémorisation, elle a donné lieu a un très important travail de recherche[62]. Elle a lieu dans l'hippocampe, une structure cérébrale conservée chez les mammifères et importante pour la mémorisation. Des lésions de l'hippocampe sont associées à des cas d'amnésie et notamment au célèbre patient H.M.[63]. Chez le rongeur, l'hippocampe joue un rôle important dans l'apprentissage spatial, c'est notamment là que l'on trouve les "cellules de lieu"[64]. Par ailleurs, l'hippocampe est l'une des rares régions du cerveau à présenter une neurogenèse chez l'adulte, processus de plasticité cérébrale qui serait impliqué dans l'apprentissage et la mémorisation[65]. On retrouve le phénomène de la LTP dans de nombreuses régions cérébrales comme l'amygdale, le cervelet ou le cortex.
Trois voies nerveuses (faisceaux d'axones) peuvent être stimulées dans l'hippocampe et donner lieu à une potentialisation à long terme de leur transmission synaptique. Dans le sens de l'influx nerveux :
- La voie perforante en provenance du cortex entorhinal fait synapse avec les cellules granulaires du gyrus denté ;
- Les fibres moussues issues des cellules granulaires faisant synapse avec les cellules pyramidales de l'aire CA3 (Corne d'Ammon 3) ;
- Les collatérales de Schaffer issues des cellules pyramidales de l'aire CA3 faisant synapse avec les cellules pyramidales de l'aire CA1 (figure 6).
Les trois voies ne sont cependant pas équivalentes et les mécanismes de LTP y sont différents. La LTP induite par stimulation des fibres moussues (2) est dite "non-associative" alors que pour les deux autres voies (1 et 3), elle est "associative".
Non-associative (fibres moussues)
Les récepteurs AMPA/kaïnate au glutamate sont impliqués dans la transmission synaptique, à l'état basal, entre les axones des cellules granulaires du gyrus denté et les cellules pyramidales de la région CA3. Dans la majorité des cas, l'apparition du phénomène de LTP au niveau de cette la synapse ne dépend pas des récepteurs NMDA[66]. La LTP dépend de l'influx calcique dans la terminaison présynaptique. Celle-ci induit une activation de l'adénylate cyclase dépendante de la calmoduline et une activation de la protéine kinase A, de manière similaire à ce qui est observé chez l'Aplysie lors d'un conditionnement. Par ailleurs, cette forme de LTP peut être modulée par des afférences noradrénergiques (en provenance du locus cœruleus). La noradrénaline active les récepteurs bêta-adrénergiques (de type β1) qui conduisent, comme la sérotonine chez l'Aplysie, à une activation de l'adénylate cyclase[67]. On parlera alors de "LTP non-Hebbienne" par rapport à la LTP associative et en référence au postulat de Hebb[68].
Associative (Collatérales de Schaffer & voie perforante)
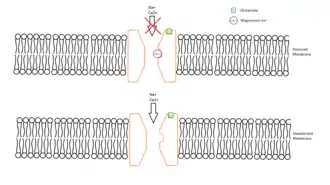
Les récepteurs AMPA/kaïnate au glutamate sont également impliqués dans la transmission synaptique à l'état basal entre les axones des cellules pyramidales de la région CA3 et CA1. L'apparition du phénomène de LTP dépend de la présence de récepteurs NMDA postsynaptiques (figures 6 et 7). De ce fait, ce type de LTP diffère de celui qui est observé dans les fibres moussues. La forme canonique de la LTP, qui ne dépend que d'une modulation des entrées sensorielles, est dite "homosynaptique" (en).
- Propriétés
D'une part, il requiert l'activation de plusieurs axones afférents par un processus dit "coopératif"[69] ; d'autres auteurs parlent d'"associativité" [70]. La stimulation présynaptique doit être suffisamment intense pour activer le neurone postsynaptique. Lorsque la stimulation d'un axone n'est pas suffisante pour générer une LTP, elle doit être associée à la stimulation d'un autre axone génèrant, elle, une LTP, les deux synapses seront alors renforcées. D'autre part, ce type de LTP est un processus "associatif", il doit y avoir une activité concomitante entre les terminaisons pré- et post-synaptiques[69] ; d'autres auteurs utilisent la notion de "dépendance de l'état"[70]. Dans tous les cas, il doit exister une forte proximité temporelle (< 100 ms) entre l'activité des neurones pré- et postsynaptiques pour que la LTP apparaisse. On parlera dans ce cas de "LTP Hebbienne" en référence à son postulat neurophysiologique.
« When an axon of cell A is near enough to excite a cell B and repeatedly or persistently takes part in firing it, some growth process or metabolic change takes place in one or both cells such that A's efficiency, as one of the cells firing B, is increased[68]. »
— Donald Hebb, The Organization of Behavior
Des mécanismes similaires interviennent au niveau de la voie perforante lors de la formation d'une LTP.
- Induction
Les récepteurs NMDA sont recrutés uniquement lorsque la liaison du glutamate est associée à une dépolarisation suffisante du neurone postsynaptique - induite par la liaison du glutamate aux récepteurs AMPA. Le récepteur NMDA agit alors comme un "détecteur de coïncidence"[71]. Dans ce cas, le est expulsé et permet un influx de dans les épines dendritiques du neurone postsynaptique. L'augmentation de la concentration calcique active deux protéines sérine/thréonine kinases, la CaMKII (protéine kinase -calmoduline dépendante) et la protéine kinase C (en). La protéine kinase A et Fyn (en) sont également activées.
- Expression (entretien)
Cette phase de la LTP implique des mécanismes pré- et postsynaptiques. Au niveau post-synaptique, la CaMKII augmente d'une part, la sensibilité des récepteurs AMPA au glutamate en les phosphorylant et d'autre part, le nombre de récepteurs AMPA au niveau de la membrane postsynaptique[72]. Certaines isoformes (gamma/γ) de la CaMKII peuvent migrer du cytosol vers le noyau et semblent jouer un rôle dans l’activation de la transcription de gènes précoces activés par CREB-1[73]. Au niveau présynaptique, la quantité de neurotransmetteur relâchée est également augmentée. La terminaison postsynaptique émet un message rétrograde, probablement le monoxyde d'azote (), vers la terminaison présynaptique communiquant ainsi l'apparition du phénomène de LTP.
- Phase précoce transitoire et phase tardive consolidée
Comme pour la mémoire et les autres formes de plasticité, la LTP a des phases temporelles[74]. Un train de stimulations électriques (1 s à 100 Hz) produit une LTP à court terme qui dure de une à trois heures appelée "précoce". Quatre trains de stimulations espacés entre eux de 10 min génèrent une LTP à long terme pouvant durer plus de 24 h et appelée "tardive". Alors que les phases précoces son différentes dans les fibres moussues et dans les collatérales de Schaffer, la phase tardive est similaire. La phase tardive est dépendante de la transcription et de la traduction. La répétition des stimulations induit une activation de l'adénylate cyclase par le complexe -calmoduline, de manière similaire à ce qui est observé lors du conditionnement classique chez l'Aplysie. L'augmentation d'AMPc provoque une activation de la protéine kinase A - qui active la MAPK - les deux sont alors transloquées dans le noyau et activent CREB-1 par phosphorylation. CREB-1, en se liant à l'ADN, active l'expression de gènes régulateurs (C/EBP-β (en)) et effecteurs (tPA, BDNF) qui conduiront à des modifications structurales - création de nouvelles synapses - renforçant ainsi l'efficacité de la transmission synaptique à long terme[12].
Des résultats suggèrent que chaque cellule pyramidale de la région CA3 ne possède qu'une seule synapse fonctionnelle, en conditions basales, avec les neurones de la région CA1[75]. Initialement, un potentiel d'action conduit au relargage d'une seule vésicule synaptique au niveau d'une zone active (en) unique. Lors de l'induction chimique - par application d'AMPc perméant activant la PKA - d'une LTP tardive, plusieurs vésicules sont relarguées, pas par une zone active unique mais par plusieurs, à la suite de la croissance de nouvelles terminaisons présynaptiques et à l'addition de nouveaux groupes (cluster) de récepteurs postsynaptiques[76].
- Modulation et contraintes
La phase tardive de la LTP peut être modulée par les afférences sérotoninergiques du raphé dorsal et dopaminergiques, en provenance notamment de la substance noire et de l'aire tegmentale ventrale, qui influencent l'activité de l'adénylate cyclase et la production d'AMPc. Lorsqu'un système neuromodulateur, ou tout autre synapse supplémentaire, intervient dans le phénomène de LTP, on parle alors de plasticité "hétérosynaptique" (en) ; la sensibilisation chez l'Aplysie est un phénomène hétérosynaptique (voir plus haut). Dans ce cas, le phénomène de plasticité intervient au niveau de synapses d'une voie qui n'a pas été stimulée, en plus de la voie qui a été stimulée. Certains auteurs ont mis en évidence que le glutamate pourrait activer la libération, notamment de dopamine, indépendamment de la stimulation de ces voies neuromodulatrices[77].
La phase tardive de la LTP subit également des contraintes, notamment par la calcineurine[78], qui doivent être levées afin de permettre la formation du plasticité à plus long terme.
Amygdalienne
Une forme de LTP hétérosynaptique a été décrite dans l'amygdale latérale[79], une structure cérébrale impliquée, notamment, dans l'attribution d'une valence émotionnelle aux stimuli sensoriels et à la peur. Dans ce cas, la LTP est induite par la stimulation simultanée des afférences corticales et thalamiques sur des neurones de projection de l'amygdale, elle ne concerne néanmoins que les afférences corticales et dépend des récepteurs NMDA. Cette stimulation est destinée à mimer l'activité physiologiques induite par un conditionnement de peur[80]. Cette forme de plasticité est "associative" - il faut une synchronisation des entrées sensorielles présynaptiques - mais indépendante de l’activité postsynaptique. L’expression de la LTP se manifeste sous la forme d'une augmentation persistante de la probabilité de fusion des vésicules synaptiques au niveau des afférences corticales.
Dans ce cas, il n’existe pas de neurone modulateur, on est en présence de trois neurones glutamatergiques. Le couplage entre une facilitation hétérosynaptique (neurones présynaptiques 1 et 2) et une activité homosynaptique (neurone présynaptique 2 et postsynaptique) est responsable d’une augmentation des concentrations intracellulaires en AMPc et du renforcement synaptique. Ces changements sont plus importants que la somme de ceux qui sont produits individuellement par des processus homo- et hétérosynaptiques. Cette combinaison pourrait être considérée comme une nouvelle catégorie de plasticité (Kandel).[réf. incomplète]
Pendant le développement
Les récepteurs iononotropiques au GABA de type A (GABAA) sont, avant d’être inhibiteurs chez l'adulte, responsables de la consolidation des premières synapses excitatrices durant le développement embryonnaire du cerveau. Ils amorcent, notamment, la pré-stimulation des récepteurs NMDA[81].
Liens avec la physiologie et la mémoire
Bien que la LTP soit un phénomène induit artificiellement, il pourrait avoir un rôle dans la physiologie nerveuse et le comportement[82], notamment dans la mémoire spatiale. Richard Morris est le premier, en , à avoir mis en évidence que l'inhibition du récepteur NMDA, par injection intraventriculaire d'AP5, un antagoniste des récepteurs NMDA, conduisait à un déficit à la fois de la LTP et de l'apprentissage spatial suggérant un lien entre ces phénomènes[83].
Mémoire spatiale

Chez le rongeur, il est possible d'évaluer la mémoire spatiale grâce au test de la piscine de Morris, du nom de son créateur[84]. Lors de ce test, une petite plate-forme est immergée (−1 cm dans une piscine (~1,5 à 2 m de diamètre) remplie d'eau opaque (à ~26 ˚C) afin de rendre la plate-forme invisible. Diverses formes géométriques sont placées autour de la piscine afin de servir d'indices visuels permettant au rongeur de se repérer dans l'espace. Les rongeurs, placées dans l'eau, cherchent naturellement à en sortir. S'ils rencontrent la plate-forme, au cours de leurs déplacements aléatoires dans la piscine, ils montent dessus afin de s'y réfugier. Lorsqu'ils sont placés de nouveau dans la piscine, ils se dirigent de plus en plus rapidement vers la plate forme à chaque répétition, on en conclut qu'ils ont mémorisé l'emplacement de la plate-forme. L'apprentissage et la mémorisation de cette localisation dépendent de l'hippocampe.
En , et en parallèle, les équipes du Dr Kandel et du Dr Susumu Tonegawa, prix Nobel de Physiologie/Médecine en , ont utilisé pour la première fois des modèle de souris transgéniques pour évaluer les conséquences sur l'apprentissage et la mémorisation de l'inactivation de gènes (knock-out) impliqués dans la LTP[85].
- α-CaMKII
Alcino J. Silva (en), alors chercheur postdoctoral et maintenant responsable d'une équipe de recherche à UCLA, produisit un modèle de souris pour lesquelles l'isoforme alpha de la CaMKII était absente (souris α-CaMKII-/-)[86]. Ces souris présentaient un comportement globalement normal même si les auteurs notèrent qu'elles étaient particulièrement "nerveuses" et essayaient à tout prix d'éviter d’être manipulées par les humains. La structure cytoarchitectonique de l'hippocampe et du néocortex était normale ainsi que la transmission synaptique et la plasticité synaptique à court terme. Ces souris ne semblaient donc présenter qu'un déficit de formation de la LTP au niveau de la région CA1 de l'hippocampe lorsque l'α-CaMKII était absente.
Dans une deuxième série d'expériences, Alcino Silva et ses collègues vont mettre en évidence que les souris α-CaMKII-/- présentent également un déficit d'apprentissage et de mémoire spatiale ; elles mettent plus de temps à retrouver la plate-forme et oublient sa localisation dans le test de la piscine de Morris[87]. Il s'assurera par ailleurs que ces déficits ne sont pas dus à des défauts de motivation, de vision ou d'apprentissage en général en utilisant d'autres tests comportementaux. Il notera enfin que ces souris, comme celles qui ont une lésion de l'hippocampe, présentent une augmentation du comportement exploratoire et de l'activité en général.
- Fyn
L'équipe d'Eric Kandel va avoir une approche un peu différente en réalisant un crible sur quatre tyrosine kinases appartenant à la famille Src : Src (en), Yes (en), Abl (en) et Fyn (en)[88]. Ces kinases seraient activées par l'influx calcique intervenant lors de l'induction de la LTP et participeraient au relargage du messager synaptique rétrograde. Les auteurs vont mettre en évidence que les souris fyn- présentent un déficit de LTP sans pour autant que la transmission synaptique ou que la plasticité synaptique à court terme ne soient atteintes. Par ailleurs, ces souris vont être incapables d'apprendre à localiser la plate-forme lorsqu'elle est immergée ; là encore, sans que cela ne soit dû à un déficit de motivation, un problème visuel ou un déficit global de la capacité d'apprentissage. Enfin, les auteurs vont mettre en évidence une implication de Fyn dans le développement de l'hippocampe car la région CA3 présente une prolifération anormale des cellules pyramidales probablement due à déficit de l'apoptose. L'ensemble des altérations observées par les auteurs pourraient être dus au rôle que Fyn joue, comme c'est le cas dans les lymphocytes T, dans la mobilisation des réserves calciques intracellulaires.
Si la transgenèse est une manipulation relativement triviale de nos jours, c'était à l'époque une gageure et la première fois que les conséquences sur le comportement étaient évaluées lors de l'inactivation d'un gène. Les équipes Kandel et Tonegawa auront mis en évidence que la mutation d'un seul gène peut avoir des conséquences drastiques sur l'apprentissage et la mémorisation et renforcera l’idée selon laquelle la LTP est un support cellulaire de la mémoire spatiale. Leur approche présentait cependant des limites qui seront dépassées les années suivantes. En effet, au début des années , les délétions étaient obtenues à partir de recombinaisons dans des cellules souches embryonnaires et concernaient donc l'ensemble des cellules de l'individu[89]. De ce fait, les effets éventuels de la mutation pouvaient être dus à un mécanisme défectueux dans n'importe quel type de neurone du système nerveux. Il était par ailleurs difficile de déterminer si les conséquences de la mutation avaient une origine développementale, lors de la formation des circuits neuronaux, ou ponctuelle, lors de la mémorisation.
- Récepteurs NMDA
En , un autre type de souris transgéniques sera mis au point par l'équipe du Dr Tonegawa et permettra de faire un lien entre la LTP et la mémoire spatiale de manière encore plus spécifique[90]. Lors de l'apparition de ce modèle de souris, on a même pu lire que c'était « le début d'un rêve » en neurobiologie[91]. En effet, l'équipe de Tonegawa a supprimé du génome de la souris le gène Grin1, codant une sous-unité du récepteur NMDA (GRIN1), et ce uniquement dans les neurones de l'aire CA1 de l'hippocampe. Ils ont ainsi mis en évidence que la LTP était supprimée au niveau de ces synapses sans que la transmission synaptique ou la plasticité à court terme soient modifiées[90]. Par ailleurs, la LTP dans le gyrus denté était préservée. Chez ces souris, la LTP est absente uniquement dans la région CA1 de l'hippocampe. Par ailleurs, ces souris présentaient des défauts d'apprentissage spatial - elles mettaient plus de temps à trouver la plate forme - alors qu'une autre forme d'apprentissage non-spatial n'était pas modifiée, permettant d'exclure des altérations dans la capacité à nager ou à repérer les indices visuels. Les auteurs de conclure que la LTP serait un processus cellulaire qui interviendrait dans l'"acquisition" de la mémoire spatiale.
Cellules de lieu
Les cellules pyramidales de l'hippocampe ont un rôle physiologique, ce sont des "cellules de lieu"[64]. Chaque neurone est plus particulièrement actif - il génère un nombre plus important de potentiels d'action - lorsque l'organisme est dans une configuration particulière (orientation de la tête par exemple) dans un endroit spécifique de l'environnement. L'activité de l'ensemble des cellules pyramidales (~ 1 million chez la souris) génère ainsi une carte cognitive de l'environnement spatial immédiat de l'organisme. Chaque fois que l'individu entre dans un lieu nouveau, une nouvelle carte est constituée en quelques minutes et persiste pendant des semaines voir des mois. Les mêmes cellules pyramidales seront réactivées lorsque l'organisme pénétrera de nouveau dans le même environnement[92]. Une même cellule pourra être impliquée dans différentes représentations spatiales.
Le modèle de souris transgénique mis au point par l'équipe du Dr Tonegawa [93] a permis d'évaluer l'implication des cellules pyramidales de l'aire CA1 à la fois dans la plasticité synaptique[90] et dans la représentation de l'espace[94]. Une équipe du MIT ainsi analysé l'activité des cellules de lieu dans ces souris et mis en évidence que les patrons d'activité établies par ces cellules étaient moins précis et plus étendus, il en résultait une diminution de la résolution de leur représentation de l'espace environnant[94]. Alors qu'il est possible de prédire la position d'une souris dans un espace qu'elle a déjà visité à partir de l'activité de ses cellules de lieu, ce n'est pas possible lorsque le récepteur NMDA est absent des cellules de l'aire CA1. Cette étude permit d'associer le phénomène de la LTP, spécifiquement dans la région CA1 de l'hippocampe, avec un processus physiologique de représentation de l'espace environnant.
Synapses silencieuses
- Synapses "sourdes"[95] : la stimulation de ce type de synapses glutamatergiques excitatrices ne génère pas de PPSE. Des données indiquent que ce manque de réponse est dû à l’absence de récepteurs AMPA sur la terminaison postsynaptique. Ces synapses sont particulièrement présentes durant le développement et plus rares dans le cerveau adulte. La présence privilégiée de récepteurs NMDA sur ces synapses nécessite à la fois une activation du récepteur et une dépolarisation de la terminaison postsynaptique pour expulser le et permettre un afflux d'ions permettant de générer un PPSE. Or, la dépolarisation est possible grâce à la présence des récepteurs AMPA. Ce type de synapse serait une forme immature de la synapse glutamatergique[96].
- Synapses "muettes" : l'émission de glutamate, par la terminaison présynaptique, n'est pas suffisante pour activer les récepteurs AMPA qui présentent une faible affinité pour le glutamate.
- Synapses "chuchotantes" : le relargage de glutamate est insuffisant - ou capturé par des synapses adjacentes présentant des récepteurs NMDA à forte affinité pour le glutamate - pour susciter une réponse postsynaptique[97].
Les récepteurs AMPA, et plus précisément leur présence au niveau postsynaptique, jouent donc un rôle déterminant dans la plasticité synaptique. De nombreux processus permettent de contrôler leur présence et leur activité, que ce soit des modifications post-traductionnelles à court terme (phosphorylation), le trafic (à plus long terme, internalisation ou externalisation) ou l'expression génique pendant le cycle de vie (notamment l'absence durant le développement). L'ensemble de ces processus participe à la capacité de plasticité que possèdent les synapses glutamatergiques[96].
Saturation
Appelée également "occlusion", il s'agit de la limite maximale ou "plafond" de la potentialisation[98]. Elle dépend de facteurs limitants tels que : le nombre de récepteurs postsynaptiques, la quantité de vésicules présynaptiques libérables, etc. L’occlusion de la LTP survient typiquement quand les neurotransmetteurs ont saturé l'ensemble des récepteurs postsynaptiques.
Lorsque deux neurones sont impliqués :
- Ex1 : augmentation du nombre de vésicules synaptiques libérées par une stimulation électrique présynaptique plus intense, multiplication par trois (arbitraire) de la potentialisation jusqu’à atteindre la saturation des récepteurs postsynaptiques, utilisation de la marge existant entre le nombre de récepteurs et le nombre de neurotransmetteurs.
- Ex2 : le BDNF induit une augmentation du nombre de récepteurs postsynaptiques ; ce qui induit aussi une potentialisation trois fois plus élevée, donc une occlusion trois fois moins importante, si le nombre de neurotransmetteurs libérés est suffisant pour occuper tous les récepteurs - préalables et induits par le BDNF.
- Ex3 : Effet synergique s'il y a combinaison des phénomènes décrits ci-dessus, multiplication des facteurs facilitant entre eux, multiplication par neuf ⇒ l'occlusion est donc atteinte neuf fois moins facilement.
Lorsqu'un seul neurone est impliqué :
- Ex4 : un stimulus peut en occlure un autre au niveau de la même cellule. Le stimulus initial empêche l’expression du second stimulus en le précédant dans le temps, il y a compétition dans l’utilisation de la machinerie cellulaire au profit du premier stimulus.
ex. : stimulation à la fois électrique et par le BDNF : le premier stimulus entré en action empêche le second d’en faire de même par surexploitation de la cellule.
La dépression synaptique à long terme
Alors que la LTP correspond à une augmentation de l'efficacité synaptique, la dépression à long terme (long-term depression, LTD en anglais) est un processus d'affaiblissement de l'efficacité synaptique[99],[100]. Ce phénomène a initialement été décrit à la fin des années aux niveaux des mêmes synapses que la LTP - entre les collatérales de Schaffer et les cellules pyramidales de l'aire CA1[101]. La LTD est induite par une stimulation longue (10 à 15 min) et de basse fréquence (1 Hz - un choc électrique par seconde). Comme pour la LTP, la LDP est "spécifiquement" induite au niveau des synapses activées et peut diminuer les potentiels postsynaptiques excitateurs qui sont évoqués pour plusieurs heures[102].
Tout comme la LTP, la LTD dépend des récepteurs NMDA et de l'influx postsynaptique de . La différence entre les phénomènes est la quantité de calcium entrant. Alors que de fortes concentrations de activent la CaMKII, de faibles concentrations vont activer des phosphatases lors de la LTD. Ces phosphatases participent à une diminution du nombre de récepteurs AMPA au glutamate présents au niveau postsynaptique. Ces récepteurs sont probablement internalisés par un processus d'endocytose dépendant de la clathrine. La réduction du nombre de récepteurs diminue ainsi la sensibilité au glutamate et l'efficacité de la transmission synaptique.
Cérébelleuse
Le phénomène de LTD est un peu différent au niveau du cervelet, une structure impliquée, notamment, dans le contrôle des actions motrice. Du point de vue cellulaire, la LTD intervient entre les cellules de Purkinje et leurs afférences excitatrices, les fibres grimpantes et parallèles. La LTD abaisse l'efficacité de la transmission synaptique entre la fibre parallèle et grimpante et la cellule de Purkinje. Elle nécessite l'activité des deux voies, elle est dite "associative".
Du point de vue moléculaire[103], la voie parallèle active les récepteurs AMPA et métabotropiques (mGluR) au glutamate. Alors que les récepteurs AMPA conduisent à une entrée de dépolarisant le neurone, les récepteurs mGluR amènent à la production d’inositol triphosphate (IP3) et de diacylglycérol (DAG). Les fibres grimpantes participent de leur coté à l'activation de canaux dépendants du voltage. Cette entrée de associée à la mobilisation des réserves de du réticulum endoplasmique par l'IP3 induisent une importante augmentation de la concentration calcique intracellulaire. et DAG participent à l'activation synergique de la protéine kinase C. Il s'ensuit, comme dans l'hippocampe, une internalisation des récepteurs AMPA. Elle conduit à une diminution de la sensibilité au glutamate et un abaissement de l'efficacité de la transmission synaptique.
Métaplasticité
Il s'agit d'un changement, à la suite d'un événement initial, dans la capacité d'un stimulus à induire une plasticité synaptique à long terme (LTP ou LTD)[104]. La nature de la plasticité (LTP ou LTD) n'est pas modifiée, c’est uniquement la réactivité/réceptivité aux stimuli présynaptiques qui est modulée.
ex. : La STP (short-term potentiation) est induite dans la région CA1 par une courte rafale de stimulation (short burst, 30 Hz pendant 150 ms). En soi, une telle stimulation induit seulement une STP transitoire qui diminue rapidement pour retourner aux conditions initiales (baseline). Cependant, il semblerait qu’il existe des effets à long terme de cette activité paraissant, a priori, neutres. Ceux-ci sont apparents lors de stimulations ultérieures du même neurone. Il correspondent à la formation d'une LTP, et une LTD, par des mécanismes subcellulaires encore peu clairs.
ex. : L’induction d'une LTP au niveau des collatérales de Schaffer par une stimulation tétanique est inhibée si une stimulation plus faible (5 Hz) est administrée au préalable sur la même voie neuronale. Cet effet est spécifique de l'entrée sensorielle et dure moins de 30 min. De plus, au fil des expérimentations, la stimulation initiale semble augmenter le seuil de stimulation nécessaire à l'induction de la LTP plutôt que de le bloquer. Dans d’autres cas, avec la même stimulation d'amorçage (priming), on assiste à une facilitation de la LTP lors de stimuli tétaniques successifs.
Des auteurs parlent de "plasticité de la plasticité synaptique" en parlant de ces phénomènes[104]. Selon eux, la métaplasticité serait dépendante des récepteurs NMDA (stimulation d'amorçage, the priming stimulation), donc dépendante de la concentration intracellulaire en , mais elle impliquerait également des récepteurs métabotropiques au glutamate (mGluR (en)) ; elle pourrait "transformer" une LTP en LTD. Son lien avec le comportement et la mémoire est sujet à discussion[105].
Plasticité fonction du temps d'occurrence des impulsions
Une autre forme de plasticité synaptique est la plasticité fonction du temps d'occurrence des impulsions[106].
Synthèse
L'ensemble des mécanismes de plasticité présentés ci-dessus possèdent de nombreux points communs. Ils ont une phase à court terme qui, pour être consolidée - et comme pour la mémorisation - dépend de la répétition et de l'espacement entre les stimulations - sessions d'apprentissages. Les formes de plasticité à court terme dépendent de modifications post-traductionnelles de protéines existantes (phosphorylation). Les formes à long terme dépendent de la transcription, de la traduction et de modifications structurales (croissance d'épines dendritiques, élagage). Les acteurs moléculaires sont souvent les mêmes (PKA, MAPK, CREB) dans les différentes formes de plasticités et ils sont fortement conservés par l'évolution.
Si un raccourci peut être fait entre la plasticité synaptique et la mémorisation d'apprentissages implicites chez les invertébrés, les mécanismes sont beaucoup plus compliqués pour la mémoire explicite chez les vertébrés. D'autant plus que chez les vertébrés, il s'agit d'une problématique de neurosciences des systèmes, de nombreuses structures cérébrales interagissent et se transfèrent les informations lors du processus de mémorisation et pas seulement un groupe restreint de neurone. De nombreuses découvertes restent encore à faire dans le domaine et il est encore difficile d'affirmer que la plasticité synaptique est le seul support moléculaire et cellulaire de la mémoire[12].
Notes et références
- Purves et al. 2005.
- Pour revue, voir : (en) Asok A, Leroy F, Rayman JB et Kandel ER., « Molecular Mechanisms of the Memory Trace. », Trends Neurosci., vol. 42, no 1, , p. 14-22 (PMID 30391015, PMCID PMC6312491, DOI 10.1016/j.tins.2018.10.005, lire en ligne [PDF], consulté le )

- Bruno Cessac et Hugues Berry, « Du chaos dans les neurones », sur interstices.info, (consulté le ).
- L'adage anglais Use it or lose it! [Vous le perdrez si vous ne l'utilisez pas] est parfois employé pour illustrer le phénomène : (en) Shors TJ, Anderson ML, Curlik DM 2nd et Nokia MS., « Use it or lose it: how neurogenesis keeps the brain fit for learning. », Behav Brain Res., vol. 227, no 2, , p. 450-8 (PMID 21536076, PMCID PMC3191246, DOI 10.1016/j.bbr.2011.04.023, lire en ligne [PDF], consulté le )

- (en) Hughes JR., « Post-tetanic potentiation. », Physiol Rev., vol. 38, no 1, , p. 91-113 (PMID 13505117, DOI 10.1152/physrev.1958.38.1.91, lire en ligne, consulté le )
- (en) Cooke SF et Bliss TV., « Plasticity in the human central nervous system. », Brain, vol. 129, no Pt 7, , p. 1659-73 (PMID 16672292, DOI 10.1093/brain/awl082, lire en ligne [PDF], consulté le )

- (en) Bliss TV et Collingridge GL., « A synaptic model of memory: long-term potentiation in the hippocampus. », Nature, vol. 361, no 6407, , p. 31-9 (PMID 8421494, DOI 10.1038/361031a0, lire en ligne, consulté le )
- (en) Jerzy Konorski, Conditioned reflexes and neuron organization., Cambridge, Univ. Press, coll. « Cambridge biological studies », , 267 p. (OCLC 14659990, lire en ligne).
- (en) Kandel ER, Dudai Y et Mayford MR., « The molecular and systems biology of memory. », Cell, vol. 157, no 1, , p. 163-86 (PMID 24679534, DOI 10.1016/j.cell.2014.03.001, lire en ligne [PDF], consulté le )

- (en) Donald O. Hebb, The Organization of Behavior : A Neuropsychological Theory, New York, John Wiley if Sons, Inc., , 378 p. (ISBN 978-0-8058-4300-2, lire en ligne), p. 62.

- Ronzano R., « Astrocytes and microglia: active players in synaptic plasticity. » [« Astrocytes, microglie et plasticité synaptique. »], Med Sci (Paris)., vol. 33, no 12, , p. 1071-1078 (PMID 29261495, DOI 10.1051/medsci/20173312014, lire en ligne [PDF], consulté le )

- Cet article est une adaptation du discours d'Eric Kandel lors de la remise de son prix Nobel en décembre 2000. (en) Kandel ER., « The molecular biology of memory storage: a dialogue between genes and synapses. », Science., vol. 294, no 5544, , p. 1030-8 (PMID 11691980, DOI 10.1126/science.1067020, lire en ligne, consulté le )
- (en) Quinn WG, Harris WA et Benzer S., « Conditioned behavior in Drosophila melanogaster. », Proc Natl Acad Sci U S A., vol. 71, no 3, , p. 708-12 (PMID 4207071, PMCID PMC388082, DOI 10.1073/pnas.71.3.708, lire en ligne [PDF], consulté le )

- Purves et al. 2018, p. 169-190.
- de l'ordre de la milliseconde à la seconde.
- de l'ordre de l'heure à la journée, voire à la semaine.
- (en) Pinsker H, Kupfermann I, Castellucci V et Kandel E., « Habituation and dishabituation of the gill-withdrawal reflex in Aplysia. », Science, vol. 167, no 3926, , p. 1740-2 (PMID 5416541, DOI 10.1126/science.167.3926.1740, lire en ligne, consulté le )
- En réalité, il y a 24 neurones sensoriels et 6 neurones moteurs ainsi que des interneurones excitateurs et inhibiteurs mais ils sont rarement représentés afin de simplifier et sans que cela ne change l'interprétation du phénomène.
- Purves et al. 2005, p. 577.
- Kandel, Schwartz et Jessel 2000a, p. 1250.
- (en) Bailey CH et Chen M., « Morphological basis of long-term habituation and sensitization in Aplysia. », Science, vol. 220, no 4592, , p. 91-3 (PMID 6828885, DOI 10.1126/science.6828885, lire en ligne, consulté le )
- (en) Twick I, Lee JA et Ramaswami M., « Olfactory habituation in Drosophila-odor encoding and its plasticity in the antennal lobe. », Prog Brain Res., vol. 208, , p. 3-38 (PMID 24767477, DOI 10.1016/B978-0-444-63350-7.00001-2, lire en ligne, consulté le )
- (en) Wilson DA., « Olfaction as a model system for the neurobiology of mammalian short-term habituation. », Neurobiol Learn Mem., vol. 92, no 2, , p. 199-205 (PMID 18678264, PMCID PMC2730360, DOI 10.1016/j.nlm.2008.07.010, lire en ligne [PDF], consulté le )

- (en) Pellegrino R, Sinding C, de Wijk RA et Hummel T., « Habituation and adaptation to odors in humans. », Physiol Behav., vol. 177, , p. 13-19 (PMID 28408237, DOI 10.1016/j.physbeh.2017.04.006, lire en ligne, consulté le )
- (en) Pinsker HM, Hening WA, Carew TJ et Kandel ER., « Long-term sensitization of a defensive withdrawal reflex in Aplysia. », Science, vol. 182, no 4116, , p. 1039-42 (PMID 4748675, DOI 10.1126/science.182.4116.1039, lire en ligne, consulté le )
- Kandel, Schwartz et Jessel 2000a, p. 1250-51.
- Kandel, Schwartz et Jessel 2000a, p. 1254.
- (en) Castellucci VF, Blumenfeld H, Goelet P et Kandel ER., « Inhibitor of protein synthesis blocks long-term behavioral sensitization in the isolated gill-withdrawal reflex of Aplysia. », J Neurobiol., vol. 20, no 1, , p. 1-9 (PMID 2921606, DOI 10.1002/neu.480200102, lire en ligne, consulté le )
- (en) Dash PK, Hochner B et Kandel ER., « Injection of the cAMP-responsive element into the nucleus of Aplysia sensory neurons blocks long-term facilitation. », Nature, vol. 345, no 6277, , p. 718-21 (PMID 2141668, DOI 10.1038/345718a0, lire en ligne, consulté le )
- (en) Davis S, Bozon B et Laroche S., « How necessary is the activation of the immediate early gene zif268 in synaptic plasticity and learning? », Behav Brain Res., vol. 142, nos 1-2, , p. 17-30 (PMID 12798262, DOI 10.1016/s0166-4328(02)00421-7, lire en ligne, consulté le )
- (en) Hegde AN, Inokuchi K, Pei W, Casadio A, Ghirardi M, Chain DG, Martin KC, Kandel ER et Schwartz JH., « Ubiquitin C-terminal hydrolase is an immediate-early gene essential for long-term facilitation in Aplysia. », Cell, vol. 89, no 1, , p. 115-26 (PMID 9094720, DOI 10.1016/s0092-8674(00)80188-9, lire en ligne [PDF])

- (en) Alberini CM, Ghirardi M, Metz R et Kandel ER., « C/EBP is an immediate-early gene required for the consolidation of long-term facilitation in Aplysia. », Cell, vol. 76, no 6, , p. 1099-114 (PMID 8137425, DOI 10.1016/0092-8674(94)90386-7, lire en ligne, consulté le )
- (en) Puthanveettil SV, Monje FJ, Miniaci MC, Choi YB, Karl KA, Khandros E, Gawinowicz MA, Sheetz MP et Kandel ER., « A new component in synaptic plasticity: upregulation of kinesin in the neurons of the gill-withdrawal reflex. », Cell, vol. 135, no 5, , p. 960-73 (PMID 19041756, PMCID 2635114, DOI 10.1016/j.cell.2008.11.003, lire en ligne [PDF], consulté le )

- (en) McGuire SE, Deshazer M et Davis RL., « Thirty years of olfactory learning and memory research in Drosophila melanogaster. », Prog Neurobiol., vol. 76, no 5, , p. 328-47 (PMID 16266778, DOI 10.1016/j.pneurobio.2005.09.003, lire en ligne, consulté en )
- (en) Barco A, Bailey CH et Kandel ER., « Common molecular mechanisms in explicit and implicit memory. », J Neurochem., vol. 97, no 6, , p. 1520-33 (PMID 16805766, DOI 10.1111/j.1471-4159.2006.03870.x, lire en ligne, consulté le )
- (en) Martin KC, Casadio A, Zhu H, Yaping E, Rose JC, Chen M, Bailey CH et Kandel ER., « Synapse-specific, long-term facilitation of aplysia sensory to motor synapses: a function for local protein synthesis in memory storage. », Cell, vol. 91, no 7, , p. 927-38 (PMID 9428516, DOI 10.1016/s0092-8674(00)80484-5, lire en ligne [PDF], consulté le )

- (en) Steward O., « mRNA localization in neurons: a multipurpose mechanism? », Neuron, vol. 18, no 1, , p. 9-12 (PMID 9010200, DOI 10.1016/s0896-6273(01)80041-6, lire en ligne [PDF], consulté le )

- (en) Frey U et Morris RG., « Synaptic tagging and long-term potentiation. », Nature, vol. 385, no 6616, , p. 533-6 (PMID 9020359, DOI 10.1038/385533a0, lire en ligne [PDF], consulté le )
- (en) Bilz F, Geurten BRH, Hancock CE, Widmann A et Fiala A., « Visualization of a Distributed Synaptic Memory Code in the Drosophila Brain. », Neuron, vol. S0896-6273, no 20, , p. 30217-8 (PMID 32268119, DOI 10.1016/j.neuron.2020.03.010, lire en ligne, consulté le )
- (en) Darnell RB., « Memory, synaptic translation, and...prions? », Cell, vol. 115, no 7, , p. 767-8 (PMID 14697195, DOI 10.1016/s0092-8674(03)01022-5, lire en ligne [PDF], consulté le )

- (en) Richter JD., « Cytoplasmic polyadenylation in development and beyond. », Microbiol Mol Biol Rev., vol. 63, no 3, , p. 446-56 (PMID 10357857, PMCID 98972, lire en ligne [PDF], consulté le )

- (en) Huang YS, Carson JH, Barbarese E et Richter JD., « Facilitation of dendritic mRNA transport by CPEB. », Genes Dev., vol. 17, no 5, , p. 638-53 (PMID 12629046, PMCID 196011, DOI 10.1101/gad.1053003, lire en ligne [PDF], consulté le )

- (en) Si K, Giustetto M, Etkin A, Hsu R, Janisiewicz AM, Miniaci MC, Kim JH, Zhu H et Kandel ER., « 2003 », Cell, vol. 115, no 7, a neuronal isoform of cpeb regulates local protein synthesis and stabilizes synapse-specific long-term facilitation in aplysia., p. 893-904 (PMID 14697206, DOI 0.1016/s0092-8674(03)01021-3, lire en ligne [PDF], consulté le )

- (en) Si K, Lindquist S et Kandel ER., « A neuronal isoform of the aplysia CPEB has prion-like properties. », Cell, vol. 115, no 7, , p. 879-91 (PMID 14697205, DOI 10.1016/s0092-8674(03)01020-1, lire en ligne [PDF], consulté le )

- (en) Prusiner SB., « Prions. », Proc Natl Acad Sci U S A., vol. 95, no 23, , p. 13363-83 (PMID 9811807, PMCID 33918, DOI 10.1073/pnas.95.23.13363, lire en ligne [PDF], consulté le )

- (en) Keleman K, Krüttner S, Alenius M et Dickson BJ., « Function of the Drosophila CPEB protein Orb2 in long-term courtship memory. », Nat Neurosci., vol. 10, no 12, , p. 1587-93 (PMID 17965711, DOI 10.1038/nn1996, lire en ligne, consulté le )
- (en) Majumdar A, Cesario WC, White-Grindley E, Jiang H, Ren F, Khan MR, Li L, Choi EM, Kannan K, Guo F, Unruh J, Slaughter B et Si K., « Critical role of amyloid-like oligomers of Drosophila Orb2 in the persistence of memory. », Cell, vol. 148, no 3, , p. 515-29 (PMID 22284910, DOI 10.1016/j.cell.2012.01.004, lire en ligne [PDF], consulté le )

- (en) Fioriti L, Myers C, Huang YY, Li X, Stephan JS, Trifilieff P, Colnaghi L, Kosmidis S, Drisaldi B, Pavlopoulos E et Kandel ER., « The Persistence of Hippocampal-Based Memory Requires Protein Synthesis Mediated by the Prion-like Protein CPEB3. », Neuron, vol. 86, no 6, , p. 1433-48 (PMID 26074003, DOI 10.1016/j.neuron.2015.05.021, lire en ligne [PDF], consulté le )

- Kandel, Schwartz et Jessel 2000b, p. 1240.
- (en) « Ivan Pavlov - Biographical », sur nobelprize.org (consulté le )
- (en) Tully T et Quinn WG., « Classical conditioning and retention in normal and mutant Drosophila melanogaster. », J Comp Physiol A., vol. 157, no 2, , p. 263-77 (PMID 3939242, DOI 10.1007/bf01350033, lire en ligne, consulté le )
- Kandel, Schwartz et Jessel 2000b, p. 1240-2.
- (en) Hawkins RD., « A cellular mechanism of classical conditioning in Aplysia. », J Exp Biol., vol. 112, , p. 113-28 (PMID 6392464, lire en ligne [PDF], consulté le )

- Kandel, Schwartz et Jessel 2000a, p. 1252-4.
- (en) Tomchik SM et Davis RL., « Dynamics of learning-related cAMP signaling and stimulus integration in the Drosophila olfactory pathway. », Neuron, vol. 64, no 4, , p. 510-21 (PMID 19945393, PMCID PMC4080329, DOI 10.1016/j.neuron.2009.09.029, lire en ligne [PDF], consulté le )

- Pour revue, voir : (en) Davis RL., « Olfactory memory formation in Drosophila: from molecular to systems neuroscience. », Annu Rev Neurosci., vol. 28, , p. 275-302 (PMID 16022597, DOI 10.1146/annurev.neuro.28.061604.135651, lire en ligne [PDF], consulté le )

- (en) Edward L. Thorndike, Animal intelligence : Experimental studies, New York, The Macmillan company, , 297 p. (lire en ligne).

- Purves et al. 2005, p. 582.
- Pour revue, voir : (en) Zucker RS et Regehr WG., « Short-term synaptic plasticity. », Annu Rev Physiol., vol. 64, , p. 355-405 (PMID 11826273, DOI 10.1146/annurev.physiol.64.092501.114547, lire en ligne [PDF], consulté le )

- Pour revue, voir : (en) Jackman SL et Regehr WG., « The Mechanisms and Functions of Synaptic Facilitation. », Neuron, vol. 94, no 3, , p. 447-464 (PMID 28472650, PMCID PMC5865607, DOI 10.1016/j.neuron.2017.02.047, lire en ligne [PDF], consulté le )

- (en) Bliss TV et Lomo T., « Long-lasting potentiation of synaptic transmission in the dentate area of the anaesthetized rabbit following stimulation of the perforant path. », J Physiol., vol. 232, no 2, , p. 331-56 (PMID 4727084, PMCID PMC1350458, DOI 10.1113/jphysiol.1973.sp010273, lire en ligne, consulté le )
- Pour revue, voir : (en) Nicoll RA., « A Brief History of Long-Term Potentiation. », Neuron, vol. 93, no 2, , p. 281-290 (PMID 28103477, DOI 10.1016/j.neuron.2016.12.015, lire en ligne [PDF], consulté le )

- (en) Scoville WB et Milner B., « Loss of recent memory after bilateral hippocampal lesions. », J Neurol Neurosurg Psychiatry., vol. 20, no 1, , p. 11-21 (PMID 13406589, PMCID PMC497229, DOI 10.1136/jnnp.20.1.11, lire en ligne [PDF], consulté le )

- (en) O'Keefe J et Dostrovsky J., « The hippocampus as a spatial map. Preliminary evidence from unit activity in the freely-moving rat. », Brain Res., vol. 34, no 1, , p. 171-5 (PMID 5124915, DOI 10.1016/0006-8993(71)90358-1, lire en ligne, consulté le )
- (en) Altman J et Das GD., « Postnatal neurogenesis in the guinea-pig. », Nature, vol. 214, no 5093, , p. 1098-101 (PMID 6053066, DOI 10.1038/2141098a0, lire en ligne, consulté le )
- (en) Staubli U., « A peculiar form of potentiation in mossy fiber synapses. », Epilepsy Res Suppl., vol. 7, , p. 151-7 (PMID 1334660)
- Kandel, Schwartz et Jessel 2000a, p. 1258-60.
- Hebb 1949, p. 62.
- Kandel, Schwartz et Jessel 2000a, p. 1260.
- Purves et al. 2005, p. 586.
- Purves et al. 2005, p. 588.
- Pour revue, voir : (en) Nicoll RA., « Expression mechanisms underlying long-term potentiation: a postsynaptic view. », Philos Trans R Soc Lond B Biol Sci., vol. 358, no 1432, , p. 721-6 (PMID 12740118, PMCID PMC1693172, DOI 10.1098/rstb.2002.1228, lire en ligne [PDF], consulté le )

- Pour revue, voir : (en) Zalcman G, Federman N et Romano A., « CaMKII Isoforms in Learning and Memory: Localization and Function. », Front Mol Neurosci., vol. 11, , p. 445 (PMID 30564099, PMCID PMC6288437, DOI 10.3389/fnmol.2018.00445, lire en ligne, consulté le )

- Kandel, Schwartz et Jessel 2000a, p. 1262.
- (en) Bolshakov VY, Golan H, Kandel ER et Siegelbaum SA., « Recruitment of new sites of synaptic transmission during the cAMP-dependent late phase of LTP at CA3-CA1 synapses in the hippocampus. », Neuron, vol. 19, no 3, , p. 635-51 (PMID 9331354, lire en ligne [PDF], consulté le )

- Kandel, Schwartz et Jessel 2000a, p. 1264.
- (en) Whitton PS., « Glutamatergic control over brain dopamine release in vivo and in vitro. », Neurosci Biobehav Rev., vol. 21, no 4, , p. 481-8 (PMID 9195606, DOI 10.1016/s0149-7634(96)00034-6, lire en ligne, consulté le )
- (en) Malleret G, Haditsch U, Genoux D, Jones MW, Bliss TV, Vanhoose AM, Weitlauf C, Kandel ER, Winder DG et Mansuy IM., « Inducible and reversible enhancement of learning, memory, and long-term potentiation by genetic inhibition of calcineurin. », Cell, vol. 104, no 5, , p. 675-86 (PMID 11257222, DOI 10.1016/s0092-8674(01)00264-1, lire en ligne [PDF], consulté le )

- (en) Humeau Y, Shaban H, Bissière S et Lüthi A., « Presynaptic induction of heterosynaptic associative plasticity in the mammalian brain. », Nature, vol. 426, no 6968, , p. 841-5 (PMID 14685239, DOI 10.1038/nature02194, lire en ligne, consulté le )
- (en) LeDoux J., « The amygdala. », Curr Biol., vol. 17, no 20, , R868-74 (PMID 17956742, DOI 10.1016/j.cub.2007.08.005, lire en ligne [PDF], consulté le )

- (en) Ben-Ari Y, Khazipov R, Leinekugel X, Caillard O et Gaiarsa JL., « GABAA, NMDA and AMPA receptors: a developmentally regulated 'ménage à trois'. », Trends Neurosci., vol. 20, no 11, , p. 523-9 (PMID 9364667, DOI 10.1016/s0166-2236(97)01147-8, lire en ligne, consulté le )
- Pour revue, voir : (en) Sweatt JD., « Neural plasticity and behavior - sixty years of conceptual advances. », J Neurochem., vol. 139, no Suppl 2, , p. 179-199 (PMID 26875778, DOI 10.1111/jnc.13580, lire en ligne [EPUB], consulté le )

- (en) Morris RG, Anderson E, Lynch GS et Baudry M., « Selective impairment of learning and blockade of long-term potentiation by an N-methyl-D-aspartate receptor antagonist, AP5. », Nature, vol. 319, no 6056, , p. 774-6 (PMID 2869411, DOI 10.1038/319774a0, lire en ligne, consulté le )
- (en) Morris R., « Developments of a water-maze procedure for studying spatial learning in the rat. », J Neurosci Methods., vol. 11, no 1, , p. 47-60 (PMID 6471907, DOI 10.1016/0165-0270(84)90007-4, lire en ligne, consulté le )
- (en) Barinaga M., « Knockouts shed light on learning. », Science, vol. 257, no 5067, , p. 162-3 (PMID 1321491, DOI 10.1126/science.1321491, lire en ligne, consulté le )
- (en) Silva AJ, Stevens CF, Tonegawa S et Wang Y., « Deficient hippocampal long-term potentiation in alpha-calcium-calmodulin kinase II mutant mice. », Science, vol. 257, no 5067, , p. 201-6 (PMID 1378648, DOI 10.1126/science.1378648, lire en ligne, consulté le )
- (en) Silva AJ, Paylor R, Wehner JM et Tonegawa S., « Impaired spatial learning in alpha-calcium-calmodulin kinase II mutant mice. », Science, vol. 257, no 5067, , p. 206-11 (PMID 1321493, DOI 10.1126/science.1321493, lire en ligne, consulté le )
- (en) Grant SG, O'Dell TJ, Karl KA, Stein PL, Soriano P et Kandel ER., « Impaired long-term potentiation, spatial learning, and hippocampal development in fyn mutant mice. », Science, vol. 258, no 5090, , p. 1903-10 (PMID 1361685, DOI 10.1126/science.1361685, lire en ligne, consulté le )
- (en) Capecchi MR., « Altering the genome by homologous recombination. », Science, vol. 244, no 4910, , p. 1288-92 (PMID 2660260, DOI 10.1126/science.2660260, lire en ligne, consulté le )
- (en) Tsien JZ, Huerta PT et Tonegawa S., « The essential role of hippocampal CA1 NMDA receptor-dependent synaptic plasticity in spatial memory. », Cell, vol. 87, no 7, , p. 1327-38 (PMID 8980238, DOI 10.1016/s0092-8674(00)81827-9, lire en ligne [PDF], consulté le )

- (en) Stevens CF., « Spatial learning and memory: the beginning of a dream. », Cell, vol. 87, no 7, , p. 1147-8 (PMID 8980219, DOI 10.1016/s0092-8674(00)81808-5, lire en ligne [PDF], consulté le )

- Kandel, Schwartz et Jessel 2000a, p. 1264-7.
- (en) Tsien JZ, Chen DF, Gerber D, Tom C, Mercer EH, Anderson DJ, Mayford M, Kandel ER et Tonegawa S., « Subregion- and cell type-restricted gene knockout in mouse brain. », Cell, vol. 87, no 7, , p. 1317-26 (PMID 8980237, DOI 10.1016/s0092-8674(00)81826-7, lire en ligne [PDF], consulté le )

- (en) McHugh TJ, Blum KI, Tsien JZ, Tonegawa S et Wilson MA., « Impaired hippocampal representation of space in CA1-specific NMDAR1 knockout mice. », Cell, vol. 87, no 7, , p. 1339-49 (PMID 8980239, DOI 10.1016/s0092-8674(00)81828-0, lire en ligne [PDF], consulté le )

- Purves et al. 2005, p. 594-95.
- Pour revue, voir : (en) Lüscher C, Nicoll RA, Malenka RC et Muller D., « Synaptic plasticity and dynamic modulation of the postsynaptic membrane. », Nat Neurosci., vol. 3, no 6, , p. 545-50 (PMID 10816309, DOI 10.1038/75714, lire en ligne, consulté le )
- (en) Voronin LL et Cherubini E., « 'Deaf, mute and whispering' silent synapses: their role in synaptic plasticity. », J Physiol., vol. 557, no Pt 1, , p. 3-12 (PMID 15034124, PMCID PMC1665055, DOI 10.1113/jphysiol.2003.058966, lire en ligne, consulté le )

- (en) Moser EI et Moser MB., « Is learning blocked by saturation of synaptic weights in the hippocampus? », Neurosci Biobehav Rev., vol. 23, no 5, , p. 661-72 (PMID 10392658, DOI 10.1016/s0149-7634(98)00060-8, lire en ligne, consulté le )
- Pour revue, voir : (en) Linden DJ et Connor JA., « Long-term synaptic depression. », Annu Rev Neurosci., vol. 18, , p. 319-57 (PMID 7605065, DOI 10.1146/annurev.ne.18.030195.001535, lire en ligne [PDF], consulté le )

- (en) Collingridge GL, Peineau S, Howland JG et Wang YT., « Long-term depression in the CNS. », Nat Rev Neurosci., vol. 11, no 7, , p. 459-73 (PMID 20559335, DOI 10.1038/nrn2867, lire en ligne, consulté le )
- (en) Dunwiddie T et Lynch G., « Long-term potentiation and depression of synaptic responses in the rat hippocampus: localization and frequency dependency. », J Physiol., vol. 276, , p. 353-67 (PMID 650459, PMCID PMC1282430, DOI 10.1113/jphysiol.1978.sp012239, lire en ligne [PDF], consulté le )

- Purves et al. 2005, p. 592-7.
- Pour revue, voir : (en) Ito M., « The molecular organization of cerebellar long-term depression. », Nat Rev Neurosci., vol. 3, no 11, , p. 896-902 (PMID 12415297, DOI 10.1038/nrn962, lire en ligne, consulté le )
- Pour revue, voir : (en) Abraham WC et Bear MF., « Metaplasticity: the plasticity of synaptic plasticity. », Trends Neurosci., vol. 19, no 4, , p. 126-30 (PMID 8658594, DOI 10.1016/s0166-2236(96)80018-x, lire en ligne, consulté le )
- (en) Abraham WC et Richter-Levin G., « From Synaptic Metaplasticity to Behavioral Metaplasticity. », Neurobiol Learn Mem., vol. 154, , p. 1-4 (PMID 30217268, DOI 10.1016/j.nlm.2018.08.015, lire en ligne, consulté le )
- Pour revue, voir : (en) Feldman DE., « The spike-timing dependence of plasticity. », Neuron, vol. 75, no 4, , p. 556-71 (PMID 22920249, PMCID PMC3431193, DOI 10.1016/j.neuron.2012.08.001, lire en ligne [PDF], consulté le )

Annexes
Bibliographie
![]() : document utilisé comme source pour la rédaction de cet article.
: document utilisé comme source pour la rédaction de cet article.
- Éric R. Kandel (trad. de l'anglais), À la recherche de la mémoire : Une nouvelle théorie de l’esprit, Paris, Odile Jacob, coll. « Sciences », , 512 p. (ISBN 978-2-7381-1880-6, lire en ligne).
- Larry R. Squire et Eric R. Kandel, La mémoire : De l'esprit aux molécules, Paris, Flammarion, coll. « Champs », , 414 p. (ISBN 978-2-08-080139-5).
- Dale Purves, George J. Augustine, David Fitzpatrick, William C. Hall, Anthony-Samuel LaMantia, James O. McNamara et S. Mark Williams, Neurosciences, Bruxelles, De Boeck Université, coll. « Neurosciences & Cognition », , 3e éd., 811 p. (ISBN 978-2-8041-4797-6, lire en ligne), chap. 24 (« Plasticité des synapses et des circuits adultes »), p. 575-599.
 .
. - Dale Purves, George J. Augustine, David Fitzpatrick, William C. Hall, Anthony-Samuel LaMantia, James O. McNamara et S. Mark Williams, Neurosciences, Bruxelles, De Boeck Université, coll. « Neurosciences & Cognition », , 6e éd., 811 p. (ISBN 978-2-8073-1492-4, lire en ligne).

- (en) Eric R. Kandel, James H. Schwartz et Thomas M. Jessel, Principles of Neural Science, New York, McGraw-Hill Medical, , 4e éd., 1414 p. (ISBN 978-0-8385-7701-1), chap. 62 (« Learning and Memory »), p. 1227-1246.
 .
. - (en) Eric R. Kandel, James H. Schwartz et Thomas M. Jessel, Principles of Neural Science, New York, McGraw-Hill Medical, , 4e éd., 1414 p. (ISBN 978-0-8385-7701-1), chap. 63 (« Cellular Mechanisms of Learning and the Biological Basis of Individuality »), p. 1247-1279.
 .
.
Articles connexes
Liens externes
- AMEISEN, Jean-Claude. « Je me souviens… ». Sur les épaules de Darwin. France Inter, samedi . 52 minutes.
- AMEISEN, Jean-Claude. Au pays de la mémoire et de l'oubli. Sur les épaules de Darwin. France Inter, samedi . 52 minutes.
- Eric R. Kandel, « La biologie moléculaire de la mémoire : un dialogue entre gènes et synapses », sur ipubli-inserm.inist.fr, (DOI 10.1051/medsci/2003195625, consulté le ).
- Serge Laroche, « Les mécanismes de la mémoire », sur pourlascience.fr, (consulté le ).
- Portail de la physiologie
- Portail des neurosciences
- Portail de la biologie cellulaire et moléculaire