Drosophila melanogaster
La drosophile ou mouche du vinaigre (Drosophila melanogaster) est une espèce d'insectes diptères brachycères de la famille des Drosophilidae.
Pour les articles homonymes, voir Mouche.
.jpg.webp)
| Règne | Animalia |
|---|---|
| Embranchement | Arthropoda |
| Sous-embr. | Hexapoda |
| Classe | Insecta |
| Sous-classe | Pterygota |
| Infra-classe | Neoptera |
| Ordre | Diptera |
| Sous-ordre | Brachycera |
| Infra-ordre | Muscomorpha |
| Famille | Drosophilidae |
| Sous-famille | Drosophilinae |
| Tribu | Drosophilini |
| Sous-tribu | Drosophilina |
| Infra-tribu | Drosophiliti |
| Genre | Drosophila |
| Sous-genre | Sophophora |
| Groupe | Melanogaster |
La drosophile mesure quelques millimètres de long et est connue pour pondre dans les fruits. Thomas Hunt Morgan, un embryologiste et généticien américain, était parmi les premiers à étudier sa zoologie et ses variations phénotypiques (Morgan, Bridges et Sturtevant, 1925) ; en 1933, il a reçu le prix Nobel de physiologie ou médecine pour ses découvertes sur le rôle joué par les chromosomes de la drosophile dans l’hérédité[1]. Depuis, cette dernière est devenue l'un des principaux organismes modèles des recherches en génétique et en développement. Son utilisation comme espèce modèle nous permet d’avoir une acquisition de connaissances rapide vu que l’étendue de son génome est connue et qu’elle est facile à manipuler (petite taille, élevage aisé)[2]. De plus, son code génétique et l'organisation de la cellule reflètent ceux de la grande majorité des animaux, incluant les organismes plus complexes, notamment l’Homme[2].
Ainsi, plusieurs autres expériences ayant pour sujet la drosophile ont permis de comprendre la reproduction sexuée, le développement de l'embryon, ou bien encore l’adaptation à l’environnement, chez l’ensemble des Animalia. Entre autres, les études de Hall, Rosbash et Young sur les mécanismes de l’horloge de la drosophile et les gènes impliqués ont reçu le prix Nobel de médecine de 2017[3],[4]. Dans la littérature biologique contemporaine, elle est souvent désignée tout simplement sous le nom de son genre, Drosophila (qui contient pourtant de nombreuses autres espèces).
Nom
Drosophila, nom du genre, est une adaptation scientifique moderne du grec δρόσος, drósos, « rosée », + φίλος, phílos, « qui aime »[pourquoi ?]. L'épithète spécifique melanogaster, également tirée du grec, signifie « au ventre noir ».
« Mouche du vinaigre » est l'appellation vernaculaire de l'espèce[5]. Elle renvoie à son attirance pour ce breuvage et pour les matières volatiles issues de la fermentation[6] (en contradiction formelle avec l'adage selon lequel « on n'attrape pas les mouches avec du vinaigre[7] »).
Aspect physique
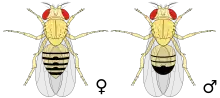

Ces mouches sont de couleur brun jaunâtre, avec des anneaux transversaux noirs sur l'abdomen. Elles ont des yeux rouge vif. Elles présentent un dimorphisme sexuel : les femelles mesurent environ 3 à 4 millimètres de long ; les mâles sont un peu plus petits et la partie arrière de leur corps est plus foncée. Les antennes sont courtes et possèdent une extrémité plumeuse. De plus, cette mouche possède des ailes de taille réduite et d'aspect chiffonné. Pour un néophyte qui essaierait de décrire la différence entre les sexes sous une loupe binoculaire, le caractère distinctif le plus marquant est probablement l'amas de poils pointus entourant l'anus et les parties génitales du mâle. Sur le site web FlyBase, on trouve un grand nombre d'images à ce propos.
Cycle de vie
Le cycle de vie de Drosophila melanogaster dure environ deux semaines à 22 °C ; le cycle prend deux fois plus de temps à 18 °C. Les femelles pondent environ 400 œufs dans des fruits en putréfaction ou dans d'autres matières organiques. Les œufs ont une longueur d'environ 0,5 millimètre. La larve sort de l'œuf après 24 heures et croît durant cinq jours en muant deux fois, 24 et 48 heures après l'éclosion. Au cours de leur croissance, elles se nourrissent des micro-organismes qui décomposent le fruit, ainsi que des sucres du fruit lui-même. Ensuite, les larves s'encapsulent dans la pupe et subissent une métamorphose qui dure cinq jours, à la suite de laquelle l'adulte émerge.
Les femelles s'accouplent 8 à 12 heures après être sorties de leur pupe (dépendant de la température). Elles stockent le sperme des mâles auxquels elles se sont accouplées pour pouvoir l'utiliser ultérieurement. Pour cette raison, les généticiens doivent capturer les mouches femelles avant leur premier rapport sexuel et s'assurer ainsi qu'elles ne s'accouplent qu'avec le mâle précis requis par l'expérience. Selon le Red Book de Michael Ashburner[réf. souhaitée], les femelles inséminées peuvent être « re-virginisées » par incubation prolongée à −10 °C, ce qui tue le sperme.
Cobaye exceptionnel en génétique
.jpg.webp)
Drosophila melanogaster est l'un des organismes modèles les plus étudiés en recherche biologique, en particulier en génétique et en biologie du développement. Il y a plusieurs raisons pour cela :
- Elles sont petites et faciles à élever en laboratoire
- Leur cycle de génération est court (environ deux semaines) et elles ont une grande productivité (les femelles peuvent pondre jusqu'à 500 œufs en dix jours)
- Les larves matures ont des chromosomes géants dans les glandes salivaires.
- Elles n'ont que 4 paires de chromosomes : 3 autosomiques, et 1 sexuelle.
- Les mâles n'effectuent pas de recombinaison, ce qui facilite les études génétiques.
- Des techniques de transformation génétique sont disponibles depuis 1987.
- Leur génome, qui est compact, a été séquencé en 1998.
Génome des Drosophila
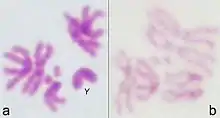
Le génome des Drosophila contient 4 paires de chromosomes : une paire X/Y, et trois autosomes appelés 2, 3, et 4. Le quatrième chromosome est si minuscule qu'on l'omet souvent. Le génome contient environ 165 millions de bases et environ 13 000 gènes. Le génome a fini d'être séquencé et annoté en 2000[8].
Similitude par rapport aux humains
D'un point de vue génétique, les êtres humains et les drosophiles ont des similitudes significatives. Selon une étude de de l'Institut américain de recherche sur le génome humain, environ 60 % des gènes sont conservés entre les deux espèces[9]. Selon une analyse de 2001, 77 % des gènes associés à des maladies humaines identifiées ont un homologue dans le génome de la drosophile[10]. 50 % des protéines de cette mouche ont des analogues chez les mammifères. Drosophila est utilisée comme modèle génétique pour diverses maladies humaines dont la maladie de Parkinson et celle de Huntington.
.jpg.webp)
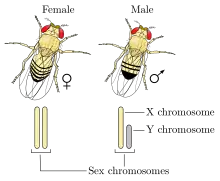
Déterminisme du sexe chez la drosophile
Le chromosome Y ne définit pas le sexe mâle chez la mouche comme chez l'être humain. C'est le rapport entre le nombre de gènes autosomaux déterminant le caractère mâle et le nombre de gènes femelles portés sur le ou les chromosomes X qui importe. Ainsi une mouche XY peut phénotypiquement être une femelle si la balance entre le nombre de gènes déterminant mâle et femelle penche en faveur du déterminisme femelle[11]. Plus précisément, si le rapport entre le nombre de chromosomes X et le nombre de jeux d'autosomes est supérieur à 1 pour 1, on obtient une mouche femelle. De même, si ce rapport est inférieur ou égal à 0,5 pour 1, on obtient une mouche mâle. Par exemple une mouche diploide (deux jeux d'autosomes) possédant deux chromosomes X est une femelle, alors qu'une mouche diploide possédant un seul chromosome X est un mâle. Il est à noter que certains génotypes particuliers donnent des mouches de phénotype intermédiaire (intersexe) et stériles[12].
Nomenclature génétique
Le nom des gènes nommés d'après des allèles récessifs commence par une minuscule, celui des allèles dominants par une majuscule. Les gènes qui doivent leur nom à un dérivé de protéine commencent par une minuscule. Les gènes sont typiquement écrits en italiques. La convention d'écriture des génotypes est :
- X/Y ; 2nd/2nd ; 3rd/3rd.2
Dans la communauté de la biologie du développement, les généticiens, travaillant sur des Drosophila nomment les mutations d'après le phénotype observé. Par exemple, l'homologue de Pax 6, qui est important pour la formation de l'œil est appelé eyeless (sans œil) car cette structure est absente chez le mutant. eyeless est donc requis pour la formation de l'œil. Ces noms évoquent directement la fonction des gènes, et sont faciles à mémoriser.
Mécanismes de régulation de l’horloge circadienne
Boucle de rétroaction principale
L'horloge circadienne de la drosophile implique plusieurs gènes rythmiques interliés par des boucles de rétroaction pour permettre une régulation étroite. La première boucle implique les gènes Per (Period) et Tim (Timeless) comme facteurs principaux[13]. La transcription de ces deux gènes est activée durant le temps de Zeitgeber de ZT4 à ZT18, lorsque l’hétérodimère formée par les protéines Clock (Circadian Locomotor Output Cycles Kaput) et Cycle (Cyc) se lie à la boîte E de leur promoteur respectif[14],[15],[16]. Le temps de Zeitgeber est en relation avec les cycles lumière / obscurité des horloges circadiennes dans lesquelles ZT0 à ZT12 correspond à la lumière constante et ZT12 à ZT0, à l’obscurité constante[17]. Une fois traduite, les protéines Per et Tim s’associent ensemble pour former un hétérodimère à leur tour[18]. L’accumulation des hétérodimères Per/Tim dans le cytoplasme entraîne sa pénétration à travers la membrane nucléique à environ ZT0[15]. Dans le noyau, elles inhibent la liaison entre les protéines Clk et Cyc, ce qui provoque l’arrêt de la transcription de ces propres gènes[19] [Figure 1]. Cela étant dit, l’expression oscillatoire des protéines de Clk et Cyc est décalée de phase par rapport à l’expression de Per et Tim vu que ces deux couples d’hétérodimères sont interliés par une boucle de rétroaction négative.
Boucle de rétroaction secondaire
En plus de la boucle de rétroaction principale, l’horloge interne est régulée par une boucle de rétroaction secondaire impliquant directement l’hétérodimère Clk/Cyc ainsi que les facteurs de transcription vrille (Vri) et PDP1 (protéine de domaine PAR 1) qui travaillent ensemble afin de créer une oscillation cohérente de l'expression de Clk[20],[21]. Expérimentalement, in vivo, l’absence de Vri dans les cellules rythmiques entraîne une augmentation de la transcription de Clk ce qui résulte, subséquemment, à une surexpression des protéines per et tim[22] ; autrement dit, à l’état sauvage, Vri est un inhibiteur de la transcription de Clk. Par opposition à Vri, Pdp1 est un activateur de la transcription de Clk : en présence de ce facteur de transcription, Clk, ainsi que per et tim, sont surexprimées[23]. L'activation de la transcription de Vri et Pdp1 est directement régulé par le complexe Clk/Cyc, formant, ainsi, une seconde boucle de rétroaction qui régule l’expression rythmique du gène Clk[20] [Figure 2].
Les deux boucles de rétroaction impliquent, toutes deux, l’hétérodimère Clk/Cyc ; ces deux protéines peuvent être considérées comme l’élément central de la régulation du rythme endogène des drosophiles[24] [Figure 2]. Cette relation entre les boucles de régulation de la rythmicité de l’horloge circadienne assure une meilleure stabilité et constance pour maintenir l’homéostasie de l’organisme sous multiples conditions externes.
Influence des signaux environnementaux : effets de la lumière sur l’horloge
Régulation circadienne
Le temps circadien est utilisé afin d'interpréter la photopériode afin d'obtenir des résultats qui dépendent de la longueur du jour. Chez la drosophile, la variation de la lumière externe affecte grandement les mécanismes de l’horloge circadienne qui coordonne leurs activités physiologiques. En effet, selon la présence ou l’absence de lumière, le motif d’expression des gènes impliqués et la distribution cellulaire des protéines sont modifiés dans les neurones régulateurs, clock neurons. Durant la journée, la lumière active la protéine Cryptochrome (Cry) qui est directement impliqué dans le processus d’ubiquitination et de dégradation de la protéine Tim de l’hétérodimère Per/Tim[15]. En absence de la protéine Tim, la protéine Per devient sensible à la phosphorylation par la protéine doubletime (DBT). Toutefois cette dernière n'est pas directement responsable de la dégradation de Per. Or, une fois que les hétérodimère Per/Tim dégradés, le complexe Clk/Cyc ne reçoit plus de signal d’inhibition et se lie de nouveau au promoteur des gènes Per et Tim[15],[20],[25]. Ainsi, durant le jour, la transcription de ces gènes est continuée, mais les protéines sont systématiquement dégradées par Cry[26] [Figure 3]. L’arrivée de la nuit coïncide avec l’achèvement du signal lumineux, et donc, l’inactivation de Cry. Cela conduit à une accumulation de Per et Tim dans le cytoplasme[15] ; Per et Tim entre, alors, dans le noyau soit séparément, soit en tant que hétérodimère, et régule l’expression de d’autres gènes[27].
Au niveau de la seconde boucle de rétroaction impliquant Vri et Pdp1ε, les répercussions directes de la lumière sont encore peu connues. Par contre, par l’analyse de Western blot de protéines extraites à différentes périodes de la journée, il est possible de constater qu’elles sont, toutes les deux, transcrites durant la journée et leur concentration chute en obscurité[20] [Figure 4]. Or, vri est dégradé avant Pdp1ε d’une période d’environ 4 heures, ce qui permet de définir le passage de l’activation à la répression de la transcription Clk[20],[24],[28].
Régulation circannuelle
Comme la photopériode varie au cours de l’année, la réponse aux signaux environnementaux lumineux permet un mécanisme d’estimation du nombre de jours passés, qui est toutefois peu connu. Il semblerait que lorsqu’un certain seuil de période d’activation ou d’inhibition est atteint par les gènes de l’horloge, les neurosécréteurs émettent un signal endogène responsable de divers mécanismes physiologiques comme le développement ou la diapause[29]. Toutefois, il semblerait que le processus d’éclosion est ne soit pas régulé par le photopériodisme[30]. D’autant plus, des études récentes démontrent que des changements dans la photopériode peuvent même conférer un avantage au niveau de la tolérance du froid. En effet, chez Drosophila Montana, une journée écourtée dicte un signal qui peut permettre une acclimatation au froid anticipée. Il s’agit alors d’une plasticité de tolérance au froid induite par des changements photopériodiques perçus par l’horloge interne[31].
Les horloges périphériques et la synchronisation de ces cellules
Des horloges moléculaires ont été identifiées dans divers tissus périphériques de la drosophile[32]. Effectivement, des segments corporels dissociés et ensuite cultivés (la tête, le thorax et l'abdomen), marqués avec la protéine fluorescente verte GFP[33], démontre l'autonomie circadienne de ses tissus [Figure 5]. De plus, chaque segment dissocié est rythmique avec la même phase et la même forme d'onde. Cela confirme que l'horloge moléculaire de la drosophile peut fonctionner à un niveau cellulaire et ce de manière autonome. Chaque cellule à une capacité photoréceptrice et peut un certain rythme endogène propre[34]. Précédemment, la tête était considérée comme la coordonnatrice principale de l'horloge moléculaire chez la drosophile mais ces résultats illustrent qu'elle ne coordonne pas tous les rythmes. Il s’agit de la lumière dans ce cas qui a le potentiel d'affecter en même temps toutes les parties du corps et celle-ci sert de signal de coordination principal[33]. Cependant, dire que la lumière est l'unique cause de synchronisation n'est pas tout à fait juste, car il est possible que la température en soit également impliqué. De plus, le comportement alimentaire de la drosophile est sous contrôle des tissus métaboliques qui le régulent de face rythmique. L'horloge moléculaire affecte le stockage d'énergie dans le corps gras de la drosophile. En effet, l'homéostasie énergétique de la drosophile est contrôlée grâce aux horloges neuronales et périphériques qui ont des effets opposés sur le métabolisme du glucose[35]. Bref, il existe des oscillateurs circadiens autonomes présents dans tout le corps et chaque cellule chez la drosophile est capable de supporter leurs propres horloges indépendantes.
Développement et embryogénèse
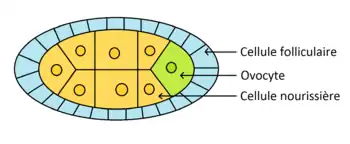
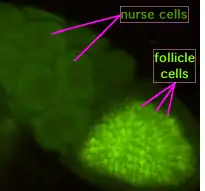
L'ovogenèse se déroule dans les ovarioles de la femelle. Les cellules souches germinales se divisent de façon asymétrique pour donner une nouvelle cellule souche et un cystoblaste. Il y a formation d'un syncitium de 16 cystocytes appelé cyste. L'un des cystes se différentie en ovocyte et les 15 autres en cellules nourricières. L'ovocyte migre vers la région postérieur. L'axe-antéro-postérieur est donc mis en place avant la fécondation (de même que l'axe dorso-ventral). Des ponts cytoplasmiques relient les cellules, ce qui permet aux cellules nourricières de transférer des ARNm à l'ovocyte. Les cellules folliculaires et nourricières disparaissent avant la fécondation.
La fécondation déclenche des mitoses incomplètes sans ségrégation des noyaux dans des cellules différentes. Il y a formation d'un syncitium. Certains noyaux migrent à l'extrémité postérieure de l'embryon et se cellularisent formant les cellules germinales initiales. La plupart des autres noyaux migrent ensuite à la périphérie de l'embryon et il y a cellularisation, formant un blastoderme. La gastrulation permet aux cellules ventrales formant le mésoderme de rentrer à l'intérieur de l'embryon par invagination puis par délamination. L'endoderme forme le tube digestif par une double invagination, formant deux tubes qui se rejoignent au milieu de l'embryon. Les 14 segments (ou plus précisément les parasegments) se mettent en place.
La vision chez les Drosophila

Un œil composé de drosophile contient 800 unités de vision ou ommatidia, ce qui en fait l'un des plus développés parmi les insectes. Chaque ommatidium contient 8 cellules photoréceptrices (R1-8), des cellules de support, des cellules de pigment, et une cornée. Les drosophiles standard ont des cellules de pigment rougeâtre (causés par les pigments pteridines et ommochromes)[36] qui servent à absorber l'excès de lumière bleue ce qui empêche l'éblouissement de la mouche par la lumière ambiante. Certains gènes de la couleur des yeux régulent le transport vésiculaire des cellules. Les enzymes et autres substances nécessaires à la synthèse des pigments sont donc transportées à la granule du pigment, qui contient les molécules précurseures des pigments.[36]
Vol des Drosophila
Les ailes d'une mouche peuvent battre jusqu'à 250 fois par seconde. Les mouches volent par des séquences directes de mouvement alternant avec de rapides rotations appelées saccades. Au cours de ces rotations, une mouche peut effectuer une rotation de 90 degrés en moins de 50 millisecondes.
Notes et références
- (en) Ilona Miko, « Thomas Hunt Morgan and Sex Linkage », Nature Education, vol. 1, no 1, , p. 143 (lire en ligne).
- (en) Benjamin A. Pierce, Genetics : a conceptual approach, New York, W. H. Freeman and Company, , 5e éd. (1re éd. 2003), 700 p. (ISBN 978-1-4641-0946-1 et 1-4641-0946-X).
- (en) Paul E. Hardin, Jeffrey C. Hall et Michael Rosbash, « Feedback of the Drosophila period gene product on circadian cycling of its messenger RNA levels », Nature, vol. 343, no 6258, , p. 536–540 (ISSN 0028-0836, e-ISSN 1476-4687, PMID 2105471, DOI 10.1038/343536a0).
- (en) Thaddeus A. Bargiello, F. Rob Jackson et Michael W. Young, « Restoration of circadian behavioural rhythms by gene transfer in Drosophila », Nature, vol. 312, no 5996, , p. 752–754 (ISSN 0028-0836, e-ISSN 1476-4687, PMID 6440029, DOI 10.1038/312752a0, lire en ligne).
- Didier Pol, « Élevage de la mouche du vinaigre, Drosophila melanogaster », sur planet-vie.ens.fr, .
- « Les Entreprises Maheu Ltée / Gestion parasitaire (extermination) », sur Entreprises Maheu (consulté le ).
- Pierre Kerner, « Les mouches du vinaigre avinées », sur Podcast Science, .
- (en) M.D. Adams et S.E. Celniker et al., « The genome sequence of Drosophila melanogaster », Science, vol. 287, , p. 2185-2195 (PMID 10731132)
- « Background on Comparative Genomic Analysis », sur Genome.gov (consulté le ).
- LT Reiter, L Potocki, S Chien, M Gribskov et E Bier, « A Systematic Analysis of Human Disease-Associated Gene Sequences In Drosophila melanogaster », Genome Research, vol. 11, no 6, , p. 1114–1125 (PMID 11381037, PMCID 311089, DOI 10.1101/gr.169101)
- http://www.snv.jussieu.fr/bmedia/balance/Droso_fichiers/GenomeF4.swf.
- (de) « Drosophila melanogaster », dans Wikipedia, (lire en ligne)
- Reppert, S.M. et Sauman, I. (1995). period and timeless Tango: A Dance of Two Clock Genes. Neuron, 15:983-986. DOI: https://doi.org10.1016/0896-6273(95)90086-1.
- Stanewsky, R. (2003). Genetic analysis of the circadian system in Drosophila melanogaster and mammals. J Neurobiol 54: 111–147. DOI : https://doi.org/10.1002/neu.10164.
- Hardin, P. E. (2014). Molecular genetic analysis of circadian timekeeping in Drosophila. Adv Genet, 74:141-173. DOI :10.1016/B978-0-12-387690-4.00005-2.
- Rosato, E., Tauber, E. et Kyriacou, C. (2006). Molecular genetics of the fruit-fly circadian clock. European Journal of Human Genetics , 14 : 729–738.
- Eckel-Mahan, K. et Sassone-Corsi, P. (2015). Phenotyping Circadian Rhythms in Mice. Curr Protoc Mouse Biol., 5 (3): 271-281. DOI: 10.1002/9780470942390.mo140229.
- Dauvilliers, Y. (2005). Génétique des rythmes circadiens et des troubles du rythme circadien du sommeil. Médecine du Sommeil, 1 (4) : 4-10. DOI: https://doi.org/10.1016/S1769-4493(05)70143-6.
- Hardin, P.E., Krishnan, B., Houl, J.H., Zheng, H., Dryer, S.E. et Glossop, N.R. (2003). Central and peripheral circadian oscillators in Drosophila, Novartis Fround Symp., 253:140-160.
- Cyran, S. A., Buchsbaum, A. M., Reddy, K.L., Lin, M. C., Glossop, N. R., Hardin, P. E., …, Blau, J. (2003). vrille, Pdp1, and dClock form a second feedback loop in the Drosophila circadian clock. Cell, 112(3) : 329-341.
- Glossop, N.R., Houl, J.H., Zheng, H., Ng, F.S., Dudek, S.M. et Hardin, P.E. (2003). VRILLE feeds back to control circadian transcription of Clock in the Drosophila circadian oscillator. Neuron, 37(2): 249-261. DOI: https://dx.doi.org/10.1016/S0896-6273(03)00002-3.
- Blau, J. et Young, M.W. (1999). Cycling vrille expression is required for a functional Drosophila clock, Cell, 99: 661–671. DOI: https://dx.doi.org/10.1016/S0092-8674(00)81554-8.
- McDonald, M.J. et Rosbach, M. (2001). Microarray Analysis and Organisation of Circadian Gene Expression in Drosophila, Cell, 107(5): 567-578. DOI: https://dx.doi.org/10.1016/S0092-8674(01)00545-1.
- Paranjpe, D. A. et Sharma, V. K. (2005). Evoltuion of temporal order in living organisms. Journal of Circadian Rhythms, 3 (7): 1-13. DOI: http://doi.org/10.1186/1740-3391-3-7.
- Tataroglu, O. et Emery, P. (2014). Studying circadian rhythms in Drosophila melanogaster. Methods, 68 (1): 140-150. DOI: 10.1016/j.ymeth.2014.01.001.
- Allada, R., White, N.E., So, W.V., Hall, J.C. et Rosbach, M. (1998). A Mutant Drosophila Homolog of Mammalian Clock Disrupts Circadian Rhythms and Transcription of period and timeless, Cell, 93(5):791-804. DOI: https://dx.doi.org/10.1016/S0092-8674(00)81440-3.
- Lee, C., Bae, K. et Edery, I. (1999). PER and TIM inhibit the DNA binding activity of a Drosophila CLOCK-CYC/dBMAL1 heterodimer without disrupting formation of the heterodimer: a basis for circadian transcription. Mol Cell Biol, 19(8): 5316-5325.
- Allada, R. (2003). Circadian clocks: a tale of two feedback loops. Cell, 112 (3): 284-286. DOI: https://doi.org/10.1016/S0092-8674(03)00076-X.
- Shiga, S. (2013). Photoperiodic plasticity in circadian clock neurons in insects. Frontiers in Physiology, 4(69). DOI: http://doi.org/10.3389/fphys.2013.00069.
- Khare P.V., Keny V.L., Vanlalnghaka C., Satralkar M.K., Kasture M.S., Barnabas R.J. et Joshi D.S. (2004). Effects of temperature, photoperiod, and light intensity on the eclosion rhythm of the high-altitude Himalayan strain of Drosophila ananassae. Chronobiol Int, 21(3):353-65.
- Vesala, L., Salminen, T.S., Kankare, M. et Hoikkala, A. (2012). Photoperiodic regulation of cold tolerance and expression levels of regucalcin gene in Drosophila montana. Journal of Insect Physiology, 58(5): 704-709. DOI: https://doi.org/10.1016/j.jinsphys.2012.02.004.
- (en) Jadwiga M. Giebultowicz, Ralf Stanewsky, Jeffrey C. Hall et David M. Hege, « Transplanted Drosophila excretory tubules maintain circadian clock cycling out of phase with the host », Current Biology, vol. 10, no 2, , p. 107-110 (ISSN 0960-9822, OCLC 4636413296, DOI 10.1016/S0960-9822(00)00299-2).
- Plautz, J. D., Kaneko, M., Hall, J. C. et Kay, S. A. (1997). Independent photoreceptive circadian clocks throughout Drosophila. Science, 278(5343): 1632-1635.
- Rouyer, F. (1998). Chez les dropsophiles, les horloges circadiennes ont leurs propres yeux, medecine/scicence, 14:448-450.
- Xu, K., Zheng, X. et Sehgal, A. (2008). Regulation of feeding and metabolism by neuronal and peripheral clocks in Drosophila. Cell metabolism, 8(4): 289-300.
- Paaqua Grant, Tara Maga, Anna Loshakov et Rishi Singhal, « An Eye on Trafficking Genes: Identification of Four Eye Color Mutations in Drosophila », G3: Genes|Genomes|Genetics, vol. 6, no 10, , p. 3185–3196 (ISSN 2160-1836, PMID 27558665, PMCID 5068940, DOI 10.1534/g3.116.032508, lire en ligne, consulté le )
Liens externes (en anglais)
- (en) Référence Catalogue of Life : Drosophila melanogaster Meigen, 1830 (consulté le )
- (en) Référence Fauna Europaea : Drosophila melanogaster
- (fr+en) Référence ITIS : Drosophila melanogaster Meigen, 1830
- (en) Référence Animal Diversity Web : Drosophila melanogaster
- (en) Référence NCBI : Drosophila melanogaster (taxons inclus)
- A quick and simple introduction to Drosophila melanogaster
- FlyBase
- The WWW Virtual Library: Drosophila
- The Berkeley Drosophila Genome Project
- Keeping and Breeding Fruit Flies
- Abstract of the papers describing the genome of Drosophila melanogaster
- FlyMove
- The Interactive Fly - A guide to Drosophila genes and their roles in development
- Drosophila Nomenclature - naming of genes
Lien externe (en français)
- (fr) Référence INPN : Drosophila melanogaster Meigen, 1830
- Portail de l’entomologie