Margaritifera margaritifera
Mulette perlière

| Règne | Animalia |
|---|---|
| Embranchement | Mollusca |
| Classe | Bivalvia |
| Sous-classe | Palaeoheterodonta |
| Ordre | Unionoida |
| Famille | Margaritiferidae |
| Genre | Margaritifera |

EN A1ce+2c : En danger
La moule perlière d'eau douce (Margaritifera margaritifera (Linnaeus 1758), ou mulette perlière, est un mollusque lamellibranche des rivières claires d'Europe, de Russie, du Canada[1] et de la façade est des États-Unis, communément classée parmi les moules d'eau douce.
Dans le cycle de développement de l'espèce, la larve doit — durant quelques mois — parasiter un saumon ou une truite (qui la nourrit et la transporte).
Les adultes tolèrent des substrats limoneux ou vaseux mais les juvéniles ont impérativement besoin d'un substrat sableux ou graveleux dans lequel de l'eau propre et oxygénée puisse circuler[2].
C'est une espèce connue pour sa durée de vie exceptionnelle (plus d'un siècle), mais qui est au bord de l'extinction bien que protégée[3].
Cette espèce a été exploitée jusqu'au milieu du XXe siècle pour la production des perles de joaillerie, avant la découverte au XVIIIe siècle des huîtres perlières tropicales, souvent plus grosses et surtout plus régulières.
Synonymes
Cette espèce a aussi dans le passé été nommée :
- Unio elongata (Lamarck, 1819)
- Margaritifera margaritifera durrovensis (Bloomer, 1928)
- Margaritana durrovensis (Bloomer, 1928)
Description, identification
 Coquille/valves, faces externes.
Coquille/valves, faces externes.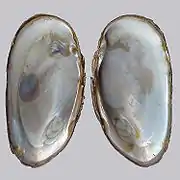 Coquille/valves, faces internes.
Coquille/valves, faces internes.
La coquille (dont la forme évoque celle d'un rein) est longue de 60 à 150 mm, et large de 30 à 60 mm (pour une épaisseur de 25 à 40 mm)[4]. Ses valves, épaisses par rapport à celles d'autres moules, sont striées à l'extérieur (= bandes d'accroissement) et nacrée à l'intérieur. La couleur externe fonce avec l'âge, pour devenir noire ou presque noire[4].
Quand la moule est ouverte, le côté rond vers le haut, la valve droite a une seule dent cardinale et la valve gauche en a deux[4].
Environ une moule sur 1000 produirait une perle, souvent de forme irrégulière, généralement produite au bord du manteau[4].
Pour plus de détails, voir clé d'identification[5].
Écologie
Bauer (1992) a conclu de l'étude de 48 populations de cette espèce à travers l'Europe qu'il existe une variation importante des traits d'histoire de vie selon la latitude (du cercle polaire arctique à l'Espagne), avec un succès de reproduction positivement corrélée à la fois la durée maximale de vie (constatée au nord) et la longueur maximale de la coquille, mais négativement corrélée au taux de croissance[6], ce qui laisserait penser que les populations du sud sont plus vulnérables en termes de succès de reproduction.
Cycle de vie
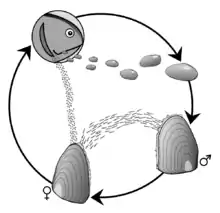
Le cycle de vie de la moule perlière se déroule en 4 étapes de développement : le stade glochidies, une phase parasitaire, un stade juvénile et le stade adulte. Il est associé à celui de la truite fario[7] et à celui du saumon atlantique, car les larves du mollusque sont réputées ne pouvoir se développer qu'à l'abri dans les branchies de ces poissons, et uniquement de ceux-ci.
Chez les moules d'eau douce, les sexes sont séparés (mais si la densité de population est réduite, les femelles peuvent devenir hermaphrodites et s'autoféconder).
Les quatre stades de développement sont :
Stade de la fécondation et production des glochidies
En juillet-août, les mâles libèrent leurs spermatozoïdes dans l'eau. Ceux qui seront captés par le siphon respiratoire d'une femelle pourront éventuellement féconder les œufs (qui sont présents dans ses branchies). Une fois la fécondation effectuée, l’œuf se développe et donne une larve, nommée glochidium (constituée de deux petites valves triangulaires mesurant de 0.04 à 0.07 mm), incubée par la femelle durant quatre semaines. Fin septembre, les glochidies mesurent 0,05 mm de long[4]. Elles sont expulsées par toutes les femelles en possédant dans le cours d'eau[4].
Stade parasitaire
Elle doit ensuite se fixer sur l'appareil branchial d'une truite fario ou d'un saumon atlantique (cette phase parasitaire ne dure en général que quelques semaines (en théorie jusqu'au printemps suivant, et parfois jusqu'à 10 mois), mais elle est importante pour la dispersion spatiale et les échanges génétiques au sein de l'espèce[8]). Dans 6 rivières écossaises, on a trouvé des glochidies dans les branchies de saumons d'élevage d'Ecosse[9], et même autant que chez les saumons sauvages des mêmes régions mais ces larves ne peuvent alors se laisser transporter (et elles pourraient souffrir de certains traitements médicamenteux donnés aux poissons)[9]. Il a été noté à cette occasion que les saumons adultes en sont moins porteurs que les jeunes saumons d'un an (peut être en raison d'une immunité acquise par exposition antérieure ?) et que dans certaines rivières il existe des différences entre le taux de saumons et de truites porteurs de glochidies (certaines populations de truites en portaient moins ; peut-être en raison d'un comportement ou lieu de vie différent ?)[9]. Les auteurs notent aussi que dans un lot de saumoneaux d'élevage de moins de 1 ans où la charge parasitaire a été contrôlée, les glochidies ont mis jusqu'à 11 mois pour mûrir et seulement 5 à 10 % des glochidiums ont réussi à se métamorphoser et excyster des moules juvéniles[9].
Quand le glochidium s'est transformé en un minuscule bivalve (de 0,5 mm environ) il se détache du poisson et cherche un substrat qui lui convienne[4].
Une étude (conduite par des parasitologues dans les années 1970 et publiée en 1978[10]) a consisté à disposer 594 salmonidés nord-américains de 4 espèces différentes (et de 30,5 à 87 mm de long car ce sont les juvéniles qui sont les plus infestés par les glochidies) dans des cage en rivière puis à les comparer à 178 poissons sauvages trouvés dans les mêmes rivières. Dans ce cas 99 % des saumons chinook (Oncorhynchus tshawytscha), 75 % des saumons coho (Oncorhynchus kisutch), 88 % de la truite fardée (Salmo clarki), et 95 % de la truite arc en ciel (Salmo gairdneri) étaient infestés par des glochidies, avec une incidence de la parasitose comparable en cage et chez les poissons sauvages indigènes libres[10]. Le nombre moyen de glochidies par poisson encagé et sauvage était respectivement de 446 et 399 pour le saumon quinnat, 8 et 24 pour le saumon coho, 72 et 88 pour la truite arc. 212 glochidies ont été trouvés en moyenne chez la truite fardée encagée, mais aucune truite fardée juvénile indigène n'a été capturée lors de cette étude[10]. En 1971 dans la rivière Siletz (Oregon) à une température moyenne de l'eau de 12,8 °C, le Glochidium s'est formé dans les moules en moyenne en 13 jours[10]. Les moules les ont libérés dans l'eau du au [10]. Puis ils ont été retrouvés chez ces 4 espèces de poissons, enkystés dans les filaments des branchies, les arcs branchiaux, les râteaux, et parfois dans les pseudobranchies de ces 4 espèces, mais le plus souvent dans les filaments de lamelles. Durant ce stade, ils ont grandi de 500 % (par rapport à leur taille initiale de 70 à 75 µm)[10]. Les parois des kystes d'abord épaisses de 15 µm d'épaisseur, mais au fur et à mesure que le parasite grandit, la paroi s’amincit. Jusqu'à 15 lamelles peuvent fusionner à la paroi[10]. Sauf pour les lamelles "captées" par le parasite, le sang continuait à circuler dans les capillaires des lamelles fusionnées, mais ces lamelles, sauf en position ultrapériphérique, n'étaient probablement plus fonctionnelles pour la respiration du poisson. En outre les parasites enkystés sur les côtés de filaments branchiaux freinent le flux sanguin en y pinçant les artérioles[10]. Les grands parasites enkystés sur les lamelles diminuent la capacité d'échange des branchies. Certains filaments branchiaux sont déformés par les grands parasites en situation distale. Ces changements sont pathologiques quand la charge parasitaire est importante, et peuvent même conduire à la mort précoce de poissons par asphyxie, et, même quand l'infestation est légère, la connexion du glochidium au système sanguin pourrait offrir des portes d'entrée à des champignons ou bactéries pathogènes, et être source d'une mortalité secondaire et différée[10].
Phase post-parasitaire
À ce stade, la toute jeune moule, très légère, peut encore se déplacer assez facilement (par expulsion d'eau) et en se laissant porter par le courant. Elle se fixe alors dans le fond d'une rivière ou d'un ruisseau parfois profondément (5 et 50 cm de profondeur) et y continue sa croissance durant 5 ans avant de remonter plus en surface, ou elle poursuit sa croissance jusqu'à la maturité sexuelle (atteinte à l'âge de 12 à 20 ans selon le climat et les conditions de croissance).
Cette phase semble particulièrement critique pour la survie de l'espèce ; la jeune moule est sensible aux polluants qui sont souvent stockés dans le sédiment où elle va s'enfoncer pour se protéger ; à ce stade, dans les zones peu profondes, elle peut aussi être mangée par des animaux fouisseurs (oiseaux d'eau), ou mourir asphyxiée si le substrat est colmaté par un sédiment trop fin.
Phase de croissance
Elle se prolonge jusqu'à la maturité sexuelle, à une vitesse variant selon le contexte (température de l'eau en particulier).
Longévité
C'est une des caractéristiques remarquables de l'espèce, puisqu'elle varie entre 20 et 30 ans pour les individus vivant dans les eaux plus chaudes du sud de l'Europe, à plus de 150 ans pour ceux de Scandinavie.
Habitats




La moule perlière est réputée ne vivre (en groupes denses ou individus épars) que dans les cours d'eau peu profonds à moyennement profonds (10 cm à 2m) aux eaux pures et plutôt oligotrophes, fraiches en été, riches en oxygène et pauvres en calcaire des massifs de moyenne montagne et des plaines. Ses substrats et micro-habitats[11] préférés sont le gravier fin, les anfractuosités de roches en éboulis et moins souvent les fonds sableux[4]. Ces habitats coïncident en partie avec ceux recherchés par les salmonidés pour la ponte.
Bien que les moules d'eau douces ne soient pas réputées très mobiles, le modèle de distribution spatiale des moules adultes et plus encore des juvéniles n'est pas aléatoire : les jeunes individus de cette espèce montrent de très nettes préférences (par exemple étudiées dans la rivière Kerry, au nord-ouest de l’Écosse) de profondeur, de vitesse moyenne du courant, de substratum et de taux de végétation aquatique...)[2], en termes de distance à la berge. Les profondeurs optimales mesurée en Écosse seraient de 30 à 40 cm et les courants optimaux de 0,25 à 0,75 mètre par seconde à des niveaux d'eau intermédiaires[2].
Pour les juvéniles la qualité du substratum est vitalement déterminante ; si les adultes tolèrent des substrats limoneux ou vaseux (pour une durée inconnue), aucune jeune moule n'est trouvée vivante dans un tel habitat[2]. Des rivières où se succèdent des substrats vaseux-limoneux et plus sableux/graveleux pourraient donc abriter des populations d'âges différents. Comme les poissons peuvent remonter les glochidies vers la source, chaque rivière peut théoriquement être (re)colonisée sur une grande partie de son cours, à condition de n'être pas polluée. Ceci expliquerait le fait que les petites rivières à castors où les barrages sont nombreux puissent aussi accueillir ces moules, les jeunes en aval du barrage, et les adultes en aval et/ou en amont où les sédiments s'accumulent. Il a été démontré que les barrages de castors sont aussi très favorables aux jeunes salmonidés.
Des modélisations dont la fonction discriminante est basée sur la qualité du substratum se sont montrées capables en Écosse de prédire la présence/absence de moules, avec un taux de 76 à 92 % de succès[2].
En 2007, une étude a porté sur la survie/mortalité des très jeunes moules (stade post-parasitaire) dans leur habitat naturel selon de nombreux paramètres physicochimiques dans 26 cours d'eau de sept pays européens[8]. Elle visait notamment à vérifier le caractère bioindicateur de l'espèce pour la qualité du substrat à 5 et 10 cm dans les cours d'eau. L'étude a confirmé l'importance de la qualité du sédiment pour la jeune moule qui a besoin de sable ou de gravier pauvre en nutriments (avec présence de manganèse)[8].
Le Potentiel redox présentait une différence marquée entre la surface du sédiment et sa mesure à 5 et 10 cm dans le lit, là où il n'y a pas de recrutement de jeunes moules, alors qu'aucune différence de potentiel Redox n'était détectable sur les sites de bonne qualité riches en jeunes moules perlières. De même pour la conductivité électrique, et, dans une moindre mesure, le pH. En outre, les sections de lits de rivières où le sédiment résistait à la pénétration étaient aussi parmi les plus pauvres en recrutement de moules perlières. Ces données confirment que le colmatage du système de macropores interstitiels nuit à la survie des jeunes moules[8].
Alors que d'autres unioidés supportent ou apprécient des sédiments fins, ce n'est pas le cas de M. margaritifera pour laquelle une bonne circulation d'eau entre la surface et les interstices à 5-10 cm de profondeur est un facteur essentiel et prédictif de bonne qualité d'habitat pour cette espèce, alors que la bonne qualité chimique de l'eau libre est insuffisante, en raison d'une dissociation de l'eau courante et de l'eau interstitielle (qui peut être très polluée et anoxique dans les sites dégradés)[8].
Aire de répartition
Historiquement, l'espèce semble avoir été présente jusqu'au XIXe siècle dans une grande partie de l'Europe de l'Ouest et de l'Est de l'Amérique du Nord, et plutôt en zone froide et tempérée ce qui semble conforme au fait qu'elle soit associée dans son cycle de développement au saumon atlantique[12], mais l'espèce est en régression depuis au moins un siècle et en régression accélérée depuis la fin du XXe siècle, au point d'être considérée comme en danger d'extinction par de nombreux spécialistes.
Écologie
La mulette était autrefois largement présente et donc relativement ubiquiste, des zones froides de la Suède aux eaux plus tièdes de l'Espagne (une population a été redécouverte dans six rivières du Portugal au début des années 2000, après qu'elles y ont été considérées comme éteintes, ce qui en fait la population la plus méridionale d'Europe avec celles de la rivière Águeda en Espagne[13]), mais c'est un animal filtreur se nourrissant des particules en suspension véhiculées par les courants et très sensible à la pollution de l'eau.
Cette espèce exige un substrat gravillonnaire ou sableux, lui permettant de s'enfouir, parfois plusieurs années, ce qui laisse supposer que l'espèce et en particulier la jeune moule est a priori très sensible à la sédimentation de particules fines dans son habitat : la baisse des débits, colmatant les fonds, entraîne systématiquement sa disparition, bien qu'on observe parfois des déplacements volontaires de sujets adultes (en cas de baisse des niveaux d'eau par exemple ou d'augmentation locale de la turbidité).
Sa grande sensibilité à la pollution de l'eau en fait un excellent bioindicateur de la qualité des cours d'eau (notamment parce qu'elle semble se reproduire difficilement si le taux de nitrates dépasse 1 mg/litre).
Histoire
Cette espèce était autrefois abondante. Elle a été exploitée depuis la Préhistoire par l'Homme, sans doute comme nourriture et pour les perles de nacre qu'elle renferme parfois (exploitable en joaillerie pour 1 individu sur 1 000 en moyenne)[4]. On raconte ainsi que Marie de Médicis portait un jour, pour le baptême de son fils, une robe composée de 32 000 perles de Margaritifera margaritifera, ce qui correspond à au moins 32 millions de moules sacrifiées pour la confection de cette robe[14].
Le journal Le Figaro décrit en 1892 leur abondance dans certains cours d'eau en Bretagne, dans le Nord de la France, dans l'Est (Vologne particulièrement[15]), dans la Dordogne, la Garonne, etc., mais note déjà leur raréfaction. Il évoque aussi déjà l'espoir de leur culture et note aussi ses usages, y compris alimentaires, dans des pays comme l'Angleterre, l'Allemagne ou la Chine[16]. L'Ouest-Éclair les évoque en 1921, donnant comme exemples de localisation Le Faouët, le Stang-Alar près de Quimper, etc., signe qu'elles étaient encore assez nombreuses à cette date[17].
Lionel Bonnemaire[18] dans son livre Les mollusques des eaux douces de France et leurs perles, décrit la pêche que pratiquaient les habitants de Pont-Aven à la fin du XIXe siècle : l'Aven était alors comme "pavée" de mulettes perlières ; un dicton disait : « les perles sont mûres quand les genêts fleurissent et quand l'avoine mûrit ». À marée basse les pêcheurs, souvent les valets de ferme et les meuniers, « bêchent donc le fond avec des pelles » et l'œuvre de destruction est inouïe. Un pêcheur peut bon an mal an capturer huit ou dix mille de ces mollusques, les valves étant abandonnées sur les rives. L'auteur précise également qu'il ne manque pas à Pont-Aven de touristes désireux d'acquérir des perles comme souvenir de voyage et qui les paient des prix sans cesse plus élevés (par exemple, un certain Fridour, un pêcheur très connu des touristes, aurait trouvé seize perles en 1897 et dix en 1898, sur environ 800 mulettes examinées). Fort heureusement, les loutres et certains oiseaux comme les corbeaux, par exemple, se chargent, en dévorant la chair abandonnée de ces mollusques de supprimer ce qui serait sinon un danger d'infection[19].
Le même auteur décrit la pêche que pratiquaient des jeunes filles de Rosporden dans l'Aven au lieu-dit Kerenmeriet [Keranmeriet] en Melgven à la fin du XIXe siècle (l'Aven était alors comme "pavée" de mulettes perlières) : « Jadis, la recherche de perles occasionnait de joyeuses parties. Les jeunes filles de Rosporden se rendaient au lieu-dit Kerenmeriet, en français Le bois des filles. Il est situé au bord de l'Aven. À demi dévêtues, ces pêcheuses improvisées ne craignaient pas d'entrer dans l'eau et prenaient un grand nombre de kregen dour dous [mulettes perlières en breton], qu'elles ouvraient sur le champ pour les visiter. Elles rejetaient ensuite leurs valves dans la rivière »[20].
En France, elle était encore signalée en 1998 dans les Pyrénées-Atlantiques et les Vosges ainsi que dans le centre de la France. En 2008, elle est encore connue dans la Vienne, la Dronne et la Charente, mais est encore très présente dans la rivière Dordogne. Elle est également signalée dans l'Èbre (Espagne). Un peuplement récemment confirmé dans l'Oise s'est éteint à la suite d'une pollution chimique de la rivière. Signalée en 2015 dans le ru de Baulches dans l'Yonne[réf. nécessaire]. Le Grand Ouest héberge enfin quelques populations relictuelles notamment sur l'Airou, le Sarthon et la Rouvre pour la Basse-Normandie, l'Éllez, le ruisseau de Bonne Chère, le ruisseau du Loc'h pour la Bretagne, et les gorges du Haut-Allier en Auvergne (Haute-Loire)
État des populations, menaces
Depuis la fin du XXe siècle, l'espèce est considérée comme très vulnérable et menacée de disparition en Europe de l'ouest, notamment en raison d'une faible plasticité écologique, due à sa dépendance aux milieux non pollués et à deux espèces de salmonidés dont l'une est en forte régression (saumon atlantique sauvage) [21],[22]. D'autres espèces proches (ex : Margaritifera durrovensis Phillips en Irlande où M. margaritifera est en situation de déclin très préoccupant[23],[24]) sont aussi considérée comme en situation d'extinction imminente)[25].
Menaces
Cet animal à développement lent a une longue durée de vie et, en tant que filtreur se nourrissant à l'intérieur du sédiment les premières années puis légèrement au-dessus du fond, il est susceptible de bioaccumuler de nombreux toxiques (métaux lourds, pesticides...) qui peuvent le tuer ou nuire à ses capacités de développement et de reproduction.
Selon les données disponibles pour l'Europe de l'ouest, cette espèce a fortement régressé ou disparu, même là où les populations de truites n'ont pas régressé[26]. C'est la pollution qui semble être le premier facteur de régression de l'espèce (selon Bauer (1988), il n'y a pas d'indice ou de preuves que des changements dans la structure de la densité ou de l'âge des populations de poissons hôtes (truite) aient contribué à la baisse des moules[26]). Le facteur ayant le plus d'incidence est la pollution, d'origine agricole notamment : « La mortalité au stade adulte présentait une corrélation positive avec le taux de nitrates dans l'eau »[26]. Les taux de phosphates, de calcium et la DBO5 sont également corrélés avec une diminution de la survie et du développement de moules juvéniles. Comme la fertilité de l'espèce (mesurée par la production de glochidiums) est maintenue même dans les populations clairsemées, et dans les rivières polluées, les populations devraient récupérer si les causes du déclin sont supprimées[26].
Les effets de la pollution sont probablement aggravés par :
- la dégradation physique des cours d'eau ;
- les pratiques de l'agriculture industrielle dans le bassin versant. Outre qu'elles sont source d'eutrophisation et de pollution diffuse et chronique par les pesticides et par les antiparasitaires (encore présents dans les excréments d'animaux d'élevage)..., elles sont aussi source d'augmentation de l'érosion des sols et par suite de la turbidité de l'eau ; le recul des moules perlières d'eau douce a aussi coïncidé avec le recul des prairies permanentes extensivement pâturées ;
- l'introduction de truites arc-en-ciel (impropres au développement du glochidium[réf. nécessaire]),
- l'introduction de moules zébrées[27] et d'autres espèces exotiques ont contribué à la quasi-disparition de cette espèce sur pratiquement toute son aire de répartition ;
- l'introduction du rat musqué en particulier peut consommer en hiver de grandes quantités de moules d'eau douce.
- il est possible (mais non démontré) que les perturbateurs endocriniens soient également un facteur de régression de l'espèce, comme cela a été montré pour d'autres mollusques.
Une étude (1995), qui a utilisé de jeunes moules élevées en cage dans des rivières pour mesurer l'influence de la température et de 12 variables chimiques de l'eau sur les juvéniles, a conclu que « la croissance et la mortalité dépendent en grande partie de la température de l'eau » et qu'il « existe une relation négative entre la croissance et l'eutrophisation »[28]. Le taux de survie en cage est comparable à la survie dans le milieu naturel (avec une croissance égale ou un peu moins rapide), et il est affecté par la colonisation des cages par des insectes aquatiques et par la quantité de sédiments fins qui s'accumulent dans les cages[28].
Certaines populations sont en situation d'insularisation écologique, ce qui peut les rendre plus vulnérables.
Il est enfin possible que la génétique des truites, différentes en limite d'aire de répartition de M margaritifera influe sur leur acceptation de la glochidiose[29], et donc sur le succès de reproduction de certaines populations. La diffusion de truites d'élevages dans de très nombreux cours d'eau pourrait aussi avoir perturbé la relation de forte dépendance entre ce salmonidé et la larve parasitaire de M margaritifera.
Ces menaces ont justifié le statut particulier de cette espèce, qui relève de l'annexe III de la Convention de Berne et son classement par l'UICN en espèce menacée d'extinction.
Protection
À la suite du Grenelle de l'Environnement, la France a prévu un plan de restauration national, à décliner régionalement. La directive-cadre sur l'eau devrait contribuer à la restauration de la bonne qualité écologique des cours d'eau et des bassins versants, mais un certain nombre de paramètres critiques dont la turbidité restent préoccupants, voire montrent une dégradation. Le réchauffement climatique, en mettant en été à sec les parties amont de cours d'eau, est également un facteur de risque supplémentaire.
Un programme de conservation de mulettes perlières est actuellement en cours dans le Massif Armoricain et concerne les 6 principales populations restantes de ce secteur (Bretagne et Basse-Normandie), avec le soutien de l'Union européenne (programme LIFE+). Coordonné par l'association Bretagne Vivante, il se déroule jusqu'en 2016[30]. Dans le cadre de ce programme, les populations de mulette de ces 6 cours d'eau sont étroitement suivies.
Des études en génétique des populations ont permis de démontrer que la population de la rivière Éllez en Finistère montrait une différenciation exceptionnelle mais une très faible variabilité génétique pouvant être expliquée par l’isolement de cette population depuis plusieurs dizaines de millions d’années dans l’ouest de la Bretagne, et depuis un million d’années dans la dépression géographique locale, le Yeun Elez[31]. Des données similaires existent pour le N-W de l'Espagne[32]
Un Plan National d'Action pour la Mulette perlière (version préliminaire 2010-05-30) vient d'être mis en place[33], et la première station d'élevage inaugurée dans le Finistère[34].
Relations parasite-hôte
La moule semble parasiter le poisson-hôte, mais avec une relation de type interactions durables qui se fait aussi au bénéfice du poisson, car les moules d'eau douce ont une grande capacité de filtration de l'eau, et leur présence est a priori bénéfique pour les poissons et en particulier pour leurs alevins et œufs quand ils sont dans le sédiment sableux ou de graviers.
Voir aussi
Articles connexes
- Bivalve d'eau douce
- Mollusca
- Unionoida
- filtreur
- espèce bioindicatrice
- Perlenbach, Rivière des Perles, sur les territoires belge et allemand.
Références taxonomiques
- (fr) Référence Catalogue of Life : Margaritifera margaritifera (Linnaeus, 1758)
- (en) Référence Fauna Europaea : Margaritifera margaritifera
- (fr+en) Référence ITIS : Margaritifera margaritifera (Linnaeus, 1758)
- (en) Référence Animal Diversity Web : Margaritifera margaritifera
- (en) Référence NCBI : Margaritifera margaritifera (taxons inclus)
- (en) Référence UICN : espèce Margaritifera margaritifera Linnaeus, 1758
- (en) Référence Animal Diversity Web : Margaritifera margaritifera (consulté le )
- (en) Référence Catalogue of Life : Margaritifera margaritifera (Linnaeus, 1758) (consulté le )
- (en) Référence Fauna Europaea : Margaritifera margaritifera (consulté le )
- (fr) Référence INPN : Margaritifera margaritifera (Linnaeus, 1758) (consulté le )
- (fr+en) Référence ITIS : Margaritifera margaritifera (Linnaeus, 1758) (consulté le )
- (en) Référence NCBI : Margaritifera margaritifera (taxons inclus) (consulté le )
- (en) Référence uBio : Margaritifera margaritifera Linnaeus, 1758 (consulté le )
- (en) Référence UICN : espèce Margaritifera margaritifera Linnaeus, 1758 (consulté le )
- (en) Référence World Register of Marine Species : espèce Margaritifera margaritifera (Linnaeus, 1758) (consulté le )
Notes et références autres que taxonomiques
- Clarke, Arthur H., 1981, Les Mollusques d'eau douce du Canada, Musée national des sciences naturelles
- (en) Lee C. Hastie, Philip J. Boon, Mark R. Young (2000) Physical microhabitat requirements of freshwater pearl mussels, Margaritifera margaritifera (L.) ; Hydrobiologia June 2000, Vol.429, n°1-3, pp 59-71 (résumé)
- Liste des espèces protégées en France, Directive Habitats-Faune-Flore : Annexe II,
Directive Habitats-Faune-Flore : Annexe V
Convention de Berne : Annexe III - Motte, G. (2006). Moule perlière Margaritifera margaritifera (Linnaeus, 1758) Mulette perlière. Cahiers « Natura 2000 », voir p 19/136.
- Description morphologique, Projet LIFE2002Nature/B/8590 : "Conservation des habitats de la Moule perlière" (archive consultée le 19 avril 2021).
- Bauer G (1992) Variation in the life span and size of the freshwater pearl mussel. J Anim Ecol 61:425–436
- Bauer G (1987) The parasite stage of the freshwater pearl mussel. II Susceptibility of brown trout. Arch. Hydrobiol. Suppl, 76 (4): 393-402
- (en) Geist, J., & Auerswald, K. (2007). Physicochemical stream bed characteristics and recruitment of the freshwater pearl mussel (Margaritifera margaritifera). Freshwater Biology, 52(12), 2299-2316
- (en) Hastie LC & Young MR (2001) Freshwater pearl mussel (Margaritifera margaritifera) glochidiosis in wild and farmed salmonid stocks in Scotland. Hydrobiologia, 445(1-3), 109-119 (résumé/extrait).
- (en) Duane W. Karna and Raymond E. Millemann (1978) Glochidiosis of Salmonid Fishes. III. Comparative Susceptibility to Natural Infection with Margaritifera margaritifera (L.) (Pelecypoda: Margaritanidae) and Associated Histopathology ; The Journal of Parasitology Vol. 64, No. 3 (Jun., 1978), p. 528-537 Published by: The American Society of Parasitologists Article Stable URL: https://www.jstor.org/stable/3279799
- Hastie, L. C., Boon, P. J., & Young, M. R. (2000). Physical microhabitat requirements of freshwater pearl mussels, Margaritifera margaritifera (L.). Hydrobiologia, 429(1-3), 59-71.
- (en) Young, M. R., Cosgrove, P. J., & Hastie, L. C. (2001). The extent of, and causes for, the decline of a highly threatened naiad: Margaritifera margaritifera. In Ecology and Evolution of the Freshwater Mussels Unionoida (p. 337-357). Springer Berlin Heidelberg (voir carte Page 2)
- (en) Reis, J. (2003). The freshwater pearl mussel [Margaritifera margaritifera (L.)](Bivalvia, Unionoida) rediscovered in Portugal and threats to its survival. Biological Conservation, 114(3), 447-452 (résumé).
- Nouvelles initiatives vertes pour la planète, Journal Sud Ouest, (lire en ligne).
- http://legemmologue.com/wp-content/uploads/2017/04/Marie_Chabrol_PL_3_2013.pdf
- Le Figaro n°13 du 26 mars 1862, consultable https://gallica.bnf.fr/ark:/12148/bpt6k272642m/f3.image.r=Mulette.langFR
- F. Perret, Perles et nacres, L'Ouest-Éclair n°7289 du 15 novembre 1921, consultable https://gallica.bnf.fr/ark:/12148/bpt6k583594x/f1.image.r=Mulette.langFR
- Lionel Bonnemaire (1843-1905), avocat collectionneur de bijoux et amulettes populaires
- François de Beaulieu, La mulette perlière, témoin menacé, revue "ArMen" n° 198, janvier-février 2014
- http://www.forgottenbooks.com/readbook_text/Les_Mollusques_des_Eaux_Douces_de_France_et_Leurs_Perles_1200192538/91
- Bauer G (1991). Plasticity in life history traits of the freshwater pearl mussel—consequences for the danger of extinction and for conservation measures. In Species conservation: a population-biological approach (p. 103-120). Birkhäuser Basel. (résumé)
- Araujo, R., & Ramos, M. A. (2000). Status and conservation of the giant European freshwater pearl mussel (Margaritifera auricularia)(Spengler, 1793)(Bivalvia: Unionoidea). Biological Conservation, 96(2), 233-239.
- (en) Moorkens, E. A. (1999). http://www.npws.ie/publications/archive/IWM8-1.pdf Conservation management of the freshwater pearl mussel Margaritifera margaritifera. Part 1: Biology of the species and its present situation in Ireland]. Irish Wildlife Manuals, 8, 4-31.
- (en) Beasley, C. R., Roberts, D., & Mackie, T. G. (1998). https://www.researchgate.net/publication/233741075_Does_the_freshwater_pearl_mussel_Margaritifera_margaritifera_L._face_extinction_in_Northern_Ireland/file/60b7d51e0a98ea849c.pdf Does the freshwater pearl mussel, Margaritifera margaritifera L., face extinction in Northern Ireland?] ; Aquatic Conservation: Marine and Freshwater Ecosystems, 8(2), 265-272.
- (en) Moorkens, E. A., & Costello, M. J. (1994). Imminent extinction of the Nore freshwater pearl mussel Margaritifera durrovensis Phillips: a species unique to Ireland. Aquatic Conservation: Marine and Freshwater Ecosystems, 4(4), 363-365.(résumé)
- Bauer G (1988) Threats to the freshwater pearl mussel Margaritifera margaritifera L. in Central Europe. Biological Conservation, 45: 239-253 (résumé)
- Paquet,A. et al. (2005). Les mulettes au Québec. Le Naturaliste Canadien. Vol. 129: p.82 (http://www.cdpnq.gouv.qc.ca/pdf/article-mulettes.pdf)
- (en) Volker Buddensiek (1995) The culture of juvenile freshwater pearl mussels Margaritifera margaritifera L. in cages: A contribution to conservation programmes and the knowledge of habitat requirements ; Biological Conservation Vol.74, n°1, Pages 33–40 (résumé)
- (en) Bouza C, Arias J, Castro J, Sanchez L, Martinez P (1999) Genetic structure of brown trout, Salmo trutta L. at the southern limit of the distribution range of the anadromous form. Mol Ecol 8:1991–2001
- http://www.life-moule-perliere.org/accueilmoule.php
- http://www.geosciences.univ-rennes1.fr/spip.php?article1188
- (en) Bouza, C., Castro, J., Martínez, P., Amaro, R., Fernández, C., Ondina, P., ... & San Miguel, E. (2007). Threatened freshwater pearl mussel Margaritifera margaritifera L. in NW Spain: low and very structured genetic variation in southern peripheral populations assessed using microsatellite markers. Conservation Genetics, 8(4), 937-948.
- « L'entreprise de l'écologie - Biotope, l'entreprise de l'écologie », sur Biotope, l'entreprise de l'écologie (consulté le ).
- Braspart, la moule perlière y est élevée
Liens externes
- Fiche espèce du Muséum national d'histoire naturelle (France), et carte de répartition française
- Carte de répartition française du réseau Natura 2000 donnant les lieux d'observation
- Fiche de LIFE-Ruisseaux donnant accès à des photos et clé de détermination ainsi que la carte européenne de protection
- Projet LIFE (Belgique) de sauvegarde de la moule perlière
- Projet LIFE (Luxembourg) de restauration de la moule perlière des Ardennes
- Projet LIFE + (France) de conservation de la moule perlière du Massif Armoricain
clé d’identification
Bibliographie
- Araujo, R. & Ramos, A. (2001). Action Plans for Maragaritifera auricularia and Maragaritifera margaritifera in Europe. Conseil de l'Europe, Nature and environnement, N°117, 66p
- Arey, L. B. (1932) The formation and structure of the glochidial cyst. Bull. Mar. Biol. Lab. Woods Hole 62: 212–221.
- Bauer, G. & Vogel, C. (1987) The parasite stage of the freshwater pearl mussel (Margaritifera margaritifera L.) I. Host response to glochidiosis. Arch. Hydrobiol. Suppl. 76 (4): 393-402.
- Bauer, G. (1987) Reproductive strategy of the freshwater pearl mussel. J. Anim. Ecol., 56 : 691-704.
- Bauer, G. (1987) The parasite stage of the freshwater pearl mussel (Margaritifera margaritifera L.) III. Host relationship. Arch. Hydrobiol. Suppl. 76 (4): 413-423.
- Bauer G. (1986) The status of the freshwater pearl mussel Margaritifera margaritifera L. in the south of its European range. Biological Conser6ation 38: 1–9.
- Bauer, G. (1988) Threats to the freshwater pearl mussel Margaritifera margaritifera L. in Central Europe. Biological Conservation, 45: 239-253 (http://www.sciencedirect.com/science/article/pii/0006320788900560 résumé]).
- Bauer, G., Hochwald, S. & Silkenat, W. (1991) Spatial distribution of freshwater mussels: the role of host fish and metabolic rate. Freshwater Biology, 26 : 377-386.
- Bloom, R.A. & Matheson, J.C. (1993). Environmental assessment of avermectins by the US Food and Drug administration. Veterinary Parasitology, 48 : 281-294.
- Birringer, D. & Truffner, U. (1990) Studie der Ourbeckens zwischen Ouren und Dasburg im Hinblick auf die Schaffung eines Naturschutzgebietes. Mém. Dipl. europ. Sc. Environ. F.U.L., Arlon, 189 p + ann.
- Bogan, A. E. (1993) Freshwater bivalve extinctions (Mollusca: Unionoida): a search for causes. American Zoologist, 33(6), 599-609 (résumé).
- Bouchet P (1990) La malacofaune française : endémisme, patrimoine naturel et protection. Revue d'écologie (La Terre et la Vie) , 45 : 259-288.
- Bouchet P. & H...ROS V (1981) Bibliographie des inventaires faunistiques de France, 1758-1980. Mollusques. Coll. Inventaire de faune et de flore, volume 14. Secrétariat de la faune et de la flore, Paris, 100 p.
- Buddensiek, V. (1995) The culture of juvenile freshwater pearl mussels Margaritifera margaritifera L. in cages. A contribution to conservation programs and the knowledge of habitat requirements. Biological Conservation, 74 : 33-40.
- Buddensiek, V., Engel, H., Fleichauer-Rössing, S. & Wächtler, K. (1993a) Studies on the chemistry of interstitial water taken from defined horizons in the fine sediments of bivalve habitats in several northern German lowland waters. II: Microhabitats in Margaritifera margaritifera l., Unio crassus (PHILLIPSSON) and Unio tumidus PHILLIPSSON. Archiv. Hydrobiol., 127 : 151-166.
- Chemin E (1926) Les mollusques d'eau douce. Encyclopédie pratique du naturaliste, Lechevalier, Paris, 185 p.
- Cochet G (1998) Le statut des Margaritiferidae en France (Mollusca : Bivalvia : Unionidae). Vertigo, 6: 27-31.
- Cochet G (1999) Inventaire des cours d'eau : Margaritifera margaritifera en France. Rapport inédit, ministère de l'Environnement, direction de l'eau, Paris, 175 p.
- Cochet G. (2000) Impact des aménagements des cours d'eau et des activités agrosylvicoles sur les populations françaises de Margaritifera margaritifera . Propositions pour une reconquête des cours d'eau par l'espèce. p. : 123-127. In Actes de l'atelier sur les corridors écologiques pour les invertébrés : stratégie de dispersion et de recolonisation dans le paysage agrosylvicole moderne, Neuchâtel (Suisse), 10-. Conseil de l'Europe, Strasbourg.
- Cochet G., (2001) Le statut de Margaritifera margaritifera en France (Mollusca : Bivalvia : Unionacea : Margaritiferidae). p. : 29- 34. In ROBERT J.C., GUILBOT R., DOMMANGET J.L. & MAURIN H (2001) Inventaire et cartographie des invertébrés comme contribution à la gestion des milieux naturels français. Actes du séminaire tenu à Besançon les 8, 9 et . Muséum national d'histoire naturelle (IEGB/SPN), OPIE, 324 p.
- Cochet G. & PARIS L. (1999) La Moule perlière ( Margaritifera margaritifera ) dans le Morvan. Coll. Cahiers scientifiques, 2 (sous presse). Parc naturel régional du Morvan, Saint-Brisson.
- Cochet G. (2000). Fiche espèce de Margaritifera margaritifera. In : J-C. Rameau, C. Gauberville, N. Drapier. Gestion forestière et diversité biologique. Identification et gestion intégrée des habitats et espèces d’intérêt communautaire.
- Collins M. & WELLS S.M. (1987) Invertébrés ayant besoin d'une protection spéciale en Europe. Coll. Sauvegarde de la nature, volume 35. Conseil de l'Europe, Strasbourg, 170 p.
- Dufrêne, M. (2002). Programme Life-Nature : Conservation of habitats of pearl mussels in Belgium. C.R.N.F.B.,106 p.
- Geist, J., & Auerswald, K. (2007). Physicochemical stream bed characteristics and recruitment of the freshwater pearl mussel (Margaritifera margaritifera). Freshwater Biology, 52(12), 2299-2316.
- Groh, K. (2000). Cahier espèce. Grand Duché du Luxembourg, Ministère de l’Environnement. 12p.
- Harsanyi, A. (1995) Die Flubperlmuschel : eine aussterbende Tierart. Jungtiere überleben in unseren Gewässern nicht. Fischer und Teichwirt, 10 : 370-372.
- Hruska, J. (1992) The freshwater pearl mussel in South Bohemia: Evaluation of the effect of temperature on reproduction, growth and age structure of the population. Archiv. Hydrobiol., 126 : 181-191.
- « La mulette perlière », La Hulotte, vol. 101, , p. 44.
- Jungbluth, J.H. (1993) Analyses concernant la détérioration des eaux courantes dans les bassins hydrologiques de la Rur et du système Schwalm/Perlenbach. Annexe au point 3b de la réunion du , 5 pp.
- Keith P., Guilbot R. & Cochet G., (1998) Mollusques, crustacés, arachnides et autres petits invertébrés des eaux douces. Ministère de l'Environnement, OPIE, SPN/MNHN, CSP, Paris, 48 p.
- Kinet, S. & Libois, R. (1999). Proposition pour la conservation des unionides (Mollusques bivalves) dans le bassin de l’Our. Rapport de convention « Inventaire de quatre espèces rares et menacées d’extinction dans le Parc Naturel Hautes-Fagnes Eifel et évaluation de la qualité de leurs habitats potentiels accompagnée de recommandations de gestion ». Deuxième partie, Région Wallonne – Université de Liège, 20p.
- Laudelout, A. & Libois, R. (2003). Rapport sur les espèces macro-indicatrices de la qualité des cours d’eau. Répartition, habitats, mesures de protection et de restauration des populations. Convention avec le MRW, DGRNE, DCNN, 139pp.
- Moog, O., Nesemann, H., Ofenbock, T. & Stundner, C. (1995) Die Situation der Flubperlmusschel Margaritifera margaritifera in Österreich. Artenschutzreport, 5 : 1-3.
- Moog, O., Nesemann, H., Ofenbock, T. & Stundner, C. (1998) The freshwater pearl mussel Margaritifera margaritifera (L.) in Austria: fundamental conservation measures for an endangered species. Verh. Internat. Verein. Limnol., 26 : 2438-2443.
- Moorkens, E.A., Valovirta, I. & Speight, M.C.D. (2000). Towards a margaritiferid water quality standart. Convention on the conservation of European wildlife and natural habitats. Council of Europe, T-PVS/invertebrates (2000) 2, 14p.
- Motte, G. (2006). Moule perlière Margaritifera margaritifera (Linnaeus, 1758) Mulette perlière. Cahiers « Natura 2000 », voir p 19/136.
- Quéré P (1996) Étude de l'évolution des populations de Margaritifera margaritifera L. en Bretagne : premiers résultats. Penn ar Bed , 162:39.
- Skinner, A., Young M. & Hastie, L. (2003). Ecology of the Freshwater Pearl Mussel. Conserving Natura 2000 Rivers Ecology Series No. 2 English Nature, Peterborough., 16p.
- Wächtler, K. (1986) Zur Biologie der Flubperlmuschel Margaritifrea margaritifera (L.). Naturwissenschaften, 73 : 225-233.
- Woodward F.R., (1995) Margaritifera margaritifera (Linnaeus, 1758). p. 501-510. In VAN HELSDINGEN P.J., WILLEMSE L. & SPEIGTH M.C.D., (1996) Background information on Invertebrates of the Habitats Directive and the Bern Convention. Part III - Mollusca and Echinodermata. Nature and environment, 81. Council of Europe, Strasbourg, 529 p
- Young, M.R (1991) Conserving the Freshwater Pearl Mussel (Margaritifera margaritifera L.) in the British Isles and Continental Europe. Aquatic conservation : marine and freshwater ecosystems, 1 : 73-77.
- Young, M.R. & Williams, J.C. (1984) The reproductive biology of the freshwater pearl mussel in Scotland, I. Field studies. Arch. Hydrobiol., 99 : 405-422.
- Young, M.R. & Williams, J.C. (1984) The reproductive biology of the freshwater pearl mussel in Scotland, I. Field studies. Arch. Hydrobiol., 99 : 405-422.
- Young Young, M. R., Cosgrove, P. J., & Hastie, L. C. (2001). The extent of, and causes for, the decline of a highly threatened naiad: Margaritifera margaritifera. In Ecology and Evolution of the Freshwater Mussels Unionoida (p. 337-357). Springer Berlin Heidelberg ([ résumé]).
- Young, M.R.& Willams, J.C. (1983) The status and conservation of the freshwater pearl mussel in Great Britain. Biological Conservation, 25 : 35-52
- Portail de la conservation de la nature
- Portail des mollusques et de la malacologie