Hétérotypie
L’hétérotypie, signifiant littéralement « forme différente » ou « changement de type »[1], est un terme relativement nouveau provenant de la discipline qu’est l’« évo-dévo », la biologie évolutive du développement.
Ne doit pas être confondu avec hétérotopie.
Il désigne la modification du type de structure à un endroit donné d'un organisme. Cette structure sera donc différente de celle retrouvée chez l’ancêtre commun[2]. Il s'agit de la modification de l'expression d'un gène ou de son patron d'expression : des mutations entrent en jeu au niveau de molécules régulatrices importantes qui ont pour rôle de contrôler la formation embryonnaire et la spécification des tissus[1]. Ces mutations vont provoquer des changements dans le développement, impliquant des modifications de formes durant l’évolution[1]. L’hétérotypie permet de créer de nouvelles structures ou fonctions aux structures pré-existantes. Elle peut aussi mener à la création de nouvelles protéines, ou encore de nouveaux types cellulaires.
Terminologie
Il existe des termes relativement proches de celui d’hétérotypie :
- la nouveauté morphologique désigne une nouvelle structure qui n’a pas d’homologie avec l’ancêtre commun. Ce terme est peu distingué de celui d’hétérotypie car il veut sensiblement dire la même chose[3].
- l'autapomorphie : un caractère autapomorphique est censé être un caractère dérivé unique à un taxon[4]. Une autapomorphie peut apparaître à partir des différents types de remodelage du patron de développement et ainsi produire un taxon.
Remodelage du patron de développement
L’hétérotypie est une des quatre formes de remodelage du patron de développement. Les trois autres sont l’hétérochronie, qui est un changement dans le timing de développement ; l’hétérotopie, qui est un changement dans la disposition spatiale du développement et l’hétérométrie qui représente une modification dans le nombre, la taille d’une structure, ou la quantité de quelque chose (lorsque l’on parle d’hormones ou de protéines par exemple). Différents types de remodelage peuvent intervenir en même temps, d’ailleurs l’hétérotypie est souvent associée à au moins une des trois autres formes de remodelage[2].
Hétérotypie non-évolutive
Il existe plusieurs exemples d’hétérotypie non-évolutive chez la drosophile (Drosophila melanogaster)[2]. En effet des mutations géniques ont été induites en laboratoire produisant des hétérotypies chez la drosophile. Ces mutations ont été produites en laboratoire et ne confèrent donc pas d’avantages évolutifs aux individus qui la portent, c’est même plutôt le contraire, expliquant leur caractère non-évolutif, car elles ne peuvent se propager dans la population.
Antennapedia

Les drosophiles mutantes sont produites à partir d’une mutation au niveau du gène Antennapedia (Antp). Ce gène fait partie de la famille des gènes homéotiques Hox qui sont responsables de l’identité segmentaire le long de l’axe antéro-postérieur des insectes[2],[5]. Finalement, cette mutation entraine l’apparition de segments à l’emplacement d’autres segments représentant aussi un exemple d’hétérotopie. En effet, des pattes poussent sur la tête, à la place des antennes de ces drosophiles. Il s’agit d’hétérotypie car il y a l’apparition d’un nouveau type de structure à un endroit donné[6].
Bithorax

Cette autre forme d’hétérotypie non-évolutive ayant été observée à nouveau sur le modèle de la drosophile, est due à une mutation sur le domaine Ultrabithorax (Ubx) appartenant au complexe de gènes bithorax avec le domaine infra-abdominal (ABD-A). L’ordre des Diptères chez les insectes ne possède qu’une paire d’ailes antérieures sur le mésothorax, alors que la paire postérieure sur le métathorax a été remplacée durant l’évolution par des haltères, ou balanciers, qui ont pour rôle de stabiliser leur vol. Avec cette mutation, la paire d’haltères et le métathorax qui la porte, sont remplacés par un deuxième mésothorax avec une paire d’ailes. La drosophile se retrouve donc avec deux paires d’ailes antérieures.
Hétérotypie évolutive
Il existe de nombreux exemples d’hétérotypie évolutive, car les individus créés sont apparus au cours de l’évolution et grâce au remodelage du patron de développement qu’ils ont subi, leur fitness a augmenté leur permettant de se répandre dans la population au cours du temps et de passer la barrière de la sélection naturelle.
Origine de nouvelles structures/fonctions
L'hétérotypie est, entre autres, la création de nouvelles structures ou fonctions au cours de l'évolution.
Des exemples chez les amphibiens
Chez les Anoures, un sous-ordre d’Amphibiens, la mâchoire inférieure ne possède pas de dents. Cependant, certains Néobatrachia (sous-ordre des Anoures) dont la famille des Ceratophryidae possèdent des odontoïdes, c’est-à-dire des éléments constitués de tissus dentaires formant dans le cas présent des crocs qui pointent vers le haut[7]. Ces crocs sont robustes et complètement ossifiés. Ils sont implantés dans la partie médiane de la mâchoire inférieure. Ils se fondent parmi les dents durant les premiers stades métamorphiques de ces amphibiens[7].
Chez d’autres membres du sous-ordre des Anoures, les odontoïdes sont une projection laminaire des dents, alors que dans le cas des Ceratophryidae, il s’agit de véritables ossifications positionnées de manière anormale (ectopique) au niveau de l’os de la mandibule. La présence de ces crocs au niveau de la mâchoire inférieure d’une famille particulière d’Amphibien est un bon exemple d’hétérotypie car la mandibule présente donc un nouveau type de structure, mais il s’agit aussi d’un exemple d’hétérotopie car on a un changement dans la disposition spatiale des crocs[7].
Il existe une autre hétérotypie unique parmi le sous-ordre des Anoures : une ossification dorsale transversale supplémentaire au sein de ce groupe d’Amphibiens[7].
Outre l’hétérotypie, ce sous-ordre d’amphibiens présente aussi des cas d’hétérotopie, d’hétérochronie et d’hétérométrie. Il y a donc eu de nombreux effets de l’évolution dans ce sous-ordre, ce qui fait de lui un bon modèle pour l’étude et la compréhension du remodelage des patrons de développement.
Ces amphibiens présentent des nouveautés morphologiques, c’est-à-dire des changements morphologiques qui permettent l’acquisition potentielle de nouvelles fonctions. Deux processus pourraient aider à comprendre ces nouveautés évolutives[8]. Le premier est un changement de rôle d’une structure préexistante, permettant la mise en lumière d’un nouveau pic adaptatif[8]. En d’autres termes, une structure existante va être utilisée pour d’autres fonctions afin de mieux s’adapter à l’environnement. Le second processus serait qu'une contrainte développementale vienne à s'adoucir ou disparaître, permettant à une nouvelle structure viable et unique de s’intégrer plus facilement physiquement et fonctionnellement parlant[8].
La grande diversité morphologique de la famille d’amphibiens Ceratophyridae est expliquée par ces deux processus, qui ont eu lieu durant l’évolution de la famille.
Exemple chez les crustacés
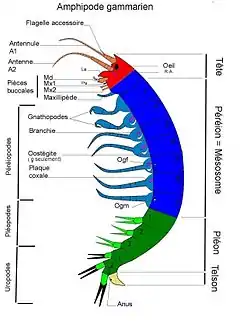
Les crustacés possèdent des maxillipèdes, qui sont des pièces buccales provenant, pour certaines lignées, de la transformation des appendices thoraciques les plus antérieurs. Cette modification trouverait son origine dans un changement au niveau de l’expression du complexe de gènes Bithorax. L’absence des gènes Ubx et ABD-A dans les segments antérieurs de certains Malacostraca serait corrélée avec l’apparition des maxillipèdes chez l’adulte[9].
Mais il existe un autre gène qui entre en jeu dans cette transformation. Le gène « Sex combs reduced » (Scr) qui intervient chez la drosophile, au niveau des segments de la tête[10]. Il intervient dans le même type de fonction chez les autres insectes[11] mais dans le cas du cloporte rugueux (Porcellio scaber), ce gène joue un rôle dans l’apparition des maxillipèdes[12]. En effet, l’apparition et l’accumulation de protéines provenant de la traduction de l’ARN messager du gène Scr transcrit, est corrélée avec la transformation des premières pattes thoraciques en maxillipèdes chez le cloporte[12]. Cela suggère un nouveau mécanisme de régulation du processus de transformation homéotique de la patte au maxillipède[9].
Encore une fois, il s’agit d’un bel exemple d’hétérotypie, puisqu’une structure s’est transformée en une autre au cours de l’évolution du sous-embranchement des Crustacés, offrant une nouvelle forme et une nouvelle fonction à un segment préexistant.
Le gène Scr chez les insectes et les crustacés
Les gènes « Sex combs reduced » (Scr) et les gènes Antennapedia et Ultrabithorax dont nous avons parlé précédemment sont des gènes homéotiques. Ce type de gènes contrôle la diversité de développement des segments chez les insectes. Cependant, le lieu d’action de ces gènes n’est pas toujours le même en fonction des espèces d’insectes[5]. Le gène Scr intervient dans la spécification des segments de la tête chez les insectes[5]. Cependant, ce gène a acquis une nouvelle fonction dans le sous-embranchement des crustacés. Le gène Scr intervient dans la formation d’une nouvelle pièce buccale, le maxillipède comme il est expliqué dans l’exemple précédent[12].
Donc ce gène présente un changement évolutif au sein de l’embranchement des arthropodes puisqu’il ne permet pas le développement du même type de structure chez les insectes et les crustacés.
Remodelage du patron de développement chez les vertébrés

Dans l’histoire de l’évolution des vertébrés, il y avait déjà une séparation entre les reptiles et les mammifères mais certains reptiles étaient encore proches de ces derniers. Il y a 200 millions d’années environ il y a eu une diversification de ces reptiles, les Morganucodontides[13].
Cette diversification fut accompagnée d’une transition entre les reptiles de l’époque et les mammifères à partir des os de la mâchoire vers les os de l’oreille. En effet les reptiles qui existent actuellement et probablement les anciens aussi, ne possèdent qu’un petit os dans l’oreille : l’étrier, contrairement aux mammifères qui en possèdent trois : l’étrier, le marteau et l’enclume[13]. Cela provient de la diversification des os de la mâchoire. Les os de la mâchoire des reptiles possèdent une disposition différente par rapport à celle des mammifères. La mâchoire inférieure des reptiles est composée de deux os : l’os articulaire et l’os dentaire, alors que la mâchoire supérieure est composée d’un os que l’on appelle le carré. La mâchoire inférieure et supérieure s’articulant ensemble. Les mammifères quant à eux, possèdent la mandibule et la maxille qui sont respectivement la mâchoire inférieure et supérieure. Ces deux os ne sont pas articulés ensemble mais requièrent la présence du temporal qui est un os crânien[13].
Il existe de nombreux « mammifères – reptiles » et mammifères connus qui sont à différents stades de la transition. Mais entre les reptiles et les mammifères, c’est le Morganucodon, aujourd’hui disparu, qui fait la jonction (vidéo en anglais expliquant le lien entre les reptiles, les mammifères et Morganucodon. Cette espèce avait une double articulation au niveau de la mâchoire, une ressemblant à celle des mammifères avec le début d’une jointure entre les os principaux de la mâchoire inférieure et supérieure ; et une ressemblant à celle des reptiles avec une jointure entre l’articulaire et le carré[13]. Finalement, au cours de l’évolution, l’articulaire et le carré ont perdu leur rôle. En effet il existait deux structures qui jouaient le même rôle puisqu’il y avait une double articulation. De ce fait, une des articulations était en trop, ce fut celle plus « reptilienne ». L’articulaire et le carré se sont donc séparés des os de la mâchoire, ont migré vers l’oreille pour résulter en, respectivement, le marteau et l’enclume (ou incus), les deux autres osselets de l’oreille des mammifères[13]. À la place de ne pas être utile au niveau de la mâchoire, c'est os ont développé un rôle nouveau pour l'audition.
Finalement, il n'y a pas eu que de l'hétérotypie avec la création de nouvelles structures à partir des os de la mâchoire en allant vers les os de l'oreille. C'est aussi un exemple d'hétérométrie car il y a eu diminution de la taille des os et d'hétérotopie car les os ont changé d'emplacement.
Origine de nouveaux types cellulaires
L’embranchement des Cnidaires est le seul à posséder une cellule urticante sécrétrice de « poison » appelée nématocyste[14]. Ils s’en servent pour capturer leurs proies. C’est un changement qui repose sur de l’hétérotypie, car un type cellulaire est finalement devenu un autre type cellulaire avec une nouvelle fonction. Le nématocyste est constitué de protéines appelées les minicollagènes[14]. Avec l’évolution, des nématocystes de plus en plus complexes se sont développés au sein de l’embranchement des Cnidaires. Les différentes classes, allant des Anthozoa aux Medusozoa ne possèdent plus forcément le même type de nématocystes, malgré le fait que chaque espèce en possèdent plusieurs types différents[14]. Plus les cellules urticantes deviennent complexes, plus le nombre et la complexité des protéines minicollagènes augmente aussi par duplication des gènes et diversification des séquences. Une trentaine sont aujourd’hui répertoriés[14]. Des types de nématocystes différents ont évolué dans la classe des Medusozoa lors de leur changement de mode de vie, de sessile à pélagique. Cependant, l’origine de ces cellules reste une question en suspens[14]. Proviennent-ils uniquement des Cnidaires ? Dans ce cas leur complexité aurait augmenté très rapidement durant leur évolution. Sont-ils hérités d’un ancêtre ? Ils proviendraient alors des premiers animaux multicellulaires ? Il existe de nombreuses hypothèses mais pour l’instant il n’y a aucune certitude[14].
Comment le concept de remodelage du patron de développement peut s’intégrer à l’évolution ?
Selon les néo-darwinnistes, les mutations permettent l’apparition de variations de manière totalement aléatoire et donc de manière impartiale. La sélection est donc la seule responsable de la direction que prend le changement évolutif[15]. En effet, toutes les mutations n’aboutissent pas à des individus viables et/ou à une augmentation du fitness permettant à ceux-ci de se reproduire et donc de transmettre ces mutations dans la population. La sélection intervient, faisant disparaitre un grand nombre de mutations.
Selon les externalistes, seul l’environnement est responsable de l’apparition de mutations et donc de variations chez les organismes[15].
Cependant, la directionnalité de l’évolution peut aussi provenir du remodelage du patron de développement[16]. Elle provient du remodelage mais n’est pas un remodelage ou une contrainte, c’est important de le préciser (pourtant le remodelage peut aller dans certaines directions tout en entrainant des contraintes). La directionnalité provient aussi de la sélection car elle découle d’effets positifs favorisant le changement ou négatifs. La sélection naturelle produit ces deux types d’effets[15].
L’environnement est une teneur importante de la sélection, mais il y a d’autres facteurs, comme le remodelage, qui entrent en jeu.
Par exemple, pour l’hétérotypie, dans le cas des osselets chez les mammifères, si nous partons de Morganucodon, il possédait des jointures doubles, l’une d’elles s’est différentiée en autre chose car il était inutile d’avoir deux fois la même structure. Cela a permis la diversification de ce type de structure chez les espèces qui sont apparues postérieurement. Ce changement évolutif a passé l’obstacle de la sélection naturelle puisqu’actuellement les mammifères dont l’humain, possèdent toujours les trois osselets dans l’oreille qui trouvent leur origine dans la mâchoire reptilienne. Il y a donc eu sélection, mais rien n’indique que l’environnement a joué un rôle dans cette modification évolutive. Il s’agit d’un facteur de l’évolution.
Notes et références
- (en) Robert Hine, A Dictionary of Biology, Oxford, Oxford University press, , 736 p., p. 283
- (en) M. Webster et L. M. Zelditch, « Evolutionary Modifications of Ontogeny: Heterochrony and beyond », Paleobiology, vol. 31, no 3, , p. 354-372
- (en) G.B. Müller et G.P. Wagner, « Novelty in evolution: restructuring the concept. », Annual Review of Ecology and Systematics, vol. 22, , p. 229–56
- (en) L. Grande et O. Rieppel, Interpreting the hierarchy of nature. From systematic patterns to evolutionary process theory., San Diego, Academic Press,
- (en) M. Akam, I. Dawson et G. Tear, « Homeotic genes and the control of segment diversity », Development, vol. 104, , p. 123 - 133
- Vidéo en anglais expliquant la mutation
- (en) M. Fabrezi, S. I. Quinzio, J. Goldberg, J. C. Cruz, Chuliver Pereyra, M. et Wassersug, R. J., « Developmental changes and novelties in ceratophryid frogs », EvoDevo, vol. 7, no 5, , p. 1-16 (lire en ligne)
- (en) B. Hallgrímsson, H.A. Jamniczky, N.M. Young, C. Rolian, U. Schmidt-Ott et R.S. Marcucio, « The generation of variation and developmental basis for evolutionary novelty. », Journal of experimental zoology, vol. 318, , p. 501–517
- (en) M. Averof et N.H. Patel, « Crustacean appendage evolution associated with changes in Hox gene expression. », Nature, vol. 388, , p. 607-698
- (en) T.C. Kaufman, M. A. Seeger et G. Olsen, « Molecular and genetic organization of the Antennapedia gene complex of Drosophila melanogaster. », Advances in genetics, vol. 27, , p. 309-362
- (en) B. T. Rogers et T. C. Kaufman, « Structure of the insect head in ontogeny and phylogeny: a view from Drosophila. », International revue of cytology, vol. 174, , p. 1-84
- (en) A. Abzhanov et T. C. Kaufman, « Novel regulation of the homeotic gene Scr associated with a crustacean leg-to-maxilliped appendage transformation. », Development, vol. 126, , p. 1121-1128
- (en) Arthur Wallace, Evolution : a developmental approach, Hoboken, New Jersey, John Wiley & Sons, , 416 p. (lire en ligne)
- (en) C. N. David, S. Özbek, P. Adamczyk, S. Meier, B. Pauly, J. Chapman, J. S. Hwang, T. Gojobori et T. Holstein, « Evolution of complex structures : minicollagens shape the cnidarian nematocyst. », Trends in genetics, vol. 24, no 9, , p. 431-438
- (en) W. Arthur, « The concept of developmental reprogramming and the quest for an inclusive theory of evolutionary mechanisms. », Evolution and development, vol. 2, no 1, , p. 49-57
- (en) G. Roth et D. B. Wake, « Trends in the functional morphology and sensorimotor control of feeding behavior in salamanders: an example of the role of internal dynamics in evolution. », Acta Biotheoretica, vol. 34, , p. 175-192
Articles connexes
- Biologie évolutive du développement
- Remodelage du patron de développement
- Hétérochronie
- Hétérotopie
- Hétérométrie
- Portail de la biologie cellulaire et moléculaire
- Portail origine et évolution du vivant