Barrière hémato-encéphalique
La barrière hémato-encéphalique, ou hémo-encéphalique, ou hémato-méningée est une barrière physiologique présente dans le cerveau chez tous les tétrapodes (vertébrés terrestres), entre la circulation sanguine et le système nerveux central (SNC). Elle sert à réguler le milieu (homéostasie) dans le cerveau, en le séparant du sang. Les cellules endothéliales, qui sont reliées entre elles par des jonctions serrées et qui tapissent les capillaires du côté du flux sanguin, sont les composants essentiels de cette barrière.
Pour les articles homonymes, voir BHE.
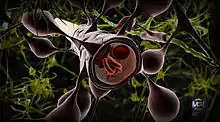
La barrière hémato-encéphalique protège le cerveau des agents pathogènes, des toxines et des hormones circulant dans le sang. Elle représente un filtre extrêmement sélectif, à travers lequel les nutriments nécessaires au cerveau sont transmis, et les déchets sont éliminés. Ce processus d'alimentation et d'élimination est produit par toute une série de mécanismes de transport actif.
Cette fonction de protection du cerveau complique le traitement médicamenteux d'un grand nombre de maladies neurologiques, car de nombreuses molécules actives ne peuvent pas traverser la barrière hémato-encéphalique. La recherche sur la manière de surmonter la barrière hémato-encéphalique est tout à fait actuelle. Bien peu de maladies – rares en plus – sont spécifiques de la barrière hémato-encéphalique, tandis qu'elle peut être atteinte par de nombreuses maladies générales. Une atteinte, ou une lésion, de la barrière hémato-encéphalique est une complication à prendre très au sérieux.
Les premières expériences, qui ont indiqué l'existence de cette barrière ont été conduites par Paul Ehrlich en 1885. Mais il a mal interprété les résultats de ses expériences. La preuve définitive de l'existence de la barrière n'a été donnée qu'en 1967 par des recherches en microscopie électronique en transmission.
Fonctions de la barrière hémato-encéphalique

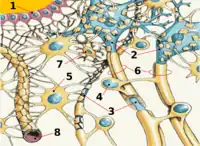
Chez l'humain, le cerveau représente environ 2 % de la masse corporelle. Mais ses besoins en énergie sont environ de 20 % du total. Contrairement aux autres organes du corps, le cerveau dispose de très peu de réserves en nutriments et en oxygène. Et les cellules nerveuses ne sont pas capables de satisfaire leurs besoins en énergie de manière anaérobie, c'est-à-dire sans aucun apport d'oxygène élémentaire. C'est ainsi qu'une interruption de l’apport de sang au cerveau amène au bout de 10 s une syncope (perte de connaissance), et quelques minutes après, les cellules nerveuses commencent à mourir[1]. Selon l’activité de chaque domaine du cerveau, ses besoins en énergie et ses réserves peuvent être très différents. Pour ajuster les apports aux besoins, chaque domaine est en mesure de régler par lui-même les apports sanguins qui lui sont nécessaires[1].
Les fonctions complexes du cerveau sont liées à des processus électrochimiques et biochimiques très sensibles, qui ne peuvent se dérouler que dans un milieu interne homéostatique largement débarrassé de toutes perturbations. Par exemple, les oscillations du pH du sang (une mesure du caractère basique ou acide) ne doivent pas se répercuter sur le cerveau. Les variations de la concentration en potassium changeraient le potentiel de la membrane des cellules nerveuses. Les neurotransmetteurs emportés par le sang dans les vaisseaux ne doivent pas pénétrer dans le système nerveux central, car ils y perturberaient sérieusement le fonctionnement des synapses qui s'y trouvent. En plus, les neurones ne sont pas capables de se régénérer en cas de dommage dû à une variation du milieu[1]. Enfin, le cerveau, organe de commande central, doit être protégé de l’influence de matières étrangères au corps, telles que par exemple des xénobiotiques, ou des agents pathogènes. L'imperméabilité considérable de la barrière hémato-encéphalique à l'égard des agents pathogènes, des anticorps et des leucocytes en fait une « barrière immunologique »[2],[3].
Par ailleurs, en raison des besoins très importants en énergie du cerveau – par comparaison avec d'autres organes – des quantités de déchets biochimiques très importantes doivent être éliminées à travers la barrière hémato-encéphalique[4].
Pour accomplir toutes ces fonctions (alimentation, élimination et homéostasie), le circuit des vaisseaux sanguins cérébraux des vertébrés présente, par comparaison avec les vaisseaux périphériques, toute une série de différences structurelles et fonctionnelles. Cette différenciation exerce une très large séparation du cerveau de l'espace extracellulaire environnant, et est une condition essentielle pour la protection du tissu neuronal sensible, et pour l'obtention d'un milieu interne stable[1].
Les changements du fonctionnement de la barrière hémato-encéphalique provoquent des altérations du système nerveux central, et peuvent en provoquer des troubles fonctionnels ou des maladies[4]. Par suite, une série de maladies neurologiques est reliée plus ou moins directement à la barrière hémato-encéphalique.
Anatomie de la barrière hémato-encéphalique

L'élément essentiel de la barrière hémato-encéphalique est constitué par les cellules endothéliales avec leurs jonctions serrées. Mais deux autres types de cellules sont également importants, tant du point de vue de la fonction que celui de la naissance et de la croissance de la barrière hémato-encéphalique : les péricytes et les astrocytes[5]. Les interactions entre cellules endothéliales, péricytes et astrocytes sont plus étroites qu'entre tous autres types de cellules. Ces trois types de cellules forment ensemble la barrière hémato-encéphalique de la plupart des vertébrés, la barrière hémato-encéphalique cellulaire[6],[7]. Il existe dans le règne animal d'autres types de barrière hémato-encéphalique, qui sont abordés dans l'article détaillé.
Endothélium
Les capillaires sont tapissés – comme les vaisseaux périphériques – de cellules endothéliales. Dans le cerveau, celles-ci ont une structure particulièrement étanche[8]. le nombre des mitochondries est environ de 5 à 10 fois plus élevé que dans les capillaires périphériques, en raison de l'énergie nécessitée pour exercer un transport actif des nutriments nécessaires à travers les cellules[9]. Les cellules endothéliales présentent sur leurs membranes une quantité d'aquaporines, canaux spécialisés pour le passage de l’eau, pour la régulation de la quantité d'eau au sein du cerveau.
L'étanchéité de la barrière peut être quantifiée par sa résistance électrique. Chez un rat adulte, la résistance monte à environ 2 000 Ω cm2. Dans les capillaires musculaires, elle n'est que d'environ 30 Ω cm2[10].
Jonctions serrées

Les cellules endothéliales sont liées ensemble par de solides liaisons, appelées jonctions serrées, qui rendent imperméable l'espace entre cellules. Plusieurs types de protéines membranaires les ceinturent afin d'assurer l'étanchéité.
Lame basale
Les cellules épithéliales sont entourées par une couche protéique, la lame basale[11] épaisse de 40 à 50 nm, donc visible seulement au microscope électronique.
Péricytes
Les péricytes sont de petites cellules ovales, qui couvrent en tout 20 % de la surface externe des capillaires, solidement amarrées aux cellules endothéliales. Elles jouent trois rôles principaux :
- Un rôle moteur permis par leur haut contenu en actine, et qui module la section du capillaire en fonction des besoins.
- Un rôle de macrophage, qui leur permet d'intervenir en seconde ligne de défense contre les agressions venant de la circulation sanguine.
- Un rôle de régulateur des divisions cellulaires et de la différenciation cellulaire des cellules endothéliales. Ils jouent notamment un rôle important lors de la formation de nouveaux vaisseaux (angiogenèse)[12].
Astrocytes
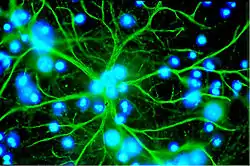
Les astrocytes sont des cellules en étoile, significativement plus grandes que les péricytes. Ils couvrent les capillaires du cerveau à 99 % avec leurs pieds enchevêtrés en rosettes. L'interaction immédiate (20 nm) entre cellules endothéliales et astrocytes induit dans les deux sens les spécificités anatomiques[13],[14].
Leurs fonctions principales sont :
- une modulation rapide de la perméabilité des cellules endothéliales,
- l'alimentation des neurones,
- la régulation du milieu extracellulaire,
- la synthèse du cholestérol, qui ne peut pas traverser la barrière hémato-encéphalique, pour la myéline des gaines des axones neuronaux[15]
Domaines du cerveau sans barrière hémato-encéphalique
Tous les capillaires du cerveau ne font pas partie de la barrière hémato-encéphalique : les parties du cerveau qui sécrètent des hormones et celles qui ont une fonction sensorielle sur la composition du sang doivent rester en communication avec la circulation sanguine.
On dénombre six organes circumventriculaires partiellement démunis de barrière hémato-encéphalique[16],[17]. Il s'agit de l'organe subfornical (en), l'organe vasculaire de la lame terminale, la neurohypophyse, la glande pinéale (ou épiphyse), l'organe subcommissural et l'area postrema. Ces régions sont entourées de tanycytes, analogues aux épendymocytes qui séparent le cerveau du liquide cérébrospinal remplissant l'épendyme, mais avec des jonctions serrées très étanches.
Autres informations
On consultera avec profit l'article détaillé pour des informations sur :
- Les données générales et statistiques sur la barrière hémato-encéphalique
- Les phases du développement de la barrière chez le fœtus et le nouveau-né
- Des perspectives sur l'évolution de la barrière chez les vertébrés supérieurs, et les paradoxes qu'elle présente.
Barrière sang - liquide cérébrospinal
Outre la barrière hémato-encéphalique, il existe une deuxième barrière entre la circulation sanguine et le système nerveux central : la barrière sang-LCS. Cette barrière est formée par les cellules épithéliales et les jonctions serrées des plexus choroïdes[18],[19]. La barrière sang-LCS a aussi une part de l'homéostasie du cerveau. Elle l'approvisionne en vitamines, en nucléotides et en glucose. La contribution au transport de matières vers le cerveau est en fin de compte assez faible, et totalement insuffisante pour couvrir les besoins du cerveau en nutriments et oxygène. La surface d'échange que forment les capillaires intracérébraux de la barrière hémato-encéphalique représente 5 000 fois celle des plexus choroïdes.
Outre ces deux barrières, si importantes pour le système nerveux central, on trouve dans le corps d'autres barrières ultrasélectives analogues, qui contrôlent l'échange de matières avec le sang. Parmi d'autres, ce sont :
- la barrière système nerveux central-liquide cérébrospinal, assurée principalement par les épendymocytes et autres cellules des plexus choroïdes. Les astrocytes assurent la communication entre les deux barrières par différents types de pieds ;
- la barrière sang-placenta ;
- la barrière entre le sang et les tubes séminifères, assurée par des jonctions serrées entre cellules de Sertoli ;
- la barrière entre sang et urine, assurée par à la fois par une limitation en taille des molécules pouvant traverser, et par une charge électrique négative des membranes, repoussant les protéines du sang ;
- la barrière entre sang et thymus, destinée à protéger les lymphocytes-T de tout contact avec des antigènes pendant leur maturation. Elle est effectuée par une succession de cinq couches différentes de cellules dans la paroi des capillaires
- la barrière des poumons : sang et air ne sont séparés que par deux couches de cellules, l'endothélium des capillaires et l'épithélium des poumons, partageant la même lame basale.
Processus de transport à la barrière hémato-encéphalique
La barrière hémato-encéphalique doit assurer, malgré son étanchéité, le transport de nutriments et d'oxygène vers le cerveau, et éliminer les déchets.
- Transport paracellulaire
Pour éviter toute fuite incontrôlée, les cellules endothéliales sont liées par des jonctions serrées étanches. Seules de toutes petites molécules peuvent passer à travers les jonctions serrées : eau, glycérine ou urée[20].
- Diffusion libre
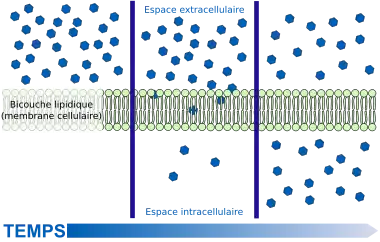
La forme la plus simple est la diffusion libre ou passive, qui tend à établir un équilibre de concentration ou de potentiel chimique des substances. Elle ne requiert aucune énergie. Le débit est proportionnel à la différence de potentiel et n'est pas contrôlable[21].
Les petites molécules peuvent franchir la membrane par des trous correspondant à des déformations locales des chaînes de phospholipides constituant la membrane. Les trous sont mobiles, et peuvent donc accompagner la molécule dans son trajet à travers la membrane[22]. Encore faut-il que la molécule en question ait une affinité raisonnable pour les lipides. Ce processus ne concerne donc essentiellement que les petites molécules lipophiles (hydrophobes).
- Passage par canaux

Les petites molécules polaires, comme l'eau, ne peuvent pratiquement pas diffuser à travers les membranes par le processus décrit. On trouve dans la membrane cellulaire un grand nombre de protéines qui jouent le rôle de canaux spécialisés pour le passage de l'eau : les aquaporines. Elles offrent une grande perméabilité à l'eau, dans les deux sens selon la différence de pression osmotique[23]. Il existe de nombreux autres types de canaux, plus ou moins spécialisés, qui peuvent être ouverts ou fermés sous l'influence d'agents physiques. Mais tous ces canaux partagent la propriété de passivité : quand ils sont ouverts, ils laissent passer les molécules appropriées dans le sens de l'équilibre des concentrations.
- Diffusion facilitée
Des molécules vitales comme le glucose et certains acides aminés ne peuvent pas passer par des canaux. Il existe alors des transporteurs membranaires adaptés aux diverses molécules nécessaires. Les protéines membranaires de transport peuvent fonctionner comme uniport (une molécule à la fois), comme symport (deux molécules ou plus dans le même sens) ou comme antiport (deux molécules ou plus en sens contraires)[24].
- Transport actif
Les transports décrits ci-dessus ne nécessitent de la part de la cellule aucune contribution énergétique. Mais il existe des substances qui doivent être transportées contre le gradient de concentration. Ceci nécessite alors une consommation d'énergie pour actionner des systèmes de transport actif ou « pompes ». Le transport du sang vers le cerveau est nommé « influx », et en sens inverse « efflux ». Certains de ces mécanismes sont très spécifiques, et identifient les molécules par leur forme, et distinguent donc les formes énantiomères gauche et droite. Par exemple, la D-asparagine est un ingrédient nécessaire pour la formation de certaines hormones. Elle bénéficie donc d'un transporteur actif d'influx. Par contre, la L-asparagine est un acide aminé stimulant dont l’accumulation dans le cerveau serait délétère. Elle est donc éliminée par un transport actif d'efflux.
Les transporteurs actifs d'efflux sont souvent peu spécifiques, leur rôle étant d'éliminer des déchets de nature parfois imprévisible.
Tous les types de transport pour tous les substrats n'ont pas encore été clairement identifiés.
- Transport vésiculaire
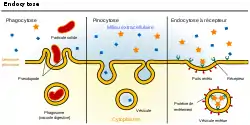
Les grosses molécules, ou même agrégats, qui ne peuvent pas utiliser de protéine membranaire de transport sont incorporées dans la cellule endothéliale par endocytose : la membrane plasmique se déforme en puits autour de l'objet à incorporer, puis la margelle du puits se soude, et la membrane recouvre son intégrité, tandis que l'objet est enfermé dans une vésicule. La vésicule peut traverser la cellule et s'ouvrir sur la face opposée par un mécanisme inverse, et libérer son contenu, c'est la transcytose.
- Transcytose à récepteurs
- S'il y a au puits de la membrane, des récepteurs qui se lient spécifiquement à la molécule visée, la vésicule est marquée, transportée et vidée. C'est le cas pour de grosses molécules comme la Lipoprotéine de basse densité (LDL), ingrédient de fabrication du cholestérol[25], l'insuline[26], et d'autres hormones peptidiques.
- Transcytose par adsorption
- Dans ce cas, la sélection se fait par la charge : le puits absorbe les molécules positivement chargées (les cations), d'où l'autre dénomination de « transport cationique ». Elle permet un plus grand débit que la transcytose à récepteurs.
- Principaux transporteurs
On consultera à ce sujet la table des principaux transporteurs.
Mesure et représentation de la perméabilité de la barrière hémato-encéphalique
Comme il est indiqué dans la section précédente, les processus de transport de substrats à travers la barrière hémato-encéphalique sont très variés, tant dans la nature du ou des substrats à transporter que dans le sens même où s'effectue le transport. Or il est essentiel pour la médecine et la pharmacie de savoir comment faire pénétrer dans le cerveau des médicaments (psychotropes) ou comment empêcher des toxiques, par exemple destinés à d'autres organes, d'y pénétrer[27].
La manière la plus classique est de procéder à des essais in vivo, sur l’animal, puis sur l'homme (« essais cliniques »), mais on peut recourir de façon plus aisée à des essais in vitro, voire à des simulations in silico[28].
Bases physiques
Un modèle simplifié, basé sur un seul capillaire a été mis au point par Renkin (1959) et Crone (1965)[29]. Le résultat s'exprime comme le « produit perméabilité-surface PS » de l’échantillon de capillaire. Il détermine la fraction E extraite en un passage d'une quantité de sang Q :
- [30].
Pour E < 0,2, la perméabilité est le facteur limitant, autrement elle est modérée ou grande.
Procédés in vitro
Le procédé le plus simple et le plus réaliste est l'utilisation de vaisseaux isolés, qui restent vivants pour un certain temps[31].
Avec des lignées de cellules endothéliales immortalisées, cultivées en couches simples, on peut faire des essais quantitatifs[32]. La qualité de ces couches, celle des jonctions serrées, se mesure par leur résistance électrique, qui doit être aussi élevée que possible. Dans l'organisme vivant, elle peut être de l’ordre de 2 000 Ω cm2. Dans une culture mixte d'astrocytes et de cellules épithéliales[33], elle peut monter à 800 Ω cm2.
Procédés in vivo
Le premier procédé a été l'injection de colorants suivie de l'examen anatomique de l'animal. Le colorant franchissant la barrière hémato-encéphalique laisse une trace tenace. Ceci permet d'étudier des lésions volontaires de la barrière[34].
Les procédés in vivo sont irremplaçables pour leur sensibilité aux conditions physiologiques, le temps pendant lequel on peut les laisser agir et le nombre de passages du sang à travers le réseau capillaire.
- Indice d'absorption cérébrale
Le rapport entre les taux d'absorption d'une substance à tester et une substance facilement absorbée, toutes deux marquées radioactivement donne l'indice d'absorption cérébrale (Brain Uptake Index ou BUI). Cette méthode ne s'applique qu'à des substances rapidement absorbées. Voir la table pour quelques substances courantes.
- Indice d'efflux cérébral
Il est également intéressant de connaître pour chaque substrat les propriétés d'efflux de la barrière hémato-encéphalique. On compare le substrat testé à une matière de référence, peu capable de sortir de la barrière, toutes deux marquées radioactivement. Elles sont microinjectées directement dans le cerveau. L'indice d'efflux cérébral (Brain Efflux Index ou BEI) se calcule en fonction de ce qui reste de chacune des matières par rapport à ce qui a été injecté[35].
- Perfusion cérébrale
Dans la méthode de perfusion, le substrat marqué est longuement perfusé dans la carotide. Puis l'animal est sacrifié et la radioactivité du cerveau mesurée. Délicate, elle est réservée à des cas de BEI très faibles.
Il est intéressant de séparer les capillaires par centrifugation avant la mesure, afin d'éliminer tout le substrat qui lui est encore lié[36].
- Technique de diffusion d'indicateur
Dans cette technique, la substance de référence doit être incapable de traverser la barrière hémato-encéphalique. Le substrat à tester et la référence ne sont pas marqués radioactivement. Ils sont infusés dans la carotide, et dosés dans le sang de retour (veine jugulaire interne). Le dosage des matières permet le calcul de la quantité de substrat absorbée. Cette technique par différence ne convient donc que pour des substrats franchissant facilement la barrière[37].
- Autoradiographie quantitative
Voir dans le Wikilivre sur la photographie, les articles spécialisés sur l'autoradiographie et la fluorographie.
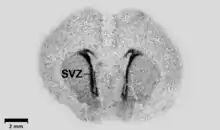
La figure ci-contre présente une autoradiographie d'un cerveau d'embryon de rat. Les domaines radioactifs sont foncés (zone subventriculaire SVZ). Le trait noir donne l'échelle de 2 mm.
Cette technique consiste en injection intraveineuse de substance marquée au carbone 14. Les organes sont disséqués, tranchés au microtome et déposés sur du film à rayons X. Connaissant la quantité de marqueur, on peut en déduire le produit perméabilité-surface de l’échantillon[29].
- Microdialyse intracérébrale
On implante dans le tissu nerveux une membrane hémiperméable. Par un microcathéter, on perfuse des substances, et/ou recueille le liquide interstitiel, éventuellement en continu[38].
En médecine humaine, la microdialyse intracérébrale est utilisée pour le monitoring neurochimique en cas d'accident vasculaire cérébral.
- Procédés d'imagerie
L'activité de la barrière hémato-encéphalique, le débit des capillaires, sont liés à l'activité du tissu nerveux qu'ils alimentent. On a donc une interaction entre ces trois grandeurs, qui peuvent varier substantiellement à l’échelle globale du cerveau. Ceci mène à dresser de façon non invasive des images globales du cerveau, essentiellement par trois méthodes qui se complètent : la tomographie par émission de positons (TEP), l'imagerie par résonance magnétique (IRM) et la spectroscopie par résonance magnétique (SRM).
- La tomographie par émission de positons
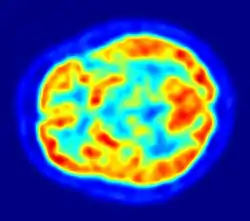
- La méthode repose sur des molécules marquées par un émetteur bêta+ : carbone 11 ou fluor 18. Le positon émis s'arrête dans la matière dense, et s'annihile avec un électron, donnant une paire de rayons gamma opposés. Le point de désintégration se situe donc sur la ligne joignant les points de détection des gammas. On peut ainsi, avec assez de désintégrations, reconstituer par le calcul la densité des molécules marquées.
- En raison de la courte demi-vie des émetteurs bêta+, cette méthode ne peut être utilisée qu'auprès de centres dotés de cyclotrons capables de fabriquer ces nucléides, et de laboratoires en mesure de les incorporer aux molécules à marquer.
- Imagerie par résonance magnétique (IRM)
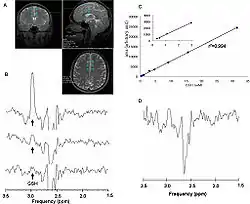
- L'imagerie par résonance magnétique est trop peu sensible pour représenter le passage de substances actives à travers une barrière hémato-encéphalique saine. En cas de lésion, l’IRM avec produit de contraste joue un grand rôle.
- Spectroscopie par résonance magnétique (SRM)
- La SRM est une version de l'IRM où l'on fait continûment varier la fréquence pour exciter successivement divers noyaux, et donc leur réponse, ce qui se manifeste par un spectre avec des pics caractéristiques : fluor-19, carbone-13, phosphore-31, et hydrogène dans d'autres substances que l'eau. Les signaux très faibles nécessitent de longs temps de mesure et la mesure sur des volumes appréciables[38],[40].
Stratégies pour franchir la barrière hémato-encéphalique
Comme il a été indiqué dans la section Processus de transport à la barrière hémato-encéphalique, il n'y a que peu de substances capables de franchir la barrière hémato-encéphalique, ce pourquoi beaucoup de médicaments psychotropes finissent par échouer à la barrière. 98 % de ces substances ne peuvent pas traverser la barrière hémato-encéphalique[41].
Il y a donc des dizaines d'années que l'on travaille intensément sur des méthodes susceptibles de rendre possible un transport de substance active dans le cerveau, en contournant – ou mieux en franchissant sélectivement – la barrière hémato-encéphalique[42],[43]. Un ensemble de stratégies pour surmonter la barrière hémato-encéphalique ont été mises au point dans ce but, ou en sont encore au stade d'élaboration[44],[45],[46].
En octobre 2014, la start-up française CarThera développe un dispositif novateur pour ouvrir temporairement la barrière hémato-encéphalique. Ce dispositif est basé sur utilisation conjointe de microbulles de gaz injectées dans la circulation sanguine et d'ultrasons focalisés[47]. Le principe est le suivant : quand les ondes ultrasonores rencontrent des microbulles de gaz dans les vaisseaux sanguins aux abords du tissu biologique cible, celles-ci se mettent à osciller, entrainant alors des effets physiques et biologiques conduisant à la déstabilisation transitoire des cellules endothéliales de la barrière hématoencéphalique[48].
Dysfonctionnements de la barrière hémato-encéphalique
Les dysfonctionnements de la barrière hémato-encéphalique peuvent être provoqués par toutes sortes de pathologies. La barrière elle-même peut d'ailleurs être à l'origine de quelques maladies neurologiques très rares, de nature génétique.
Les perturbations du rôle protecteur de la barrière hémato-encéphalique sont une complication de beaucoup de maladies neurodégénératives et de blessures du cerveau. Certaines maladies périphériques, comme le diabète, ou certaines inflammations, ont une action nuisible sur le fonctionnement de la barrière hémato-encéphalique[49].
D'autres pathologies peuvent perturber le fonctionnement des endothéliums « du dedans vers le dehors », c'est-à-dire que des influences provenant de la matrice extracellulaire perturbent l'intégrité de la barrière hémato-encéphalique. Par exemple, on a le glioblastome[50].
Mais un ensemble de maladies se manifestent dans le cerveau par le fait que certains agents peuvent pénétrer dans la barrière hémato-encéphalique. Parmi ceux-ci par exemple, le VIH, le virus T-lymphotrope humain, le virus du Nil occidental, certaines bactéries comme le méningocoque ou le vibrion cholérique[50].
Dans le cas de la sclérose en plaques, les agents pathogènes sont des cellules du système immunitaire de l'individu lui-même, qui franchissent la barrière hémato-encéphalique. De même, dans certains cancers non cérébraux, certaines cellules en métastase peuvent franchir la barrière hémato-encéphalique et donner lieu à des métastases cérébrales[50].
Agressions exogènes de la barrière hémato-encéphalique
Alcool
La consommation excessive d'alcool est un facteur majeur de risque pour les maladies psychophysiologiques, les inflammations et la sensibilité aux infections bactériennes. De plus, la consommation chronique d'alcool endommage la barrière hémato-encéphalique[51],[52],[53], ce qui est considéré comme un facteur important pour l'amorce de maladies neurodégénératives[54]. Les dommages à la barrière hémato-encéphalique sont démontrés aussi bien par les recherches neuropathologiques sur les alcooliques que par des expériences sur des animaux[55].
Dans les expériences sur animaux, il a été établi que l'enzyme Myosin light-chain kinase (en) (MLCK) conduit dans l'endothélium à la phosphorylation de nombreuses protéines des jonctions serrées ou du cytosquelette des protéines, ce qui endommage l’intégrité de la barrière hémato-encéphalique[56]. En outre, le stress oxydant dû à l'alcool conduit à des dommages supplémentaires à la barrière hémato-encéphalique[57].
Ce n'est pas l’alcool lui-même qui active l'enzyme MLCK dans l'endothélium, mais ses métabolites.
La dégradation fonctionnelle de la barrière hémato-encéphalique facilite la migration des leucocytes dans le cerveau, ce qui facilite le développement de pathologies neuro-inflammatoires[55].
Nicotine
L'abus chronique de nicotine sous forme de tabac fait non seulement augmenter le risque de cancer des poumons, mais aussi celui de maladie cardiovasculaire. Parmi les risques cardiovasculaires, il existe une corrélation directe avec les risques de démence. Plusieurs méta-analyses établissent que les fumeurs ont un risque significativement plus élevé de démence par maladie d'Alzheimer que les non-fumeurs. Le risque de démence vasculaire, ou de déficit cognitif léger n'est pas ou que peu augmenté[58]. L'exposition quotidienne à la nicotine modifie chez les animaux non seulement la fonction mais aussi la structure de la barrière hémato-encéphalique des sujets[59]. La substance modèle saccharose peut passer à travers les endothéliums significativement plus facilement, ce qui traduit en réalité une distribution modifiée des protéines de jonction serrée ZO-1[60], et une activité réduite de la claudine-3[61].
Après une exposition chronique à la nicotine, on a constaté dans l'endothélium une formation augmentée de microvillosités, de symport Na+/K+/2Cl− et pompe sodium-potassium déréglés[59].
Des études épidémiologiques, montrent que les fumeurs courent un risque significativement plus élevé de méningite bactérienne, par rapport aux non-fumeurs. La nicotine change les filaments d'actine du cytosquelette, ce qui semble faciliter le passage d'agents pathogènes comme le colibacille vers le cerveau[62].
Pour certains composés à diffusion limitée, par exemple l'antagoniste de la nicotine méthyllycaconitine qui se fixe sur le récepteur nicotinique à l'acétylcholine (nACHrs) et auquel on attribue des vertus pour le sevrage nicotinique, le passage de la barrière hémato-encéphalique devient plus difficile[63].
La mise au point d'un vaccin sur la base d'une immunoglobuline G fait l'objet de recherches. Ce vaccin devrait stimuler des anticorps se liant spécifiquement à la nicotine, et par suite empêchant son passage à travers la barrière hémato-encéphalique[64],[65],[66],[67].
Ondes électromagnétiques (téléphones mobiles)
Les effets adverses sur la santé des rayonnements électromagnétiques dans le domaine du MHz au GHz à haute densité d'énergie sont bien connus. C'est avec eux que l'on fait cuire la nourriture au four à micro-ondes. Cependant, les effets des rayonnements de densité d'énergie bien inférieure, comme en téléphonie ou application multimédia mobile, sont sujets à controverses. Les effets spécifiques sur la barrière hémato-encéphalique sont un domaine d'incertitude[68].
À haute densité d'énergie du rayonnement électromagnétique, on observe un échauffement significatif du tissu corporel. Dans le crâne, ce réchauffement pourrait influencer la barrière hémato-encéphalique et la rendre plus perméable. On observe ce genre d'effets de réchauffement sur des organes périphériques[69]. Dans les circonstances de la téléphonie mobile, le cerveau s'échauffe au maximum de 0,1 K (15 minutes de conversation à puissance d'émission maximum). Un bain chaud ou un travail corporel fatigant peuvent échauffer plus fort le cerveau sans danger[70]. Des études scientifiques datant du début des années 1990[71], en particulier dans le groupe du neurochirurgien suédois Leif G. Salford de l'université de Lund,rapportent une ouverture de la barrière hémato-encéphalique dans le domaine non thermique avec des fréquences GSM[72],[73],[74],[75].
D'autres groupes de travail ne confirment pas les résultats de Salford[76],[18], certains remettant en cause la méthode utilisée[18].
Diagnostics en médecine humaine
IRM renforcée par produit de contraste

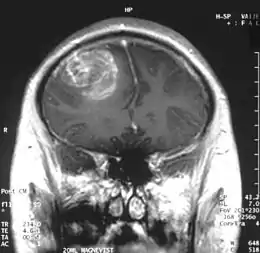
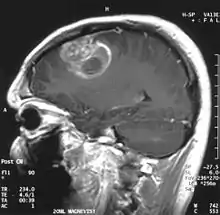
Le premier produit de contraste mis au point pour l'IRM est le gadolinium (Gd). En raison de sa toxicité, il faut l’emballer (le chélater) dans une molécule de DTPA. On a ainsi obtenu en 1984 le Gd-DTPA[77], qui avait le potentiel pour obtenir des IRM renforcés pour le diagnostic de lésions locales de la barrière hémato-encéphalique[78]. La molécule de Gd-DTPA est très polaire, et par conséquent bien trop hydrophile pour traverser une barrière hémato-encéphalique saine. Les modifications des jonctions serrées, comme celles qui peuvent par exemple être provoquées par un glioblastome, permettent le transport paracellulaire de ce produit de contraste dans le tissu cérébral. Là, il renforce le contraste, par interaction avec les protons de l'eau environnante, et rend visibles les défauts de la barrière hémato-encéphalique. Comme ce sont les vaisseaux responsables de l'alimentation de la tumeur qui sont touchés, dans son voisinage immédiat, on peut en apprécier l'extension.
Au cas d'un accident vasculaire cérébral aigu, le dommage à la barrière hémato-encéphalique peut être soumis au diagnostic de la même manière par IRM renforcée par produit de contraste[79].
Par la détermination du temps de relaxation, la quantité de Gd-DTPA dans le tissu cérébral peut être quantifiée[80].
Autres procédés d'imagerie
Au moyen de traceurs marqués par un élément radioactif, qui ne passent pas normalement à travers la barrière hémato-encéphalique, on peut aussi entreprendre des recherches sur le fonctionnement de celle-ci chez l'homme. Pour cela, on peut en principe utiliser la tomographie d'émission monophotonique (TEMP, ou en anglais SPECT), ou la tomographie par émission de positons (TEP, ou en anglais PET).
Par exemple, chez des patients victimes d'un accident vasculaire cérébral aigu, on peut montrer une augmentation de l'absorption du 99mTc chélaté par l'hexa-methyl-propylene-amine-oxime (HMPAO)[81],[82].
Au moyen de la tomodensitométrie, on peut aussi quantifier les défauts de la barrière hémato-encéphalique par la diffusion de produits de contraste appropriés hors des capillaires[83],[84],[85].
Histoire de la découverte de la barrière hémato-encéphalique

La première preuve d'existence pour la barrière hémato-encéphalique vient du chimiste allemand Paul Ehrlich. En 1885, il constata qu'après injection de colorants vitaux solubles dans l'eau dans la circulation sanguine de rats, tous les organes étaient colorés, sauf le cerveau et la moelle épinière[86].
En 1904, il en tira une conclusion fausse, c'est-à-dire que la cause de cette découverte était une faible affinité du tissu cérébral pour le colorant injecté[87].
En 1909, Edwin Goldmann, un ancien collaborateur de Paul Ehrlich, injecte par intraveineuse le colorant synthétisé cinq ans auparavant par Ehrlich, le bleu de trypan, un colorant azoïque. Là-dessus, il remarque que le plexus choroideus, contrairement au tissu cérébral qui l'entoure, est coloré de façon marquée[88]. En 1913, il injecte la même substance directement dans le liquide cérébrospinal de chiens et lapins[89]. Goldmann en conclut que le liquide cérébrospinal et le plexus choroideus ont une fonction importante dans le transport des nutriments du système nerveux central. De plus, il soupçonne une fonction de barrière contre les substances neurotoxiques[36].
En 1898, Arthur Biedl et Rudolf Kraus mènent des expériences avec l’acide gallique. Ce composé se révèle non toxique par application dans la circulation générale. Mais son injection dans le cerveau s'avère neurotoxique, avec des réactions pouvant aller jusqu'au coma[90].
Max Lewandowsky utilise en 1900 pour des expériences semblables le ferrocyanure de potassium et arrive à des conclusions semblables à celles de Biedl et Kraus. Lewandowsky utilise à cette occasion pour la première fois le concept de « barrière hémato-encéphalique »[91],[92].

En 1890, Charles Smart Roy et le futur prix Nobel de médecine Charles Scott Sherrington postulent que le cerveau possède un mécanisme intrinsèque pour faire correspondre l'irrigation vasculaire aux variations locales de l'activité :

Lina Stern née le 26 août 1878 et morte 7 mars 1968 à Moscou, femme médecin et biochimiste soviétique, première membre féminine de l'académie des sciences de Russie, a apporté de réelles contributions à la recherche sur la barrière hémato-encéphalique, qu'elle désigna comme telle en 1921[95].
La différence entre la barrière hémato-encéphalique et la barrière sang - liquide cérébrospinal fut prise en compte dans les années 1930 par Friedrich Karl Walter[96] et Hugo Spatz[97]. Ils ont posé que le flux de liquide cérébrospinal était par lui-même insuffisant pour assurer l'échange de gaz du système nerveux central[36].
Bien que les expériences de Goldmann et Ehrlich eussent indiqué l'existence d'une barrière entre la circulation sanguine et le système nerveux central, ce n'est que dans les années 1960 que les derniers doutes concernant son existence ont été dissipés. Un point critique dans l'expérience de Goldmann consistait en ce que le sang et le liquide cérébro-spinal, les deux liquides dans lesquels il avait injecté des colorants, diffèrent considérablement, ce qui pouvait influer sur le comportement de la diffusion et l'affinité pour le tissu nerveux. La compréhension a été rendue encore plus difficile par la trouvaille expérimentale que les colorants azoïques basiques coloraient le tissu nerveux, donc franchissaient la barrière, tandis que les colorants acides ne le faisaient pas. Ulrich Friedemann en conclut que c'étaient les propriétés électrochimiques des colorants qui en étaient responsables : les capillaires cérébraux étaient perméables aux substances neutres ou de pH supérieur au sang, et imperméables aux autres[98]. Mais par la suite, quand un grand nombre de substances furent testées pour leur capacité à franchir la barrière hémato-encéphalique, cette hypothèse se révéla insuffisante. Dans les modèles d'explication suivants, on introduisit et soumit à discussion tout une série de paramètres, comme la masse molaire, la taille de la molécule, les affinités de liaison, les constantes de dissociation, le caractère lipophile, la charge électrique, et leurs diverses combinaisons[99],[92].
La compréhension actuelle de la structure de base de la barrière hémato-encéphalique est fondée sur des vues au microscope électronique de cerveaux de souris, que l'on arriva à faire à la fin des années 1960[100],[101]. Thomas S. Reese et Morris J. Karnovsky ont injecté à leurs sujets animaux pendant leurs expériences de la peroxydase de raifort (HRP) par voie intraveineuse. Ils n'ont trouvé l'enzyme, au microscope électronique, que dans la lumière des capillaires et dans des vésicules micropinocytaires au sein des cellules endothéliales. À l'extérieur des endothéliums, dans la matrice extracellulaire, ils n'ont pas trouvé de peroxydase. Ils en ont conclu que les jonctions serrées entre les cellules endothéliales empêchent le passage vers le cerveau[102],[1].
Notes et références
- (de) Sabine Wolf, Bernhard Seehaus, Klaus Minol et Hans Günter Gassen, « Die Blut-Hirn-Schranke : Eine Besonderheit des cerebralen Mikrozirkulationssystems. », Naturwissenschaften, Springer, vol. 83, , p. 302–311 (DOI 10.1007/BF01152211, résumé)
- (en) Werner Risau, Britta Engelhardt et Hartmut Wekerle, « Immune function of the blood-brain barrier: in complete presentation of protein (auto-)antigens by rat brain microvascular endothelium in vitro. », Journal of Cell Biology, vol. 110, , p. 1757–1766 (PMID 1692329, lire en ligne)
- (de) Björn Bauer, « In vitro Zellkulturmodelle der Blut-Hirn-Schranke zur Untersuchung der Permeation und P-Glykoprotein-Interaktion von Arzneistoffen. », Dissertation, Ruprecht-Karl-Universität Heidelberg, (lire en ligne)
- (en) Sumio Ohtsuki, « New Aspects of the Blood–Brain Barrier Transporters; Its Physiological Roles in the Central Nervous System », Biol. Pharm. Bull., vol. 27, , p. 1489–1496 (PMID 15467183, lire en ligne) (article de revue)
- (en) T. J. Raub, S. L. Kuentzel et G. A. Sawada, « Permeability of bovine brain microvessel endothelial cells in vitro: barrier tightening by a factor released from astroglioma cells. », Exp. Cell Res., vol. 199, , p. 330–340 (PMID 1347502)
- (en) M. Bundgaard et N. J. Abbott, « All vertebrates started out with a glial blood-brain barrier 4-500 million years ago. », Glia, no 56, , p. 699–708 (PMID 18338790)
- (en) W. M. Pardridge, « Molecular biology of the blood–brain barrier. », Mol. Biotechnol., vol. 30, , p. 57–69 (PMID 15805577) (article de revue)
- (en) J. C. Lee, « Evolution in the concept of the blood-brain barrier phenomenon. », Progress in Neuropathology, , p. 84–145 (ISBN 0-88167-188-6)
- (en) Y. Takakura, K.L. Audus et R.T. Borchardt, « Blood-brain barrier: transport studies in isolated brain capillaries and in cultured brain endothelial cells. », Adv. Pharmacol., vol. 22, , p. 137–165 (PMID 1958501) (article de revue)
- (en) Arthur M. Bott, Hazel C. Jones et N. Joan Abbot, « Electrical resistance across the blood-brain barrier in anaesthetized rats: a developmental study. », J. Physiol., vol. 429, , p. 47–62 (PMID 2277354)
- (de) M. Pavelka et J. Roth, Funktionelle Ultrastruktur., Springer Verlag, , 334 p. (ISBN 978-3-211-83563-0 et 3-211-83563-6), p. 234–235
- (en) Britta Engelhardt, « Development of the blood-brain barrier. », Cell Tissue Res., Springer Verlag, vol. 314, , p. 119–129 (PMID 12955493) (article de revue)
- (en) Jochen Neuhaus, Werner Risau et Hartwig Wolburg, « Induction of blood-brain barrier characteristics in bovine brain endothelial cells by rat astroglial cells in transfilter coculture. », Ann. N. Y. Acad. Sci., Wiley, vol. 633, , p. 578–580 (PMID 1789585)
- (en) N. Joan Abbott, Lars Rönnbäck et Elisabeth Hansson, « Astrocyte-endothelial interactions at the blood-brain barrier. », Nat. Rev. Neurosci., vol. 7, , p. 41–53 (PMID 16371949) (article de revue)
- (en) Ingemar Bjorkhem et Steve Meaney, « Brain Cholesterol: Long Secret Life Behind a Barrier. », Arterioscler. Thromb. Vasc. Biol., vol. 24, , p. 806–815 (PMID 14764421) (article de revue)
- (en) Henri M. Duvernoy et Pierre-Yves Risold, « The circumventricular organs: an atlas of comparative anatomy and vascularization. », Brain Res. Rev., Elsevier, vol. 56, , p. 119–147 (PMID 17659349) (article de revue)
- Regards récents sur la barrière hémato-encéphalique
- (de) N Hettenbach, « Einfluss chronischer elektromagnetischer Befeldung mit Mobilfunkstrahlen (GSM und UMTS) auf die Integrität der Blut-Hirn-Schranke von Ratten », Dissertation, Ludwig-Maximilians-Universität München,
- (en) S. I. Rapoport, Blood-brain Barrier in Physiology and Medicine, Raven Press, (ISBN 0-89004-079-6)
- (de) Ines Sauer, « Apolipoprotein E abgeleitete Peptide als Vektoren zur Überwindung der Blut-Hirn-Schranke. », Thèse de doctorat, Freie Universität Berlin, (lire en ligne)
- (en) Richard D. Egleton et Thomas P. Davis, « Development of neuropeptide drugs that cross the blood-brain barrier. », NeuroRx, The American Society for Experimental NeuroTherapeutics, vol. 2, , p. 44–53 (PMID 15717056, lire en ligne) (article de revue)
- (en) H. Träuble, « Carriers and specificity in membranes. 3. Carrier-facilitated transport. Kinks as carriers in membranes. », Neurosci. Res. Program Bull., vol. 9, , p. 361–372 (PMID 5164654)
- (en) A. S. Verkman, « More than just water channels: unexpected cellular roles of aquaporins. », J. Cell Sci., vol. 118, , p. 3225–3232 (PMID 16079275) (article de revue).
- (en) E. M. Cornford et S. Hyman, « Blood-brain barrier permeability to small and large molecules. », Adv. Drug Deliv. Rev., vol. 36, , p. 145–163 (PMID 10837713)
- (en) Bénédicte Dehouck, Marie-Pierre Dehouck, Jean-Charles Fruchart et Romeo Cecchelli, « Upregulation of the low density lipoprotein receptor at the blood-brain barrier: intercommunications between brain capillary endothelial cells and astrocytes. », J. Cell Biol., vol. 126, , p. 465–473 (PMID 8034745, lire en ligne)
- (en) K. R. Duffy, W. M. Pardridge et R. G. Rosenfeld, « Human blood-brain barrier insulin-like growth factor receptor. », Metabolism, vol. 37, , p. 136–140 (PMID 2963191)
- (en) N. Bodor et P. Buchwald, « Recent advances in the brain targeting of neuropharmaceuticals by chemical delivery systems. », Adv. Drug Deliv. Rev., vol. 36, , p. 229–254 (PMID 10837718) (article de revue).
- (en) Ulrich Bickel, « How to measure drug transport across the blood-brain barrier. », NeuroRx, vol. 2, , p. 15–26 (PMID 15717054, lire en ligne) (article de revue).
- (en) J. Fenstermacher et L. Wei, « Measuring local cerebral capillary permeability-surface area products by quantitative autoradiography. », dans W. M. Pardridge, Introduction to the Blood-brain Barrier, Cambridge University Press, (ISBN 0-521-58124-9), p. 122–132
- (en) A. M. Peters, « Fundamentals of tracer kinetics for radiologists. », Br. J. Radiol., vol. 71, , p. 1116–1129 (PMID 10434905, lire en ligne) (article de revue).
- (en) F. Lasbennes et J. Gayet, « Capacity for energy metabolism in microvessels isolated from rat brain. », Neurochem. Res., vol. 9, , p. 1–10 (PMID 6325972)
- (en) M. Gumbleton et K. L. Audus, « Progress and limitations in the use of in vitro cell cultures to serve as a permeability screen for the blood-brain barrier. », J. Pharm. Sci., vol. 90, , p. 1681–1698 (PMID 11745727) (article de revue).
- (en) R. Cecchelli, B. Dehouck, L. Descamps, L. Fenart, V. V. Buée-Scherrer, C Duhem, S. Lundquist, M. Rentfel, G. Torpier et M. P. Dehouck, « In vitro model for evaluating drug transport across the blood-brain barrier. », Adv. Drug Deliv. Rev., vol. 36, , p. 165–178 (PMID 10837714)
- (en) Scott B. Raymond, Lisa H. Treat, Jonathan D. Dewey, Nathan J. McDannold, Kullervo Hynynen et Brian J. Bacskai, « Ultrasound Enhanced Delivery of Molecular Imaging and Therapeutic Agents in Alzheimer's Disease Mouse Models. », PLoS ONE, vol. 3, , e2175 (PMID 18478109, lire en ligne)
- (en) Ikumi Tamai et Akira Tsuji, « Drug delivery through the blood-brain barrier. », Adv. Drug Deliv. Rev., vol. 19, , p. 401–424 (DOI 10.1016/0169-409X(96)00011-7) (article de revue).
- (de) Stephanie Nobmann, « Isolierte Gehirn-Kapillaren als in vitro-Modell der Blut-Hirn Schranke », Ruprecht-Karls-Universität Heidelberg, (consulté le )
- (en) J. B. Van Bree, A. G. De Boer, M. Danhof et D. D. Breimer, « Drug transport across the blood-brain barrier, II. Experimental techniques to study drug transport. », Pharma. Weekbl. Sci., vol. 14, , p. 338–348 (PMID 1475172) (article de revue)
- (en) E. C. de Lange, M. Danhof, A. G. de Boer et D. D. Breimer, « Methodological considerations of intracerebral microdialysis in pharmacokinetic studies on drug transport across the blood-brain barrier. », Brain Res. Brain Res. Rev., vol. 25, , p. 27–49 (PMID 9370049) (article de revue).
- (en) Daisuke Matsuzawa, « Negative Correlation between Brain Glutathione Level and Negative Symptoms in Schizophrenia: A 3T 1H-MRS Study. », PLoS ONE, vol. 3, , e1944 (PMID 18398470, lire en ligne)
- (en) K Albert, H Rembold, G Kruppa, E Bayer, M Bartels et G Schmalzing, « 19F Nuclear Magnetic Resonance Spectroscopy of neuroleptics: The first in vivo pharmacokinetics of trifluoperazine in the rat brain and the first in vivo spectrum of fluphenazine in the human brain. », Biol. Psychiatry, vol. 30, , p. 656–662 (PMID 2386658)
- (en) William M. Pardridge, « Blood-brain barrier drug targeting: the future of brain drug development. », Mol. Interv., vol. 3, , p. 90–105 (PMID 14993430, lire en ligne) (article de revue).
- (en) David J. Begley, « Delivery of therapeutic agents to the central nervous system: the problems and the possibilities. », Pharmacol. Ther., vol. 104, , p. 29–45 (PMID 15500907) (article de revue).
- (en) William M. Pardridge, « Why is the global CNS pharmaceutical market so under-penetrated? », Drug Discov. Today, vol. 7, , p. 5–7 (PMID 11790589)
- (en) Albertus G. de Boer et Pieter J. Gaillard, « Strategies to improve drug delivery across the blood-brain barrier. », Clin. Pharmacokinet., vol. 46, , p. 553–576 (PMID 17596102) (article de revue).
- (en) Albertus G. de Boer et Pieter J. Gaillard, « Drug targeting to the brain. », Annu. Rev. Pharmacol. Toxicol., vol. 47, , p. 323–355 (PMID 16961459) (article de revue).
- (en) Paris-Robidas S, Brouard D, Emond V, Parent M et Calon F, « Internalization of targeted quantum dots by brain capillary endothelial cells in vivo. Journal of cerebral blood flow and metabolism », Official journal of the International Society of Cerebral Blood Flow and Metabolism, , p. 731-42 (ISSN 1559-7016, lire en ligne)
- SonoCloud, Low Intensity Contact Ultrasound Implant for Blood Brain Barrier Opening and Drug Delivery sur le site de CarThera
- (en) Brain barrier opened for first time to treat cancer, sur New Scientist. Consulté le 22 octobre 2014.
- (en) Brian T. Hawkins et Richard D. Egleton, « Pathophysiology of the blood-brain barrier: animal models and methods. », Curr. Top Dev. Biol., Elsevier, vol. 80, , p. 277–309 (PMID 17950377) (article de revue).
- (en) N. Weiss, F. Miller, S. Cazaubon et P. OK Couraud, « The blood-brain barrier in brain homeostasis and neurological diseases. », Biochim. Biophys. Acta, , epreprint (PMID 19061857) (article de revue).
- (en) EM Cornford, LD Braun, WH Oldendorf et MA Hill, « Comparison of lipid-mediated blood-brain-barrier penetrability in neonates and adults. », Am. J. Physiol., vol. 243, , p. 161C–168C (PMID 7114247)
- (en) Imdat Elmas, Mutlu Küçük, Rivaze Bulut Kalayci, Aydin Çevik et Mehmet Kay, « Effects of profound hypothermia on the blood-brain barrier permeability in acute and chronically ethanol treated rats. », Forensic Science International, vol. 119, , p. 212-216 (PMID 11376985)
- (en) S. C. Phillips et B. G. Cragg, « Weakening of the blood-brain barrier by alcohol-related stresses in the rat. », J. Neurol. Sci., vol. 54, , p. 271–27 (PMID 7201507)
- (en) Ashok K Singh, Yin Jiang, Shveta Gupta et Elhabib Benlhabib, « Effects of chronic ethanol drinking on the blood brain barrier and ensuing neuronal toxicity in alcohol-preferring rats subjected to intraperitoneal LPS injection. », Alcohol Alcohol, vol. 42, , p. 385–399 (PMID 17341516, lire en ligne)
- (en) James Haorah, Bryan Knipe, Santhi Gorantla, Jialin Zheng et Yuri Persidsky, « Alcohol-induced blood-brain barrier dysfunction is mediated via inositol 1,4,5-triphosphate receptor (IP3R)-gated intracellular calcium release. », J. Neurochem., vol. 100, , p. 324–336 (PMID 17241155)
- (en) James Haorah, David Heilman, Bryan Knipe, Jesse Chrastil, Jessica Leibhart, Anuja Ghorpade, Donald W. Miller et Yuri Persidsky, « Ethanol-induced activation of myosin light chain kinase leads to dysfunction of tight junctions and blood-brain barrier compromise. Alcoholism. », Clinical and Experimental Research, vol. 29, , p. 999–1009 (PMID 15976526)
- (en) J. Haorah, B. Knipe, J. Leibhart, A. Ghorpade et Y. Persidsky, « Alcohol-induced oxidative stress in brain endothelial cells causes blood-brain barrier dysfunction. », Journal of Leukocyte Biology, vol. 78, , p. 1223–1232 (PMID 16204625, lire en ligne)
- (en) Ruth Peters, Ruth Poulter, James Warner, Nigel Beckett, Lisa Burch et Chris Bulpitt, « Smoking, dementia and cognitive decline in the elderly, a systematic review. », BMC Geriatr., vol. 8, , p. 36 (PMID 19105840, lire en ligne) (article de revue).
- (en) P. R. Lockman, G. McAfee, W. J. Geldenhuys, C. J. Van der Schyf, T. J. Abbruscato et D. D. Allen, « Brain uptake kinetics of nicotine and cotinine after chronic nicotine exposure. », J. Pharmacol. Exp. Ther., vol. 314, , p. 636–642 (PMID 15845856)
- (en) Thomas J. Abbruscato, Steve P. Lopez, Karen S. Mark, Brian T. Hawkins et Thomas P. Davis, « Nicotine and cotinine modulate cerebral microvascular permeability and protein expression of ZO-1 through nicotinic acetylcholine receptors expressed on brain endothelial cells. », J. Pharm. Sci., vol. 91, , p. 2525–2538 (PMID 12434396)
- (en) Brian T. Hawkins, Thomas J. Abbruscato, Richard D. Egleton, Rachel C. Brown, Jason D. Huber, Christopher R. Campos et Thomas P. Davis, « Nicotine increases in vivo blood-brain barrier permeability and alters cerebral microvascular tight junction protein distribution. », Brain Res., vol. 1027, , p. 48–58 (PMID 15494156)
- (en) Yu-Hua Chen, Steven Han-Min Chen, Ambrose Jong, Zhao Yi Zhou, Wei Li, Kazuhiro Suzuki et Sheng-He Huang, « Enhanced Escherichia coli invasion of human brain microvascular endothelial cells is associated with alternations in cytoskeleton induced by nicotine. », Cell Microbiol., vol. 4, , p. 503–514 (PMID 12174085)
- (en) P. R. Lockman, C. J. Van der Schyf, T. J. Abbruscato et D. D. Allen, « Chronic nicotine exposure alters blood-brain barrier permeability and diminishes brain uptake of methyllycaconitine. », J. Neurochem., vol. 94, , p. 37–44 (PMID 15953347)
- (en) Michael Kotlyar et Dorothy K. Hatsukami, « Managing nicotine addiction. », J. Dent. Educ., vol. 66, , p. 1061–1073 (PMID 12374267)
- (en) Paul R. Pentel, « A nicotine conjugate vaccine reduces nicotine distribution to brain and attenuates its behavioral and cardiovascular effects in rats. », Pharmacol. Biochem. Behav., vol. 65, , p. 191–198 (PMID 10638653)
- (en) D. E. Keyler, D. Shoeman, M. G. LeSage, A. D. Calvin et P. R. Pentel, « Maternal vaccination against nicotine reduces nicotine distribution to fetal brain in rats. », J. Pharmacol. Exp. Ther., vol. 305, , p. 587–592 (PMID 12606612, lire en ligne)
- (en) Mark G. LeSage, Daniel E. Keyler, Yoko Hieda, Greg Collins, Danielle Burroughs, Chap Le et Paul R. Pentel, « Effects of a nicotine conjugate vaccine on the acquisition and maintenance of nicotine self-administration in rats. », Psychopharmacology, vol. 184, , p. 409–416 (PMID 15991003)
- (en) John A. D'Andrea, C.K. Chou, Sheila A. Johnston et Eleanor R. Adair, « Microwave effects on the nervous system. », Bioelectromagnetics, vol. 6, , p. 107–147 (PMID 14628310) (article de revue).
- (en) Tarak H. Patel, Shane Sprague, Qin Lai, David F. Jimenez, Constance M. Barone et Yuchuan Ding, « Blood brain barrier (BBB) dysfunction associated with increased expression of tissue and urokinase plasminogen activators following peripheral thermal injury. », Neurosci. Lett., vol. 444, , p. 222–226 (PMID 18718505)
- (en) Ingeburg Ruppe, « Aufbau und Funktion der Blut-Hirn-Schranke. », Newsletter, vol. 1, , p. 15–17 (lire en ligne)
- (en) B. R. Persson, L. G. Salford, A. Brun, J. L. Eberhardt et L. Malmgren, « Increased permeability of the blood-brain barrier induced by magnetic and electromagnetic fields. », Ann. N. Y. Acad. Sci., vol. 649, , p. 356–358 (PMID 1580510)
- (en) Leif G. Salford, Arne E. Brun, Jacob L. Eberhardt, Lars Malmgren et Bertil R. R. Persson, « Nerve cell damage in mammalian brain after exposure to microwaves from GSM mobile phones. », Environ. Health Perspect., vol. 111, , p. 881–883 (PMID 12782486)
- (en) Henrietta Nittby, Gustav Grafström, Jacob L. Eberhardt, Lars Malmgren, Arne Brun, Bertil R. R. Persson et Leif G. Salford, « Radiofrequency and extremely low-frequency electromagnetic field effects on the blood-brain barrier. », Electromagn. Biol. Med., vol. 27, , p. 103–126 (PMID 18568929) (article de revue).
- (en) Jacob L. Eberhardt, Bertil R. R. Persson, Arne E. Brun, Leif G. Salford et Lars O. G. Malmgren, « Blood-brain barrier permeability and nerve cell damage in rat brain 14 and 28 days after exposure to microwaves from GSM mobile phones. », Electromagn. Biol. Med., vol. 27, , p. 215–229 (PMID 18821198)
- (en) LG Salford, A Brun, K Sturesson, JL Eberhardt et BR Persson, « Permeability of the blood-brain barrier induced by 915 MHz electromagnetic radiation, continuous wave and modulated at 8, 16, 50, and 200 Hz. », Microsc. Res. Tech., vol. 27, , p. 535–542 (PMID 8012056)
- (en) Helmut Franke, E.B. Ringelstein et F. Stögbauer, « Electromagnetic fields (GSM 1800) do not alter blood-brain barrier permeability to sucrose in models in vitro with high barrier tightness. », Bioelectromagnetics, vol. 26, , p. 529–535 (PMID 16142784)
- (en) Hanns-Joachim Weinmann, Robert C. Brasch, Wolf-R. Press1 et George E. Wesbey, « Characteristics of Gadolinium-DTPA Complex: A Potential NMR Contrast Agent. », Am. J. Roentgenol., vol. 142, , p. 619–624 (PMID 6607655, lire en ligne)
- (en) Robert C. Brasch1, Hanns-Joachim Weinmann et George E. Wesbey, « Contrast-enhanced NMR imaging: animal studies using gadolinium-DTPA complex. », Am. J. Roentgenol., vol. 142, , p. 625–630 (PMID 6607656, lire en ligne)
- (en) Val M. Runge, John E. Kirsch, John W. Wells, John N. Dunworth et Cecil E. Woolfolk, « Visualization of Blood-Brain Barrier Disruption on MR Images of Cats with Acute Cerebral Infarction: Value of Administering a High Dose of Contrast Material. », Am. J. Roentgenol., vol. 162, , p. 431–435 (PMID 8310940, lire en ligne)
- (en) M. A. Ibrahim, J. F. Emerson et C. W. Cotman, « Magnetic resonance imaging relaxation times and gadolinium-DTPA relaxivity values in human cerebrospinal fluid. », Invest. Radiol., vol. 33, , p. 153–162 (PMID 9525754)
- (en) A. V. Alexandrov, L. E. Ehrlich, C. F. Bladin et S. E. Black, « Clinical significance of increased uptake of HMPAO on brain SPECT scans in acute stroke. », J. Neuroimaging, vol. 6, , p. 150–155 (PMID 8704289) (article de revue).
- (en) J. C. Masdeu et J. Arbizu, « Brain single photon emission computed tomography: technological aspects and clinical applications. », Semin. Neurol., vol. 28, , p. 423–434 (PMID 18843571)
- (de) Marco Essig, « Bildgebende CT-Diagnostik beim Schlaganfall », Visions, vol. 12, , p. 15–17
- (en) K. A. Miles, « Perfusion CT for the assessment of tumour vascularity : which protocol ? », Br. J. Radiol., vol. 76, , p. 36–42 (PMID 15456712, lire en ligne)
- (en) David A. C. Leggett, Kenneth A. Miles et Benjamin B. Kelley, « Blood-brain barrier and blood volume imaging of cerebral glioma using functional CT: a pictorial review. », Eur. J. Radiol., vol. 30, , p. 185–190 (PMID 10452716) (article de revue).
- (de) Paul Ehrlich, Das Sauerstoff-Bedürfniss des Organismus : Eine Farbenanalytische Studie. (Thèse de doctorat), Berlin, August Hirschwald,
- (de) Paul Ehrlich, Ueber die Beziehungen von chemischer Constitution, Verteilung und Pharmakologischer Wirkung. Gesammelte Arbeiten zur Immunitaetsforschung., Berlin, August Hirschwald, , p. 574
- (de) Edwin E. Goldmann, « Die äußere und innere Sekretion des gesunden und kranken Organismus im Lichte der vitalen Färbung. », Beitr. Klin. Chirurg., vol. 64, , p. 192–265
- (de) Edwin E. Goldmann, « Vitalfärbung am Zentralnervensystem. », Abh. K. Preuss. Akad. Wiss. Phys. Med., vol. 1, , p. 1–60
- (de) A. Biedl et R. Kraus, « Über eine bisher unbekannte toxische Wirkung der Gallensäuren auf das zentrale Nervensystem. », Zentralblatt Innere Medizin, vol. 19, , p. 1185–1200
- (de) Max Lewandowsky, « Zur Lehre von der Cerebrospinal Flüssigkeit. », Zentralblatt Klinische Medizin, vol. 40, , p. 480–494
- (en) B. T. Hawkins et T. P. Davis, « The blood-brain barrier/neurovascular unit in health and disease. », Pharmacol. Rev., vol. 57, , p. 173–185 (PMID 15914466) (article de revue).
- (en) C. S. Roy et C. S. Sherrington, « On the regulation of the blood supply of the brain. », J. Physiol., vol. 11, , p. 85–108 (lire en ligne)
- (en) Olaf B. Paulson et Eric A. Newman, « Does the release of potassium from astrocyte endfeet regulate cerebral blood flow? », Science, American Association for the Advancement of Science (États-Unis), vol. 237, , p. 896–898 (PMID 3616619, [http://www.pubmedcentral.nih.gov/articlerender. fcgi?tool=pubmed&pubmedid=3616619 lire en ligne])
- (en) A. A. Vein, « Lina Stern: Science and fate », Annual Meeting of the International Society for the History of the Neurosciences, vol. 11, (lire en ligne)
- (de) Friedrich Karl Walter, « Die allgemeinen Grundlagen des Stoffaustausches zwischen dem Zentralnervensystem und dem übrigen Körper. », Arch. Psychiatr. Nervenkr., vol. 101, , p. 195–230
- (de) Hugo Spatz, « Die Bedeutung der vitalen Färbung für die Lehre vom Stoffaustausch zwischen dem Zentralnervensystem und dem übrigen Körper. », Arch. Psychiatr. Nervenkr., vol. 101, , p. 267–358
- (en) Ulrich Friedemann, « Blood-brain barrier. », Physiol. Rev., vol. 22, , p. 125–145 (résumé)
- (en) R. D. Tschirgi, « Blood-brain barrier : fact or fancy ? », Fed. Proc., vol. 21, , p. 665–671 (PMID 13922779)
- (en) G. Miller, « Drug targeting. Breaking down barriers. », Science, vol. 297, , p. 1116–1118 (PMID 12183610)
- (en) William M. Pardridge, « The blood-brain barrier: bottleneck in brain drug development. », NeuroRx, vol. 2, , p. 3–14 (lire en ligne) (article de revue).
- (en) T. S. Reese et M. J. Karnovsky, « Fine structural localization of a blood-brain barrier to exogenous peroxidase. », J. Cell Biol., vol. 34, , p. 207–217 (PMID 6033532, lire en ligne)
Voir aussi
Bibliographie
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Blut-Hirn-Schranke » (voir la liste des auteurs).
- Extraits du cours de PCEM1 du Pr Bertrand Bloch (PU-PH) sur le tissu nerveux, Université Victor Segalen, Bordeaux 2.
- (en) D. Kobiler, Blood-brain Barrier., Springer Verlag, (ISBN 0-306-46708-9)
- (en) A. G. De Boer et W. Sutanto, Drug Transport Across the Blood-brain Barrier., CRC Press, , 216 p. (ISBN 90-5702-032-7, présentation en ligne)
- (en) W. M. Pardridge, Introduction to the Blood-brain Barrier., Cambridge University Press, (ISBN 0-521-58124-9)
- (en) E. M. Taylor, Efflux Transporters and the Blood-brain Barrier., Nova Publishers, , 247 p. (ISBN 1-59454-625-8, présentation en ligne)
- (en) D. J. Begley, The Blood-brain Barrier and Drug Delivery to the CNS., Informa Health Care, (ISBN 0-8247-0394-4)
- (en) E. de Vries et A. Prat, The Blood-brain Barrier and Its Microenvironment., Taylor & Francis, (ISBN 0-8493-9892-4)
- (en) M. Bradbury, The Concept of a Blood-Brain Barrier., Wiley-Interscience, (ISBN 0-471-99688-2)
- (de) P. Ramge, Untersuchungen zur Überwindung der Blut-Hirn-Schranke mit Hilfe von Nanopartikeln., Shaker Verlag, (ISBN 3-8265-4974-0)
- (de) Peter Uwe Brenner, « Die Struktur der Blut-Hirn- und der Blut-Liquor-Schranke. – Eine Literaturstudie – », Thèse de doctorat, Ludwig Maximilans Universität München, (lire en ligne)
Articles connexes
Liens externes
- Portail des neurosciences
- Portail de la pharmacie
- Portail de la médecine
- Portail de la physiologie