Arginine
L'arginine (abréviations IUPAC-IUBMB : Arg et R) est un acide α-aminé dont l'énantiomère L est l'un des 22 acides aminés protéinogènes, encodé sur les ARN messagers par les codons CGU, CGC, CGA, CGG, AGA et AGG. Son rayon de van der Waals est égal à 148 Å (14,8 nm). Elle est caractérisée par la présence d'un groupe guanidine à l'extrémité de sa chaîne latérale, ce qui en fait un résidu très basique, chargé positivement dans les protéines, et dont le point isoélectrique vaut 10,76. Elle n'est pas considérée comme essentielle pour l'homme mais peut être produite en quantité insuffisante par l'organisme selon l'état de santé des individus, nécessitant alors un apport alimentaire.
Pour les articles homonymes, voir Arg.
| Arginine | ||
| ||
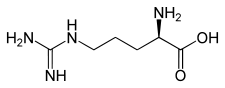 | ||
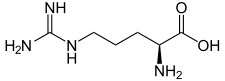
| L ou S(+)-arginine (haut) et D ou R(–)-arginine (bas) Structure de la D-Arginine. |
||
| Identification | ||
|---|---|---|
| Nom UICPA | acide 2-amino-5-carbamimidamidopentanoïque | |
| Synonymes |
R, Arg, acide (S)-2-amino-5-guanidopentanoïque |
|
| No CAS | (racémique) D ou R (–) L ou S (+) |
|
| No ECHA | 100.000.738 | |
| No CE | 230-571-3 (racémique) 205-866-5 D ou R (–) 200-811-1 |
|
| Code ATC | B05 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | C6H14N4O2 [Isomères] |
|
| Masse molaire[1] | 174,201 ± 0,0072 g/mol C 41,37 %, H 8,1 %, N 32,16 %, O 18,37 %, |
|
| pKa | l-arginine : pKa1=2,03, pKa2=9,00, pKa3=12,10 à 25 °C[2] | |
| Propriétés physiques | ||
| T° fusion | 244 °C (décomposition) | |
| Masse volumique | 1,1 g·cm-3 | |
| Propriétés biochimiques | ||
| Codons | AGA, AGG, CGU, CGC, CGA, CGG |
|
| pH isoélectrique | 10,76[2] | |
| Acide aminé essentiel | selon les cas | |
| Occurrence chez les vertébrés | 4,2 %[3] | |
| Cristallographie | ||
| Classe cristalline ou groupe d’espace | L-arginine dihydratée : P21 (n°4) | |
| Paramètres de maille | L-arginine dihydratée : a = 5,638 Å |
|
| Précautions | ||
| SIMDUT[5],[6] | ||
| Arginine (d-) : Produit non contrôlé Arginine (l-) : Produit non contrôlé |
||
| Directive 67/548/EEC | ||
 Xi |
||
| Unités du SI et CNTP, sauf indication contraire. | ||
Historique
L'arginine fut isolée pour la première fois à partir de plants de lupin en 1886 par le chimiste suisse Ernst Schultze[7]. Elle est également dérivée de la guanidine, produite à partir du guano[8].
Structure
La chaîne latérale de l'arginine est constituée d'une chaîne aliphatique de 3 carbones (hors le carbone α) à l'extrémité de laquelle se trouve un groupement guanidinium. Ce groupement avec un pKa de 12,48[9] donne un caractère très basique à l'arginine, ce qui en fait l'acide aminé le plus basique des acides aminés protéinogènes.
Métabolisme de l'arginine
La plupart des organismes vivants sont capables de créer (biosynthèse ou anabolisme) ou dégrader (catabolisme) l'arginine.
Biosynthèse
L'arginine est créée de novo chez de nombreux organismes à partir du glutamate, lui-même appartenant au cycle de Krebs.

Catabolisme
L'arginine peut être dégradée et ainsi servir de source d'énergie, de carbone et d'azote à la cellule qui la consomme. De nombreuses voies différentes ont été mises en évidence dans l'ensemble des organismes vivants connus.
Cycle de l'urée
Chez divers animaux, dont les mammifères, l'arginine est décomposée en ornithine et en urée. Cette dernière est une molécule azotée qui peut être éliminée (par excrétion dans les urines) de manière à réguler la quantité de composés azotés présente dans les cellules de leurs organismes.
Fonctions biologiques
Il s'agit d'un acide aminé qualifié de « non essentiel » (sauf chez l’enfant) , ce dernier pouvant être synthétisé par l'organisme humain. Il est un constituant des protéines.
Il permet la synthèse du monoxyde d'azote (NO) par la NO synthase, intervenant ainsi dans la vasodilatation des artères[10].
La concentration sanguine d'une forme méthylée de l'arginine, l'homoarginine, serait corrélée avec un meilleur pronostic à la suite d'un accident vasculaire cérébral[11].
Utilisation
L'arginine est un composant fréquemment utilisé dans les boissons énergisantes. Elle a été utilisée en particulier par Red Bull en France, en remplacement de la taurine lorsque cette dernière était encore interdite par la législation.
Il est également utilisé dans certains compléments alimentaires, notamment pour fixer le magnésium[12],[13].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- "Properties of Amino Acids," in CRC Handbook of Chemistry and Physics, 91st Edition (Internet Version 2011), W. M. Haynes, ed., CRC Press/Taylor and Francis, Boca Raton, FL., p. 7-1
- (en) M. Beals, L. Gross, S. Harrell, « Amino Acid Frequency », sur The Institute for Environmental Modeling (TIEM) à l'université du Tennessee (consulté le )
- « L-Arginine dihydrate », sur www.reciprocalnet.org (consulté le )
- « Arginine (d-) » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- « Arginine (l-) » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Annales de physiologie végétale, Volumes 1 à 3, Institut national de la recherche agronomique (France), 1959
- http://georges.dolisi.free.fr/Les%20prions/proteine.htm
- (en) « Amino Acid Structures », sur cem.msu.edu (consulté le ).
- Böger RH, Bode-Böger SM, The clinical pharmacology of L-arginine, Annu Rev Pharmacol Toxicol, 2001;41:79–99
- Choe C, Atzler D, Wild PS et al. Homoarginine levels are regulated by L-arginine:glycine amidinotransferase and affect stroke outcome: results from human and murine studies, Circulation, 2013;128:1451–1461
- « Une percée majeure en nutrithérapie : l’arginine un nouveau nutriment pour renforcer les effets du magnésium », sur lanutritherapie.fr (consulté le ).
- « Arginine / Magnesium - Usages, effets secondaires, Avis, Composition, Interactions, Précautions, Suppléants, et dosage - TabletWise », sur tabletwise.com (consulté le ).
Voir aussi
Articles connexes
- Portail de la chimie
- Portail de la biochimie
- Portail de la biologie cellulaire et moléculaire
- Portail de la pharmacie
- Portail de la médecine