Thyroïdite de Hashimoto
La thyroïdite de Hashimoto ou thyroïdite chronique lymphocytaire est une thyroïdite chronique auto-immune particulièrement fréquente caractérisée notamment par la présence d'anticorps anti-thyroperoxydase et par une infiltration lymphoïde de la glande thyroïde. Généralement évoqué à l'examen clinique devant un goitre et une hypothyroïdie, le diagnostic de la maladie nécessite la réalisation d'examens complémentaires biologiques et morphologiques. Le traitement de la maladie fait généralement appel à une hormonothérapie substitutive.
| Spécialité | Endocrinologie |
|---|
| CIM-10 | E06.3 |
|---|---|
| CIM-9 | 245.2 |
| OMIM | 140300 |
| DiseasesDB | 5649 |
| MedlinePlus | 000371 |
| eMedicine | 120937 |
| eMedicine | med/949 |
| MeSH | D050031 |
![]()
Histoire
C’est en examinant des pièces de thyroïdectomie réalisées chez quatre[1] femmes d’âge moyen dans un contexte de goitre compressif que le médecin japonais Hakaru Hashimoto (1881−1934) découvre la maladie en 1912[2]. Il publie sa découverte avec l’article Kōjōsen rinpa-setsu shushō-teki henka ni kansuru kenkyū hōkoku ou Zur Kenntnis der lymphomatösen Veränderung der Schilddrüse (Struma lymphomatosa) dans « Archiv für klinische Chirurgie », y décrivant alors l’infiltration lymphocytaire de la glande thyroïde[3].
En 1957, la thyroïdite de Hashimoto devient la première maladie auto-immune spécifique d’organe à être reconnue[4]. Initialement sous-diagnostiquée et considérée comme une maladie rare[2],[1], la thyroïdite de Hashimoto est aujourd'hui reconnue comme une des pathologies thyroïdiennes les plus fréquentes[1].
Epidémiologie
Incidence et prévalence
Les estimations de l’incidence et de la prévalence de la thyroïdite de Hashimoto sont variables. Une incidence de 1/1000 a été proposée ainsi qu’une prévalence de 8/1000[2]. La maladie est ainsi la première cause d’hypothyroïdie dans les pays où les apports en iode sont satisfaisants[5],[6].
Facteurs de risque
Il existe une nette prédominance féminine de la maladie de Hashimoto avec un sex-ratio estimé entre 8 pour 1[2] et 20 pour 1[1]. Cette thyroïdite survient généralement aux alentours de l’âge de 40 ans mais peut se voir à tout âge y compris en population pédiatrique[1]. Elle serait également plus fréquente chez les populations caucasiennes et asiatiques[2].
Une histoire familiale de maladies de la thyroïde est fréquente, avec une forte implication du complexe antigénique HLA-DR5 (en) dont la présence est associée à un risque relatif de 3 au Royaume-Uni. Par ailleurs, la thyroïdite de Hashimoto pourrait être liée avec le polymorphisme génique CTLA-4 (Cytotoxic T-lymphocyte Associated-4) (en) qui entraîne une diminution du fonctionnement des produits du gène et une régulation négative de l'activité des lymphocytes T[7]. Ce mécanisme est également retrouvé dans le diabète de type 1[8].
Des apports élevés en iode dans l'alimentation[2], une carence en sélénium, des maladies infectieuses et quelques médicaments ont été impliqués comme facteurs de risque chez les personnes avec un risque génétique déjà prédéterminé[9].
L'incidence est augmentée chez les patients avec des anomalies chromosomiques, comme dans le syndrome de Turner[10],[11], le syndrome de Down (ou trisomie 21)[11] et le syndrome de Klinefelter[12].
Des recherches récentes suggèrent un potentiel rôle du virus HHV-6 (possiblement variant A) dans le développement ou la stimulation de la thyroïdite de Hashimoto[13].
Le rôle du tabac est discuté. Des études tendent à montrer un effet protecteur du tabac avec une réduction des taux sériques en auto-anticorps ainsi qu'une évolution moins fréquente vers l'hypothyroïdie[2]. Le mécanisme physiopathologique de cet effet protecteur n'est cependant pas compris[2].
Pathologies associées
La thyroïdite de Hashimoto est associée à la survenue d'autres maladies auto-immunes[14] : diabète de type 1[1],[10], maladie cœliaque[1],[10], vitiligo, maladie de Biermer, insuffisance surrénale (notamment dans le cadre d'un syndrome de Schmidt) et polyarthrite rhumatoïde.
La maladie de Basedow peut être associée à la thyroïdite de Hashimoto et il existe des formes de passage entre ces deux maladies[15]. On parle ainsi de « Hashitoxicose », entité décrite pour la première fois en 1971[2].
Physiopathologie et anatomopathologie
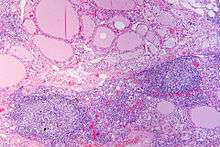
Sur le plan physiopathologique, les anticorps dirigés contre la thyroperoxydase et/ou la thyroglobuline causent une destruction progressive des follicules thyroïdiens de la glande thyroïde.
Macroscopiquement, le goitre est symétrique, non adhérent aux éléments péri-thyroïdiens et présente une surface capsulaire discrètement bosselée[1].
En microscopie les lésions consistent en une association de fibrose interstitielle, d'infiltration lymphoïde et de destruction épithéliale[1],[2]. Le degré de fibrose est très variable[1]. L'infiltration lymphoïde présente une organisation en follicules avec des lymphocytes B au centre et des lymphocytes T dans le cortex[2]. Les cellules épithéliales thyroïdiennes sont également modifiées, apparaissant élargies et acidophiles (cellules de Hürthle)[2].
Clinique
Signes locaux
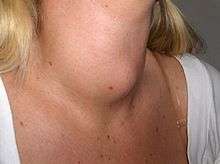
Ces signes sont liés à la présence du goître induit par la thyroïdite. Celui-ci est diffus et sa surface est le plus souvent régulière. Sa consistance est très particulière : ferme, « suiffée » ou « caoutchoutée ». Parfois ces changements peuvent ne pas être palpables[16]. Le goitre peut éventuellement être responsable de signes compressifs (dysphonie, dysphagie et dyspnée)[2]. La palpation cervicale ne retrouve généralement pas d'adénomégalie. Il n'est pas mis en évidence non plus de douleur ou de signes inflammatoires locaux.
Signes généraux
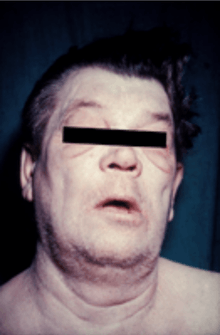
Ces derniers sont liés à la dysthyroïdie avec au premier plan l'hypothyroïdie. L'hyperthyroïdie peut également être présente, en particulier au début de l'évolution de la maladie. On soulignera que les signes de dysthyroïdie peuvent être absents initialement, la fonction thyroïdienne n'étant pas nécessairement perturbée. En revanche plus la maladie évolue et plus l'hypothyroïdie devient fréquente.
Parmi les signes cliniques induits par l'hypothyroïdie on retrouve notamment[2] : constipation, bradycardie, myxœdème, anémie, règles irrégulières, asthénie, troubles de la concentration et de la mémoire, dépression, peau sèche et épaissie, perte de cheveux.
Examens complémentaires
Biologie
La positivité à un taux élevé des anticorps anti-TPO, retrouvée dans 95 % des cas, est le meilleur signe biologique pour diagnostiquer la thyroïdite de Hashimoto[2]. Elle survient préférentiellement chez des sujets HLA B8-DR3 (en). Le titre en anticorps est de plus associé au degré d'infiltration lymphoïde de la glande[2]. On notera que la positivité des anticorps anti-TPO est par ailleurs très rare chez les sujets sains[2].
En cas de négativité des anticorps anti-TPO, on peut retrouver une augmentation des anticorps anti-thyroglobuline[17].
Il n'y a pas nécessairement, au début, de trouble de la fonction hormonale, mais la maladie évoluera toujours vers une hypothyroïdie avec des taux de T4 anormalement bas et secondairement des taux de TSH élevés.
Enfin, la thyroïdite de Hashimoto n'est pas associée à la présence de marqueurs sériques de l'inflammation.
Imagerie
L'échographie de la thyroïde montre un goitre hypoéchogène[17],[15]. Le parenchyme thyroïdien devient plus hétérogène au cours de l'évolution. On peut notamment mettre en évidence des pseudo-nodules et des nodules de régénérations hyperéchogènes (white knight)[15]. Des ganglions récurrentiels peuvent être visualisés[15]. La vascularisation est hétérogène en Doppler couleur. L'étude en Doppler pulsé retrouve une élévation des vitesses systoliques[15], toutefois moindre que dans la maladie de Basedow.
La scintigraphie est inutile dans ce contexte d'hypothyroïdie. Lorsqu'elle est réalisée elle montre des résultats très variables ne contribuant donc pas au diagnostic[18].
Complications
La thyroïdite de Hashimoto peut être associée à toute autre maladie auto-immune : collagénose, insuffisance surrénalienne, à un cancer de la thyroïde ou entraîner des complications cardio-vasculaires. Elle peut aussi entraîner des symptômes laissant penser à tort à un virage maniaque (manie) caractéristique d'un trouble bipolaire[19].
La thyroïdite de Hashimoto peut se compliquer d'une encéphalite (encéphalite de Hashimoto)[20]. Cette entité a été décrite pour la première fois en 1966 et seuls une centaine de cas ont été rapportés dans la littérature depuis[20].
Le lymphome thyroïdien complique moins de 1 % des thyroïdites auto-immunes[14],[15]. Toutefois celui-ci doit être évoqué devant toute augmentation de volume du goitre ou en cas de survenue d'adénopathie[15].
Traitement
Le traitement chirurgical n'a aujourd'hui que rarement sa place dans la thyroïdite de Hashimoto. On le réservera essentiellement aux goitres compressifs[2].
La prise en charge est avant tout médicale, consistant en une hormonothérapie thyroïdienne substitutive[2]. Les hormones thyroïdiennes permettraient une diminution du volume du goitre tout en corrigeant l'hypothyroïdie latente ou évidente.
Notes et références
- Takashi Akamizu, Nobuyuki Amino et Leslie J. DeGroot, Endotext, MDText.com, Inc., (PMID 25905412, lire en ligne)
- P. Caturegli, A. De Remigis et N.R. Rose, « Hashimoto thyroiditis: Clinical and diagnostic criteria », Autoimmunity Reviews, vol. 13, nos 4-5, , p. 391–397 (DOI 10.1016/j.autrev.2014.01.007, lire en ligne)
- (de) H. Hashimoto, « Zur Kenntnis der lymphomatösen Veränderung der Schilddrüse (Struma lymphomatosa) », Archiv für Klinische Chirurgie, Berlin, vol. 97, , p. 219–248
- (en) Donna Nakazawa, The Autoimmune Epidemic, New York, Simon & Schuster, , 32–35 p. (ISBN 978-0-7432-7775-4)
- JR Garber, Cobin, RH, Gharib, H, Hennessey, JV, Klein, I, Mechanick, JI, Pessah-Pollack, R, Singer, PA, Woeber, KA for the American Association of Clinical Endocrinologists and the American Thyroid Association Taskforce on Hypothyroidism in Adults et American Association Of Clinical Endocrinologists And American Thyroid Association Taskforce On Hypothyroidism In Adults, « Clinical Practice Guidelines for Hypothyroidism in Adults », Thyroid, vol. 22, no 12, , p. 1200–1235 (PMID 22954017, DOI 10.1089/thy.2012.0205, lire en ligne)
- Chakera, AJ, Pearce, SH et Vaidya, B, « Treatment for primary hypothyroidism: current approaches and future possibilities », Drug Design, Development and Therapy, vol. 6, , p. 1–11 (PMID 22291465, PMCID 3267517, DOI 10.2147/DDDT.S12894)
- F. K. Kavvoura, T. Akamizu, T. Awata, Y. Ban, D. A. Chistiakov, I. Frydecka, A. Ghaderi, S. C. Gough et Y. Hiromatsu, « Cytotoxic T-Lymphocyte Associated Antigen 4 Gene Polymorphisms and Autoimmune Thyroid Disease: A Meta-Analysis », Journal of Clinical Endocrinology & Metabolism, vol. 92, no 8, , p. 3162–70 (PMID 17504905, DOI 10.1210/jc.2007-0147)
- Eric M. Jacobson et Yaron Tomer, « The CD40, CTLA-4, thyroglobulin, TSH receptor, and PTPN22 gene quintet and its contribution to thyroid autoimmunity: Back to the future », Journal of Autoimmunity, vol. 28, nos 2–3, , p. 85–98 (PMID 17369021, PMCID 2043086, DOI 10.1016/j.jaut.2007.02.006)
- L. Saranac, S. Zivanovic, B. Bjelakovic, H. Stamenkovic, M. Novak et B. Kamenov, « Why is the Thyroid So Prone to Autoimmune Disease », Hormone Research in Paediatrics, vol. 75, no 3, , p. 157–65 (PMID 21346360, DOI 10.1159/000324442)
- Renata Lorini, Roberto Gastaldi, Cristina Traggiai et Paola Polo Perucchin, « Hashimoto's Thyroiditis », Pediatric endocrinology reviews: PER, vol. 1 Suppl 2, , p. 205–211; discussion 211 (ISSN 1565-4753, PMID 16444160, lire en ligne)
- Tommaso Aversa, Fortunato Lombardo, Mariella Valenzise et Maria Francesca Messina, « Peculiarities of autoimmune thyroid diseases in children with Turner or Down syndrome: an overview », Italian Journal of Pediatrics, vol. 41, , p. 39 (ISSN 1824-7288, PMID 25971674, PMCID PMC4440559, DOI 10.1186/s13052-015-0146-2, lire en ligne)
- Olena O. Seminog, Alla B. Seminog, David Yeates et Michael J. Goldacre, « Associations between Klinefelter's syndrome and autoimmune diseases: English national record linkage studies », Autoimmunity, vol. 48, no 2, , p. 125–128 (ISSN 1607-842X, PMID 25295757, DOI 10.3109/08916934.2014.968918, lire en ligne)
- Elisabetta Caselli, Maria Chiara Zatelli, Roberta Rizzo, Sabrina Benedetti, Debora Martorelli, Giorgio Trasforini, Enzo Cassai, Ettore C. Degli Uberti et Dario Di Luca, « Virologic and immunologic evidence supporting an association between HHV-6 and Hashimoto's thyroiditis », PLoS Pathogens, vol. 8, no 10, , e1002951 (PMID 23055929, PMCID 3464215, DOI 10.1371/journal.ppat.1002951)
- Endocrionologie, diabète et maladies métaboliques. Collège des enseignants d'endocrinologie, diabète et maladies métaboliques p361
- Jean Tramalloni et Hervé Monpeyssen, Échographie de la thyroïde, Elsevier Masson, (ISBN 978-2-294-72582-1, lire en ligne)
- Page 56 in: (en) Staecker, Hinrich; Thomas R. Van De Water; Van de Water, Thomas R., Otolaryngology: basic science and clinical review, Stuttgart, Thieme, (ISBN 0-86577-901-5)
- Giorgio Grani, Giovanni Carbotta, Angela Nesca et Mimma D'Alessandri, « A comprehensive score to diagnose Hashimoto's thyroiditis: a proposal », Endocrine, vol. 49, no 2, , p. 361–365 (ISSN 1559-0100, PMID 25280964, DOI 10.1007/s12020-014-0441-5, lire en ligne)
- S. Yarman, A. Mudun, F. Alagol et R. Tanakol, « Scintigraphic varieties in Hashimoto's thyroiditis and comparison with ultrasonography », Nuclear Medicine Communications, vol. 18, no 10, , p. 951–956 (ISSN 0143-3636, PMID 9392797, lire en ligne)
- (en) MJ Weiner et C Kennedy, « Prasad's syndrome », Br J Psychiatry, no 152, , p. 438-439 (PMID 3167392, lire en ligne [PDF])
- S. Bannier, F. Taithe, C. Solmon et P. Thieblot, « Encéphalopathie corticosensible associée à une thyroidite auto-immune: données actuelles », Annales d'Endocrinologie, vol. 68, nos 2-3, , p. 167–172 (DOI 10.1016/j.ando.2007.01.022, lire en ligne)
Voir aussi
Articles connexes
Bibliographie
- Endocrionologie, diabète et maladies métaboliques. Collège des enseignants d'endocrinologie, diabète et maladies métaboliques p361
Liens externes
- AFMT : Site Officiel de l'Association Française des Malades de la Thyroïde
- Portail de la médecine