Facteur de virulence
Un facteur de virulence est une molécule produite par un agent infectieux (bactéries, virus, mycètes, protozoaires) qui contribue au caractère pathogène — la virulence — de ces organismes en leur permettant :
- d'occuper une niche chez l'hôte (colonisation), ce qui passe par l'attachement à ses cellules ;
- d'échapper au système immunitaire de l'hôte (immunoévasion) ;
- d'inhiber le système immunitaire de l'hôte (immunosuppression) ;
- d'entrer et de sortir des cellules de l'hôte dans le cas des infections intracellulaires (typiquement pour les virus) ;
- d'absorber les nutriments de l'hôte.
Typologie
Les agents infectieux possèdent une grande variété de facteurs de virulence. Certains font partie de leur patrimoine génétique et sont propres aux bactéries, comme les endotoxines (lipopolysaccharide), tandis que d'autres proviennent d'éléments génétiques mobiles tels que les plasmides et les bactériophages, comme les exotoxines. Les facteurs de virulence codés sur des éléments génétiques mobiles se propagent par transfert horizontal de gènes et peuvent faire d'une bactérie inoffensive un agent infectieux. Une bactérie comme Escherichia coli O157:H7 a ainsi acquis l'essentiel de sa virulence à partir d'éléments génétiques mobiles. Les bactéries à Gram négatif sécrètent de nombreux facteurs de virulence à l'interface avec la cellule hôte, via la circulation de vésicules à travers leur membrane externe pour envahir la cellule hôte, se nourrir à ses dépens, voire assurer d'autres fonctions de communication intercellulaire.
De nombreux agents infectieux ont convergé vers des facteurs de virulence semblables pour échapper aux défenses des cellules d'eucaryotes. Ces facteurs de virulence acquis agissent de deux manières différentes pour assurer la survie et la croissance de ces germes :
- ils favorisent la colonisation de l'hôte, comme les adhésines (en), les invasines et les facteurs antiphagocytaires, ces derniers protégeant de la phagocytose ;
- ils affaiblissent ou détruisent l'hôte, comme les toxines, les hémolysines, les lipases et les peptidases.
Adhésines
Les adhésines (en) sont des protéines membranaires ou des pili qui permettent aux bactéries d'adhérer aux cellules cibles, étape indispensable à l'infection[1]. Elles réagissent avec des récepteurs homologues des cellules hôtes.
Facteurs d'invasion
Il s'agit d'éléments favorisant la propagation des agents infectieux à travers les tissus, par exemple :
- la streptokinase, enzyme produite par diverses espèces de streptocoques, dont le streptocoque du groupe A, et qui se lie au plasminogène pour l'activer en formant de la plasmine[2] afin de favoriser la fibrinolyse ;
- la hyaluronidase, qui hydrolyse l'acide hyaluronique du tissu conjonctif, des cellules épithéliales et du tissu nerveux, et produite notamment par les streptocoques du groupe A[3], les pneumocoques, les staphylocoques et Clostridium perfringens[4] ;
- les peptidases, désoxyribonucléases et lipases, qui attaquent les constituants macromoléculaires des cellules hôtes ;
- les flagelles, qui assurent la motilité de certains germes pathogènes, et participent de ce fait à leur propagation.
Facteurs antiphagocytaires
Les facteurs antiphagocytaires protègent les bactéries de la phagocytose par les leucocytes du système immunitaire. Ces facteurs sont de plusieurs ordres :
- une capsule, par exemple constituée de glycocalyx ou de lipopolysaccharide ; les pneumocoques sont un exemples de bactéries pathogènes encapsulées ;
- la protéine M (en) des streptocoques du groupe A[5], une protéine de surface qui peut être inactivée par des anticorps ;
- la protéine A du staphylocoque doré, qui se lie surtout aux immunoglobulines G1 et G2[6],[7] en les positionnant « à l'envers », de sorte qu'elles ne sont pas reconnues par les récepteurs Fc (effet d'anti-opsonisation) ;
- la leucocidine de Panton-Valentine est un facteur de virulence présent chez la plupart des staphylocoques dorés résistants à la méticilline[8],[9] et acquis par ces derniers à partir du matériel génétique d'un bactériophage qui les a préalablement contaminés[10] ; elle agit en formant des pores dans les membranes des cellules infectées ;
- la coagulase, sécrétée par divers microorganismes, dont certains staphylocoques dorés et Yersinia pestis, réagit avec la prothrombine pour former de la staphylothrombine et convertir le fibrinogène en fibrine dans le plasma sanguin, ce qui a pour effet d'entourer la bactérie d'une couche protectrice qui la protège de la phagocytose et du système immunitaire de l'hôte ;
- le facteur d'agglutination A du staphylocoque doré qui se lie au fibrinogène et participe à sa coagulation[11].
Endotoxines
Les endotoxines sont des toxines thermostables de la membrane externe de certaines bactéries à Gram négatif. Il s'agit par exemple du lipide A, constituant du lipopolysaccharide, qui est libéré lors de la lyse de ces bactéries, et est susceptible d'entraîner un syndrome de réponse inflammatoire systémique. Ces endotoxine induisent une série d'effets :
- libération d'interleukine 1 par les macrophages, jouant notamment le rôle de pyrogène endogène, en élevant la température corporelle (fièvre) ;
- libération de facteurs de nécrose tumorale[12], contribuant aux signes cardinaux de l'inflammation : Rubor (rougeur, érythème), Calor (chaleur, due à la vasodilatation), Tumor (tuméfaction, œdème), Dolor (douleur), Functio laesa (atteinte fonctionnelle).
- liaison du lipide A aux récepteurs des cellules B, conduisant à la maturation des lymphocytes B ;
- activation alternative du système du complément ;
- action sur le système des kinines et sur l'hémostase.
Les bactéries à Gram négatif responsables d'un sepsis sont susceptibles de provoquer une intoxication par endotoxines à l'issue d'un traitement antibiotique sous l'effet de la libération massive d'endotoxines consécutive à la destruction des agents infectieux, ce qui peut conduire à un choc septique.
Exotoxines
Les exotoxines sont des toxines sécrétées par des bactéries vivantes, contrairement aux endotoxines qui sont libérées lors de la destruction de ces bactéries. Elles sont souvent produites par des bactéries elles-mêmes infectées par des bactériophages. Elles agissent de différentes manières :
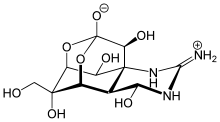
- les lipases contribuent à la destruction de la membrane plasmique des cellules cibles ; c'est par exemple le cas de la lécithinase C, également appelée toxine α de Clostridium perfringens[13] ;
- les toxines porogènes (en) perforent la membrane cellulaire en y insérant des pores transmembranaires, comme l'α-toxine staphylococcique[14] ;
- les neurotoxines altèrent les nerfs ou l'action des neurotransmetteurs ; ce sont par exemple :
- la tétanospasmine, ou toxine tétanique, responsable du tétanos et principale toxine produite par Clostridium tetani ;
- la toxine botulique, responsable du botulisme et produite par Clostridium botulinum ;
- la tétrodotoxine, produite par plusieurs bactéries et qui bloque certains canaux sodium[15].
- la toxine cholérique de Vibrio cholerae provoque la diarrhée aqueuse du choléra ;
- la toxine diphtérique de Corynebacterium diphtheriae inhibe un facteur d'élongation dans la diphtérie.
Notes et références
- (en) Loïc Coutte, Sylvie Alonso, Nathalie Reveneau, Eve Willery, Brigitte Quatannens, Camille Locht et Françoise Jacob-Dubuisson, « Role of Adhesin Release for Mucosal Colonization by a Bacterial Pathogen », Journal of Experimental Medicine, vol. 197, no 6, , p. 735-742 (PMID 12629063, PMCID 2193847, DOI 10.1084/jem.20021153, lire en ligne)
- (en) Lakshmi V. Mundada, Mary Prorok, Melanie E. DeFord, Mariana Figuera, Francis J. Castellino et William P. Fay, « Structure-Function Analysis of the Streptokinase Amino Terminus (Residues 1–59) », Journal of Biological Chemistry, vol. 278, no 27, , p. 24421-24427 (PMID 12704199, DOI 10.1074/jbc.M301825200, lire en ligne)
- (en) Clarise Rivera Starr et N. Cary Engleberg, « Role of Hyaluronidase in Subcutaneous Spread and Growth of Group A Streptococcus », Infection and Immunity, vol. 74, no 1, , p. 40-48 (PMID 16368955, PMCID 1346594, DOI 10.1128/IAI.74.1.40-48.2006, lire en ligne)
- (en) V. Zukaite et G. A. Biziulevicius, « Acceleration of hyaluronidase production in the course of batch cultivation of Clostridium perfringens can be achieved with bacteriolytic enzymes », Letters in Applied Microbiology, vol. 30, no 3, , p. 203-206 (PMID 10747251, DOI 10.1046/j.1472-765x.2000.00693.x, lire en ligne)
- (en) Neil Chanter, Nicola C. Talbot, J. Richard Newton, Dawn Hewson et Kristien Verheyen, « Streptococcus equi with truncated M-proteins isolated from outwardly healthy horses », Microbiology, vol. 146, no 6, , p. 1361-1369 (PMID 10846214, DOI 10.1099/00221287-146-6-1361, lire en ligne)
- (en) Johann Deisenhofer, « Crystallographic refinement and atomic models of a human Fc fragment and its complex with fragment B of protein A from Staphylococcus aureus at 2.9- and 2.8-Å resolution », Biochemistry, vol. 20, no 9, , p. 2361-2370 (PMID 7236608, DOI 10.1021/bi00512a001, lire en ligne)
- (en) Eric H. Sasso, Gregg J. Silverman et Mart Mannik, « Human IgA and IgG F(ab′)2 that bind to staphylococcal protein A belong to the VHIII subgroup », Journal of Immunology, vol. 147, no 6, , p. 1877-1883 (PMID 1909733, lire en ligne)
- (en) S. Szmigielski, G. Prévost, H. Monteil, D.A. Colin et J. Jeljaszewicz, « Leukocidal Toxins of Staphylococci », Zentralblatt für Bakteriologie, vol. 289, no 2, , p. 185-201 (PMID 10360319, DOI 10.1016/S0934-8840(99)80105-4, lire en ligne)
- (en) Jun Kaneko et Yoshiyuki Kamio, « Bacterial two-component and hetero-heptameric pore-forming cytolytic toxins: structures, pore-forming mechanism, and organization of the genes », Bioscience, Biotechnology, and Biochemistry, vol. 68, no 5, , p. 981-1003 (PMID 15170101, DOI 10.1271/bbb.68.981, lire en ligne)
- (en) Gerard Lina, Yves Piémont, Florence Godail-Gamot, Michèle Bes, Marie-Odile Peter, Valérie Gauduchon, François Vandenesch et Jerome Etienne, « Involvement of Panton-Valentine Leukocidin—Producing Staphylococcus aureus in Primary Skin Infections and Pneumonia », Clinical Infectious Diseases, vol. 29, no 5, , p. 1128-1132 (PMID 10524952, DOI 10.1086/313461, lire en ligne)
- (en) Anthony Loughman, J. Ross Fitzgerald, Marian P. Brennan, Judy Higgins, Robert Downer, Dermot Cox et Timothy J. Foster, « Roles for fibrinogen, immunoglobulin and complement in platelet activation promoted by Staphylococcus aureus clumping factor A », Molecular Microbiology, vol. 57, no 3, , p. 804-818 (PMID 16045623, DOI 10.1111/j.1365-2958.2005.04731.x, lire en ligne)
- (en) L. J. Walsh, G. Trinchieri, H. A. Waldorf, D. Whitaker et G. F. Murphy, « Human dermal mast cells contain and release tumor necrosis factor alpha, which induces endothelial leukocyte adhesion molecule 1 », Proceedings of the National Academy of Sciences of the United States of America, vol. 88, no 10, , p. 4220-4224 (PMID 1709737, PMCID 51630, DOI 10.1073/pnas.88.10.4220, Bibcode 1991PNAS...88.4220W, lire en ligne)
- (en) Tomoko Takahashi, Takao Sugahara et Akira Ohsaka, « Purification of Clostridium perfringens phospholipase C (α-toxin) by affinity chromatography on agarose-linked egg-yolk lipoprotein », Biochimica et Biophysica Acta (BBA) - Protein Structure, vol. 351, no 1, , p. 155-171 (PMID 4365891, DOI 10.1016/0005-2795(74)90074-9, lire en ligne)
- (en) Juliane Bubeck Wardenburg et Olaf Schneewind, « Vaccine protection against Staphylococcus aureus pneumonia », Journal of Experimental Medicine, vol. 205, no 2, , p. 287-294 (PMID 18268041, PMCID 2271014, DOI 10.1084/jem.20072208, lire en ligne)
- (en) Edward G. Moczydlowski, « The molecular mystique of tetrodotoxin », Toxicon, vol. 63, , p. 165-183 (PMID 23261990, DOI 10.1016/j.toxicon.2012.11.026, lire en ligne)
- Portail de la biologie cellulaire et moléculaire
- Portail de la microbiologie