Yersinia pestis
Yersinia pestis est une bactérie gram négatif du genre Yersinia. Elle est responsable de la peste.
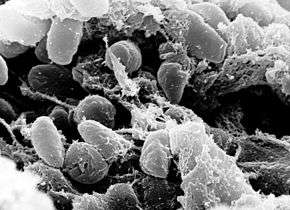
observé au microscope électronique
| Règne | Bacteria |
|---|---|
| Division | Proteobacteria |
| Classe | Gamma Proteobacteria |
| Ordre | Enterobacteriales |
| Famille | Enterobacteriaceae |
| Genre | Yersinia |
Nom binominal
(Lehmann & Neumann, 1896) van Loghem, 1944
Elle fut découverte en 1894 par Alexandre Yersin, un bactériologiste franco-suisse travaillant pour l'Institut Pasteur, durant une épidémie de peste à Hong Kong, en même temps que Kitasato Shibasaburō mais séparément. Kitasato tout d'abord la baptisa Pasteurella pestis en l'honneur de Pasteur. Ce n'est que plus tard qu'elle prit son nom actuel, en hommage à Yersin.
L'identification des diverses pandémies historiques avec Yersinia pestis n'est pas évidente, à des époques où le terme de « peste » pouvait désigner toute sorte de maladies infectieuses. Elle a été formellement identifiée dans une tombe de Bavière du VIe siècle[1] ainsi que dans un charnier de peste de 1722 à Marseille (France). Les descriptions précises des symptômes lors de la peste qui toucha l'Europe en 1347-1349 laissent également peu de doutes.
Épidémiologie
Le bacille de Yersin existe chez les rongeurs sauvages qui représentent le réservoir naturel du germe et chez lesquels peut sévir la peste sylvatique (en). Le vecteur intermédiaire principal est le rat, animal très sensible au bacille pesteux. L'épizootie chez les rats est propagée par leurs ectoparasites, essentiellement par les puces (Xenopsylla cheopis). Le bacille se développe dans le tube digestif de la puce, le bloquant et incitant la puce à piquer davantage : lors de morsures, des bacilles sont régurgités dans la plaie, assurant ainsi la transmission de la maladie. Lorsque la population de rats est décimée, les ectoparasites en surnombre provenant des cadavres cherchent de nouveaux hôtes : si le nombre de rats survivants est réduit, les puces peuvent chercher à parasiter des hôtes inhabituels, en particulier l'homme. Les puces peuvent rester contagieuses pendant plusieurs semaines.
Le rôle joué par les rats dans l'épidémiologie de la peste explique le cheminement des grandes épidémies de l'histoire. Ces rongeurs étant fréquents dans les ports, le point de départ d'une épidémie sur un continent se situait presque invariablement dans une ville portuaire où les rats pesteux provenant d'un foyer lointain étaient amenés par les navires.
Premiers stades de l'évolution du bacille
Bien que les premiers signes d'infection chez l'homme à Yersinia pestis aient été identifiés au néolithique tardif (5000-3500 avant le présent), ces souches manquent des composants génétiques clés nécessaires à l'adaptation aux puces, rendant ainsi leur mode de transmission aux humains peu clairs. Dans une étude de 2018, des chercheurs ont reconstruit les génomes anciens de Y. pestis à partir d'individus associés à la période de l'âge du bronze tardif (~ 3800 BP) dans la région de Samara (Russie) et montrent des distinctions claires entre ces nouvelles souches et la lignée du néolithique tardif. Ils suggèrent que la capacité totale de transmission médiée par les puces causant la peste bubonique a évolué plus de 1.000 ans plus tôt qu'avancé précédemment et proposent que plusieurs lignées de Y. pestis se sont établies au cours de l'âge du bronze, dont certaines persistent jusqu'à nos jours[2].
Maladie chez l'homme
Chez l'homme, la maladie peut revêtir différents aspects suivant la porte d'entrée du germe et le stade d'évolution :
- après la morsure de puce, le germe se développe sur place et après une courte incubation de 3 à 6 jours atteint par voie lymphatique le premier relais ganglionnaire (souvent inguinal en cas de morsure aux membres inférieurs). Là, la bactérie est provisoirement arrêtée et provoque le gonflement et la suppuration du ganglion, réalisant la peste bubonique, le bubon pouvant se fistuliser et laisser s'écouler le pus. Ce stade local est parfaitement curable et le malade est peu contagieux ;
- la barrière ganglionnaire est rapidement franchie et, à la forme bubonique, fait suite la peste septicémique rapidement mortelle ;
- au cours de l'essaimage du germe, les poumons peuvent être le siège d'un foyer pneumonique. Cette pneumonie pesteuse rend le malade contagieux, les expectorations étant riches en bacilles. La propagation se fait alors très rapidement d'homme à homme par inhalation de particules chargées de germes qui engendrent d'emblée une peste pneumonique sans passer par le stade bubonique.
Caractères bactériologiques
Cocco-bacille dont la coloration bipolaire est particulièrement nette dans le frottis de pus.
Culture lente, optimum de température = 28 - 30 °C. Pas d'uréase et germe immobile (différences avec les autres Yersinia).
Antigènes
Le sérum anti-pesteux permet la recherche du germe par immunofluorescence dans les prélèvements, mais il existe des antigènes commun avec Yersinia pseudotuberculosis.
Pouvoir pathogène expérimental
Très marqué pour le rat, le cobaye, la souris. Les ectoparasites de ces animaux représentent un danger de dissémination.
Prophylaxie et traitement
- Maladie à déclaration obligatoire.
- Isolement du cas.
- Mesures de dératisation sur les navires. Quarantaine. Surveillance des rats dans les ports ainsi que des rongeurs sauvages dans les foyers d'endémie.
- Lutte contre les ectoparasites (insecticides).
- La vaccination est utilisée en zone d'endémie (ex. armée américaine au Vietnam) mais son efficacité est de courte durée (3 à 6 mois).
- La précocité du traitement est capitale. Les formes septicémiques et pneumoniques ont une évolution trop rapide tandis que les antibiotiques sont bien actifs au stade bubonique.
Sensibilité aux antibiotiques
Les molécules efficaces contre Y. pestis sont la streptomycine[3],[4], chloramphénicol ou tétracyclines[5] (dont la doxycycline) ou la gentamicine[6].
Notes et références
- (en) I.Wiechmann, G. Grupe « Detection of Yersinia pestis DNA in two early medieval skeletal finds from Aschheim (Upper Bavaria, 6th century A.D.) » American Journal of Physical Anthropology, 2005-126 :48-55
- (en) Maria A. Spyrou, Rezeda I. Tukhbatova, Chuan-Chao Wang, Aida Andrades Valtueña, Aditya K. Lankapalli, Vitaly V. Kondrashin, Victor A. Tsybin, Aleksandr Khokhlov, Denise Kühnert, Alexander Herbig, Kirsten I. Bos & Johannes Krause, Analysis of 3800-year-old Yersinia pestis genomes suggests Bronze Age origin for bubonic plague, nature.com, 8 juin 2018
- (en) Wagle PM. « Recent advances in the treatment of bubonic plague » Indian J Med Sci 1948;2:489–94
- (en) Meyer KF. « Modern therapy of plague » JAMA 1950;144(12):982–5.
- (en) Kilonzo BS, Makundi RH, Mbise TJ. « A decade of plague epidemiology and control in the Western Usambara mountains, north-east Tanzania » Acta Trop. 1992;50(4):323–9.
- (en) Mwengee W, Butler T, Mgema S. et al. « Treatment of plague with gentamicin or doxycycline in a randomized clinical trial in Tanzania » Clin Infect Dis 2006;42(5):614–21.
Lien externe
- Portail de la médecine
- Portail de la microbiologie
- Portail des maladies infectieuses