Nicotinamide adénine dinucléotide phosphate
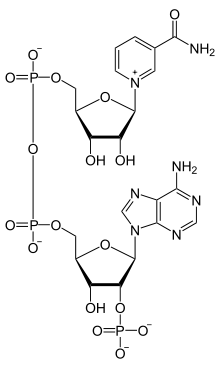
Le nicotinamide adénine dinucléotide phosphate (NADP) est une coenzyme présente dans toutes les cellules vivantes[3]. Il s'agit d'un dinucléotide, dans la mesure où la molécule est constituée d'un premier nucléotide, dont la base nucléique est l'adénine, uni à un second nucléotide, dont la base est le nicotinamide. Le NADP existe sous une forme réduite, notée NADPH, et une forme oxydée, notée NADP+. Très semblable au NAD, il ne diffère chimiquement de ce dernier que par la présence d'un groupe phosphate sur le second atome de carbone du β-D-ribofurannose du résidu d'adénosine. Le NAD est phosphorylé en NADP par la NAD+ kinase tandis que le groupe phosphate du NADP est clivé pour redonner du NAD par la NADP+ phosphatase[4].
| Nicotinamide adénine dinucléotide phosphate | |
  |
|
| Structure du NADPH (à gauche) et du NADP+ (à droite) |
|
| Identification | |
|---|---|
| Nom UICPA | 2’-O-phosphonoadénosine 5’-(3-(1-(3-carbamoylpyridinio)-1,4-anhydro-D-ribitol-5-yl) dihydrogène diphosphate) |
| Synonymes |
triphosphopyridine nucléotide (TPN) |
| No CAS | |
| No ECHA | 100.000.163 |
| No CE | 200-178-1 |
| PubChem | 5885 |
| ChEBI | 18009 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C21H28N7O17P3 [Isomères] |
| Masse molaire[1] | 743,405 ± 0,0253 g/mol C 33,93 %, H 3,8 %, N 13,19 %, O 36,59 %, P 12,5 %, |
| Précautions | |
| SGH[2] | |
 Attention |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Le NADP intervient dans le métabolisme comme transporteur d'électrons dans les réactions d'oxydoréduction, le NADPH comme réducteur et le NADP+ comme oxydant. Plus spécifiquement, le NADPH fournit du pouvoir réducteur dans les réactions de biosynthèse de l'anabolisme, par exemple dans la voie du mévalonate de biosynthèse du cholestérol ou encore dans la biosynthèse des acides gras, ainsi que dans les réactions d'oxydoréduction destinées à protéger les cellules de la toxicité des dérivés réactifs de l'oxygène en régénérant le glutathion GSH[5]. Il est également impliqué dans la génération de radicaux libres par explosion oxydative dans les cellules du système immunitaire (granulocytes neutrophiles), ces radicaux contribuant à la destruction des agents infectieux[6]. Enfin, le NADPH est également la source du pouvoir réducteur utilisé dans l'hydroxylation par les cytochromes P450 des composés aromatiques, des stéroïdes, des alcools et des drogues.
Rôle cellulaire
Au niveau du métabolisme, le NADPH est principalement produit par la phase oxydative de la voie des pentoses phosphates. Le NADPH est la source principale d'électrons utilisés dans les réactions biosynthétiques dans la cellule. Il est également utilisé dans les mécanismes de protection contre le stress oxydant et les espèces réactives de l'oxygène (ROS). La détoxication de ces espèces réactives fait intervenir le glutathion qui doit être régénéré constamment par la glutathion réductase suivant le schéma suivant :
La maladie métabolique connue sous le nom de favisme ou déficit en glucose-6-phosphate déshydrogénase (G6PDH) entraîne un déficit cellulaire en NADPH. Ceci résulte du déficit en G6PDH qui catalyse la première étape de la phase oxydante de la voie des pentoses phosphates. Elle conduit en particulier à une hypersensibilité au stress oxydant.
Différence avec le NADH

NADPH. 
NADH.
Le NADH et le NADPH sont tous les deux des porteurs d'électrons. Mais alors que le NADH est impliqué dans des réactions d'oxydations (où le NAD+ aspire les électrons d'un composé à oxyder : réactions cataboliques), le NADPH, lui, participe à des réactions de réductions (visant à offrir des électrons à un composé : réactions anaboliques). Comme dit précédemment, la différence chimique entre le NADPH et le NADH est le groupement phosphate sur le ribose portant l'adénine en position 2'. Cet unique groupe phosphate est situé trop loin dans la molécule pour pouvoir interférer sur le transfert d'électron s'effectuant sur le cycle pyridine du nicotinamide (situé en haut sur les formules topologiques de la galerie ci-dessus). Les deux molécules possèdent donc des propriétés de transfert d'électrons similaires. En revanche, la présence du phosphate sur le NADPH lui confère une différence de forme spatiale par rapport au NADH. L'intérêt biologique du phosphate (présent sur le NADPH et absent du NADH) réside donc dans la capacité de chaque molécule à être reconnue différentiellement par deux groupes d'enzymes spécifiques. Ainsi, le métabolisme cellulaire dispose de deux voies pouvant fonctionner de manière indépendante : une voie catabolique utilisant le NAD+ et une voie anabolique utilisant le NADPH. En effet, dans les cellules, le ratio NAD+/NADH est maintenu élevé, tandis que le ratio NADP+/NADPH est faible[7].
Articles connexes
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé β-Nicotinamide adenine dinucleotide phosphate hydrate, consultée le 27 avril 2019.
- (en) Sebastiaan K. Spaans, Ruud A. Weusthuis, John van der Oost et Servé W. M. Kengen, « NADPH-generating systems in bacteria and archaea », Frontiers in Microbiology, vol. 6, , p. 742 (PMID 26284036, PMCID 4518329, DOI 10.3389/fmicb.2015.00742, lire en ligne)
- (en) Shigeyuki Kawai et Kousaku Murata, « Structure and Function of NAD Kinase and NADP Phosphatase: Key Enzymes That Regulate the Intracellular Balance of NAD(H) and NADP(H) », Bioscience, Biotechnology, and Biochemistry, vol. 72, no 4, , p. 919-930 (PMID 18391451, DOI 10.1271/bbb.70738, lire en ligne)
- (en) Glenn F. Rush, Joel R. Gorski, Mary G. Ripple, Janice Sowinski, Peter Bugelski et William R. Hewitt, « Organic hydroperoxide-induced lipid peroxidation and cell death in isolated hepatocytes », Toxicology and Applied Pharmacology, vol. 78, no 3, , p. 473-483 (PMID 4049396, DOI 10.1016/0041-008X(85)90255-8, lire en ligne)
- (en) Kishiko Ogawa, Katsuhiko Suzuki, Mitsuharu Okutsu, Kyoko Yamazaki et Shoji Shinkai, « The association of elevated reactive oxygen species levels from neutrophils with low-grade inflammation in the elderly », Immunity & Ageing, vol. 5, , p. 13 (PMID 18950479, PMCID 2582223, DOI 10.1186/1742-4933-5-13, lire en ligne)
- (en) Bruce Alberts, Alexander Johnson, Julian Lewis et Martin Raff, chap. I.2 « Catalysis and the Use of Energy by Cells », dans Molecular Biology of the Cell, , 4e éd. (ISBN 0-8153-3218-1, lire en ligne)
- Portail de la biochimie
- Portail de la biologie cellulaire et moléculaire
- Portail de la chimie