Dracunculose
La dracunculose, autrefois filariose de Médine, est une maladie parasitaire causée par un ver parasite appelé communément ver de Guinée, ou Dracunculus medinensis. Elle fait partie des maladies tropicales négligées.

| Spécialité | Infectiologie, helminthologie et médecine tropicale |
|---|
| CIM-10 | B72 |
|---|---|
| CIM-9 | 125.7 |
| DiseasesDB | 3945 |
| eMedicine | 997617 |
| eMedicine | ped/616 |
| MeSH | D004320 |
| Symptômes | Myalgie, fièvre, nausée, vomissement, prurit et urticaire allergique (en) |
| Maladie transmissible | Pollution de l'eau |
| Causes | Filaire de Médine |
| Médicament | Thiabendazole |
| Patient UK | Guinea-Worm-Disease-(Dracunculiasis) |
![]() Mise en garde médicale
Mise en garde médicale
La larve du parasite est présente dans des crustacés microscopiques, les Cyclops, vivant dans l’eau stagnante. La contamination humaine se fait par ingestion d'eau contaminée. Devenu adulte, le ver filiforme se déplace dans les tissus sous-cutanés vers les extrémités inférieures du corps. Il perce la peau pour pondre ses embryons au contact de l'eau.
Cette maladie peut être invalidante durant plusieurs semaines. Fléau connu depuis l'Antiquité dans les régions subtropicales, elle touchait encore, en 1976, 10 millions de personnes dans 20 pays endémiques. Depuis les années 1980, elle fait l'objet d'une campagne d'éradication mondiale, basée sur l'éducation et l'hygiène de l'eau.
En 2020, on ne compte plus que 27 cas humains de dracunculose, notifiés dans 6 pays : 12 au Tchad, 11 en Éthiopie, et 1 cas dans chacun des pays suivants : Angola, Cameroun, Mali et Soudan du Sud.
Histoire
Le nom de Dracunculus vient du latin « petit dragon ».
Maladie
C'est une maladie connue depuis l'Antiquité. Des médecins historiens du XIXe siècle ont vu la dracunculose dans le Nahash ou « serpent de feu » qui frappe le peuple de Moïse dans le Livre des Nombres ; cette interprétation a été contestée par la suite par des historiens modernes[1].
De même la mention de l'affection en médecine égyptienne, dans le papyrus Ebers, est l'objet de discussions. Cependant, dans une momie égyptienne, datée environ mille ans avant J-C, on a pu retrouver, sous forme calcifiée, un ver Dracunculus[2].

La maladie est citée dans des textes assyriens de l'époque du roi Assurbanipal (VIIe siècle, av.J.C.) chez des prisonniers de ses expéditions en Égypte ; ce qui signerait la propagation de la maladie en Mésopotamie.
Les conquêtes d'Alexandre le Grand auraient apporté la maladie en Asie centrale et en Inde[1]. D'autres estiment que l'affection était déjà mentionnée dans un texte de l'antiquité indienne, le Rig-Véda[3].
Une autre théorie controversée est celle qui fait de la méthode d'extraction du ver de Guinée (enroulement autour d'une baguette de bois) l'origine du bâton d'Asclépios[4].
Plusieurs auteurs gréco-romains signalent la maladie, dont l'écrivain Agatharchidès au IIe siècle av. J.-C., en Grèce antique, qui la décrit comme endémique chez les peuples nomades de ce qui est maintenant le Soudan et le long de la mer Rouge. Galien la signale sous le nom de dracontiasis[4].
En Islam médiéval, Rhazès et Avicenne en donnent la première description clinique détaillée. Avicenne la nomme « maladie de Médine », tellement elle est habituelle dans la région.
Au XVIe siècle, Ambroise Paré appelle le parasite « dragonneaux qui naissent es jambes des hommes en quelque endroit d'Arabie ». Pour lui, il ne s'agit pas de vers, mais de produits d'ébullition du sang expulsés des veines[5]. Les premiers explorateurs européens, d'abord espagnols et portugais, retrouvent la maladie sur la côte de Guinée. Les Anglais l'appellent Guinea worm et les français « ver de Guinée»[4].
En 1674, le médecin allemand Georg Hieronymus Welsch (de) décrit clairement le parasite dans sa monographie[6], et c'est Linné qui lui donne son nom scientifique moderne Dracunculus medinensis en 1758.
En 1819, Carl Asmund Rudolphi découvre que le ver de Guinée est une femelle contenant des formes larvaires. Des médecins militaires britanniques détectent la présence de ces larves dans l'eau, et croient d'abord, à tort, que la contamination se fait par voie transcutanée[2].
En 1870, au cours de ses recherches dans le Turkestan russe, Aleksei Fedchenko découvre le rôle des cyclops dans le développement du parasite[4], ainsi que la contamination probable par ingestion d'eau contaminée. Ces travaux seront confirmés par Patrick Manson en 1894. Le cycle complet de la maladie est établi par le bactériologiste indien Dyneshvar Atmaran Turkhud en 1913[2].
Répartition géographique
L'Afrique est considérée comme le continent d'origine de la maladie, de la vallée du Nil jusqu'en Afrique de l'Ouest et au Golfe de Guinée. Historiquement la maladie était fréquente en Perse et au Moyen-Orient, jusqu'au Turkestan et en Inde[7].

Le continent américain (régions tropicales et subtropicales) a été atteint lors du commerce des esclaves, mais la maladie ne s'y est pas maintenue. Les derniers cas datent du milieu du XXe siècle, comme au Brésil (Bahia) ou dans les Guyanes[8]. De même l'Océanie a pu être touchée comme aux îles Fidji.
La maladie sévissait surtout dans les régions chaudes et arides, le développement du parasite nécessitant de l'eau et une température supérieure à 19 °C. La maladie humaine apparait alors autour des rares mares et puits disponibles, là où s'opèrent les contacts nécessaires entre le parasite et la population venant se ravitailler en eau[7]. Elle était la plus répandue dans les villages des zones rurales très isolées et dans les zones où se déplacent des groupes nomades.
Au cours du XXe siècle, l'extension géographique de la maladie se réduit considérablement avec l'amélioration du niveau de vie et surtout de l'accès à l'eau potable. Dans les années 1930, la maladie est éliminée dans le Turkestan soviétique, et en Iran dans les années 1970. Dans les années 1980, l'Inde et le Pakistan entament une campagne d'élimination de la dracunculose[4], ces pays seront certifiés indemnes en 1996.
À la fin du XXe siècle, la maladie reste présente en Afrique sub-saharienne (tropicale et subtropicale).
Fardeau social
En 1947, plus de 48 millions de personnes étaient atteintes de la maladie (Afrique, Moyen-Orient, Inde).
La maladie ne présente guère de risque vital, mais elle est connue pour provoquer des incapacités temporaires de plusieurs semaines, perturbant les travaux agricoles et les activités scolaires dans les communautés atteintes. Au Mali, chez les Dogons, la dracunculose est appelée «la maladie des greniers vides»[9].
En 1976, l'OMS estime à 10 millions le nombre de cas dans le monde dans une vingtaine de pays. Dans la même période, la dracunculose fait perdre chaque année en Inde, plus de 11 millions de journées de travail chez 4 % (personnes atteintes) de la population des villages en zone endémique. Au Nigéria, une étude réalisée en 1987, estime cette perte à 20 millions de $ US par récolte annuelle.
En 1981, l'OMS fait de la réduction de la dracunculose, un indicateur de progrès dans sa campagne internationale d'accès à l'eau potable. En 1989, l'OMS prend la décision d'éradiquer mondialement la dracunculose.
En 1997, la Banque mondiale estime que le retour sur investissements pour réduire la dracunculose est de 29 % pour la période 1987-1998[9].
Cycle évolutif
Contamination humaine
Une eau contaminée contient des crustacés minuscules, les cyclops, dont la taille moyenne est de l'ordre du mm. Ces cyclops, de la sous-classe des copépodes, peuvent contenir une larve parasitaire (en général une seule larve par cyclops).
La contamination se fait par ingestion d’eau contaminée (non filtrée). L’acide gastrique digère les crustacés, mais pas les larves du ver de Guinée abritées à l'intérieur. Ces larves gagnent ensuite l’intestin grêle pour en traverser la paroi et se disséminer à l’intérieur du corps, probablement dans le tissu rétro-péritonéal[7].
Phase interne
.png.webp)
Les larves parviennent au stade adulte en trois mois environ. L'accouplement a lieu lorsque mâle et femelle ont encore la même taille[10]. Après l'accouplement, le mâle, dont la longueur ne dépasse pas les 4 cm, meurt et disparaît par résorption. Les femelles fécondées continuent leur croissance pour atteindre une longueur allant jusqu'à 100 cm (60-80 cm en moyenne), pour un diamètre de moins de 2 mm.
La femelle fécondée se déplace à l'intérieur du corps, attirée par les régions déclives, dans 90 % des cas vers la région des pieds et des chevilles. Ses œufs fécondés éclosent dans son utérus sous forme d'embryons, au nombre de un à trois millions[10],[11].
Son corps n'est plus qu'un long sac presque entièrement occupé par l'utérus clos bourré d'embryons, son tube digestif est complètement aplati et non fonctionnel[10]. Au bout d'un an environ après l'infestation, arrivée à ce stade, et à proximité de la peau, la femelle cherche une issue en sécrétant une toxine irritante pour percer le revêtement cutané.
Il se forme ainsi une plaie où se présente l'utérus du parasite. Il suffit d'un contact avec de l'eau pour que l'utérus se contracte et se rompe en expulsant plusieurs centaines de milliers d'embryons. Le processus peut se répéter à chaque contact hydrique pendant une dizaine de jours.
Lorsque l'utérus est vidé, le ver parasite meurt pour se résorber ou être expulsé par fragments dans du pus[7].
Phase externe aquatique
Les embryons libérés dans l'eau sont des larves appelées microfilaires de 600 μm de long, qui nagent à la façon des têtards et peuvent survivre quelques jours dans l'eau. Elles sont avalées par des petits crustacés transparents, les cyclops. La larve occupe la cavité générale d'un cyclops qui ne parait pas incommodé. Elle effectue son développement en trois stades séparés par deux mues, en deux à quatre semaines environ. La larve est alors infectante, prête à parasiter son hôte définitif ingérant son hôte intermédiaire[8].
Épidémiologie
La distribution inégale de la maladie est fonction de l'approvisionnement en eau. Dans les pays à eau courante, les fleuves et rivières sont pauvres en cyclops car ils sont entraînés par le flot, alors qu'ils peuvent se concentrer en eau stagnante dans les étangs, mares, citernes et puits.
Un cycle de contamination se perpétue ainsi à partir d'un point d’eau, plus ou moins rudimentaire, qui est souvent le seul dont dispose toute la communauté. Rythmée par les saisons de pluie ou de culture, la dracunculose réapparaît chaque année dans les villages touchés, les malades venant soulager leurs pieds dans l'eau.
La maladie est saisonnière, dépendant de facteurs climatiques et humains. Dans le Sahel, la transmission se fait en général à la saison des pluies (de mai à août) quand les points d'eau de surface sont disponibles. Dans les zones forestières et de savane humide, la maladie s'observe plutôt en saison sèche (de septembre à janvier), quand les eaux stagnantes de surface se raréfient et concentrent les cyclops. Ces deux modèles principaux s'accompagnent de nombreuses variations locales[12],[13].
Le développement de la larve parasitaire ne peut se faire à une température inférieure à 19 °C. Sa température optimale (développement le plus rapide) est d'environ 26 °C[8].
Les sujets les plus souvent atteints sont les jeunes adultes (15 à 45 ans), notamment lors de travaux agricoles, car ils boivent alors de grandes quantités d'eau contaminée. Les enfants d'âge scolaire ou les femmes peuvent présenter un fort taux d'infestation selon les zones locales et leur exposition relative[4].
En 2018, la maladie reste présente dans trois pays d'endémie : Éthiopie, Mali et Tchad. Deux pays sont en voie de certification «pré-certifiés» (voir section Éradication) : Soudan et Soudan du sud.
Clinique
La maturation du ver dans l'organisme humain est le plus souvent silencieuse. Le ver qui cherche à s'extérioriser est solitaire près d'une fois sur deux, mais il est possible de dénombrer plus de vingt parasites chez un même sujet.
Le ver peut mourir avant ou au cours de son déplacement. Le cadavre du ver se calcifie en quelques mois en étant visible à la radiographie. Cette éventualité constitue une forme de guérison, mais selon la localisation (proximité d'un tronc nerveux, d'une articulation...), des patients peuvent ressentir des douleurs[8].
Évolution non compliquée
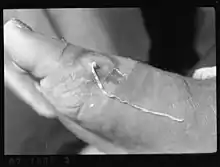
Lorsque la femelle fécondée commence à se déplacer et se rapproche de la peau, des manifestations de type allergique peuvent survenir : urticaire, nausées, troubles respiratoires d'allure asthmatique... Une éruption locale avec démangeaisons peut se produire au niveau du point où se formera la plaie de sortie du ver.
À cet endroit, se constitue un empâtement profond et douloureux, recouvert d'une peau inflammatoire, sur laquelle apparait une cloque de quelques mm à 4 cm de diamètre. Cette cloque ou phlyctène finit par se rompre. Elle laisse une ulcération au fond de laquelle une portion blanchâtre du ver peut être visible.
Au voisinage et sous la peau, le reste du ver est palpable sous la forme d'un cordon induré ou d'une masse pelotonnée, il peut aussi rester caché dans une masse inflammatoire. Le sujet atteint ressent des douleurs à type de brûlures.
Après rupture de la peau, et vidange de ses embryons, le ver meurt et son cadavre s'élimine peu à peu. En l'absence de complications, l'orifice de sortie cicatrise en quelques semaines. La maladie peut souvent durer des mois lorsqu'il existe plusieurs vers[7],[8].
Complications
Les complications sont fréquentes : surinfections, ruptures du ver, égarements du ver et complications de voisinage. Ces complications peuvent immobiliser le patient jusqu'à un an.
La surinfection est due au manque d'hygiène de la plaie de sortie : ulcère infecté, phlegmon, voire fièvre élevée et septicémie. Les surinfections par tétanos ou gangrène gazeuse sont rares mais possibles.
Les ruptures du ver peuvent être spontanées ou plus souvent liées à des tentatives maladroites d'extraction. Le morceau de ver se rétracte au fond des tissus, occasionnant des réactions allergiques (inflammations musculaires) et suppurations.
En se déplaçant au voisinage d'une articulation, le ver peut provoquer une réaction d'hydarthrose (épanchement articulaire). S'il pénètre dans l'articulation, il entraine une arthrite septique ou non, avec des risques de séquelles articulaires et musculaires définitives (risque historique).
Au cours de ses déplacements, le ver peut s'égarer (environ 10 % des cas) et chercher à s'extraire en dehors de la région du pied et de la cheville. Toutes les localisations de sortie possibles ont été observées : à la face, à la langue, au bras, au dos, au sein chez la femme, au scrotum chez l'homme... Le ver peut aussi manquer la peau et finir par mourir au niveau d'un organe thoracique ou abdominal, ou comprimer des troncs nerveux, voire la moelle épinière. Ces localisations peuvent simuler des urgences médicales ou chirurgicales, de diagnostic plus difficile que les sorties cutanées[7],[8].
L'infection ne procure pas d'immunité, et la maladie peut se répéter chaque année.
Traitement
Il n'existe aucun médicament ou vaccin susceptibles de prévenir ou traiter efficacement la dracunculose. Le traitement repose sur la méthode traditionnelle.
Médicaments
De nombreux produits ont été utilisés depuis le XIXe siècle en étant globalement inefficaces, avec des effets secondaires importants pour le patient lorsqu'on cherchait à obtenir la mort du ver. De même l'injection d'un produit dans le corps du ver lui-même (pour le tuer ou l'anesthésier) a été abandonnée en raison des risques de ruptures du ver, et des complications liées à une élimination par abcès[7].
Depuis les années 1960, plusieurs médicaments antihelminthiques ont été proposés comme le thiabendazole (Mintezol), le métronidazole (Flagyl), le mébendazole (Vermox)... Ils ne sont guère utilisés, car s'ils peuvent faciliter l'extraction du ver à la peau, par une action de type anti-inflammatoire, ils n'ont pas d'action efficace sur les vers non encore émergents. Le mébendazole peut entrainer une migration anormale du ver, compliquant la maladie[14].
Les produits couramment employés sont symptomatiques (antalgiques, anti-inflammatoires...). Les surinfections sont traitées par antibiotiques, ainsi que la vaccination pour la prévention du tétanos.
Méthode traditionnelle
Vieille de trois mille ans[15], cette méthode consiste à enrouler le ver autour d'un bâtonnet, au niveau de l'orifice de sortie. La femelle adulte est extraite du patient à raison de quelques cm par jour. On enroule d'un tour ou plus, sans jamais forcer, en s'arrêtant à la moindre résistance. Ce processus très lent peut prendre plusieurs jours et, dans certains cas, jusqu'à quelques semaines, mais il est nécessaire pour éviter la rupture du parasite[7],[16].
Cette technique nécessite un agent de santé entrainé (sinon une rupture survient près d'une fois sur deux), pouvant aussi prodiguer des soins infirmiers réguliers (désinfection cutanée, pansements humides, bandage, recommandations...)[9].
Chirurgie
La chirurgie est utilisée lors de complications sévères, notamment les phlegmons des parties molles, les abcès articulaires, les compressions médullaires... Elles associent incisions, drainages, libération ou ponction évacuatrice[8].
Éradication de la dracunculose
Dans les années 1980, l'OMS adopte plusieurs résolutions pour réduire régionalement la dracunculose. En 1989, la décision est prise de l'éradiquer mondialement. Le suivi mondial est coordonné par l'OMS avec l'appui des CDC américains, de la Fondation Carter, et de l'UNICEF[9].
Programmes
Les programmes d'éradications reposent sur la surveillance des cas, l'approvisionnement et le contrôle de l'eau, et l'éducation.
Surveillance
.jpg.webp)
La surveillance consiste à dépister rapidement les personnes atteintes pour les traiter, éviter une surinfection et extraire le ver. Il faut leur faire comprendre qu'elles ne doivent pas tremper leurs lésions dans les marigots, afin d'interrompre le cycle de transmission. Les pays endémiques qui n'ont plus de cas durant un an sont dits «pré-certifiés», au bout de trois ans s'ils n'ont toujours aucun cas, ils sont certifiés indemnes de dracunculose.
Au fur et à mesure que les cas se raréfient, la recherche des derniers cas doit être menée de façon active, par exemple au porte-à-porte ou encore avec l'octroi de récompenses pour le signalement de cas (de 40 à 160 $ US par cas confirmé durant la phase de pré-certification)[9]. Cette surveillance doit se poursuivre jusqu'à l'éradication mondiale de la dracunculose.
Éducation et contrôle de l'eau
L'approvisionnement en eau consiste à protéger les points d'eau (couverture maçonnée, grillage...) pour éviter de s'y tremper, à améliorer les accès rudimentaires (margelles surélevées, installation de pompes...). Durant la saison de transmission, un produit chimique, le téméphos, peut être utilisé dans les points d'eaux stagnantes pour détruire le vecteur (cyclops) et rendre l'eau potable.
L'arme principale de la campagne est l'éducation. Des volontaires locaux expliquent le cycle de vie du parasite. Ils apprennent aux villageois africains à filtrer l'eau à travers du tissu (filtres en nylon par exemple) ou un filtre portatif (paille ou pipe équipée de filtres). Les filtres à pores de 0,15 mm de diamètre sont suffisants[13].
Les campagnes d'informations s'appuient aussi sur une série de films-documentaires[9].
Premiers résultats (1989-2012)
Dans le monde entier, il y avait environ 3,5 millions de cas rapportés en 1986, dans une vingtaine de pays. En 1989 on compte un million de cas. L'objectif d'éradication, d'abord prévu pour 1995, a été plusieurs fois reporté (en 2004 pour 2009, en 2012 pour 2015).
En 1996, la maladie est certifiée éradiquée au Pakistan et en Inde.

En 2003, il reste 33 000 cas dans douze pays endémiques, tous en Afrique sub-saharienne : Bénin, Burkina Faso, Côte d’Ivoire, Éthiopie, Ghana, Mali, Mauritanie, Niger, Nigéria, Ouganda, Soudan et Togo[17].
En 2006, on compte 25 000 cas mondiaux, le Ghana et le Soudan représentant 98 % des cas. Le Mali a connu un taux de réduction de 58 % des cas, le Togo de 63 %, le Nigeria de 66 % et le Burkina Faso de 73 %. Le Sénégal est le premier pays africain à avoir éradiqué cette maladie[18].
En 2010, 1 800 cas sont notifiés, la plupart dans quatre pays seulement : Éthiopie, Mali, Soudan du sud et Tchad[19].
En 2011, seuls 1 058 cas mondiaux ont été recensés. La transmission de la dracunculose est certifiée interrompue dans plusieurs pays africains, comme le Kenya, le Sénégal, le Cameroun, la République centrafricaine (2007) et le Yémen (2004).
En 2012, on compte 541 cas dont plus de 95 % au Soudan du Sud, où les conflits armés rendent très difficiles les actions sanitaires.
Phase finale (2013-?)
Début 2013, l'objectif d'éradication est reporté à 2015[20].
Problèmes en cours
Avec les problèmes d'insécurité (conflits armés), les infections animales sont devenues l'un des deux obstacles principaux à l'éradication complète de la dracunculose.

Depuis 2012, les cas de transmission chez l'animal (babouins, chiens...) sont apparus de façon significative. Connus depuis longtemps, ils étaient considérés comme un phénomène marginal ou anecdotique : dans les régions de forte endémie humaine, la dracunculose humaine à D. medinensis pouvait toucher accessoirement des animaux.
Avec la réduction de la dracunculose à quelques centaines de cas mondiaux, la dracunculose chez les chiens est apparue prédominante, surtout au Tchad. Les CDC américains ont confirmé que les animaux infectés étaient bien infectés par D. medinensis (entre autres par empreinte génétique). De nouveaux modes de contamination sont discutés comme la consommation d'animaux aquatiques parasités (poissons, grenouilles...) crus ou mal cuits[15],[21]. Il s'agirait de cas humains ou animaux transmis par des hôtes paraténiques[14] (hôte surnuméraire facultatif).
Les raisons de l'émergence de dracunculose canine au Tchad (et guère ailleurs) ne sont pas connues. L'hypothèse écologique (surpêche, sècheresse...) est contredite par le fait que les pratiques incriminées sont séculaires, et l'infection canine absente dans le passé. De même, les différences génétiques éventuelles de D. medinensis au Tchad ne paraissent pas jouer un rôle significatif[21].
2018 et 2019
En 2018, 28 cas humains ont été notifiés : (17 au Tchad, 10 au Soudan du Sud, et 1 en Angola) depuis le début de l'année. Pour la même année, chez les chiens domestiques, on compte 1 069 (1 040 au Tchad, 11 en Éthiopie, et 18 au Mali) contre 855 en 2017[22].
En 2019, 54 cas humains ont été notifiés dans 3 pays : 48 au Tchad, 4 au Soudan du Sud, 1 en Angola et 1 (cas importé probable du Tchad) au Cameroun. Quatre autres pays sont en attente de certification d'éradication : l'Éthiopie, aucun cas humain notifié depuis 2018, le Mali depuis 2016, la République démocratique du Congo, et le Soudan. La surveillance de cette maladie est rendue difficile par l’insécurité imputable aux conflits, les troubles civils, comme les vols de bétail, et les déplacements massifs de populations.[23]
En 2019, chez les chiens domestiques, on compte 1935 cas au Tchad, 8 au Mali, 2 en Éthiopie, et 1 en Angola[23].
2020 et 2021
En 2020, 27 cas humains de dracunculose ont été notifiés dans 6 pays : 12 au Tchad, 11 en Éthiopie, et 1 cas dans chacun des pays suivants : Angola, Cameroun, Mali et Soudan du Sud[24]. Chez les chiens domestiques, toujours en 2020, on compte 1508 cas canins au Tchad, 9 au Mali et 3 en Éthiopie[24].
En 2021, pour la période janvier-mai, 5 cas de dracunculose ont été notifiés (4 au Tchad et 1 en Éthiopie) contre 19 en 2020 pour la même période[25].
En théorie, la dernière personne au monde à souffrir de dracunculose peut désormais survenir à tout moment. Cependant, cela ne pourra être su qu'au bout d'un an, et véritablement confirmé que plusieurs années après[21] (en principe trois ans après le dernier cas humain ou animal).
Notes et références
- P B Adamson, « Dracontiasis in antiquity. », Medical History, vol. 32, no 2, , p. 204–209 (ISSN 0025-7273, PMID 2967412, PMCID PMC1139858, lire en ligne, consulté le )
- F. E. G. Cox, « History of Human Parasitology », Clinical Microbiology Reviews, vol. 15, no 4, , p. 595–612 (ISSN 0893-8512, PMID 12364371, DOI 10.1128/CMR.15.4.595-612.2002, lire en ligne, consulté le )
- « OMS | Historique et dates importantes », sur www.who.int (consulté le )
- (en) Donald R. Hopkins, Dracunculiasis, Cambridge, Cambridge University Press, , 1176 p. (ISBN 0-521-33286-9), p. 688.dans The Cambridge World History of Human Disease, K.F. Kiple (dir.).
- Jean Théodoridès, Histoire de la parasitologie, Albin Michel / Laffont / Tchou, , p. 155.dans Histoire de la Médecine, tome VIII, J. Poulet et J.-C. Sournia (dir.).
- « Georg H. Velsch » Exercitatio de Vena Medinensi... 1674.
- Y-J. Golvan, Elements de parasitologie médicale, Paris, Flammarion, , 571 p. (ISBN 2-257-12589-4), p. 72-75.
- Marc Gentilini, Médecine tropicale, Paris, Flammarion Médecine-Sciences, , 928 p. (ISBN 2-257-14394-9), p. 214-220.
- Gautam Biswas, Dieudonne P. Sankara, Junerlyn Agua-Agum et Alhousseini Maiga, « Dracunculiasis (guinea worm disease): eradication without a drug or a vaccine », Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences, vol. 368, no 1623, , p. 20120146 (ISSN 1471-2970, PMID 23798694, PMCID PMC3720044, DOI 10.1098/rstb.2012.0146, lire en ligne, consulté le )
- Sandy Cairncross, Ralph Muller et Nevio Zagaria, « Dracunculiasis (Guinea Worm Disease) and the Eradication Initiative », Clinical Microbiology Reviews, vol. 15, no 2, , p. 223–246 (ISSN 0893-8512, PMID 11932231, DOI 10.1128/CMR.15.2.223-246.2002, lire en ligne, consulté le )
- « OMS | Informations sur la dracunculose (1) », sur www.who.int (consulté le )
- Donald R. Hopkins 1993, op. cit., p. 687.
- « OMS | Informations sur la dracunculose (2) », sur www.who.int (consulté le )
- Sandy Cairncross, Ralph Muller et Nevio Zagaria, « Dracunculiasis (Guinea Worm Disease) and the Eradication Initiative », Clinical Microbiology Reviews, vol. 15, no 2, , p. 223–246 (ISSN 0893-8512, PMID 11932231, DOI 10.1128/CMR.15.2.223-246.2002, lire en ligne, consulté le )
- Habtamu Bedimo Beyene, Abyot Bekele, Amanu Shifara et Yehenew A. Ebstie, « Elimination of Guinea Worm Disease in Ethiopia; Current Status of the Disease’s, Eradication Strategies and Challenges to the End Game », Ethiopian medical journal, vol. 55, no Suppl 1, , p. 15–31 (ISSN 0014-1755, PMID 28878428, PMCID PMC5582630, lire en ligne, consulté le )
- (en) Tropical Medecine Central Ressource, ch. 27 (lire en ligne).
- [PDF]Dracunculiasis eradication: Geneva declaration on guinea-worm eradication, Wkly Epidemiol Rec, 2004;79:234-235.
- [PDF]Dracunculiasis eradication: global surveillance summary, 2006, Wkly Epidemiol Rec, 2007;82:133-140.
- REH du 11 mai 2012 : Éthiopie, Mali, Soudan du Sud et Tchad.
- Charlotte Chabas, « En Afrique, la guerre du ver en passe d'être gagnée », Le Monde.fr, (consulté le ).
- Donald R. Hopkins, Ernesto Ruiz-Tiben, Mark L. Eberhard et Adam Weiss, « Dracunculiasis Eradication: Are We There Yet? », The American Journal of Tropical Medicine and Hygiene, vol. 99, no 2, , p. 388–395 (ISSN 0002-9637, PMID 29869608, PMCID PMC6090361, DOI 10.4269/ajtmh.18-0204, lire en ligne, consulté le )
- OMS, « Eradication de la dracunculose, bilan 2018 », Relevé épidémiologique hebdomadaire, vol. 94, no 20, , p. 233-235 et 252. (lire en ligne)
- OMS, « Éradication de la dracunculose: bilan de la surveillance mondiale, 2019 », Relevé Epidémiologique Hebdomadaire, vol. 95, no 20, , p. 209-212. (lire en ligne)
- OMS, « Éradication de la dracunculose: bilan de la surveillance mondiale, 2020 », Relevé épidémiologique hebdomadaire, vol. 96, no 21, , p. 173 et 175. (lire en ligne)
- OMS, « Rapport mensuel des cas de dracunculose, janvier-mai 2021 », Relevé Épidémiologique Hebdomadaire, vol. 96, no 37, , p. 458-459
Voir aussi
Bibliographie
- (en) WHO, Eradication of dracunculiasis : a handbook for international certification teams, WHO, , 45 p. (ISBN 978-92-4-150830-8, lire en ligne).
Articles connexes
Liens externes
- (fr) Cours sur la dracunculose (Université UCL, Canada).
- « L'éradication de la dracunculose », sur who.int (version en français ; passer à celle en anglais pour les données plus récentes)..
- Portail de la médecine
- Portail de la parasitologie
_during_a_sandstorm_day.jpg.webp)