Cryptorchidie
La cryptorchidie est l'absence d'un ou des deux testicules dans le scrotum (chez l'homme et chez les animaux à testicules externes).

| Spécialité | Génétique médicale |
|---|
| CIM-10 | Q53 |
|---|---|
| CIM-9 | 752.5 |
| OMIM | 219050 |
| DiseasesDB | 3218 |
| MedlinePlus | 000973 |
| eMedicine | 377971 et 1017420 |
| eMedicine | med/2707 radio/201 ped/3080 |
| MeSH | D003456 |
![]()
Elle inclut l’ectopie testiculaire, qui est l'insertion du testicule dans un autre endroit, hors des bourses et de son trajet normal, en raison d'un arrêt de la migration du testicule lors de son trajet de descente ; entre la région lombaire où il se forme et son emplacement naturel dans le scrotum.
Le testicule est dit ectopique s'il se trouve au niveau crural ou plus haut si sa descente a été bloquée.
Un bébé atteint de cryptorchidie a 60 % de risque de plus que les autres de stérilité à l'âge adulte, mais ce risque est diminué en cas de rémission ou d'opération chirurgicale précoce.[réf. nécessaire]
Ces deux anomalies, notamment si associées à un hypospadias ou micropénis peuvent être un des éléments du Syndrome de dysgénésie testiculaire. Dans certains cas, il peut y avoir doute sur le sexe de l'individu (« ambiguïté sexuelle » ou intersexe)
Étymologie
Cryptorchidie vient du grec
- «crypto» signifiant «caché» ;
- «orkhidion» signifiant «testicule».
Fréquence, prévalence
Le cryptorchidisme est l'une des anomalies les plus fréquentes à la naissance chez les jeunes garçons (elle en touche presque 5 % à la naissance en Europe), et 30 % des nourrissons mâles prématurés ont au moins un testicule non-descendu. Il est souvent associé à des problèmes physiques de différenciation sexuelle, de malformations rénales et urétérales, de dysplasies, d'anomalies vertébrales de la T10 (dixième vertèbre thoracique) ou de la S5 (cinquième vertèbre sacrale)[2].
C'est une malformation dont l'incidence touchait - à la naissance, dans les années 1960-1980 - environ 3 à 4 % des nouveau-nés. Mais son incidence augmente et de manière géographiquement inégale, ce qui laisse penser que certains facteurs environnementaux ou comportementaux sont en cause[3],[4].
- Par exemple, en Italie, sur 10 730 petits garçons nés en Italie sur 20 ans (entre 1978 et 1997) examinés pour un éventuel cryptorchidisme (1 387 prématurés nés avant la 37e semaine, et 9 343 nés à terme), 737 d'entre eux avaient une crytporchidie à la naissance (soit 6,9 %)[5] ;
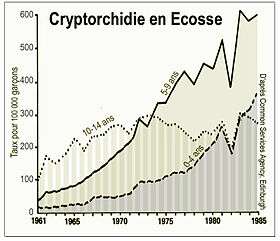
- En Angleterre et au Pays de Galles, le taux de garçons touchés semble avoir doublé en 20 ans entre 1962 et 1981[6]. L'Écosse a également enregistré une forte augmentation des cas (voir graphique ci-contre)[1] ; plus qu'en Angleterre et qu'au Pays de Galles, pour des raisons non comprises, avec une différence plus importante dans le groupe d'âge 0-4 ans, cette différence pouvant peut-être, pour partie au moins, être expliquée par le fait que, ces années-là, les chirurgiens opéraient des garçons plus jeunes en Écosse qu'en Angleterre et au Pays de Galles[1]. Les variations de diagnostic de cryptorchidie observées entre la période post-néonatale et la puberté, peuvent pour partie être liées aux difficultés de diagnostic en cas de remontée testiculaire par réflexe crémastérien ou de la tunique vaginale[7]. En Écosse, le taux cumulatif d'orchidopexie à 14 ans dans la cohorte étudiée sur 25 ans (graphique ci-contre) était prévu de 3 à 8 % par rapport au taux de cryptorchidie de 1 à 4 % enregistrée dans les comptes rendus de services néonataux. Une hypothèse pouvant expliquer cet apparent écart est que les chirurgiens opèrent un nombre significatif d'enfants avec des testicules rétractiles et/ou que des cryptorchidies acquises après la naissance sont plus fréquentes qu'on ne le pensait.
Cryptorchidie et hypospadias sont en forte augmentation dans certains pays : + 65 à 77 % au cours des dernières décennies au Royaume-Uni pour les cryptorchidies et doublement des cas d'hypospadias pour la seule décennie 1970 - 1980 aux États-Unis.
Le Danemark détient le record de cryptorchidisme avec environ 9 % des enfants touchés, contre 2,3 % seulement en Finlande (pays le moins touché)[3]. Or ces deux pays détiennent aussi des records opposés en matière de délétion de la spermatogenèse et de dysgénésie testiculaire[8],[9].
On parle même d'« exception finlandaise » pour désigner le fait que ce pays semble être celui où la spermatogenèse semble le moins diminuer depuis 50 ans. On a aussi constaté que les testicules des garçons danois étaient à la naissance plus petits que ceux des Finlandais (avec un retard de croissance pouvant atteindre l'équivalent de 18 mois)[3]. Ce phénomène est accompagné d'anomalies hormonales telle que la diminution des taux sériques d'inhibine B (un peptide hormonal, considéré comme marqueur de la fonction des cellules de Sertoli, et dont la production est normalement plus élevée chez les garçons dans les 3 à 15 mois suivant la naissance que chez l'adulte, ce qui indique que cette période est très importante pour la maturation du testicule, de la différenciation sexuelle et des cellules de Sertoli, et que les gonades mâles sont encore probablement très vulnérables aux perturbateurs endocriniens dans les 15 mois suivant la naissance[3],[10]) et de production l'hormone FSH dans les 3 premiers mois suivant la naissance.
Les bébés mâles danois sont plus souvent plus petits et ont également une prévalence plus élevée de cryptorchidies et d'hypospadias que les petits Finlandais. Chez les garçons atteints de cryptorchidie et d'hypospadias des changements hormonaux subtils sont constatés (augmentation de gonadotrophines et diminution d'inhibine B dans la cryptorchidie)[3]. Les deux types de malformations congénitales sont plus fréquents chez les enfants nés « petits pour l'âge gestationnel », ce qui montre un lien entre la croissance des garçons in utero et le développement des organes reproducteurs[3].
Dans le monde, elle est bilatérale dans environ 20 à 25 % des cas ; sinon, pour des raisons non élucidées, le testicule droit est plus souvent non-descendu.
De la moitié[11] aux 3/4 des cas se résolvent spontanément avant l'âge de 3 mois grâce à une production naturelle et normale par le bébé de gonadotrophine et de testostérone entre le premier et le quatrième mois de la vie. À un an la cryptorchidie ne concerne plus que 1 % des garçons. Des séquelles persisteront néanmoins souvent, même chez les bébés chez lesquels une descente spontanée a eu lieu dans les 3 premiers mois (le bilan hormonal montre comme séquelle un déficit en certaines hormones).
Ces deux malformations sont statistiquement associées à un risque plus grand de survenue d'un cancer du testicule (risque multiplié par 3,6, voire 5,2, selon les études)[12][réf. insuffisante],[13],[14].
Causes et facteurs de risque
Les causes ne sont pas toutes identifiées. Un petit pourcentage des cas ont une cause génétique (les cas de syndrome de Klinefelter[15] par exemple). Dans les autres cas, des interactions gène-environnement ou des perturbateurs endocriniens semblent en cause[3],[16] :
- un hypogonadisme fœtal ou du bébé peut être impliqué ;
il sera confirmé par une diminution du taux sanguin d'hormones androgéniques dans le sang.
En l'absence de facteurs génétiques, une exposition à des reprotoxiques ou à des perturbateurs endocriniens peut alors être une cause première. Souvent, un déficit en hormone hypophysaire semble induit par une inhibition de la fonction hormonale de l'hypothalamus de l'embryon (in utero), perturbant l'axe hormonal hypothalamo-pituitaro-testiculaire[17],[18],[19].
Dans certains cas, notamment quand il est inclus dans un syndrome de dysgénésie testiculaire, l'origine pourrait être l'exposition de l'embryon ou du fœtus ou du bébé à des perturbateurs endocriniens (féminisants), inhibant l'activité du système de traction des testicules vers le scrotum, lors du processus de différenciation sexuelle de l'embryon[20] et éventuellement inhibant la production d'hormone antimullérienne[21]. Le testicule reste alors bloqué dans la cavité abdominale, le plus souvent dans le canal inguinal (60 % des cas) ; - l'exposition in utero (du fœtus) à l'alcool ;
Même une quantité modeste d'alcool absorbée par la mère triple le risque de cryptorchidie (comparativement à ce qu'il est pour une mère ne buvant pas d'alcool), à partir de seulement 5 verres d'alcool par semaine (voire moins, selon une étude faite au Danemark et en Finlande, sur 10 ans, via le suivi de 5 000 femmes enceintes et de leurs enfants, dont 128 étaient victimes de cryptorchidie[22]) ; - l'exposition du fœtus à certains pesticides ou résidus de pesticides ;
C'est un facteur de risque avéré chez l'animal et chez l'Homme, même avec une exposition très ponctuelle, si elle se fait à un moment-clé de la formation maturation des organes sexuels masculins du fœtus.
Ce sont alors des effets toxiques et/ou - à faibles doses - de perturbateur endocrinien dus à ces molécules qui sont en cause.
Divers pesticides utilisés en agriculture et jardinage ont montré un effet œstrogène et d'autres effets perturbateurs. Des études antérieures avaient déjà montré un risque accru de malformations uro-génitales chez les fils d'applicateurs de pesticides (sans pouvoir préciser si l'anomalie venait des spermatozoïdes du père ou de la contamination de l'environnement et du milieu placentaire ou du sang de la mère). En 2005, une étude danoise ayant porté sur la profession des parents de 6 177 cas de cryptorchidie, 1 345 cas d'hypospadias, et 23 273 cas-contrôles, né vivant, de 1983 à 1992 au Danemark a conclu à un risque significativement plus élevé de cryptorchidie (mais non d'hypospadias) chez les fils de femmes travaillant dans le domaine du jardinage, alors que ce risque là n'était pas augmenté chez les fils d'hommes travaillent dans l'agriculture ou le jardinage. Ceci suggère que c'est au stade de la différenciation sexuelle, in utero, que l'anomalie apparait, et non au stade de la formation des gamètes chez le père[23] ; - l'exposition de la mère à la caféine ;
le risque est avéré pour les bébés de femmes enceintes qui buvaient plus de 3 tasses de café par jour[22],[24] ; - le diabète gestationnel :
c'est aussi un facteur de risque, peut être via une perturbation des systèmes contrôlés par l'insuline, qui semblent aussi en cause dans le risque de cancer du testicule (voir l'article consacré à ce cancer). - hernie inguinale :
elle peut bloquer la descente du testicule. Ce phénomène est également souvent associée à un faible poids à la naissance.
De rares cas iatrogènes ont été signalés, où la descente d'un testicule a pu être bloquée au-dessus du scrotum, à la suite d'une opération chirurgicale précoce traitant une hernie ou autre problème dans la région inguinale ; - agénésie testiculaire :
dans ce cas, les testicules n'ont simplement pas été formés lors de l'embryogenèse. C'est une anomalie congénitale très rare, cause de stérilité et de troubles hormonaux avec féminisation due au manque de testostérone) ; - la prématurité :
elle explique, très logiquement, certaines cryptorchidies ; - facteurs génétiques :
ils semblent pouvoir expliquer certains cas.
Chez la souris, plusieurs défauts des gènes du développement (ex. : gènes homéotiques et INSL3), peuvent provoquer une cryptorchidie[11]. Des mutations de ces gènes, et des perturbations dans leur régulation pourraient peut-être bientôt expliquer l'étiologie d'une grande partie des testicules non descendus[11].
Près de 4 % des pères et des frères de 6 à 10 % des garçons touchés par une cryptorchidie ont également eu de cryptorchidie), mais dans ces derniers cas, il est encore difficile de différencier ces facteurs d'autres éventuels facteurs environnementaux ou comportementaux auxquels une même famille peut être exposée. - erreur de diagnostic :
très rarement, il peut y avoir confusion avec une atrophie d'un des testicules, à la suite d'un traumatisme ou d'une orchite (inflammation testiculaire) ; Plus couramment, un testicule rétracté peut être confondu avec une cryptorchidie « vraie ».
Complications
Elles sont de trois ordres[25] :
- faible poids à la naissance ; la cryptorchidie est souvent associées à un tel déficit. Ce déficit de poids peut être dû à une à prématurité ou à un retard de croissance intra-utérin[26] ;
- problème de santé reproductive caractérisé par une « délétion de la spermatogenèse » (production de spermatozoïdes) entraînant une baisse de fertilité ou une infertilité.
- En effet la température dans le scrotum doit être inférieure de 4 °C à celle du corps[27] pour que le processus de protection des spermatozoïdes puisse correctement s'effectuer ;
- La maturation des gonades masculines commence in utero et se poursuit après la naissance. Du 3e au 5e mois de la vie, certaines des spermatogonies fœtales résidant le long de la membrane basale deviennent des spermatogonies de type A. Plus progressivement, d'autres deviennent des spermatogonies fœtales spermatogonies de type B et des spermatocytes primaires vers la 5e année après la naissance. La maturation des organes sexuels s'arrête à ce stade jusqu'aux signaux hormonaux donnés par la puberté qui les rendent fonctionnels.
- Ainsi, si à la naissance les testicules non-descendus ont un aspect normal, ils présentent néanmoins à échelle microscopique un nombre réduit de spermatogonies. L'aspect microscopique de ces tissus peut devenir nettement anormal, avec des phénomènes de dégénérescence entre deux et quatre ans après la naissance. Des études récentes ont conclu qu'une orchidopexie précoce réduisait cette dégénérescence, mais les testicules peuvent a priori rester vulnérables à de faibles doses de perturbateurs endocriniens les deux premières années suivant la naissance où ils ont une activité intense[28],[29], contrairement à ce qu'on a longtemps cru ; ces deux premières années étant même une des deux principales périodes critiques pour le développement sexuel du garçon[30],[31]. L'inhibition de la maturation et multiplication des cellules de Sertoli dans la prime enfance laisse des séquelles chez l'adulte[32] ; - risque de petite taille du pénis chez le futur adulte et adolescent, à la suite d'un déficit de testostérone en période néonatale, démontré chez le singe Rhésus en laboratoire[33],[34] et constatée chez l'Homme après la naissance[35],[36] ;
- augmentation du risque de cancers testiculaires ; ce risque est multiplié par cinq[37], mais semble également réduit s'il y a eu orchidopexie dans les 6 mois à un an suivant la naissance.
En cas de syndrome de dysgénésie testiculaire, l'origine de l'infertilité peut avoir pour cause première une perturbation endocrinienne ayant inhibé la production de testostérone in utero, et elle s'accompagne souvent d'indices de féminisation (diminution de la distance anogénitale, pénis plus petit ou micropénis…)
Diagnostic
Il n'y a généralement pas de symptômes initiaux évidents (hormis en cas de torsion testiculaire ou douleur liée à la position du testicule non descendu), mais sans soins ou opération, des complications plus tardive (stérilité, hypofertilité, cancer) sont presque systématiques.[réf. nécessaire]
- La détection de cette affection se fait à la naissance (observation et palpation par le pédiatre, ou parfois plus tardivement lors d'un examen pour d'autres causes, une visite médicale scolaire ou lorsque les parents ou l'enfant constatent cette anomalie (le plus souvent unilatérale).
- Le médecin détecte parfois une hernie inguinale causée par l'intrusion d'un organe ou d'une partie d'organe (l'intestin en général), sorti de la cavité.
- Des cas de « testicules rétractiles » existent. Comme dans ces cas, les testicules se stabilisent généralement dans le scrotum lors de l'adolescence, on ne les a généralement pas traités. On les considère maintenant comme une des formes de cryptorchidie, car de nombreux indices laissent penser qu'ils exposent l'individu aux mêmes problèmes de santé reproductive, voire de risque de cancer du testicule[38].
Le diagnostic peut être précisé par :
- l'échographie doppler détecte de 13 à 90 % des testicules non-descendus. Elle est très efficace pour les testicules haut situés dans le scrotum, dans le canal inguinal. Elle l'est moins pour les testicules pelviens ou rétropéritonéaux. Elle ne permet pas de différencier un testicule atrophique d'un testis agénésique ;
- la tomodensitométrie de l'abdomen ;
- l'IRM (imagerie par résonance magnétique) est parfois proposée, avec une sensibilité allant de 52 à 100 % selon les cas et études[39] ;
- une cœlioscopie pour parfois permettre de localiser un testicule intra-abdominal ;
- un dosage sanguin de testostérone qui en cas de taux normal ou proche de la normale signale que le testicule existe dans l'abdomen et qu'il est fonctionnel.
Une nouvelle classification[40] des formes de testicules non descendus a été proposée en 2003 ; elle différencie :
- les formes acquises (en distinguant des formes primaires et secondaires)
- Les formes primaires sont les testicules ascendants, ne pouvant être manipulés dans le scrotum), les testicules mal positionnés dans le scrotum dont en position scrotale élevée.
-Les formes secondaires (ou « testicules piégés ») sont celles qui résultent d'actes chirurgicaux dans la région homolatérale de l'aine ; - les formes congénitales (intra-abdominales, intra-canaliculaires, supra-scrotales et ectopiques) ; Elles doivent être traitées chirurgicalement et précocement, de préférence à 1 an.
Traitement
Il ne semble pas nécessaire dans près de 50 % des cas qui se résolvent spontanément avant l'âge de 3 mois[41]. À un an, la cryptorchidie ne concerne plus que 1 % des garçons[11].
Le traitement est médical (hormonal) en première intention surtout à partir de 6 mois à 1 an et en particulier quand on peut palper le ou les testicules en position scrotale élevée (fenêtre d'opportunité[42]) car après cet âge la chance d'une résolution spontanée est faible, et après deux ans le risque de cancer et de stérilité du futur adulte ou adolescent augmente significativement[41].
Une médication à base d'hormone gonadotrophine chorionique (Hormone hCG ou analogues de la GnRH) règle le problème dans moins de 20 %[11] à 50 % des cas, selon la localisation initiale du testicule non descendu[41],[43]. Les testicules non-palpables descendent rarement avec le seul traitement hormonal[11]. Des effets secondaires ont été signalés avec l'hCG (inflammation, réaction au niveau des testicules et augmentation de l'apoptose des cellules germinales conduisant à une taille adulte réduite des testicules)[11].
Le traitement est chirurgical dans les autres cas. Près de 3 % des garçons des pays occidentaux subissent une orchidopexie[2], opération qui peut être faite chez le jeune enfant. Pratiquée avant la puberté, elle diviserait par 2 le risque de cancer testiculaire[44]. Il semble que plus l'opération est pratiquée jeune (une équipe suisse recommande de la pratiquer à 6 mois) plus on diminue le risque de future hypofertilité[45]. Des complications vasculaires peuvent survenir en cas d'orchidopexie[11].
Prévention
- Limiter les contacts avec l'alcool, la caféine, les perturbateurs endocriniens lors de la grossesse, de l'allaitement et durant les premières années de la vie.
- Un des moyens de prévention secondaire, dans les pays développés, est une meilleure détection des cas par le pédiatre à la naissance, puis via le contrôle systématique des testicules lors de la visite médicale scolaire chez les enfants.
Contraception masculine
L'étude des causes d’infertilité a permis de mettre en évidence de nouvelles méthodes de contraception masculine thermique. En effet, chez une personne sans antécédent de cryptorchidie, il est possible de maintenir les testicules dans la poche inguinale en position dite de cryptorchidie artificielle. Cette méthode a été testée et est pratiquée de nos jours par de nombreux hommes. Des essais cliniques ont été menés sur une durée de 4 ans sans montrer le moindre problème d'efficacité ou de réversibilité[46],[47],[48].
Cryptorchidisme animal
Chez les chiens
La cryptorchidie est fréquente chez les chiens mâles (jusqu'à 10 % chez certaines espèces)[49]. Bien que le mécanisme génétique ne soit pas encore cerné, on admet qu'il s'agit le plus souvent d'une pathologie congénitale récessive et probablement polygénétique (impliquant plusieurs gènes)[50]. Certains auteurs ont spéculé sur le fait qu'il pourrait s'agir d'une maladie à transmission autosomique dominante, c'est-à-dire n'impliquant aucun des deux chromosomes X ou Y et donc présente chez les deux sexes, mais ne s'exprimant que chez le mâle, à certaines conditions[51] mais il est peu probable qu'il soit simplement récessif[50]. Chez le chien, les testicules descendent habituellement vers le 10e jour après la naissance et on ne considère qu'il y a cryptorchidie qu'après un délai de huit semaines[52]. Le cryptorchidisme est bilatéral (cause de stérilité) ou unilatéral. Comme chez l'homme le testicule peut être retrouvé en position inguinale ou abdominale (ou les deux à la fois).
Une intervention chirurgicale est possible après repérage du testicule (la palpation suffit généralement) et exploration ultérieure du canal inguinal ou de l'abdomen, mais ce type de correction chez les mâles reproducteurs est jugée contraire à l'éthique zootechnique ; comme c'est un trait héréditaire, les chiens touchés ne devraient pas être élevés et devraient être castrés. Les parents du chien touché devraient être considérés comme porteurs de l'anomalie génétique et les éleveurs devraient prudemment en tenir compte. Le retrait chirurgical des testicules non-descendus doit être envisagé pour ces chiens en raison du taux élevé de cancer des testicules chez ceux-ci, en particulier tumeurs à cellules de Sertoli[52]. Comparativement au chien normal, l'incidence du cancer testiculaire est 13,6 fois plus élevée chez des chiens dont les testicules sont restés en situation abdominale[49] et la torsion testiculaire est également plus probable avec les testicules non descendus.
Races canines les plus touchées
Races canines les plus touchées[51]
- Boxer
- Chihuahua
- Teckel
- Bulldog
- Bichon maltais
- Schnauzer nain
- Pékinois
- Loulou de Poméranie
- Caniche
- Shetland Sheepdog
- Lévrier whippet
- Yorkshire Terrier
Chats
Le cryptorchidisme est beaucoup plus rare chez les chats que les chiens. Une étude a trouvé 1,9 % de chats mâles non castrés victimes de cryptorchie[53]. Le chat persan y serait plus prédisposé[54]. Normalement, les testicules descendent dans le scrotum entre la 6e et la 8e semaine.
Le marquage du territoire par de l'urine est un indice qu'un chat sans testicules observables peut être un chat non castré. D'autres indices sont la présence de bajoues élargies, d'une peau plus épaisse sur la face et le cou, et la présence d'épines sur le pénis (car elles régressent généralement dans les six semaines suivant la castration)[55]. La plupart des chats cryptorchides ont un testicule bloqué en position inguinale[56]. Les tumeurs du testicule et torsion du testicule semblent rares chez les chats touchés par une cryptorchidie, mais la castration est généralement faite, en raison de comportements indésirables tels que le marquage du territoire par l'urine.
Chevaux
Chez les chevaux, la cryptorchidie est assez commune chez les étalons, qui sont alors généralement castrés. Rarement, une cryptorchidie congénitale est suivie d'un cancer du testicule comme un tératome[57].
Notes et références
- (en) Article BMJ « Short Reports, Cryptorchidism in Scotland »
- (en) D. Cortes « Cryptorchidism--aspects of pathogenesis, histology and treatment » Scand J Urol Nephrol. Suppl. 1998;196:1-54. (Résumé)
- Katharina M Main, Jorma Toppari et Niels E Skakkebæk ; Gonadal development and reproductive hormones in infant boys ; {{DOI:10.1530/eje.1.02237}} ; European Journal of Endocrinology, Vol 155, suppl_1, S51-S57 ; 2006 ; European Society of Endocrinology
- Jørgensen N, Carlsen E, Nermoen I, Punab M, Suominen J, Andersen A-G, Andersson AM, Haugen TB, Horte A, Jensen TK, Magnus O, Petersen JH, Vierula M, Toppari J & Skakkebæk NE. East–East–West gradient in semen quality in the Nordic–Baltic area: a study of men from the general population in Denmark, Norway, Estonia and Finland. Human Reproduction 2002 17 2199–2208 (Résumé)
- Ghirri P, Ciulli C, Vuerich M, Cuttano A, Faraoni M, Guerrini L, Spinelli C, Tognetti S & Boldrini A. Incidence at birth and natural history of cryptorchidism: a study of 10 730 consecutive male infants. Journal of Endocrinological Investigation 2002 25 709–715 (Résumé)
- (en) Chilvers C, Pike MC, Forman D, Fogelman K & Wadsworth ME. « Apparent doubling of frequency of undescended testis in England and Wales in 1962–1981 » Lancet 1984 2 330–332 (Résumé en anglais)
- (en) Atwell JD. « Ascent of the testis: fact or fiction » Br J Urol. 1985;57:474-7.
- (en) Skakkebæk NE, Rajpert-De Meyts E & Main KM. « Testicular dysgenesis syndrome: an increasingly common developmental disorder with environmental aspects » Human Reproduction 2001 16 972–978
- (en) NE. Skakkebæk « Testicular dysgenesis syndrome : new epidemiological evidence » International Journal of Andrology 2004;27:189–91 ; (Lien).
- (en) Andersson A-M, Toppari J, Haavisto A-M, Petersen JH, Simell T, Simell O & Skakkebæk NE. « Longitudinal reproductive hormone profiles in infants: peak of inhibin B levels in infant boys exceeds levels in adult men » Journal of Clinical Endocrinology and Metabolism 1998;83:675–81.
- (en) Toppari J, Kaleva M. « Maldescendus testis » Horm Res. 1999 Dec;51(6):261-9.
- Claudine Goldgewicht, Environnement, Risques & Santé mai-juin 2002; Volume 1, no 2.
- (en) DS. Irvine « Changing male reproductive health: a review of the clinical evidence? » Hum Ecol Risk Assess. 2001;7:1003-16. Éditeur
- (en) Purdue MP, Devesa SS, Sigurdson AJ & McGlynn KA. « International patterns and trends in testis cancer incidence » International Journal of Cancer 2005;115:822–7. CrossRef
- (en) Ross JL, Samango-Sprouse C, Lahlou N, Kowai K, Elder FE & Zinn A. « Early androgen deficiency in infants and young boys with 47, XXY Klinefelter syndrome » Hormone Research 2005;64:39–45. CrossRef
- (en) Sultan C, Balaguer P, Terouanne B, Georget V, Paris F, Jeandel C, Lumbroso S & Nicolas J. « Environmental xenoestrogens, anti-androgens and disorders of male sexual differentiation » Molecular and Cellular Endocrinology 2001;178:99–105. CrossRef
- (en) Forest MG, De Peretti E & Bertrand J. « Hypothalamic–pituitary–gonadal relationships in man from birth to puberty » Clinical Endocrinology 1976;5:551–69. (Medline)
- (en) Winter JSD, Hughes IA, Reyes FI & Faiman C. « Pituitary–gonadal relations in infancy:2. Patterns of serum gonadal steroid concentrations in man from birth to two years of age » Journal of Clinical Endocrinology and Metabolism 1976;42:679–86 (Résumé)
- (en) JSD Winter « Hypothalamic–pituitary function in the fetus and infant » Journal of Clinical Endocrinology and Metabolism 1982;11:41–55
- (en) RM. Sharpe « Pathways of endocrine disruption during male sexual differentiation and masculinization » Baillières Best Practice and Research Clinical Endocrinology and Metabolism 2006;20:91–110.
- (en) Lahlou N, Fennoy I, Carel J-C & Roger M. « Inhibin B and anti-Müllerian hormone, but not testosterone levels, are normal in infants with nonmosaic Klinefelter syndrome » Journal of Clinical Endocrinology and Metabolism 2004;89:1864–8. Résumé
- (en)Julie Rehmeyer « Drinking During Pregnancy Emerges As a Possible Male-Infertility Factor » citant un article d'Ida Damgaard et al. de février 2007, dans Environmental Health Perspectives, mis en ligne le 4 décembre 2006
- (en) Weidner IS, Moller H, Jensen TK, Skakkebaek NE. « Cryptorchidism and hypospadias in sons of gardeners and farmers » Environ Health Perspect. 1998;106:793–6. (Résumé en anglais)
- (en) Medscape News
- (en) Giwercman A, Skakkebaek NE. « The human testis -- an organ at risk? » Int J Androl. 1992;15:373-5. Medline
- (en) Main KM, Jensen RB, Asklund C, Høi-Hansen CE & Skakkebæk NE. « Low birth weight and male reproductive function » Hormone Research 2006;65:116–22. ref, Medline
- Mieusset R, Bujan L, Mansat A, Pontonnier F, « Hyperthermie scrotale et infécondité masculine » Progrès en Urologie 1992;2:31-6.
- (en) MG. Forest « Pituitary gonadotrophin and sex steroid secretion during the first two years of life » in Control of the Onset of Puberty p. 451–477. Eds MM Grumbach, PC Sizonenko & ML Aubert, Baltimore: Williams and Wilkins, 1990
- (en) HE. Chemes « Infancy is not a quiescent period of testicular development » International Journal of Andrology 2001;24:2–7. (CrossRef)
- (en) Mann DR & Fraser HM. « The neonatal period: a critical interval in male primate development » European Journal of Endocrinology 1996;149:191–7. (résumé (anglais))
- (en) Müller J & Skakkebæk NE. « Fluctuations in the number of germ cells during the late foetal and early postnatal periods in boys » Acta Endocrinologica 1984;105:271–4.
- (en) Sharpe RM, McKinnell C, Kivlin C & Fisher JS. « Proliferation and functional maturation of Sertoli cells, and their relevance to disorders of testis function in adulthood » Reproduction 2003 125 769–784 ([Résumé])
- (en) Brown GR, Nevison CM, Fraser HM & Dixson AF. « Manipulation of postnatal testosterone levels affects phallic and clitoral development in infant rhesus monkeys » International Journal of Andrology 1999;22:119–28. CrossRef
- (en) Lunn SF, Cowen GM & Fraser HM. « Blockade of the neonatal increase in testosterone by a GnRH antagonist: the free androgen index, reproductive capacity and postmortem findings in the male marmoset monkey » European Journal of Endocrinology 1997;154:125–31. (résumé, en anglais)
- (en) Boas M, Boisen KA, Virtanen HE, Kaleva M, Suomi A-M, Schmidt IM, Damgaard IN, Kai CM, Chellakooty M, Skakkebæk NE, Toppari J & Main KM. « Postnatal penile length and growth rate correlate to serum testosterone levels: a longitudinal study of 1962 normal boys » European Journal of Endocrinology 2006;154:125–9. (Résumé)
- (en) Feldman KW & Smith DW. « Fetal phallic growth and penile standards for newborn male infants » Journal of Pediatrics 1975;86:395–8. CrossRef
- (en) Dieckmann KP, Pichlmeier U. « Clinical epidemiology of testicular germ cell tumors » World J Urol. 2004;22:2-14)
- (en) Day Way Goh et John M. Hutson « Is the retractile testis a normal, physiological variant or an anomaly that requires active treatment? » Pediatric Surgery International juin 1992:7(4):249-52. (ISSN 0179-0358) DOI:10.1007/BF00183973 (Résumé en anglais)
- (en) Maghnie M, Vanzulli A, Paesano P, Bragheri R, Palladini G, Preti P. et al. « The accuracy of magnetic resonance imaging and ultrasonography compared with surgical findings in the localization of the undescended testis » Arch Pediatr Adolesc Med. 1994;148(7):699-703.
- (en) Hack WWM, Metiger RW, Bos SD, Haasnoot K. « A new clinical classification for undescended testis (UDT) » Scandinavian journal of urology and nephrology 2003;37(1):43-7. (ISSN 0036-5599) (Résumé) ; 21 ref.
- Encyclopédie Vulgaris Médical : Cryptorchidie
- (en) MM. Grumbach « A window of opportunity: the diagnosis of gonadotropin deficiency in the male infant » Journal of Clinical Endocrinology and Metabolism 2005;90:3122–7. (Résumé)
- (en) Main KM, Schmidt IM, Toppari J & Skakkebæk NE. « Early postnatal treatment of hypogonadotropic hypogonadism with recombinant human FSH and LH » European Journal of Endocrinology 2002;146:75–9.
- (en) A Pettersson, L Richiardi, A Nordenskjold, M Kaijser, O Akre. « Age at surgery for undescended testis and risk of testicular cancer » New Eng J Med. 2007;356:1835-41.
- (en) Hadziselimovic F, Herzog B. « The importance of both an early orchidopexy and germ cell maturation for fertility » Lancet Oct 2001 6;358(9288):1156-7.
- MIEUSSET R., BUJAN L. : The potential of mild testicular heating as a safe, effective and reversible contraceptive method for men. Int. J. Androl., 1994 ; 17 : 186-191.
- Mieusset R, Grandjean H, Mansat A, Pontonnier F. Inhibiting effect of artificial cryptorchidism on spermatogenesis. Fertil Steril. 1985;43:589–94.
- Mieusset R, Bujan L, Mansat A, Pontonnier F, Grandjean H. Hyperthermia and human spermatogenesis: enhancement of the inhibitory effect obtained by ‘artificial cryptorchidism’. Int J Androl. 1987;10:571–80.
- (en) Miller NA, Van Lue SJ, Rawlings CA. « Use of laparoscopic-assisted cryptorchidectomy in dogs and cats » J Am Vet Med Assoc. 2004;224(6):875–8. ; DOI:10.2460/javma.2004.224.875 résumé
- (en) Willis, Malcolm B.; Genetics of the Dog ; 1re édition, Ed : Howell Book House ; 1989 ; (ISBN 0-87605-551-X)
- (en) Stephen J. Ettinger et Edward C. Feldman, Textbook of Veterinary Internal Medicine ; 4e édition ; Ed : W.B. Saunders Company ; 1995 ; (ISBN 0-7216-6795-3)
- (en) Meyers-Wallen « Inherited Abnormalities of Sexual Development in Dogs and Cats » Recent Advances in Small Animal Reproduction Voir (Consulté 2006-08-10)
- (en) Scott K, Levy J, Crawford P. « Characteristics of free-roaming cats evaluated in a trap-neuter-return program » J Am Vet Med Assoc 2002;221(8):1136–8. DOI:10.2460/javma.2002.221.1136
- (en) John R. August (ed.) Diagnostic usefulness of and clinical syndromes associated with reproductive hormones; Griffin, Brenda ; Consultations in Feline Internal Medicine ; Vol. 5 ; Elsevier Saunders ; 2005 ; (ISBN 0-7216-0423-4)
- (en) M. Memon et A. Tibary « Canin and Feline Cryptorchidism » Recent Advances in Small Animal reproduction 2001 Voir, en PDF (consulté 2007-02-09)
- (en) Yates D, Hayes G, Heffernan M, Beynon R. « Incidence of cryptorchidism in dogs and cats » Vet Rec journal 2003;152(16):502-4.
- (en) T.C. Jones, R. D. Hunt, et N. W. King, Veterinary pathology (6e édition), Ed. Wiley-Blackwell 1997 (ISBN 0683044818) pages 1392, page 1210 ; Voir
Voir aussi
Liens externes
- Bacandrology
- ARDECOM - Association pour la Recherche et le DEveloppement de la COntraception Masculine
- Portail du handicap
- Portail de la médecine