Sulfure de zinc
Le sulfure de zinc désigne principalement deux corps ioniques inorganiques dimorphes, également composés de cations zinc et d'anions sulfures en proportion stoechiométrique, de formule ZnS. Le chimiste et le minéralogiste distinguent nettement le sulfure de zinc alpha ZnS α, de structure hexagonale, légèrement moins dense, correspondant à la wurtzite encore improprement dénommée blende hexagonale, et le sulfure de zinc bêta ZnS β, de structure cristalline cubique, correspondant à la sphalérite ou à l'ancienne blende minérale si commune dans la nature. Il existe également ZnS γ, de structure tétragonale très rare, de couleur noire à grise, nommée polhémusite, de formule (Zn,Hg)S.
| Sulfure de zinc | |
  Sphalérite (blende) et wurtzite, les deux formes cristallines du sulfure de zinc. |
|
| Identification | |
|---|---|
| Nom UICPA | sulfure de zinc(II) |
| No CAS | |
| No ECHA | 100.013.866 |
| No CE | 215-251-3 |
| No RTECS | ZH5400000 |
| PubChem | 14821 |
| SMILES | |
| InChI | |
| Apparence | poudre blanche à beige, inodore |
| Propriétés chimiques | |
| Formule | ZnS |
| Masse molaire[1] | 97,45 ± 0,03 g/mol S 32,91 %, Zn 67,11 %, |
| Propriétés physiques | |
| T° fusion | 1 700 °C[2], soluble dans les acides minéraux, insoluble dans l'acide acétique |
| T° ébullition | 1 180 °C (sublimation)[3] |
| Solubilité | presque insoluble dans l'eau[3] |
| Masse volumique | 4,1 g·cm-3[4] |
| Propriétés électroniques | |
| Bande interdite | 3,54 eV (cubique, 300 K)[réf. souhaitée] 3,91 eV (hexagonal, 300 K)[réf. souhaitée] |
| Cristallographie | |
| Système cristallin | cubique (sphalérite) hexagonal (wurtzite) |
| Précautions | |
| SGH[3] | |
| n'est pas une substance dangereuse pour le SGH | |
| NFPA 704 | |
| Transport[3] | |
non-soumis à régulation |
|
| Écotoxicologie | |
| DL50 | 2 000 mg/kg (rat, oral)[5] 2 000 mg/kg (rat, dermique)[5] |
| CL50 | 5,04 mg/l (rat, inhalation, 4 h)[5] 1 830 mg/l (poissons, 96 h)[6],[7] 0,97 mg/l (crustacés, 48 h)[7] |
| Unités du SI et CNTP, sauf indication contraire. | |
Si la couleur des minéraux peut être foncée voire noire à cause de la présence d'impuretés variées, ces corps purs dimorphes, très solubles dans les acides minéraux, sont blancs à légèrement colorés. Sous une forme dense, le sulfure de zinc synthétique ZnS β d'indice de réfraction 2,368 peut être transparent et être utilisé comme fenêtre en optique visible et infrarouge.
Propriétés physiques et chimiques
L'ancienne blende des chimistes ou ZnS β se présente pure au laboratoire sous l'aspect de granules blancs, insolubles dans l'eau et dans l'acide acétique. Sa masse volumique est de l'ordre de 4,1 g·cm-3 à 25 °C. Chauffée à 1 020 °C, elle subit une transition vers la forme ZnS α.
Les cristaux de ZnS β cubique ou sphalérite naturelle peuvent être bruns, noirs, foncés à légèrement colorés, transparents... . Le terme blende désigne toujours les minerais sulfurés de zinc à base de ZnS β. Ils contiennent souvent du fer, du manganèse..., et parfois, mais plus rarement ou à l'état de traces, de l'or et de l'argent. Dans certains cas, ZnS β incluant des ions Ag, Cu ou Mn peuvent être légèrement phosphorescents. La concentration par flottation des minerais broyés est effectuée par l'adjonction de substances induisant des propriétés de surface spécifiques ("surfactantes" ou "tensio-actives"), car ces derniers additifs comportent des fonctions xanthate ou thiosulfate, à affinités avec les sulfures cristallins.
Le ZnS α est très légèrement soluble dans l'eau, avec une solubilité de 6,9 × 10−3 g pour 1 L d'eau pure à 18 °C. Il est également insoluble dans l'acide acétique, se sublime vers 1 185 °C, et, sous une pression de 150 atmosphères, il bout à 1 850 °C. Le composé qui a deux indices de réfraction, soit 2,356 et 2,378, est phosphorescent en UV de longueur d'onde 254 nm. Il a été utilisé comme détecteur de RX, revêtement d'écran à scintillation ou écran d'ordinateur ou de TV.
D'une manière générale, le solide ZnS est mis en solution par l'action des anions cyanures, générant la formation de complexe de zinc soluble en milieu aqueux basique.
Quelles que soient leurs structures cristallines à coordinence 4, les sulfures de zinc peuvent montrer diverses phosphorescence à cause d'impuretés ou de lacunes, évidemment après exposition à la lumière ultraviolette ou aux RX, voire à une forte lumière bleue. En pratique, les impuretés insérées dans ces composés ZnS artificiels sont sélectionnées, et appelées activateurs (ions Cu, Ag et Au en remplacement du Zn, et P, As et Sb en remplacement du S) et coactivateurs (ions halogènes Cl, Br, I sur les sites S, et Al, Ga, In sur sites de Zn)[8]. Les bandes d'émission phosphorescentes plus ou moins durables après exposition préalable sont restreintes mais multiples dans le vert, bleu, rouge et infrarouge.
Préparations
Les ions zinc sont facilement précipités en solution aqueuse par les ions sulfures, avec un produit de solubilité pKs compris entre 21,6 et 23,8. Mais il faut des conditions précises. Si l'opérateur se place en solution neutre ou alcaline, par exemple avec un sulfure d'ammonium, le précipité blanc obtenu est colloïdal, impossible à filtrer, et de ce fait, impropre à la préparation de dérivés chimiques. Afin d'obtenir un précipité cristallin aisément filtrable, il faut procéder à chaud avec du chlorure d'ammonium (solution légèrement acide).
- Zn2+ aq + S2- aq + 2 NH4+aq + 2 Cl-aq → ZnS poudre blanche + 2 NH4+ + 2 Cl-
Si l'hydrogène sulfuré gazeux (H2S) est utilisé en barbotage, il faut maintenir une acidité favorable à une précipitation plus lente par un milieu tampon acétique (pH 4) ceci avec une concentration en ions zinc a peu près centimolaire (0.01 M). Un pH plus bas limite la concentration en ions sulfures libres en solution et diminue de ce fait le degré de sursaturation de la solution. Cela permet une précipitation plus lente et donc une meilleure cristallinité du précipité obtenu.
- Zn2+ aq + H2S gaz hygrogène sulfuré → 2 H+proton ou ion hydronium + ZnS poudre blanche
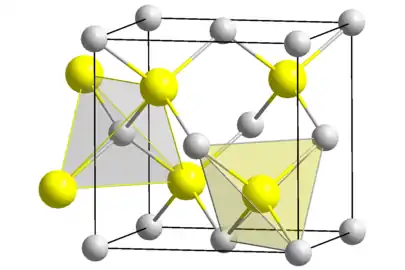
Cristallographie : deux morphologies cristallines
Le sulfure de zinc existe ainsi principalement sous deux formes cristallines, cette dualité étant souvent donnée en exemple de polymorphisme ; dans ces deux formes, la géométrie de Zn et de S est tétraédrique :
- la forme la plus stable à température ambiante est la forme cubique appelée anciennement blende et aujourd'hui sphalérite. Il existe deux façons de voir cette forme cristalline : deux mailles cubiques faces centrées (cfc), l'une de zinc, l'autre de soufre, imbriquées l'une dans l'autre et décalées d'un vecteur (a/4;a/4;a/4), ou bien une maille cfc classique de l'un des éléments (soufre par exemple) dont quatre des huit sites tétraédriques (sites situés entre un atome en coin de maille et les atomes au centre des trois faces qui se croisent en ce coin) sont occupés par des atomes de l'autre élément (dans cet exemple le zinc). Cette forme cristalline a donné son nom à la forme dite « blende » qui est la configuration cristalline d'un grand nombre de composés III-V, dont beaucoup sont des semi-conducteurs (GaAs, GaP, InAs, etc.) ;
- l'autre forme est hexagonale, connue sous le nom minéral de wurtzite, dans laquelle deux mailles hexagonales compactes de chaque élément sont imbriquées l'une dans l'autre. Cette forme donne son nom à la forme dite « wurtzite » autre forme répandue chez les semi-conducteurs binaires (ZnO, CdS, CdSe, α-SiC, GaN, AlN, etc.).
La transition entre les deux formes a lieu aux alentours de 1 020 °C.
Applications
Le sulfure de zinc peut être employé comme pigment gris blanc, dans les peintures, les cuirs et les linoleum, les caoutchoucs ou les lithopones (pigments blancs à base de ZnS·BaSO4). Parfois il est ajouté comme charge active dans certains procédés, comme dans l'industrie du caoutchouc et des plastiques où il joue un rôle de capteur et de régulateur d'acides.
Matériaux luminescents
Les sulfures de zinc préparés artificiellement, additionnés de quelques parties par million (ppm, 10-6, mg/kg) d'activateur(s) adéquat(s) et éventuellement de co-activateur(s), sont utilisés comme luminophores dans de nombreuses applications : tube cathodique, écrans à rayons X, produits phosphorescents, etc. En général, la phosphorescence efficace ne dure que quelques heures et rend une lumière principalement verte, jaune, orange...
Lorsque l'argent est utilisé comme activateur, la couleur résultante est un bleu brillant avec un maximum d'émission à 450 nanomètres. Le manganèse quant à lui produit une couleur rouge-orangé autour de 590 nanomètres et le cuivre donne une lueur verdâtre à longue durée de vie typique des objets brillants dans le noir. Le sulfure de zinc dopé au cuivre est également utilisé pour les panneaux électroluminescents[9].
Il est aussi largement utilisé comme scintillateur pour détecter les rayonnements ionisants ou comme écrans TV ou détecteur de rayons X.
Associés à des produits colorants organiques, ZnS permettait autrefois de fabriquer des peintures luminescentes sous léger éclairage UV continu, cette fois-ci par effet global de fluorescence.
Historique
La phosphorescence du ZnS α a été rapportée la première fois par le chimiste français Théodore Sidot en 1866. Ses découvertes furent présentées par Edmond Becquerel, qui obtint une partie de sa renommée pour ses recherches sur la luminescence[10].
En 1930, René Coustal[11] parvient à produire un sulfure de zinc très phosphorescent grâce à la méthode dite « par explosion ». Le sulfure de zinc a ensuite été utilisé par Ernest Rutherford et d'autres chercheurs durant les premières années de la physique nucléaire comme scintillateur, émettant de la lumière sous excitation de rayons X de rayons cathodiques, le rendant utile pour des écrans à rayons X et des tubes cathodiques[12].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Alfa Aesar (consultée le 18 juillet 2012)
- Entrée « Zinc sulfide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 18 juillet 2012 (JavaScript nécessaire)
- Fiche Sigma-Aldrich du composé Zinc sulfide, consultée le 18 juillet 2012.
- Research and Consulting Company, Technical Reports, vol. NOTOX1072, p. 1989
- Erten-Unal, M., B.G. Wixson, N. Gale et J.L. Pitt 1998, Evaluation of Toxicity, Bioavailability and Speciation of Lead, Zinc and Cadmium in Mine/Mill Wastewaters, Chem. Spec. Bioavail. 10(2):37-46
- Gale, N.L., B.G. Wixson et M. Erten, 1992, An Evaluation of the Acute Toxicity of Lead, Zinc, and Cadmium in Missouri Ozark Groundwater, Trace Subst. Environ. Health 25:169-183
- Curie G. et D., opus cité.
- Karl A. Franz, Wolfgang G. Kehr, Alfred Siggel, Jürgen Wieczoreck et Waldemar Adam, Luminescent Materials, Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim, DOI:10.1002/14356007.a15_519
- (en) T. Sidot, « Sur les propriétés de la blende hexagonale », Compt. Rend., vol. 63, , p. 188-189 (lire en ligne)
- Étude sur la phosphorescence du sulfure de zinc, Paris, Presses universitaires de France, 1931, p. 7-10.
- Greenwood, Norman N. ; Earnshaw, A. (1984), Chemistry of the Elements, Oxford, Pergamon, p. 1405 (ISBN 0-08-022057-6).
Bibliographie
- G. Curie, D. Curie, "Spectroscopie des sulfures de zinc phosphorescent", Journal de Physique, Tome 27, rubrique Colloques C2, 1966, pp. C2-111 à C2-115.Article
- Jean Saddy, Sur le déclin de la phosphorescence des sulfures de zinc, Journal de Physique et le Radium, Tome 20 (11), 1959, pp.890-897.Article
Voir aussi
Articles connexes
Liens externes
- Portail de la chimie
