Procédé sol-gel
Les procédés sol-gel (ou solution-gélification) permettent la production de matériaux vitreux, éventuellement microporeux à macroporeux par polymérisation (et éventuel retraitement thermique) sans recourir à la fusion.
Ne doit pas être confondu avec Transition sol-gel.
Le verre est ici directement fabriqué à partir d'une solution liquide (ensuite rendue colloïdale) de silice et d’autres composés chimiques (soude, chaux, magnésie…) et de catalyseurs (ou en milieu homogénisé par des ultrasons (sonochimie[1]) et/ou chauffé par des micro-ondes[2]). Ces matériaux sont regroupés sous l'appellation générique « procédé sol-gel ». On dispose par ces méthodes de matériaux massifs, mais elles sont surtout bien adaptées à la réalisation de films et revêtements (par exemple pour un traitement de surface de verre, de métal ou de matières plastiques (ex : film anti-corrosion, anti-UV, anti dépôt de polluants, anti-abrasion, ou encore traitement anti-rayures et/ou « anti-réfléchissant » de verres de lunettes ou d'autres verres ou plastiques, éventuellement bi-face)[3]. Outre le fait de pouvoir réaliser des matériaux purement inorganiques, elles sont aussi bien appropriées pour la synthèse de verres hybrides organo-minéraux (dopés). Les précurseurs nécessaires existent pour un grand nombre de métaux, métalloïdes et non-métaux. Ils sont soit liquides soit solides, et dans ce dernier cas ils sont pour la plupart solubles dans des solvants usuels. Il est donc possible de préparer des mélanges homogènes des monomères (précurseurs) ou oligomères[3].
Histoire
La fusion de matières premières à haute température (1 300 à 1 500 °C) est connue et pratiquée depuis l'antiquité (verre, métaux, soudure...). Elle permet d’obtenir l’homogénéité à l’échelle moléculaire grâce au liquide obtenu. Les fondants (soude, potasse, etc.) qui présentent une grande affinité chimique pour la silice (avec formation de silicates) abaissent la viscosité du verre liquide et en facilitent l’élaboration. La chaux, la magnésie, l’alumine assurent au verre normal sa stabilité chimique.
Depuis le XXe siècle, de nouvelles méthodes de synthèse et d’élaboration du verre sont étudiées,
Le premier brevet sol-gel date de 1939.
En associant des matériaux organiques et inorganiques, la synthèse sol-gel ouvre un champ nouveau dans le domaine des matériaux vitreux. Elle a déjà trouvé de nombreuses applications expérimentales et industrielles.
Principe
Le procédé sol-gel permet de fabriquer un polymère inorganique ou bien hybride inorganique-organique (pouvant même inclure par encapsulation[4] des molécules biologiques (protéines, bioenzymes, etc.)[5] qui pourraient déboucher sur des solutions bio-inspirées[6], à un réseau de silice par une succession de réactions chimiques simples et à une température proche de la température ambiante (20 à 150 °C) puis du verre par cuisson.
La synthèse est effectuée à partir d'alcoolates de formule M(OR)n où M est un métal ou le silicium et R un groupement organique alkyle CnH2n+1. Les particules solides (plus denses que le liquide) doivent être très petites afin que les forces de gravitation ne dépassent pas celles qui sont responsables de la dispersion homogène de ces particules dans le liquide puis dans le gel (réseau tridimensionnel de liaisons de van der Waals). La réaction de gélification prend un certain temps (dit « temps de gel » ou « point de gel »)[3].
Les réactions chimiques simples à la base du procédé sont déclenchées lorsque les précurseurs sont mis en présence d’eau : l'hydrolyse des groupements alkoxy intervient tout d’abord, puis la condensation des produits hydrolysés conduit à la gélification du système. Après le point de gel, il reste encore des molécules d'eau et/ou de solvant non mobilisées, et une phase de vieillissement du gel est alors entamée, où des modifications physico-chimiques importantes surviennent, selon trois processus, dits :
- polymérisation (le réseau vitreux se renforce au fur et à mesure que de nouvelles liaisons chimiques se constituent) ;
- mûrissement (processus de dissolution et de reprécipitation)[3] ;
- transformation de phase ou synérèse[3].
Les gels hybrides : ce sont des gels dans lesquels une certaine quantité de molécules organiques a volontairement été ajoutée et conservée dans le matériau final (qui peut être un aérogel ou un xérogel) ; ces molécules organiques (éventuellement macromolécules) peuvent être « hôte–invité » ou fonctionnellement intégrée au gel (en réseaux s'interpénétrant). Ces hybrides sont catégorisés en deux classes :
- les gels de classe I (« hôte-invité »), où les parties organique (ou bio-organique) et inorganique sont imbriquées à l’échelle des molécules sans nécessité de liaisons fortes entre elles ;
- les gels de classe II, où les parties organiques et inorganiques présentent des liaisons fortes entre elles, iono-covalentes ou covalentes. Les réactions d’hydrolyse et de condensation peuvent conduire à la formation d’un réseau organominéral.
Application
Exemple général
Nous allons décrire ces deux réactions dans le cas du tétraéthoxysilane Si(OC2H5)4 (ou TEOS) qui correspond à un système modèle pour les matériaux sol-gel.
- L'hydrolyse (figure 1)


C'est la première réaction sur les groupements alkoxy du précurseur. L'eau introduite dans une solution alcoolique de TEOS hydrolyse les groupements éthoxy en groupements silanol (Si-OH) et produit de l'éthanol. Cette réaction est catalysée en milieu basique et en milieu acide, sa vitesse est minimale à pH 7.
- La condensation (figure 2)


Cette réaction forme un pont siloxane (Si-O-Si) à partir de la condensation de deux groupements silanol et libère une molécule d'eau. Elle peut aussi avoir lieu entre un groupement éthoxy et un groupement silanol pour former un pont siloxane et libérer une molécule d'éthanol. Ces ponts siloxanes sont les unités de base du polymère inorganique. Dans les architectures moléculaires ainsi formées la « brique de base » est un tétraèdre (SiO44-) au centre duquel se trouve l’atome de silicium (figure 3), on retrouve d’ailleurs cette brique dans les verres à base de silice élaborés à haute température. Pour le TEOS, la réaction de condensation présente une vitesse minimale pour un pH de 2 ou 3. Pour des pH élevés, la réversibilité de la réaction peut devenir importante. Pour un précurseur R'-Si(OR)3 où R' est un groupement organique non-hydrolysable, la vitesse minimale de condensation est déplacée vers pH=4.
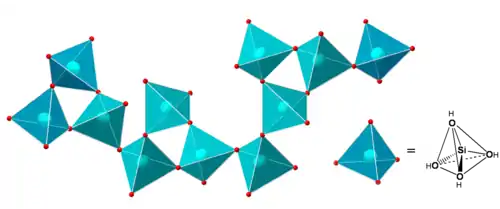
La compétition entre hydrolyse et condensation conditionne l’équilibre entre le grossissement de particules denses et leur collage ; elle détermine ainsi, à l’échelle du nanomètre, la géométrie des structures formées. Cette compétition est contrôlable chimiquement par le pH et la salinité des solutions, lesquels modifient la vitesse des réactions et la charge superficielle des particules formées.

En milieu acide (pH > 1), l’hydrolyse est rapide devant la condensation, ce qui libère l’ensemble des monomères pour la formation rapide de petites particules (unités polyédriques de quelques dizaines d'atomes) dont la taille ne dépasse pas un nanomètre. Ces particules s’agrègent ensuite pour former des amas polymériques ramifiés de faible densité, qui à leur tour s'agrègent. Ces amas restent en suspension sans précipiter, c'est le sol. Les amas occupent progressivement une fraction volumique de plus en plus importante jusqu’à une valeur proche de l’unité. La viscosité du milieu devient alors importante et le liquide finit par se figer : c’est la gélification. Macroscopiquement, cet assemblage s’achève par l’apparition d’une rigidité et d’une élasticité de type solide, provenant du gel. Solide, transparent, le gel obtenu est donc constitué d’un réseau polymérique de silice emprisonnant le solvant et éventuellement des amas encore en solution (figure 4a). Ce réseau présente une porosité dont la distribution s’échelonne de la taille des particules à celle des amas. Au-delà de la gélification, les réactions chimiques se poursuivent et modifient la distribution en taille des pores du gel.
En milieu neutre ou modérément basique, la condensation des espèces siliciées est plus rapide que l’hydrolyse, le polymère est alors progressivement alimenté en monomères. L’étape de formation des unités élémentaires est une agrégation monomère - amas dont la cinétique est limitée par la Chimie. Ce mécanisme conduit à la formation de particules denses de silice. Celles-ci, de taille pouvant atteindre plusieurs centaines de nanomètres sont chargées négativement. Les répulsions électrostatiques qui en résultent empêchent une nouvelle agrégation entre particules qui restent en suspension dans le solvant. L’ensemble particules - solvant constitue le sol. Par addition de sels ioniques ou par basculement du pH (vers un pH acide), il est possible d’écranter ces interactions coulombiennes et de permettre la déstabilisation du sol. L’agrégation entre particules, conduit alors à la gélification comme pour le système acide. Finalement, en milieu très basique (pH > 11), la dépolymérisation (rupture des ponts siloxanes) l'emporte et la silice est transformée en silicate soluble.
L’obtention d’un matériau, à partir du gel, passe par une étape de séchage qui consiste à évacuer le solvant en dehors du réseau polymérique.

Dans le cas d’un séchage hypercritique, des solides ultra-légers (figure 4b), appelés aérogels, sont obtenus. Cette technique de séchage qui opère dans des conditions de température et pression où la tension superficielle du solvant est nulle (conditions critiques) permet l'expulsion du solvant sans dégradation de la structure ramifiée de la phase solide. Ce type de séchage conduit par conséquent à des matériaux très poreux.
Les aérogels se caractérisent par un très grand pouvoir d'isolation thermique : un aérogel est cent fois moins conducteur de la chaleur qu'un verre classique, et surtout cinq fois moins que l'air. Le pouvoir d'isolation thermique, associé à la transparence dans le visible et à l'opacité dans l'infrarouge, fait des aérogels de formidables boucliers thermiques.
Le champ d'applications est très vaste : il va du double vitrage à l'utilisation dans les fusées spatiales. Ces matériaux extrêmement poreux (jusqu'à 99 %) intéressent également la physique nucléaire pour le piégeage des particules, et l'industrie de la catalyse pour l'élaboration de supports. Le fort pouvoir d’isolation thermique proviendrait, au moins en partie, de l'existence dans un réseau fractal de modes de vibrations atomiques localisées (fractons) qui ne permettraient pas la propagation de la chaleur à grande distance.

Pour un séchage traditionnel des gels en étuve ou à l’air libre, à une température proche de la température ambiante, l’élimination des solvants est beaucoup plus délicate. En effet, les forces capillaires, lorsque l'interface liquide-vapeur progresse à l'intérieur des pores du gel, créent des contraintes telles, que la structure peut s'effondrer entraînant ainsi la fissuration des monolithes, voire la transformation du gel en poudre. L'étape de séchage doit donc être conduite très lentement (augmentation progressive de la température et atmosphère confinée) de manière que le réseau s'accommode peu à peu des contraintes induites par les forces capillaires. Le séchage du gel se traduit par une densification au fur et à mesure que l'évaporation se fait et que la condensation se poursuit. Il en résulte des matériaux très faiblement poreux voire denses appelées xérogels (figure 5).
La souplesse du procédé sol-gel permet de mettre le matériau final sous diverses formes, parmi lesquelles les monolithes (matériaux massifs de quelques mm³ à quelques dizaines de cm³) et les films minces (de quelques nanomètres à quelques dizaines de micromètres d'épaisseur). Ils sont préparés à partir du sol. Dans ce cas l'évaporation du solvant est très rapide et le passage par l'état de gel n'est souvent que conceptuel. Les deux types de procédés utilisés pour former des films minces, l'enduction centrifuge (ou spin coating) et l'enduction par trempage (ou dip-coating) sont présentés respectivement sur la figure 6a et la figure 6b. Lors du dépôt sur un substrat par chacune de ces techniques, l'évaporation du solvant est un élément important. En effet juste après le dépôt et avant le traitement thermique une grande partie du solvant s'est évaporée. L'étape de séchage des films minces est en général beaucoup plus courte que pour les matériaux massifs.

Matériaux sol-gel organo-minéraux
Dans le procédé sol-gel, les réactions de base s’effectuant autour de la température ambiante, on conçoit aisément qu’il est possible d’associer des parties organiques à la partie minérale sans qu’elles subissent de dégradation thermique ultérieure.
Une première possibilité consiste à dissoudre la partie organique dans le solvant de synthèse. Le gel minéral se forme alors en tenant compte de la présence des molécules invitées. Une limitation de cette approche est la proportion faible d’organique inséré dans le réseau minéral. La seconde possibilité consiste à utiliser des précurseurs comportant à la fois des fonctions hydrolysables (par exemple -Si-OC2H5 ou -Si-OCH3) qui génèrent le réseau silicaté et des fonctions organiques (par exemple -Si-CH3) qui restent greffées au squelette minéral. Ces chaînons organiques sont liés au silicium via une liaison Si-C qui est insensible à l’hydrolyse. Selon sa nature, la partie organique peut jouer le rôle de formateur ou de modificateur par analogie aux formateurs et aux modificateurs des verres élaborés à haute température. L’analogie qui est faite entre les verres sol-gel et les verres haute température est illustrée figure 7. On voit que dans les deux cas (7b et 7c) l’introduction de modificateurs vient perturber le réseau cristallin et les propriétés des verres


Les figures 8a et 8b donnent des exemples de chaînons organiques modificateurs utilisés dans la technologie hybride. Ils confèrent au matériau final des propriétés spécifiques (accentuation du caractère hydrophobe, amélioration de certaines propriétés mécaniques, etc.). Ils se retrouvent alors comme unités pendantes. Dans le cas de la figure 8c, la partie organique est intégrée au réseau minéral. Par ailleurs la présence de groupements organiques polymérisables (formateurs) permet d’envisager une double polymérisation, organique et minérale. Les molécules décrites figures 8d et 8e portent respectivement une fonction acrylate et époxyde. Ces matériaux hybrides intermédiaires entre verre minéral et polymère organique offrent un large éventail de propriétés inédites fruit de l’association des deux mondes minéral et organique.
La figure 8f représente une molécule colorée de type azobenzène greffée sur un précurseur sol-gel. Ce produit a été préparé à partir d’alkoxysilane fonctionnalisé de formule F-R’-Si(OEt)3, où F est une fonction chimique, par exemple un groupe amine ou isocyanate, et R’ un groupe alkyle. Cette démarche permet, par liaison covalente, un greffage à la matrice, de systèmes moléculaires spécifiques. Un des avantages apporté par ce type de greffage est l’augmentation très importante de la concentration en espèces moléculaires par rapport aux systèmes simplement dissout dans le gel.

L’apport d’une partie organique plus ou moins hydrophobe au sein du réseau minéral favorise le séchage et améliore les propriétés mécaniques des matériaux hybrides. Ces derniers, obtenus sous différentes formes (monolithes, films) sont amorphes, transparents dans le visible (lorsqu’ils sont non-dopés), denses, inertes chimiquement et polissables (un nanomètre de rugosité). La figure 9a et 9b montre des échantillons de tels xérogels.
 Figure 9a : échantillons de xérogels dopés avec des molécules colorées sous forme de monolithes ou de films minces[7]. |
 Figure 9b : échantillons de xérogels monolithiques de formes diverses dopés avec des molécules de colorants[8]. |
Cette ingénierie des matériaux polyfonctionnels par voie hybride permet un couplage optimal entre les propriétés qui résultent des sous-entités organiques d’une part, et minérales d’autre part. La compréhension et la maîtrise des interactions entre le système moléculaire inséré et la matrice hôte déterminent une partie des propriétés du matériau. Nous allons montrer comment, par un choix judicieux du couple matrice/système dopant, il est possible de contrôler les propriétés optiques de matériaux hybrides.
Matériaux hybrides pour l'optique
Matrices hybrides pour lasers solides accordables
Lors de la préparation de matériaux sol-gel dopés, on peut vouloir conserver autant que possible les propriétés du système moléculaire dans le matériau composite en affaiblissant au maximum le couplage molécule-matrice. Dans ce but, l’utilisation de précurseurs alkylalkoxydes R’-Si(OR)3 permet de tapisser la surface des pores avec les groupements organiques R’, donc de limiter les interactions chimiques à des liaisons faibles de type van der Waals.
Un exemple démontrant l’intérêt de ces précurseurs est l’utilisation de matrices hybrides pour piéger des molécules organiques de colorants, afin de réaliser des systèmes lasers impulsionnels et accordables en longueur d’onde. Dans les matrices hybrides, les molécules organiques subissent un minimum d’interactions entre elles et avec le milieu, elles conservent par ailleurs leur propriété de fluorescence (figure 10a).
Les lasers à colorant permettent actuellement de fournir une gamme de longueur d'onde qui va de l’ultraviolet au proche infrarouge. Cependant, du fait de leur complexité, ces lasers accordables restent des outils de laboratoire. Une infrastructure encombrante est en effet nécessaire pour assurer le renouvellement du liquide ; elle est imposée par la dégradation des molécules organiques sous l’action prolongée du rayonnement lumineux d’excitation. Le remplacement du liquide actif par un composite verre/molécule élaboré par méthode sol-gel permet de simplifier et miniaturiser ces lasers accordables.
Au cours des années, les performances du rayonnement laser en milieu sol-gel ont considérablement augmenté. Les caractéristiques de rendement, d'accordabilité en longueur d’onde et de largeur spectrale d’émission sont maintenant à des niveaux comparables à celles des lasers à colorant liquide. Ces améliorations spectaculaires au niveau des performances sont essentiellement dues à l’utilisation de matrices hybrides. En outre les excellentes propriétés physiques (polissage, tenue au faisceau…) de ces matrices permettent d’envisager sérieusement la commercialisation de lasers à colorants solides, impulsionnels et accordables (figure 10b).
 Figure 10a : xérogels dopés fluorescents[9]. |
 |
Matrices hybrides photochromiques
Dans le cas d’une matrice sol-gel purement inorganique, préparée par exemple à partir du tétraéthoxysilane Si(OC2H5)4, la matrice est polaire. Par l’intermédiaire des fonctions silanols (Si-OH), la matrice peut interagir avec le système moléculaire invité si celui-ci porte également des groupes polaires pour former des liaisons de type hydrogène, dix fois plus énergétiques que les liaisons de van der Waals. Une conséquence de l’utilisation de matrices inorganiques est la stabilisation de formes ioniques métastables. Illustrons ces propos au travers du contrôle des propriétés de gels photochromes. Rappelons seulement que le photochromisme est la transition photoinduite entre deux composés chimiques A et B dont les spectres d’absorption dans le domaine du visible diffèrent. Pour le composé photochromique représenté figure 11, la forme incolore A est constituée de deux parties orthogonales liées par un carbone. La photocoloration se fait après irradiation avec de la lumière UV, conduisant à la rupture de la liaison carbone-oxygène. La molécule B obtenue est plane, absorbante dans le visible, et ionique. La réaction de retour vers A, avec décoloration, se fait par absorption de lumière visible. Ce processus photochimique est en général plus rapide que la décoloration thermique dont le temps caractéristique est de quelques secondes.

Le photochromisme des composés du type de celui reporté figure 11 est observé à l’état liquide dans différents solvants et à l’état solide lorsque les molécules sont piégées dans des matrices polymériques organiques. Les applications potentielles des photochromes organiques sont importantes et variées, en particulier dans les domaines des matériaux à transmission optique variable (« verres organiques » photochromiques) et celui du stockage optique de l’information. L’introduction des molécules dans des matrices hybrides organiques-inorganiques, en particulier celles préparées à partir de précurseurs alkylalkoxydes, conduit à un comportement photochromique comparable à celui observé dans les polymères organiques classiques. Le photochromisme est dit normal et les échantillons incolores sont transformés en xérogels colorés par irradiation UV. La forme stable dans ces matrices hybrides est donc la forme A (figure 12a). Lorsque les molécules sont introduites dans un xérogel purement inorganique, la forme B ionique est stabilisée par liaison hydrogène avec les groupes silanols de la matrice gel. Le photochromisme est alors inverse : les gels sont décolorés par action de la lumière visible (figure 12b).

Greffage covalent : matériaux photo-forme
Un premier avantage de la réaction de greffage est l’augmentation de la concentration volumique en molécules qui peut améliorer l’efficacité du matériau. Il en existe en fait beaucoup d’autres et de nombreuses applications peuvent être envisagées pour ces matériaux composites qui font actuellement l’objet d’études dans un grand nombre de laboratoires. Certaines propriétés de ce type d’hybrides seront dans la suite évoquées, au travers du comportement sous irradiation lumineuse, de molécules d’azobenzène greffées à la charpente silicaté de la matrice.
Les colorants de la famille des azobenzènes peuvent subir une réaction de photoisomérisation de la forme trans à la forme cis lorsqu’ils sont soumis à une irradiation lumineuse de longueur d’onde précise (figure 13). Le retour vers la forme thermodynamiquement plus stable (isomère trans) s’effectuant de façon photochimique ou thermique.

Au cours de cette transformation, les azobenzènes présentent un changement structural important qui peut affecter le milieu dans lequel ils sont plongés. Le cycle trans-cis-trans peut par exemple, dans certaines conditions, être à l’origine d’un mouvement de matière. Celui-ci intervient dans les polymères organiques à chaînes latérales de faibles poids moléculaires. Concernant les matériaux hybrides, préparés à partir de la molécule de la figure 14 (solidaire du polymère sol-gel), c’est l’état de condensation de la charpente silicatée qui est contrôlé pour observer cet effet.

Pour les matrices faiblement réticulées, le déplacement de matière intervient précisément lorsqu’une figure d’interférences créée à partir d’un laser est projetée sur le matériau (film mince de l’ordre du micromètre). Dans les zones éclairées de cette figure d’interférence la photoisomérisation des azobenzènes intervient et provoque une migration moléculaire conduisant à l’inscription de réseaux de surface. La figure 15 donne un aperçu de cette déformation de surface observée en microscopie électronique à balayage.

Le composant ainsi réalisé peut trouver des applications dans le domaine optique (coupleur…).
Miroirs interférentiels
Le dépôt de xérogels en couche mince permet de produire des miroirs interférentiels (ou miroir de Bragg) en alternant des couches de haut et bas indices d’épaisseurs parfaitement contrôlées. En général, la couche de haut-indice est un film de silice et celle de bas-indice un film de zircone ou un nanocomposite de zircone et d'un polymère classique. De tels miroirs ont été réalisés pour des lasers de puissance[3].
Matériaux hybrides pour l'électronique
Les films sol-gel sont déposés et formés selon des principes compatibles avec l'électronique, par exemple sur des plaquettes de silicium, permettant par exemple de créer des films diélectriques (BaTiO3), certains types de cellules photovoltaïques (sans matériaux ni procédés toxiques)[10],[11],[12],[13] ou encore des mémoires ferromagnétiques de seulement 200 nm d’épaisseur, directement construite sur le silicium[3].
Conclusion et perspectives
La synthèse sol-gel conduit à l’élaboration à basse température de solides amorphes transparents et denses dans lesquels des espèces moléculaires organiques peuvent être introduites. En dépit de leur coût souvent élevé, la richesse des précurseurs sol-gel permet le développement de nouveaux matériaux hybrides organiques-inorganiques dont les propriétés optiques peuvent être contrôlées à volonté. En effet, suivant la nature des alkoxydes utilisés, il est aisé de maîtriser les interactions entre le réseau polymérique de la matrice sol-gel et le système moléculaire en fonction du domaine d’application du matériau. Les systèmes présentés ici sont des exemples de réalisations. Les usages à ce jour les plus probables sont ou seront les couches minces à propriétés mécanique, électrique, électronique, magnétique ou optique, super-hydrophobes[14] ou encore antifouling (pas ou peu toxique[15]) ou antibiotique (anti-biofilm)[16] ou (bio)climatique, nanofiltrantes[17], etc.
D’autres effets ou pistes sont en cours d’étude, notamment dans le domaine de l'« autocombustion »[18],[19],[20],[21] ou des nanocomposites renfermant des nanoparticules inorganiques.
Notes et références
- Pinjari, D. V., Prasad, K., Gogate, P. R., Mhaske, S. T. et Pandit, A. B. (2015), Synthesis of titanium dioxide by ultrasound assisted sol–gel technique : Effect of calcination and sonication time. Ultrasonics sonochemistry, 23, 185-191.
- Di Carlo, L., Conte, D. E., Kemnitz, E. et Pinna, N. (2014). Microwave-assisted fluorolytic sol–gel route to iron fluoride nanoparticles for Li-Ion batteries. Chemical Communications, 50(4), 460-462.
- Dossier Technique : Le Procédé Sol-Gel, RESCOLL, 15 p.
- Gill, I. et Ballesteros, A. (1998), Encapsulation of biologicals within silicate, siloxane, and hybrid sol-gel polymers: an efficient and generic approach, Journal of the American Chemical Society, 120(34), 8587-8598 (résumé).
- Livage, J. (1996). Bioactivity in sol-gel glasses. Comptes rendus de l'Académie des sciences. Série II, Mécanique, physique, chimie, astronomie, 322(5), 417-427 (Notice Inist-CNRS).
- Sanchez, C., Arribart, H. et Guille, M. M. G., Biomimetism and bioinspiration as tools for the design of innovative materials and systems, Nature Materials, 2005, 4(4), 277-288.
- Échantillons F. Chaput, CNRS-École polytechnique.
- Échantillons F. Chaput, CNRS-École polytechnique.
- Échantillons M. Blanchard-Desce, L. Porres, CNRS-Rennes.
- Su, Z., Sun, K., Han, Z., Cui, H., Liu, F., Lai, Y.… et Green, M. A. (2014), Fabrication of Cu 2 ZnSnS 4 solar cells with 5.1% efficiency via thermal decomposition and reaction using a non-toxic sol–gel route, Journal of Materials Chemistry A, 2(2), 500-509.
- MacLeod, B. A., Schulz, P., Cowan, S. R., Garcia, A., Ginley, D. S., Kahn, A. et Olson, D. C. (2014). Improved Performance in Bulk Heterojunction Organic Solar Cells with a Sol‐Gel MgZnO Electron‐Collecting Layer. Advanced Energy Materials, 4(13) (résumé)
- Aslan, F., Adam, G., Stadler, P., Goktas, A., Mutlu, I. H. et Sariciftci, N. S. (2014). Sol–gel derived In 2 S 3 buffer layers for inverted organic photovoltaic cells. Solar Energy, 108, 230-237.
- Zhu, Z., Bai, Y., Zhang, T., Liu, Z., Long, X., Wei, Z.… et Yang, S. (2014), High‐Performance Hole‐Extraction Layer of Sol–Gel‐Processed NiO Nanocrystals for Inverted Planar Perovskite Solar Cells. Angewandte Chemie, 126(46), 12779-12783.
- Latthe, S. S., Terashima, C., Nakata, K., Sakai, M. et Fujishima, A. (2014), Development of sol–gel processed semi-transparent and self-cleaning superhydrophobic coatings, Journal of Materials Chemistry A, 2(15), 5548-5553 (résumé).
- Detty, M. R., Ciriminna, R., Bright, F. V. et Pagliaro, M. (2014), Environmentally benign sol–gel antifouling and foul-releasing coatings, Accounts of Chemical Research, 47(2), 678-687.
- Bhattacharyya, S., Agrawal, A., Knabe, C. et Ducheyne, P. (2014), Sol–gel silica controlled release thin films for the inhibition of methicillin-resistant Staphylococcus aureus, Biomaterials, 35(1), 509-517.
- Da, X., Wen, J., Lu, Y., Qiu, M. et Fan, Y. (2015). An aqueous sol-gel process for the fabrication of high-flux YSZ nanofiltration membranes as applied to the nanofiltration of dye wastewater. Separation and Purification Technology (résumé).
- Ahmad, I., Abbas, T., Ziya, A. B., Abbas, G. et Maqsood, A. (2014), Size dependent structural and magnetic properties of Al substituted Co–Mg ferrites synthesized by the sol–gel auto-combustion method, Materials Research Bulletin, 52, 11-14.
- Mirzaee, O., Mohamady, R., Ghasemi, A. et Farzin, Y. A. (2015), Study of the magnetic and structural properties of Al–Cr codoped Y-type hexaferrite prepared via sol–gel auto-combustion method, International Journal of Modern Physics B, 29(14), 1550090 (résumé).
- Liu, G. F., Fan, R. H., Yan, K. L., Wang, X. A., Sun, K., Cheng, C. B. et Hou, Q. (mai 2015), Magnetic Properties and Unusual Morphologies of Barium Ferrites Prepared by Electrospinning and Sol-Gel Auto-Combustion Method. In Materials Science Forum (vol. 815, p. 141-146) (résumé).
- Rashad, M. M., El-Shaarawy, M. G., Shash, N. M., Maklad, M. H. et Afifi, F. A. (2015), Controlling the composition, microstructure, electrical and magnetic properties of LiFe 5 O 8 powders synthesized by sol gel auto-combustion method using urea as a fuel, Journal of Magnetism and Magnetic Materials, 374, 495-501 (résumé).
Voir aussi
Articles connexes
Bibliographie
- (en) Bounor-Legaré, V. et Cassagnau, P. (2014). In situ synthesis of organic–inorganic hybrids or nanocomposites from sol–gel chemistry in molten polymers, Progress in Polymer Science, 39(8), 1473-1497 (résumé).
- (en) Brincker J, G.W. Scherer (1990), Sol-Gel Science, The Physics and Chemistry of Sol-Gel Processing, Academic Press.
- Boilot J-P. , M. Canva, C. Sanchez, B. Lebeau, F. Chaput, Y. Lévy, J. Zyss (1996), Applications des matériaux hybrides dans le domaine de l’optique, Matériaux hybrides, série Arago, Observatoire français des techniques avancées (Masson), 17, 181.
- Catauro, M., Papale, F., Roviello, G., Ferone, C., Bollino, F., Trifuoggi, M. et Aurilio, C. (2014), Synthesis of SiO2 and CaO rich calcium silicate systems via sol‐gel process: Bioactivity, biocompatibility, and drug delivery tests, Journal of Biomedical Materials Research Part A, 102(9), 3087-3092 (résumé).
- Chaput F, J.P. Boilot, F. Devreux, M. Canva, A. Brun et P. Georges (1993), Des gels pour l’optique, Pour la science, septembre, p. 46-53.
- (en) Innocenzi P. (2016), The Sol to Gel Transition. Springer Briefs in Materials. Springer.
- (en) Klein L.C. (1993), Sol-gel optics, processing and applications, Kluwer Academic Publishers, Boston.
- (en) Lee, W. J., Park, W. T., Park, S., Sung, S., Noh, Y. Y. et Yoon, M. H. (2015). Large‐Scale Precise Printing of Ultrathin Sol–Gel Oxide Dielectrics for Directly Patterned Solution‐Processed Metal Oxide Transistor Arrays. Advanced Materials (résumé).
- (en) McDermott, M. D., Zhang, J. et Otto, K. J. (). Improving the brain machine interface via multiple Tetramethyl Orthosilicate sol-gel coatings on microelectrode arrays. In Neural Engineering (NER), 2015 7th International IEEE/EMBS Conference on (p. 422-425). IEEE (résumé).
- (en) Maia, A. S., Stefani, R., Kodaira, C. A., Felinto, M. C., Teotonio, E. E. et Brito, H. F. (2014), Luminescent nanoparticles of MgAlsub (2) Osub (4): Eu, Dy prepared by citrate sol-gel method, Optical Materials.
- (en) Moein, M. M., El-Beqqali, A., Abdel-Rehim, A., Jeppsson-Dadoun, A. et Abdel-Rehim, M. (2014), Preparation of monolithic molecularly imprinted polymer sol–gel packed tips for high-throughput bioanalysis: Extraction and quantification of l-tyrosine in human plasma and urine samples utilizing liquid chromatography and tandem mass spectrometry, Journal of Chromatography B, 967, 168-173 (résumé).
- (en) Lofgreen, J. E. et Ozin, G. A. (2014). Controlling morphology and porosity to improve performance of molecularly imprinted sol–gel silica. Chemical Society Reviews, 43(3), 911-933.
- (en) Maksasithorn, S., Suriye, K., Praserthdam, P. et Debecker, D. P. (2015). Super-microporous WO3-SiO2 olefin metathesis catalysts obtained by an aerosol-assisted sol-gel route. In 3rd International Conference on Advanced Complex Inorganic Nanomaterials (ACIN 2015).
- (en) Piombini, H., Ambard, C., Compoint, F., Valle, K., Belleville, P. et Sanchez, C. (). Indentation hardness and scratch tests for thin layers manufactured by sol-gel process. In CLEO: Applications and Technology (p. AF1J-3). Optical Society of America (résumé).
- (en) Sung, S., Park, S., Lee, W. J., Son, J., Kim, C. H., Kim, Y.… et Yoon, M. H. (2015), Low-Voltage Flexible Organic Electronics Based on High-Performance Sol–Gel Titanium Dioxide Dielectric, ACS Applied Materials & Interfaces, 7(14), 7456-7461.
- (en) Toscani, S., Hernandez, O., Aparicio, C. et Spanhel, L. (2014), Glass formation and confined melting in sol–gel derived nano-ZnO aggregates, Journal of Sol-gel Science and Technology, 69(2), 457-463 (résumé).
- (en) Wang, J., Monton, M. R. N., Zhang, X., Filipe, C. D., Pelton, R. et Brennan, J. D. (2014). Hydrophobic sol–gel channel patterning strategies for paper-based microfluidics. Lab on a Chip, 14(4), 691-695.
- (en) Zhang, J., Niu, Y., Li, S., Luo, R. et Wang, C. (2014). A molecularly imprinted electrochemical sensor based on sol–gel technology and multiwalled carbon nanotubes–Nafion functional layer for determination of 2-nonylphenol in environmental samples. Sensors and Actuators B: Chemical, 193, 844-850 (résumé).
- Portail de la chimie