Photosystème I
Le photosystème I (PSI) est une oxydoréductase qui catalyse la réaction :
- plastocyanine réduite + ferrédoxine oxydée + hν plastocyanine oxydée + ferrédoxine réduite.
| N° EC | EC |
|---|
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |

| Pfam | PF00223 |
|---|---|
| InterPro | IPR001280 |
| PROSITE | PDOC00347 |
| SCOP | 1jb0 |
| SUPERFAMILY | 1jb0 |
| TCDB | 5.B.4 |
| Famille OPM | 2 |
| Protéine OPM | 1jb0 |
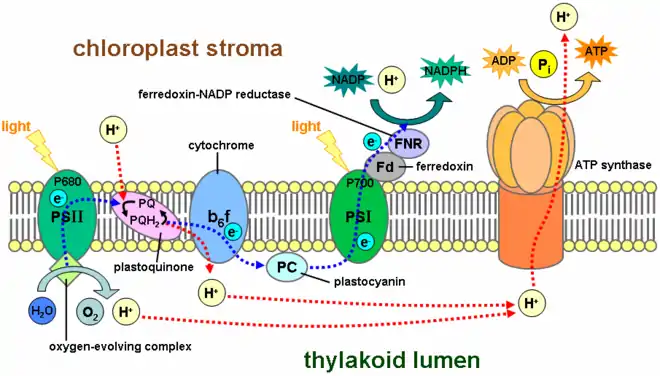
Ce complexe enzymatique est le second à intervenir dans les réactions de la photosynthèse dépendantes de la lumière. On le trouve dans la membrane des thylakoïdes chez les cyanobactéries et dans les chloroplastes des plantes et des algues. Le photosystème I a été appelé ainsi car il a été découvert avant le photosystème II, bien qu'il intervienne après celui-ci dans le fonctionnement de la photosynthèse. Certains aspects du photosystème I ont commencé à être connus dès les années 1950, mais l'importance de ces découvertes n'était pas encore comprise[3]. Louis Duysens fut le premier à proposer les concepts de photosystème I et photosystème II en 1960, et, la même année, une synthèse réalisée par Fay Bendall et Robert Hill présentait l'état de l'art des connaissances du moment en une théorie cohérente de réactions photosynthétiques[3] : ces hypothèses furent confirmées les années suivantes par les expériences conduites par les équipes de Duysens et de Witt.
Le photosystème I est un complexe protéique membranaire intégral qui utilise l'énergie lumineuse pour transférer un électron d'une plastocyanine à une ferrédoxine. Il contient plus de 110 cofacteurs, sensiblement plus que le photosystème II. Ces différents composants ont des fonctions variées. Ceux impliqués dans les transferts d'électrons du centre réactionnel du PSI sont le dimère de chlorophylle P700 comme donneur primaire d'électron et cinq accepteurs d'électron : la chlorophylle A0, la phylloquinone A1 et trois clusters fer-soufre [4Fe-4S] notés Fx, Fa et Fb.
PsaA et PsaB sont deux sous-unités principales du PSI. Ce sont deux protéines membranaires intégrales apparentées qui se lient aux composants P700, A0, A1 et Fx du système. Elles contiennent entre 730 et 750 acides aminés et posséderaient 11 segments transmembranaires. Le cluster [4Fe-4S] est lié à quatre résidus de cystéine : deux d'entre eux sont fournis par la protéine PsaA et les deux autres par la protéine PsaB. Les deux résidus de cystéine des deux protéines sont proximaux et situés dans une boucle entre les 9e et 10e segments transmembranaires. Une glissière à leucine semble être présente en aval (vers l'extrémité 3') des cystéines et pourrait contribuer à la dimérisation des unités PsaA/PsaB[4].
Notes et références
- (en) Alexey Amunts, Omri Drory et Nathan Nelson, « The structure of a plant photosystem I supercomplex at 3.4 Å resolution », Nature, vol. 447, , p. 58-63 (lire en ligne) DOI:10.1038/nature05687
- (en) Patrick Jordan, Petra Fromme, Horst Tobias Witt, Olaf Klukas, Wolfram Saenger et Norbert Kraus zlig, « Three-dimensional structure of cyanobacterial photosystem I at 2.5 Å resolution », Nature, vol. 411, no 6840, , p. 909-917 (PMID 11418848, DOI 10.1038/35082000, Bibcode 2001Natur.411..909J, lire en ligne)
- (en) Petra Fromme, Paul Mathis, « Unraveling the Photosystem I Reaction Center: A History, or the Sum of Many Efforts », Photosynthesis Research, vol. 80, nos 1-3, , p. 109-124 (lire en ligne) DOI:10.1023/B:PRES.0000030657.88242.e1
- (en) Andrew N. Webber, Richard Malkin, « Photosystem I reaction-centre proteins contain leucine zipper motifs: A proposed role in dimer formation », FEBS Letters, vol. 264, no 1, , p. 1-4 (lire en ligne) DOI:10.1016/0014-5793(90)80749-9
- Portail de la biochimie