Ferrédoxine-NADP+ réductase
La ferrédoxine-NADP+ réductase (FNR) est une oxydoréductase qui catalyse la réaction :
- 2 ferrédoxines réduites + NADP+ + H+ 2 ferrédoxines oxydées + NADPH.
| N° EC | EC |
|---|---|
| N° CAS | |
| Cofacteur(s) | FAD |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
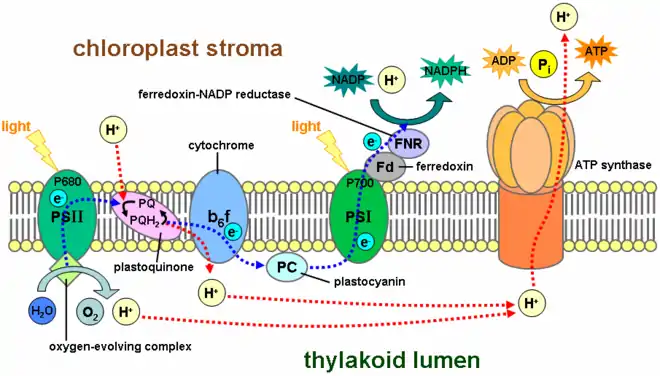
Cette enzyme est la dernière à intervenir dans le transfert des électrons au cours de la photosynthèse. Elle utilise les électrons à haut potentiel issus du photosystème I pour réduire le NADP+ en NADPH, ce dernier étant par la suite utilisé dans le cycle de Calvin. Le transfert des électrons de la ferrédoxine vers le NADP+ a lieu à la lumière en partie parce que l'activité de la FNR est inhibée dans l'obscurité[2]. Chez les organismes non photosynthétiques, cette enzyme fonctionne en sens inverse pour fournir de la ferrédoxine réduite pour diverses voies métaboliques, telles que la fixation de l'azote, la biosynthèse des terpénoïdes, le métabolisme des stéroïdes, la réponse au stress oxydant ou encore la biogenèse des protéines fer-soufre[3].
La FNR est une protéine soluble présente à la fois dans le stroma des chloroplastes et liée à la membrane des thylakoïdes. La liaison de l'enzyme à la membrane du thylakoïde intervient à l'opposé du site actif et ne semble pas affecter la structure de la protéine ni l'activité de l'enzyme[4]. La fixation de l'enzyme à la membrane est favorisée à pH acide, ce qui aurait pour effet de stabiliser l'enzyme à la surface des thylakoïdes dans l'obscurité, lorsque la réduction du NADP+ sous l'effet de la photosynthèse cesse d'avoir lieu[5]. En effet, le stroma des chloroplastes est légèrement acide dans l'obscurité et devient plus basique à la lumière[4].
Notes et références
- (en) Alessandro Aliverti, Rick Faber, Casey M. Finnerty, Cristian Ferioli, Vittorio Pandini, Armando Negri, P. Andrew Karplus et Giuliana Zanetti, « Biochemical and Crystallographic Characterization of Ferredoxin−NADP+ Reductase from Nonphotosynthetic Tissues », Biochemistry, vol. 40, no 48, , p. 14501-14508 (PMID 11724563, DOI 10.1021/bi011224c, lire en ligne)
- (en) Eero Talts, Vello Oja, Heikko Rämma, Bahtijor Rasulov, Agu Anijalg et Agu Laisk, « Dark inactivation of ferredoxin-NADP reductase and cyclic electron flow under far-red light in sunflower leaves », Photosynthesis Research, vol. 94, no 1, , p. 109-120 (lire en ligne) DOI:10.1007/s11120-007-9224-7
- (en) Alessandro Aliverti, Vittorio Pandini, Andrea Pennati, Matteo de Rosa et Giuliana Zanetti, « Structural and functional diversity of ferredoxin-NADP+ reductases », Archives of Biochemistry and Biophysics, vol. 474, no 2, , p. 283-291 (lire en ligne) DOI:10.1016/j.abb.2008.02.014
- (en) Ferdinand Alte, Anna Stengel, J. Philipp Benz, Eike Petersen, Jürgen Soll, Michael Groll et Bettina Bölter, « Ferredoxin:NADPH oxidoreductase is recruited to thylakoids by binding to a polyproline type II helix in a pH-dependent manner », Proceedings of the National Academy of Sciences of the United States of America, vol. 107, no 45, , p. 19260-19265 (lire en ligne) DOI:10.1073/pnas.1009124107
- (en) J. Philipp Benz, Minna Lintala, Jürgen Soll, Paula Mulo et Bettina Bölter, « A new concept for ferredoxin–NADP(H) oxidoreductase binding to plant thylakoids », Trends in Plant Science, vol. 15, no 11, , p. 608-613 (lire en ligne) DOI:10.1016/j.tplants.2010.08.008
- Portail de la biochimie