Nitrure
Les nitrures[1] sont des composés où l'azote est au nombre d'oxydation –III. Ils constituent une large famille dont certains représentants ont des applications concrètes comme le nitrure de titane dont la dureté est mise à profit pour renforcer certains outils.

L'ion N3− est isoélectronique de l'ion oxyde O2− et de l'ion fluorure F−. Il existe des nitrures ioniques (M3N2 où M = Be2+, Mg2+, Ca2+, etc.) et des nitrures covalents (S2N2, S2N4, etc.). L'ion nitrure est également un ligand qui se rencontre dans les complexes des éléments de transition, le nom du ligand est nitrido : ex MoO3N−. L'azote est alors considéré comme triplement lié au métal.
L'anion nitrure se rencontre à l'état solide avec un rayon ionique de 140 pm (picomètre, 1 × 10−12 m). Il n'existe jamais en solution aqueuse, car c'est une base très forte qui s'hydrolyse immédiatement au contact de l'eau en captant successivement trois protons pour donner de l'ammoniac (NH3). Il est formellement la base conjuguée de NH2−, qui est elle-même la base conjuguée de l'ion amidure NH2−, une base forte qui n'existe pas non plus dans l'eau.
Les nitrures de métaux électropositifs (entre autres: Li, Zn, et les métaux alcalino-terreux, comme le magnésium repris dans l'exemple ci-dessous) s'hydrolysent facilement au contact de l'eau, en ce compris avec l'humidité de l'air pour donner l'hydroxyde correspondant et de l'ammoniac :
- Mg3N2 + 6 H2O → 3 Mg(OH)2 + 2 NH3
L'ion nitrure N3−, chargé trois fois négativement, ne doit pas être confondu avec l'ion azoture N3− qui comprend 3 atomes d'azote alignés linéairement, mais porte une seule charge négative délocalisée sur l'ensemble de la molécule.
Nitrures métalliques

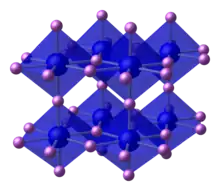
L’électronégativité de l’azote (χ = 3) est très supérieure à celle des métaux et à ce titre, la structure ionique contenant un cation métallique et l’ion nitrure est a priori susceptible d’exister. Et elle existe effectivement pour la plupart des métaux comme pour le nitrure d'aluminium AlN ci-contre.
Les nitrures métalliques peuvent se former par action directe du diazote sur les métaux à haute température. C’est par cette réaction que le gaz noble argon a été pour la première fois isolés à partir de l’air, facilement débarrassé du dioxygène par du cuivre chaud[2], et débarrassé du diazote par action du magnésium chaud[3]. Lors de cette opération où il n’est resté que de l’argon, le diazote s’est transformé en nitrure de magnésium Mg3N2.
Le rayon de l'anion nitrure (140 pm) est d'une taille supérieure (voir très supérieure) à celle de la plupart des cations métalliques. Voir la structure ci-contre du nitrure de lithium (rayon ionique du lithium 90 pm) avec les nombreux petits cations Li+ entourant les gros anions N3−.
Certains nitrures, tel le nitrure de niobium, sont supraconducteurs.
Nitrures des non-métaux
La plupart des composés binaires contenant l’azote et un non-métal ne sont pas des nitrures. Ainsi, les oxydes d’azote ne sont pas des nitrures d’oxygène. Cependant, quand l’électronégativité de l'élément lié à l'azote est inférieure à celle de l'azote, c’est le cas du bore (χ = 2), alors le composé en question est effectivement un nitrure (ex. nitrure de bore BN. Ce composé étant isoélectronique du carbone, il possède deux formes polymorphiques comme le graphite et le diamant). À la différence des nitrures métalliques, les nitrures des non-métaux sont covalents et non ioniques.
Le nitrure de bore cristallise sous forme hexagonale comme le graphite. Comme lui, il présente une excellente résistance à la chaleur, d'où son usage comme creuset. Vu sa grande dureté, il entre également dans la fabrication d'abrasifs à usage industriel. On l'a aussi utilisé dans la fabrication de nanotubes.
- Nitrure de bore
-3D-balls.png.webp) Nitrure de bore ressemblant structurellement au diamant
Nitrure de bore ressemblant structurellement au diamant-top-3D-balls.png.webp) Nitrure de bore ressemblant structurellement au graphite
Nitrure de bore ressemblant structurellement au graphite Structure de Lewis du nitrure de bore de type graphite
Structure de Lewis du nitrure de bore de type graphite
L'azote peut également former des composés covalents binaires avec le soufre, notamment la molécule cyclique de S4N4. Sa configuration spatiale en trois dimensions est celle d'un octogone qui aurait été très fortement incurvé.

Préparation des nitrures
Les nitrures se préparent de différentes façons. La réaction directe à chaud sur un métal a été mentionnée ci-dessus. Un nitrure peut aussi être obtenu par décomposition d’un azoture, d’un amidure, ou par déprotonation de l’ammoniac en présence d’un métal.
Utilisation des nitrures
Les nitrures de silicium, de titane et de tungstène sont utilisés en métallurgie (céramiques) en raison de leur grande dureté.
Nitrure d'uranium
Le terme de nitrure d'uranium se réfère à une famille de plusieurs matériaux céramiques: le mononitrure d'uranium (UN), le sesquinitrure d'uranium (U2N3) et le dinitrure d'uranium (UN2).
Le nitrure d'uranium a été considéré comme matrice potentielle de combustible nucléaire pour les réacteurs nucléaires de quatrième génération à neutrons rapide en raison de sa conductivité thermique élevée et de sa bonne résistance aux très hautes températures.
La présence d'azote dans la matrice de combustible présente cependant un inconvénient majeur sur le plan de la gestion des déchets radioactifs du combustible usé. En effet, suite à la réaction nucléaire 14N (n, p) 14C, l'azote-14 donne lieu à la formation de carbone-14, un radionucléide de longue demi-vie (T½ = 5730 ans) et très radiotoxique. Pour éviter la production de 14C, il serait nécessaire d'utiliser l'isotope 15N de l'azote (abondance isotopique: seulement 0,364 % de l'azote total), ce qui représenterait un coût prohibitif de l'enrichissement isotopique.
D'autres défis liés à la mise en œuvre et à l'obtention d'une licence de fabrication de ce type de combustible nucléaire concernent notamment la voie très complexe de conversion à partir de l'hexafluorure d'uranium (UF6) enrichi en 235U, l'impérative nécessité d'éviter l'oxydation du matériau durant sa fabrication et les questions non-résolues de sûreté liées à la route d'élimination définitive du combustible usé.
Azote dans les aciers
Le recours à la nitruration pour le traitement de surface des aciers a pour but d'en augmenter la dureté et de les rendre plus résistants à l'abrasion. Cependant, la présence d'azote interstitiel (ou dissout) au sein même du réseau cristallin de l'acier présente l'inconvénient de le fragiliser et de le rendre cassant. La présence d'azote dans l'acier entraîne un abaissement de sa ductilité et diminue son aptitude au soudage.
La teneur en azote dans les aciers doit donc être rigoureusement contrôlée. Elle est typiquement de l'ordre de 10 à 200 ppm (partie par million, mg/kg). La contamination de l'acier par l'azote dissout dans le métal provient principalement de l'azote contenu initialement dans les matériaux entrant dans la fabrication du fer métallique dans les hauts fourneaux: surtout le coke, le minerai de fer ou le fondant. Une partie des impuretés d'azote présent dans l'acier provient également du contact du métal en fusion avec l'azote de l'air ou avec l'azote gazeux pur utilisé pour homogénéiser le métal fondu dans les poches ou les creusets où il est manipulé.
L'addition de faibles quantités d'aluminium à l'acier permet la précipitation de nitrure d'aluminium (AlN) pour fixer les nitrures sous forme de phases stables dans l'acier.
L'addition de très petites quantités de niobium et de vanadium à l'acier permet de contrôler la teneur en nitrures et carbures interstitiels et d'en améliorer les propriétés mécaniques et le vieillissement[4].
L'azote présent en trace dans les aciers des composants structurels des réacteurs nucléaires et dans le zircaloy des gaines des éléments de combustible nucléaire est également le principal précurseur du 14C que l'on retrouve dans les déchets radioactifs métalliques irradiés aux neutrons. En effet, l'azote-14 se transforme en carbone-14 suite à la réaction nucléaire 14N (n, p) 14C et sa section efficace pour les neutrons thermiques n'est pas négligeable (1.81 barn). Le 14C (T½ = 5730 ans) sera relâché très lentement dans l'environnement sous forme de CH4 ou de CO2 lors de la corrosion des métaux qui le contiennent.
Voir aussi
Articles connexes
Notes et références
- Greenwood N.N. & Eanrshaw A (2003) Chemistry of the elements. 2nd Ed. Elsevier.
- (en) Carmen J. Giunta, « Using history to teach scientific method: The case of argon », J. Chem. Educ., vol. 75, no 10, , p. 1322-1325 (DOI 10.1021/ed075p1322)
- (en) Mary Elvira Weeks, « The discovery of the elements. WVIII. The inert gases », J. Chem. Educ., vol. 9, no 12, , p. 2065 (DOI 10.1021/ed009p2065)
- Eglantine Courtois (2005) Etude de la précipitation des carbures et des carbonitrures de niobium dans la ferrite par microscopie électronique en transmission et techniques associées. Thèse de doctorat préparée au Laboratoire du Groupe d’Etudes de Métallurgie Physique et de Physique des Matériaux de l’INSA de Lyon.
- Portail de la chimie