Lactobacillus gasseri
Lactobacillus gasseri est une espèce de bactérie lactique de la famille des Lactobacillaceae. Elle fait partie du microbiote des muqueuses buccales, vaginales et intestinales de l’homme ; on la trouve aussi dans les blessures, l’urine, le sang et le pus de patients souffrant de septicémie.

| Règne | Bacteria |
|---|---|
| Division | Firmicutes |
| Classe | Bacilli |
| Ordre | Lactobacillales |
| Famille | Lactobacillaceae |
| Genre | Lactobacillus |
Plusieurs souches de cette bactérie possèdent des propriétés les qualifiant pour des applications probiotiques[1].
Étymologie et histoire
L’épithète spécifique gasseri dérive du nom du bactériologiste français Francis Gasser de l’Institut Pasteur.
Avant les années 1970, L. gasseri ne pouvait être distingué de Lactobacillus acidophilus par des analyses phénotypiques ou métaboliques. Après les travaux de Gasser qui ont permis de distinguer des sous-groupes de L. acidophilus grâce à leur caractérisation par électrophorèse de la lactate déshydrogénase (Gasser[2], 1970), Lauer et Kandler[3] définirent en 1980 une nouvelle espèce nommée Lactobacillus gasseri basée sur la technique d’hybridation ADN-ADN
Description
Lactobacillus gasseri est[4] est une bactérie lactique, gram-positive, anaérobie :
- en forme de bâtonnet aux extrémités arrondies, de 0,6-0,8 x 3,0-5,0 μm
- non motile
- apparaissant isolée ou en courtes chaînes
- homofermentaire obligatoire (produit exclusivement de l’acide lactique à partir du glucose)
- le pH de croissance est entre 5 et 7
- la plupart des souches peuvent fermenter l’amidon
- sa position phylogénétique est dans le groupe des Lactobacillus delbrueckii
Colonisation des muqueuses et protection contre les pathogènes
L. gasseri colonise le système digestif et le vagin de personnes en bonne santé où elle joue un rôle protecteur contre les infections.
Activité antimicrobienne
Les bactéries lactiques ont le pouvoir d’éliminer ou d’inhiber la croissance de certains micro-organismes en produisant des bactériocines. La bactériocine la mieux caractérisée de L. gasseri est la gasserine A de L. gasseri LA39 isolée de fèces de bébé. L’activité antimicrobienne in vitro de L. gasseri LA39 a été établie pour les pathogènes Listeria monocytogenes, Bacillus cereus et Staphylococcus aureus[5]. Une autre souche, L. gasseri LF221, encode aussi deux séquences de bactériocines, nommées acidocine A et acidocine B. Elles inhibent Listeria innocua, S. aureus, et beaucoup d’espèces de Clostridium[6].
Comme toutes les bactéries lactiques, L. gasseri produit des acides organiques. Elle métabolise le glucose en acide lactique capables d’inhiber les pathogènes en provoquant chez ceux-ci une acidification intracellulaire.
Différentes études[5] ont montré que les souches L. gasseri OLL2716, ADH et SBT2055 étaient capables de coloniser transitoirement le système digestif.
Le séquençage du génome de L. gasseri ATCC 33323 a révélé les mécanismes de base pour survivre dans le tractus gastro-intestinal et la capacité de se fixer sur le mucus.
Colonisation du système gastro-intestinal
L. gasseri colonise amplement différents microbiotes des muqueuses de l’homme : la bouche, l’intestin grêle et le colon. La colonisation du vagin de la femme et la colonisation précoce du tractus gastro-intestinal du nourrisson semble indiquer une voie potentielle de transfert[5]. Le tube digestif stérile in utero du nouveau-né est contaminé par les bactéries fécales, vaginales et cutanées de la mère lors de l’accouchement. Il a été montré que L. gasseri est le micro-organisme prévalent dans le début de la colonisation du tractus gastro-intestinal du nourrisson[7].
Colonisation de la muqueuse vaginale
Le microbiote vaginal humain est un écosystème complexe qui peut être dominé par un petit nombre de Lactobacillus. C’est le cas de la bactérie L. gasseri, un commensal de la muqueuse vaginale qui la protège des infections. Sa colonisation de la muqueuse permet de développer une résistance contre les pathogènes par une inhibition directe grâce à la sécrétion d’acide lactique, de bactériocines et de peroxyde d’hydrogène. Elle est négativement corrélée avec la vaginose bactérienne[8].
Dans un essai clinique sur des femmes porteuses de vaginose traitée par clindamycine, 64% de celles qui prirent des capsules contenant 108-9 cfu de L. gasseri DSM 14869 et L. rhamnosus DSM 14870 étaient débarrassées de vaginose à comparer aux 46 % de celles du groupe placebo[9].
Modulation du système immunitaire
Le système immunitaire intestinal s’est développé sous la pression des micro-organismes infectieux mais aussi des bactéries et levures commensales du tube digestif. Les mêmes bactéries et levures ont la capacité potentielle de provoquer une réaction inflammatoire des muqueuses des poumons ou de la vessie. Une simple couche de cellules épithéliales tapisse de manière très serrée le tube digestif. Elle a la délicate fonction d’absorber les nutriments tout en formant une barrière physique et chimique empêchant la pénétration de certaines molécules et des pathogènes.
Les micro-organismes probiotiques administrés par voie orale modulent le système immunitaire par l’intermédiaire des récepteurs de l’immunité innée (ou PRR « pattern recognition receptor ») exprimés sur les cellules présentatrices de l’antigène (CPA). Une fois activées, les CPA libèrent des cytokines qui vont gouverner la prolifération et le différentiation des lymphocytes T.
Dans l’intestin, les cellules présentatrices de l’antigène (CPA) sont présentes en dessous du revêtement de cellules épithéliales dans un tissu conjonctif de soutien (appelé lamina propria), en particulier sous forme de cellules dendritiques. Ce sont des cellules présentatrice d’antigène qui ont la particularité de pouvoir introduire un prolongement cytoplasmique (une dendrite) entre les cellules épithéliales et ainsi de pouvoir entrer en contact par leurs récepteurs PRR avec les bactéries situées dans la lumière du tube digestif (voir fig. ci-dessous).
Il existe aussi un contact indirect des cellules dendritiques avec les antigènes endoluminaux s’effectuant au niveau des plaques de Peyer de l’épithélium intestinal. On y trouve des cellules M (« microfold cells ») qui incorporent par endocytose les antigènes puis les transfèrent aux cellules dendritiques.
Étude in vitro
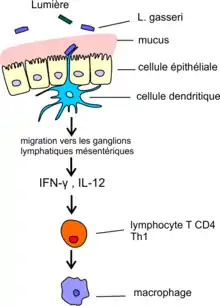
Une étude in vitro de cellules dendritiques myéloïdes humaines exposées à trois souches de lactobacilles (dont L. gasseri) a trouvé des sécrétions importantes de quelques cytokines : les interleukines IL-12 et IL-18 (mais pas de IL-10) mais aussi de l’interféron IFN-γ[10]. Ces substances de signalisation cellulaire agissent à distance sur les lymphocytes T CD4+ qui prolifèrent et dont une partie devient des lymphocytes T auxiliaires Th1. Ces derniers induisent une réponse immune cellulaire puissante.
Dans une culture in vitro de la lignée cellulaire HEK-293, il a été montré que Lactobacillus gasseri ATCC33323 peut interagir avec les récepteurs de type Toll (TLR) des macrophages. Le profil d’activation de ces récepteurs est limité à l’hétérodimère TLR2/6 et accessoirement à TLR2[11]. Il est intéressant de remarquer que les récepteurs TLR2 interagissent avec divers MAMPs « motifs moléculaires associés avec des microbes », comme l’acide lipotéichoïque, les glycolipides et peptidoglycanes des parois des bactéries à Gram positif.
Étude in vivo
Ces études in vitro, qui permettent un contact direct entre bactéries et cellules immunitaires, dans des conditions ultra-simplifiées, sont peu conformes à la configuration in vivo où les probiotiques sont en concurrence avec d’autres agents, dans des milieux très complexes et séparés du système immunitaire par la barrière épithéliale du tube digestif. Seules les études cliniques en double aveugle contre placebo peuvent être considérées[12].
Une illustration intéressante de la différence in vitro / in vivo est fournie par la réponse immune des plaques de Peyer des souris exposées aux deux lactobacilles, L. gasseri TMC0356 et L. rhamnosus GG. Quand on co-incube les cellules de plaques de Peyer in vitro avec L. gasseri, les cellules produisent des niveaux plus élevés de IL-6, IL-12, IFN-γ et Ig-A qu’avec L. rhamnosus[13]. Mais à l’inverse, si les souches de probiotique sont administrées par voie intra-gastrique, la réponse immune des plaques de Peyer indique que L. rhamnosus produit des niveaux plus élevés d’IFN-γ, IL-6 et IgA[5]. Ces résultats discordants peuvent venir de la capacité différente des deux souches à adhérer à l’épithélium et à interagir avec les plaques de Peyer.
La modulation immunitaire peut aussi dépendre des souches du probiotique. Ainsi une étude clinique en double-aveugle contre placebo, de deux souches de lactobacilles, L. gasseri CECT5714 (tiré de lait de femme) et L. coryniformis CECT5711 (tiré de fromage de chèvre) a été menée sur 50 adultes en bonne santé, en comparaison avec une prise de yaourt classique[14]. La consommation des deux nouvelles souches, tout comme le yaourt, produit un accroissement significatif des cellules phagocytaires (monocytes et neutrophiles) au bout de deux semaines (et se maintient à quatre semaines) avec peu de différence entre les deux groupes. Par contre, on observe une différence significative au niveau de l’accroissement des cellules tueuses naturelles NK à l’avantage des nouvelles souches; l’effet étant plus important au bout de deux semaines que de quatre.
Toutes les études prises ensemble, soulignent le potentiel de L. gasseri d’influencer le système immunitaire de l’hôte.
Prévention des réponses allergiques
L’hypersensibilité allergique de type I résulte d’une production excessive d’immunoglobuline E (IgE) par les lymphocytes B vis-à-vis d’un antigène de l’environnement. Cette production anormale d’IgE est liée à un environnement riche en interleukines IL-4, IL-5 et IL-13 (due à une hyperpolarisation Th2) et un déficit en interféron IFN-γ[15]. L’aptitude des micro-organismes probiotiques comme L. gasseri, à moduler le système immunitaire vers la production de lymphocytes Th1 (produisant l’IFN-γ, de IL-6 et IL-12,), pourrait leur conférer la possibilité d’abroger le développement de la réponse allergique chez les individus hypersensibles, sachant que l’expression des cytokines associées à Th1 entrave celles associées à Th2 [16]. L’IFN-γ (la signature des Th1) bloque le développement des Th2 via l’inhibition de la production d’IL-4 (la signature de Th2)[15].
Dans une étude, les cellules mononucléées sanguines périphériques (PBMC) d’individus allergiques ou en bonne santé, ont été co-incubées avec différents allergènes afin d’étudier les profils des cytokines produites. Une pré-incubation des PBMC avec L. gasseri PA16/8 diminue la production des cytokines IL-4 et IL-5 (associées à Th2) et accroît l’IFN-γ (associé à Th-1) [17].
Dans une autre étude, du lait fermenté préparé avec L. gasseri TMC0356 fut administré durant quatre semaines à 15 sujets souffrant de rhinite allergique et dotés de haut niveau d’IgE. Après le traitement, le niveau total d’IgE du sérum des individus traités avait diminué significativement comparé à celui d’avant l’intervention. Les lymphocytes Th1 dans la composition des PBMC virent leur niveau augmenter significativement[18].
Inhibition d'Helicobacter pylori
Helicobacter pylori est une bactérie commune de la muqueuse gastrique, pouvant causer des gastrites, des ulcères gastro-duodénal et des cancers gastriques. Le traitement antibiotiques permet d’alléger les symptômes mais pas nécessairement d’éradiquer H. pylori de l’estomac.
Il a été montré que L. gasseri OLL2716 possédait un effet inhibiteur direct in vitro et in vivo, sur la croissance et la colonisation de plusieurs souches de H. pylori[19]. Un essai clinique portant sur 31 sujets infectés par H. pylory qui prirent L. gasseri OLL2716 durant 16 semaines montra une diminution de H. pylori, par le moyen de biopsies antrales [20].
Soulagement des symptômes d’infections virales
À partir des années 2000, plusieurs études in vitro et in vivo ont tenté l’élucider par quels mécanismes d’action L. gasseri pouvait limiter les infections virales. Après trois jours de traitement par la souche L. gasseri TMC0356, les souris qui ont été infectées intranasalement par le virus de la grippe H1N1 montrent un taux de morbidité plus faible et un taux de survie plus élevé que les souris témoins. Les souris traitées par voie nasale par le lactobacille voient une augmentation de l’interleukine IL-1β, IL-10 et du TNF-α[21]. Une étude semblable menée avec Lactobacillus rhamnosus GG et Lactobacillus gasseri TMC0356 administrés oralement à des souris infectées par le virus de la grippe H1N1 indique une amélioration significative du score des symptômes cliniques [22]. L’expression pulmonaire de plusieurs cytokines fut augmentée, comme IFN-γ, TNF-α, et IL-12.
Une étude en double aveugle contre placebo a été menée sur 479 individus en bonne santé durant plus de trois mois, prenant L. gasseri PA 16/8, Bifidobacterium longum SP 07/3, B. bifidum MF 20/5, afin d’évaluer leur influence sur la sévérité des symptômes et la durée des rhumes[23]. Quoiqu’il n’y ait pas eu d’effet sur l’incidence des rhumes, le groupe traité par les probiotiques eut une durée réduite des symptômes avec des symptômes moins forts. De plus leurs lymphocytes T cytotoxiques et CD8+ ont été significativement renforcés (par rapport au groupe de contrôle).
L’étude montre que L. gasseri a une valeur clinique en diminuant et abrégeant la durée des symptômes des affections virales respiratoires[5].
Réduction de l’adiposité abdominale des individus en surpoids
Effets anti-obésité d’après les études in vivo
Une étude randomisée en double aveugle contre placebo fut menée en 2010 auprès de 87 adultes en bonne santé mais en surpoids, pour évaluer les effets de la souche L. gasseri SBT2055 sur l’adiposité abdominale et le poids[24]. Le probiotique était fourni sous forme de lait fermenté obtenu avec les ferments du yaourt additionnés (ou non pour le groupe contrôle) de la souche L. gasseri SBT2055. À raison d’une prise journalière de 200 g, le nombre cellules viables de L. gasseri SBT2055 absorbé est de 1011 cfu.
Le groupe ayant pris L. gasseri SBT2055 durant 12 semaines a perdu 4,6% de graisse abdominale et 3,3% de graisses sous-cutanées alors que le groupe de contrôle n’a vu aucun changement. De même leur poids corporel, tour de taille et indice de masse corporelle ont diminué respectivement de 1,4% (1,1 kg), 1,8% (1,7 cm) et 1,5% (0,4 kg/m2).
Cette étude a montré l’effet bénéfique de L. gasseri pour prévenir l’accroissement des tissus adipeux abdominaux et viscéraux chez l’homme. Une étude complémentaire (sur les rats) va immédiatement suivre pour tester les effets anti-obésité et anti-inflammatoire de L. gasseri SBT2055 en s’intéressant plus particulièrement aux adipocytes, les cellules de stockage de la graisse[25]. Car en cas de prise de poids, les adipocytes grossissent puis se multiplient si la prise de poids est trop importante. L’étude fut menée sur des rats nourris exactement de la même manière sauf pour une partie de 20 % pouvant être soit du lait (non fermenté) soit du yaourt soit du yaourt contenant les ferments classiques plus L. gasseri SBT2055. Le régime avec 10 % de lipide était assez gras.
Au bout de quatre semaines, aucune différence de poids significative n’est apparue entre les trois groupes. Par contre le groupe ayant pris L. gasseri SBT2055 avait des adipocytes de taille significativement plus petites. Lorsque les adipocytes grossissent au-delà d’un certain seuil, ils secrètent des cytokines qui induisent l’infiltration de cellules immunitaires ; macrophages, lymphocytes T et NK infiltrés dans le tissu adipeux contribuent alors à une inflammation de bas niveau. La mesure d’un marqueur sanguin d’inflammation (le sICAM, « soluble intercellular adhesion molecules ») indiqua que les deux premiers groupes (avec prise de lait ou de yaourt) avait connu une augmentation significative de leur marqueur alors que le groupe L. gasseri resta stable. Il s’ensuit qu’avec un régime assez gras, la prise de L. gasseri SBT2055 est capable de bloquer la taille des adipocytes et la croissance d’un marqueur d’inflammation, alors que le yaourt ou le lait n’ont pas de tels effets.
Mécanisme possible
Un mécanisme possible pour expliquer les propriétés mises en évidence par les études précédentes serait que L. gasseri entraverait l’absorption des lipides.
Les graisses alimentaires sont brassées dans l’estomac pour former une émulsion qui lorsqu’elle arrive dans le duodénum rencontre les sels biliaires. Ceux-ci se fixent autour des gouttelettes de graisses et en abaissant la tension superficielle, font diminuer leur taille pour former des micelles. Intervient ensuite la lipase, une enzyme digestive sécrétée par le pancréas, qui vient se fixer sur les micelles pour permettre l’hydrolyse des triglycérides contenus dans les micelles. Les acides gras libres et les monoglycérides, produits par les lipases, sont ensuite absorbés. Les graisses alimentaires sont à 95 à 98 % sous forme de triglycérides qui ne peuvent pas être absorbés tels quels dans l’intestin.
Il a été établi in vitro, que la souche L. gasseri SBT2055 supprime la libération d’acide gras d’une émulsion de matière grasse[26]. Toutefois elle ne le fait pas directement en inhibant la lipase pancréatique, mais en augmentant la taille des micelles. Cette augmentation de taille est connue pour défavoriser l’action de la lipase pancréatique. La même équipe de recherche a établi sur les humains que la prise de lait fermenté avec L. gasseri SBT2055 accroissait l’excrétion fécale des graisses. Cet effet pourrait être associé à la suppression de l’hydrolyse des graisses observée in vitro.
Liens externes
Notes
Références
- Nam Su Oh et als., « Probiotic and anti-inflammatory potential of Lactobacillus rhamnosus 4B15 and Lactobacillus gasseri 4M13 isolated from infant feces », PLOS One, vol. 13, no 2, (lire en ligne)
- F. Gasser, « Electrophoretic characterization of lactic dehydrogenase in the genus Lactobacillus », J. Gen. Microbio., vol. 62, , p. 223-239
- E. Lauer, O. Kandler, « Lactobacillus gasseri sp. nov. a new species of the subgenus Thermobacterium », Zentr. Bakteriol. Parasit. Infekt. Hyg., , p. 75-78
- Paul De Vos et als., William B. Whitman, Bergey's Manual of Systematic Bacteriology (2e ed.), volume 3, the Firmicutes, Springer,
- Kurt Selle & Todd R. Klaenhammer, « Genomic and phenotypic evidence for probiotic influences of Lactobacillus gasseri on human health », FEMS Microbiology Rev, vol. 37, , p. 915-935
- Bogovic-Matijasic B. et als, « Isolation and characterization of two bacteriocins of Lactobacillus acidophilus LF221. », Appl Microbiol Biotechnol, vol. 49, , p. 606-612
- Wall R, Fitzgerald et als., « Genomic diversity of cultivable Lactobacillus populations residing in the neonatal and adult gastrointestinal tract. », FEMS Microbiol Ecol, vol. 59, , p. 127-137
- Kiss H. et als., « Vaginal Lactobacillus microbiota of healthy women in the late first trimester of pregnancy. », BJOG, vol. 114, , p. 1402-1407
- Larsson P-G et als., « Human lactobacilli as supplementation of clindamycin to patients with bacterial vaginosis reduce the recurrence rate; a 6-month, double-blind, randomized, placebo-controlled study. », BMC Womens Health, vol. 8, no 3,
- Mohamadzadeh et als., « Lactobacilli activate human dendritic cells that skew T cells toward T helper 1 polarization », PNAS, vol. 102, no 8,
- Stoecker L. et als., « Assessment of “Lactobacillus gasseri” as a candidate oral vaccine vector », Clin. Vaccine Immunol., vol. 18, no 11, , p. 1834-44 (lire en ligne)
- Martine Heyman, « Effets des probiotiques sur le système immunitaire : mécanismes d’action potentiels », Cah. Nutri. Diét., vol. 42, no Hors-série 2,
- Harata G. et als, « Differentiated implication of Lactobacillus GG and L. gasseri TMC0356 to immune responses of murine Peyer's patch », Microbiol. Immunol., vol. 53, no 8,
- Monica Olivares et als., « The consumption of two new probiotic strains, Lactobacillus gasseri CECT 5714 and Lactobacillus coryniformis CECT 5711, boosts the immune system of healthy humans », International Microbiology, vol. 9, , p. 47-52 (lire en ligne)
- Collège des enseignants d’immunologie sous la direction de Carole Hurviez, Immunologie fondamentale et immunopathologie. Enseignement thématique et intégré, Elsevier Masson,
- Sébastien Holvoet et als., « Characterization of Candidate Anti-Allergic Probiotic Strains in a Model of Th2-Skewed Human Peripheral Blood Mononuclear Cells », Allergy and Immunology, vol. 161, no 2, , p. 142-154 (lire en ligne)
- Darab Ghadimi et als., « Effects of probiotic bacteria and their genomic DNA on TH1/TH2-cytokine production by peripheral blood mononuclear cells (PBMCs) of healthy and allergic subjects », Immunobiology, vol. 213, no 8, , p. 677-692 (lire en ligne)
- Morité H. et als., « Preliminary human study for possible alteration of serum immunoglobulin E production in perennial allergic rhinitis with fermented milk prepared with Lactobacillus gasseri TMC0356. », Microbiol. Immunol., vol. 50, no 9, , p. 701-6
- Ushiyama A,, « Lactobacillus gasseri OLL2716 as a probiotic in clarithromycin-resistant Helicobacter pylori infection », J Gastroenterol Hepatol., vol. 18,
- Sakamoto I et als., « Suppressive effect of Lactobacillus gasseri OLL 2716 (LG21) on Helicobacter pylori infection in humans », J Antimicrob Chemother, vol. 47,
- G. Harata et als., « Intranasally administered Lactobacillus gasseriTMC0356 protects mice from H1N1 influenza virus infection by stimulating respiratory immune responses », World Journal of Microbiology and Biotechnology, vol. 27, no 2, , p. 411-416
- M. Kawase et als., « Oral administration of lactobacilli from human intestinal tract protects mice against influenza virus infection », Letters in Applied Microbiology, vol. 51, no 1, , p. 6-10
- Michael de Vrese et als., « Effect of Lactobacillus gasseri PA 16/8, Bifidobacterium longum SP 07/3, B. bifidum MF 20/5 on common cold episodes: A double blind, randomized, controlled trial », Clinical Nutrition, vol. 24, , p. 481-491
- Kadooka Y et als., « Regulation of abdominal adiposity by probiotics (Lactobacillusgasseri SBT2055) in adults with obese tendencies in a randomized controlled trial. », European Journal of Clinical Nutrition, vol. 64, , p. 636-643 (lire en ligne)
- Kadooka Y. et als, « The probiotic Lactobacillus gasseri SBT2055 inhibits enlargement of visceral adipocytes and upregulation of serum soluble adhesion molecule (sICAM-1) in rats », International Dairy Journal, vol. 21, , p. 623-627
- A. Ogawa et als, « Lactobacillus gasseri SBT2055 suppresses fatty acid release through enlargement of fat emulsion size in vitro and promotes fecal fat excretion in healthy Japanese subjects », Lipids in Health and Disease, vol. 14, no 20, (lire en ligne)
- Portail de la microbiologie