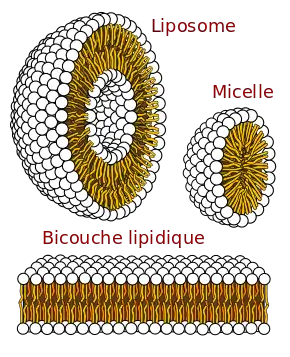
Micelle
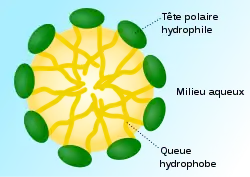
Une micelle (nom féminin dérivé du nom latin mica, signifiant « parcelle ») est un agrégat sphéroïdal de molécules amphiphiles, c'est-à-dire de molécules possédant une tête polaire hydrophile dirigée vers le solvant et une chaîne hydrophobe dirigée vers l'intérieur. Une micelle mesure de 0,001 à 0,300 micromètre.
Pour l’article ayant un titre homophone, voir Missel.
Solvatation
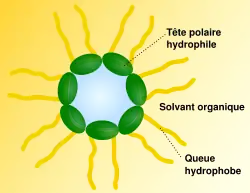
L'hydrophobie des chaînes entraîne le regroupement des molécules et la mise en place de structures sphériques ou cylindriques visant à éliminer le solvant. Elles sont faiblement liées, maintenues dans le solvant grâce à des agents qui les stabilisent, tels les détergents ou les macromolécules. Les solutions colloïdales — dont l'aspect évoque une colle (par exemple, un gel) — sont riches en micelles. Selon la polarité du solvant, on parle de micelles directes (dans un solvant polaire, tel l'eau) ou de micelles inverses (dans un solvant apolaire, tel l'huile).
Tensioactifs
Dans les détergents, la présence conjointe de groupes fonctionnels possédant une affinité, et pour l'eau, et pour les graisses, permet la formation de micelles, les molécules s'organisant en fonction des forces de répulsion vis-à-vis du solvant : dans l'eau, les extrémités lipophiles sont tournées vers l'intérieur de la micelle tandis que les extrémités hydrophiles forment l'interface de la micelle avec le solvant.
Dans un solvant organique, par exemple de l'huile, l'arrangement est inversé. La formation de micelles se produit à partir d'une température, dite de Krafft, et d'une certaine concentration, appelée concentration micellaire critique ou CMC. Les tensio-actifs forment alors des agglomérats de quelques dizaines ou centaines de molécules. Ces micelles, séparant le milieu intérieur du solvant, sont des modèles d'organisation simples rappelant les membranes des cellules vivantes.
Structures micellaires
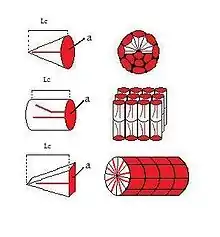
L'organisation des tensioactifs dans une solution est fortement dépendante de leur concentration et de la température. Afin de minimiser les effets de répulsion, les tensioactifs adoptent des configurations spatiales particulières. Dans l'exemple d'un milieu aqueux:
- Premièrement, à basse concentration les tensioactifs viennent se placer à la surface du solvant, interface eau/air par exemple.
- À partir d'une certaine concentration appelée CMC (Concentration Micellaire Critique) les tensioactifs vont former des micelles directes. Ce sont des sphères de taille définie par la nature du tensioactif avec les têtes hydrophiles tournées vers l'extérieur, vers le solvant, et les queues lipophiles regroupées à l’intérieur.
- Lorsqu'on augmente encore la concentration on atteint une seconde CMC à partir de laquelle les tensioactifs ne s'organisent plus en micelles sphériques mais en bâtonnets cylindriques.
- On atteint successivement encore d'autres CMC : Arrangement Hexagonal de micelles cylindriques.
- Organisation en phase lamellaires.
- Lorsque l'eau en devient même minoritaire on forme alors des micelles inverses.
Dans un milieu organique on peut observer le même schéma en inversant l'orientation de la tête et de la queue.
Structures micellaire et champs électromagnétiques
Quelques études faites dans le domaine de l'électroculture ou plus précisément du magnétoamorçage de graines ou semis laissent penser que des structures micellaires pourraient être impliquée dans la capacité des plantes à percevoir certains champs magnétiques ou électromagnétiques, même de faible intensité[1],[2],[3].
Exemples
Les lessives lavent le linge grâce, notamment, à l'action des tensioactifs qui permettent de former des micelles avec les salissures, qui restent ainsi en suspension dans l'eau. Dans la vinaigrette, mélange d'huile (liquide organique, hydrophobe) et de vinaigre (liquide aqueux, lipophobe), des molécules organiques amphiphiles naturelles présentes dans la moutarde assurent la stabilisation de l'émulsion. Dans la mayonnaise, c'est la lécithine (présente dans le jaune d'œuf) ou l'ovalbumine (protéine du blanc d'œuf) qui jouent ce rôle.
Les protobiontes sont des polymères entourés d'une micelle de lipides.
Il existe aussi des tensioactifs de différents origines :
- naturel[4]: lécithine, cholestérol...
- synthétique :
- anionique : syndet et savon
- cationique : ammonium quaternaire, les dérivés de bétaïne...
- non ionique classé selon leur balance hydrophile/lipophile (HLB) : SPAN et TWEEN
Floculation
En neutralisant les charges électriques présentes en surface des micelles, les agents floculants permettent l'agrégation, puis la sédimentation des micelles : ce processus, appelé floculation, est universellement utilisé pour le traitement primaire de l'eau dans les stations d'épuration, pour dépolluer les eaux résiduaires ou comme étape préalable de purification des eaux destinées à la consommation.
Notes et références
- Savostin P.W (2009) “Magnetic growth relations in plants,” Planta, Vol. 12, 327, 1930 ; cité par Shabrangi A & Majd A : Shabrangi, A., & Majd, A. (2009). Effect of magnetic fields on growth and antioxidant systems in agricultural plants. PIERS Proceedings, Beijing, China, March, 23-27.
- Scaiano, J. C., F. L. Cozens, and N. Mohtat, “Development of a model and application of the radical pair mechanism to radicals in micelles,” Photochem. Photobiol., Vol. 62, 818–829, 1995.
- (en) Jaime A. Teixeira da Silva et Judit Dobránszki, « Magnetic fields: how is plant growth and development impacted? », Protoplasma, vol. 253, no 2, , p. 231–248 (ISSN 0033-183X et 1615-6102, DOI 10.1007/s00709-015-0820-7, lire en ligne, consulté le )
- (en)Carey MC, Small DM.: "Micelle Formation by Bile Salts: Physical-Chemical and Thermodynamic Considerations.", Arch Intern Med., 1972;130(4):506-527. texte intégral
Bibliographie
- Jules Wellinghoff (2014), Nanoparticles may harm the brain, Science / News, 2014-07-11
- Kristina Bram Knudsen & al (2014), Differential toxicological response to positively and negatively charged nanoparticles in the rat brain ; Nanotoxicology ; November 2014, Vol. 8, No. 7, Pages 764-774 (doi:10.3109/17435390.2013.829589) (résumé)
- Marcel Lahmani, Catherine Bréchignac & Philippe Houdy, Les Nanosciences, Vol 2 "Nanomatériaux et nanochimie", Pages 555, 556, édition Belin,
- Portail de la chimie
- Portail des sciences des matériaux